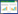文章信息
- 管磊, 张鹏, 王晓坤, 任玉鹏, 郭贝贝, 刘峰
- GUAN Lei, ZHANG Peng, WANG Xiao-kun, REN Yu-peng, GUO Bei-bei, LIU Feng
- 吡唑醚菌酯在水环境中的光解及微囊化对其光稳定性的影响
- Photodegradation of Pyraclostrobin in Water Environment and Microencapsulation Effect on Its Photostability
- 农业环境科学学报, 2015, 34(8): 1493-1497
- Journal of Agro-Environment Science, 2015, 34(8): 1493-1497
- http://dx.doi.org/10.11654/jaes.2015.08.009
-
文章历史
- 收稿日期:2015-02-13
农药在生产加工以及应用过程中,不可避免地通过多种途径流入附近水体中,直接对水生生物以及通过食物链的富集作用对动物和人类健康造成危害。农药在环境中的行为包括降解、代谢、残留、毒性和环境污染问题,而农药在水环境中光化学降解(简称光解)是其在水中主要的降解方式之一,降解产物和降解快慢等因素影响农药在环境中的残留并可能对水生生物以及人类健康带来危害[1]。农药在水环境中光解已是环境化学及环境毒理学的研究热点之一[2, 3, 4]。此外,喷洒使用后的农药在植物及土壤表面也会不可避免地受到光的影响而发生消解,使药效逐步丧失。研究农药降解速度低的剂型及施药方式,对于延长持效期,充分发挥农药的综合效益具有重要价值。
兼具吡唑结构的甲氧基丙烯酸甲酯类杀菌剂吡唑醚菌酯(Pyraclostrobin),广谱、高效、低毒,具有保护和治疗作用,已被广泛用于香蕉、大豆、西瓜、黄瓜、葡萄和水稻等作物,防治包括青霉菌、曲霉菌和镰刀菌等病原真菌引起的病害[5],专利过期后将成为我国杀菌剂市场中的重要产品。目前,国内外有关吡唑醚菌酯的研究主要集中在合成、毒理、药效和残留等方面[6, 7, 8],关于其在水中光解特性的报道仅限于乙腈和丙酮有机溶剂、汞灯和氤灯两种光源等对吡唑醚菌酯水中光解的影响,对实际应用缺乏数据支持。由于该药剂对水生生物毒性高,如对虹鳟和水蚤均为高毒,对月牙藻(Pseudokirchneriella subcapitata)为中毒[9],在水田使用时存在较高的环境风险。农药微胶囊由于将有效成分包裹起来,具有降低农药毒性、药害和环境污染,并且延长持效期和提高利用率等优点,已成为农药剂型研发的热点之一[10]。
本文采用紫外灯作为光源,比较了不同因素以及微囊化对吡唑醚菌酯在水中光稳定性的影响,为吡唑醚菌酯的合理使用和评价其对环境的影响提供依据。
1 材料与方法 1.1 药品与试剂吡唑醚菌酯(纯度99%),山东康乔生物科技有限公司;4′4-二苯基甲烷二异氰酸酯(Methylene diphenyl diisocyanate,MDI),烟台万华聚氨酯股份有限公司;聚乙二醇400(Polyethylene glycol,PEG400),山东莱阳经济技术开发区精细化工厂;乙腈、甲醇均为色谱纯,天津市永大化学试剂有限公司;二甲苯、30%过氧化氢均为分析纯,天津市凯通化学试剂有限公司。饮用纯净水来自杭州娃哈哈集团有限公司,自来水,去离子水由山东农业大学去离子水系统制得,河水取自山东省泰安市泰山区奈河。池塘水取自山东农业大学校园内池塘,池塘水和河水在实验前用孔径0.22 μm有机滤膜过滤除菌,各水样的理化性质见表 1。
Agilent 1200型高效液相色谱仪(UV检测器),Agilent B.04.02化学工作站,可变波长紫外检测器(VWD)(美国安捷伦科技有限公司),配Diamonsil C18色谱柱5 μm×250 mm×4.6 mm,BSA124S型电子分析天平(赛多利斯科学仪器(北京)有限公司),KQ-500DE 型数控超声波清洗器(江苏昆山仪器有限公司),UVA-365型紫外线照度计(Lutron electctronic enterprise co.,LTD.),DDS-307型电导率仪(杭州奥立龙仪器有限公司),SX725型pH溶氧仪(上海沪粤明科学仪器有限公司),比色皿(内径23 mm×15 mm×42 mm)。
光源:紫外灯,光强0.25 mW·cm-2,距离比色皿20 cm,比色皿接触面光强0.040 mW·cm-2。
1.3 试验方法 1.3.1 吡唑醚菌酯微胶囊的制备与性能表征用二甲苯将吡唑醚菌酯和MDI溶解得到油相,用蒸馏水将乳化剂和PEG400溶解得到水相,高速剪切下将油水两相混合,经升温固化,MDI和PEG400通过界面聚合反应得到吡唑醚菌酯微胶囊,再加入分散剂、增稠剂和防冻剂即得到20%吡唑醚菌酯微囊悬浮剂(Microcapsule suspension,CS)。其pH为6.92,平均粒径5.67 μm,包封率94.12%,球形,囊壳表面有凹陷(图 1)。

|
| 图 1 吡唑醚菌酯微胶囊的SEM图 Figure 1 SEMphotograph of pyraclostrobin microcapsules |
以乙腈为溶剂将吡唑醚菌酯配成100 mg·L-1母液,以饮用纯净水为溶剂分别将过氧化氢和20%吡唑醚菌酯CS配制成8.82 mmol·L-1和100 mg·L-1母液。
标准液系列的配制:吸取不同体积100 mg·L-1吡唑醚菌酯母液,以乙腈为溶剂,配制质量浓度为0.10、0.40、1.00、2.00、4.00、10.00 mg·L-1的吡唑醚菌酯标准溶液系列。
1.3.3 吡唑醚菌酯原药水环境中光解试验 1.3.3.1 初始浓度的影响用饮用纯净水将100 mg·L-1吡唑醚菌酯乙腈母液分别配制不同初始浓度的吡唑醚菌酯水中光解反应液,充分混合均匀。移取反应液9 mL于具塞比色皿内,密封,置于紫外灯下光照,同时以锡箔纸包裹处理作为黑暗对照,控制反应温度为(20±1)℃。不同时间间隔取样0.80 mL,样品中加入0.80 mL乙腈对半稀释,再用高效液相色谱仪测定分析。每处理3次重复。
1.3.3.2 水质的影响将处理好的饮用纯净水、去离子水、自来水、池塘水和河水,分别用于配制5.00 mg·L-1的吡唑醚菌酯水环境中光解反应液。水中光解试验方法同1.3.3.1。
1.3.3.3 H2O2的影响用饮用纯净水分别配制不同浓度H2O2溶液,其中吡唑醚菌酯的浓度均设为5.00 mg·L-1。其余水中光解试验方法同1.3.3.1。
1.3.4 吡唑醚菌酯CS水环境中光解试验用饮用纯净水分别配制不同初始浓度吡唑醚菌酯CS的水环境中光解反应液,充分混合均匀。除吡唑醚菌酯CS在高效液相色谱仪测定分析前需经超声30 min破囊(100 kW)外,其余水中光解试验方法同1.3.3.1。
1.4 色谱条件检测波长278 nm,流动相为乙腈∶水=90∶10(体积比),流速1.0 mL·min-1,柱温25 ℃,进样量20 μL。保留时间为5.00 min左右。
1.5 统计方法与计算公式用一级动力学方程拟合吡唑醚菌酯水环境中光解试验数据[11],采用DPSv13.5统计软件分析数据。计算公式如下:
式中:k为光解速率常数,min-1;C0为吡唑醚菌酯初始浓度,mg·L-1;Ct为t时刻吡唑醚菌酯的残存浓度,mg·L-1。Ct=C0 /2时所需时间为半衰期(T1/2)。
20%吡唑醚菌酯CS水环境中光解率利用下式计算[12]:
2 结果与讨论 2.1 标准曲线及方法准确度和精密度以吡唑醚菌酯质量浓度为横坐标(x)、响应的峰面积为纵坐标(y)进行线性回归,标准曲线方程为:
y=66.64x+3.651,R2=0.999
保留时间约为5.0 min,分析方法最小检出量(LOD)为1.0×10-9 g。
根据试验测定浓度范围,用饮用纯净水将吡唑醚菌酯配制成0.20、2.00、7.00 mg·L-1标准液,其平均回收率分别为99.82%、100.68%、100.41%,变异系数分别为0.42%、0.34%和0.14%。这表明该方法满足农药残留分析对准确性和精确性的要求。
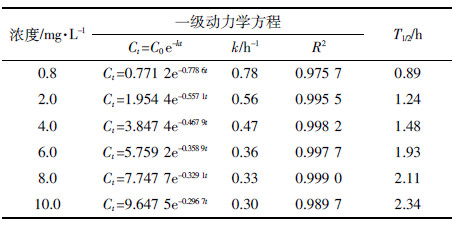
2.2 初始浓度对吡唑醚菌酯水环境中光解的影响在吡唑醚菌酯0.80、2.00、4.00、6.00、8.00、10.00 mg·L-1下,水环境中光解速率常数k与初始浓度呈负相关,半衰期随着其浓度的增大而增大,分别为0.89、1.24、1.48、1.93、2.11、2.34 h(表 2)。这与吴群等[13]、殷星等[14]、邹雅竹等[12]、贾娜等[15]分别报道的氯虫苯甲酰胺、嘧菌酯、咪鲜胺和2,4-D丁酯在水环境中光解规律相似。光照条件一致时,随着吡唑醚菌酯初始浓度的增大,水中吡唑醚菌酯分子数增加,每个分子平均接受的光能减少,故发生降解几率降低,相应光解速率常数降低。
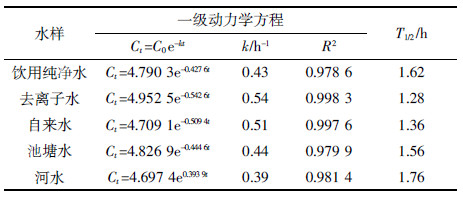
从表 3看出,吡唑醚菌酯在5种水中的光解速率由大到小依次为去离子水、自来水、池塘水、饮用纯净水和河水,其半衰期分别为1.28、1.36、1.56、1.62、1.76 h。马腾达[17]研究表明吡唑醚菌酯在不同pH的水中光解速率为pH9>pH7>pH5。由表 1可知,去离子水、自来水、池塘水、饮用纯净水和河水的pH值分别为6.75、7.63、8.62、6.52和8.50,吡唑醚菌酯水解光解速率与水的pH有关[16]。但本研究中吡唑醚菌酯水解光解速率与不同水质pH变化的规律与马腾达[17]的结果存在差异。除了pH,水的其他理化性质及其溶解物质也会影响农药在水中光解速率[18, 19]。不同水质含有的离子和可溶性物质可能与吡唑醚菌酯发生螯合作用,也可能对吡唑醚菌酯吸收和传导光能产生遮蔽效应,从而抑制吡唑醚菌酯在水环境中的光解。
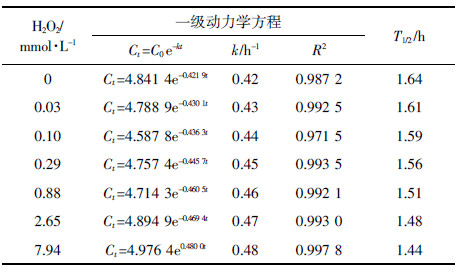
由表 4可知,随着H2O2 浓度的增大,吡唑醚菌酯在水中光解速率增大,其中H2O2 浓度为7.94 mmol·L-1时,光解速率常数为0.48 h-1,是吡唑醚菌酯单独光解的1.14倍。
H2O2 易光解产生·OH,其反应式为:
H2O2+hυ→2·OH
·OH能够攻击吡唑醚菌酯,使其发生分解[12, 20]。吴群等[13]报道H2O2对氯虫苯甲酰胺表现出显著的光敏化降解作用。本研究中H2O2对吡唑醚菌酯光解作用相对较低,可能由于紫外光加速了2H2O2 →2H2O+O2 的反应,光解产生的·OH较少。
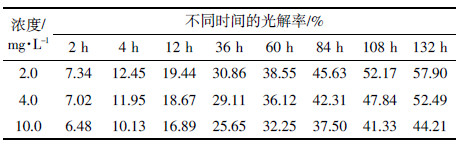
2.5 20%吡唑醚菌酯CS在水环境中的光降解由表 5可知,2.00、4.00、10.00 mg·L-1吡唑醚菌酯CS在132 h的光解率分别为57.90%、52.49%和44.21%,而未微囊化的吡唑醚菌酯2.00、4.00、10.00 mg·L-1在相同条件下光解率分别达57.90%、52.49%和44.21%时所需时间分别为1.55、1.59 h和1.97 h(根据表 2一级动力学方程计算得到)。因此,微囊化显著降低了吡唑醚菌酯在水环境中的光解速率。随着20%吡唑醚菌酯CS初始浓度的增大,其各时期光解率减小,与不同初始浓度吡唑醚菌酯原药在水环境中光解规律相似。一方面由于吡唑醚菌酯包封率为94.12%,未被包封的吡唑醚菌酯在4 h内基本光解完全;另一方面微胶囊表面的吡唑醚菌酯与水接触,容易降解,其2、4 h光解速率较快。微胶囊的囊壁材料聚氨酯既遮挡紫外光透射,又将吡唑醚菌酯包裹起来,仅通过囊壳上的孔径与水接触,在很大程度上降低了其与水的接触几率[21],因此4 h以后,吡唑醚菌酯CS在水中光解率明显降低。
吡唑醚菌酯微囊化不仅降低其在水中光解速率,而且增添了微胶囊的优势(如充分发挥药效、延长持效期和降低对非靶标生物的影响程度),故利于吡唑醚菌酯的推广应用。
3 结论(1)在紫外光下,吡唑醚菌酯在水环境中光解速率与初始浓度呈负相关性。
(2)在相同条件下,水的理化性质及其溶解物质不同导致吡唑醚菌酯在不同水质中光解速率不同,光解速率由大到小依次为去离子水、自来水、池塘水、饮用纯净水和河水。
(3)H2O2促进吡唑醚菌酯水中光解;吡唑醚菌酯光解速率与H2O2 浓度呈正相关性,其中H2O2 浓度7.94 mmol·L-1时光解速率是吡唑醚菌酯单独光解的1.14倍。该结果可为降低吡唑醚菌酯污染环境提供参考。
(4)微囊化降低吡唑醚菌酯在水环境中光降解速率,光解速率与初始浓度呈负相关。该结果可为吡唑醚菌酯的合理使用及制剂开发提供依据。
| [1] | 张晓清, 石利利, 单正军. 农药在液相中的光解研究进展[J]. 农药科学与管理, 2007, 28(7):41-46. ZHANG Xiao-qing, SHI Li-li, SHAN Zheng-jun. Studies on the photochemical degradation of pesticides in liquid solution[J]. Pesticide Science and Administration, 2007, 28(7):41-46. |
| [2] | Morrissey C A, Mineau P, Devries J H, et al. Neonicotinoid contamination of global surfacewaters and associated risk to aquatic invertebrates:A review[J]. Environment International, 2015, 74:291-303. |
| [3] | 郑立庆, 方娜, 刘国光, 等. 农药在环境中的光化学降解研究进展[J]. 安徽农业科学, 2006, 34(19):5012-5014. ZHENG Li-qing, FANG Na, LIU Guo-guang, et al. Research progress in the photolysis of pesticide in environment[J]. Journal of Anhui Agricultural Sciences, 2006, 34(19):5012-5014. |
| [4] | 刘超, 强志民, 张涛, 等. 紫外光和基于紫外光的高级氧化工艺降解农药的研究进展[J]. 环境科学学报, 2011, 31(2):225-235. LIU Chao, QIANG Zhi-ming, ZHANG Tao, et al. Degradation of pesticides by UV and UV-based advanced oxidation processes:State-of-the-art[J]. Acta Scientiae Circumstantiae, 2011, 31(2):225-235. |
| [5] | 中华人民共和国农业部农药检定所. 中国农药信息网[EB/OL].[2015-02-03]. http://www.chinapesticide.gov.cn Institute for the Control of Agrochemicals MOA. China pesticide information network[EB/OL].[2015-02-03]. http://www.chinapesticide.gov.cn. |
| [6] | 陶贤鉴, 罗亮明, 黄超群, 等. 吡唑醚菌酯的合成研究[J]. 农药研究与应用, 2009, 13(1):16-21. TAO Xian-jian, LUO Liang-ming, HUANG Chao-qun, et al. Synthesis of pyraclostrobin[J]. Agrochemicals Research & Application, 2009, 13(1):16-21. |
| [7] | Zhang F Z, Wang L, Zhou L, et al. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LC-MS/MS[J]. Ecotoxicology and Environmental Safety, 2012, 78:116-122. |
| [8] | You X W, Liu C Y, Liu F M, et al. Dissipation of pyraclostrobin and its metabolite BF-500-3 in maize under field conditions[J]. Ecotoxicology and Environmental Safety, 2012, 80:252-257. |
| [9] | Agriculture & Environment Research Unit(AERU) at the University of Hertfordshire. Pesticide Properties Database[EB/OL].[2015-02-03]. http://sitem.herts.ac.uk/aeru/iupac/atoz.htm. |
| [10] | 冯建国, 徐妍, 罗湘仁, 等. 浅谈溶剂蒸发法制备微胶囊与农药微胶囊的开发[J]. 农药学学报, 2011, 13(6):568-575. FENG Jian-guo, XU Yan, LUO Xiang-ren, et al. Discussion on the solvent evaporation method for preparation of microcapsules and the development of the pesticides microcapsules[J]. Chinese Journal of Pesticides Science, 2011, 13(6):568-575. |
| [11] | 花日茂, 岳永德, 樊德方. 乙草胺在水中的光化学降解[J]. 农药学学报, 2000, 2(1):71-74. HUA Ri-mao, YUE Yong-de, FAN De-fang. The photodegradation of acetochlor in water[J]. Chinese Journal of Pesticides Science, 2000, 2(1):71-74. |
| [12] | 邹雅竹, 龚道新. 咪鲜胺在水中的光化学降解研究[J]. 农药科学与管理, 2006, 27(2):27-30. ZOU Ya-zhu, GONG Dao-xin. Photo-degradation of prochloraz in water[J]. Pesticide Science and Administration, 2006, 27(2):27-30. |
| [13] | 吴群, 施艳红, 操海, 等. 氯虫苯甲酰胺在水溶液中光解的影响因素研究[J]. 农业环境科学学报, 2014, 33(11):2242-2246. WU Qun, SHI Yan-hong, CAO Hai, et al. Photodegradation of chlorantraniliprole in aqueous solution[J]. Journal of Agro-Environment Science, 2014, 33(11):2242-2246. |
| [14] | 殷星, 陆澄莹, 王鸣华. 嘧菌酯在水和有机溶剂中的光化学降解[J]. 农药学学报, 2014, 16(4):439-444. YIN Xing, LU Cheng-ying, WANG Ming-hua. Photochemical degradation of azoxystrobin in several organic solvents and water[J]. Chinese Journal of Pesticides Science, 2014, 16(4):439-444. |
| [15] | 贾娜, 施海燕, 王鸣华. 2, 4-D丁酯的水解与光解特性研究[J]. 农业环境科学学报, 2011, 30(6):1082-1086. JIA Na, SHI Hai-yan, WANG Ming-hua. Hydrolysis and photolysis of 2, 4-D butylate[J]. Journal of Agro-Environment Science, 2011, 30(6):1082-1086. |
| [16] | Laura L A, María-Teresa M S, Jesús S A, et al. Degradation intermediates and reaction pathway of pyraclostrobin with TiO2 photocatalysis[J]. Applied Catalysis B:Environmental, 2012, 115-116:285-293. |
| [17] | 马腾达. 吡唑醚菌酯的光解与水解特性研究[D]. 长春: 吉林农业大学, 2012:11. MA Teng-da. The photolytic and hydrolyzed characteristics of pyraclostrobin[D]. Changchun: Jilin Agricultural University, 2012:11. |
| [18] | Sakkas V A, Lambropoulou D A, Albanis T A. Photochemical degradation study of irgarol 1051 in natural waters:Influence of humic and fulvic substances on the reaction[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2002, 147(2):135-141. |
| [19] | 花日茂, 徐利, 吴祥为, 等. 表面活性剂对水中乙草胺光解的影响[J]. 农业环境科学学报, 2007, 26(3):1049-1053. HUA Ri-mao, XU Li, WU Xiang-wei, et al. Effect of surfactants on the photo-degradation of acetochlor in water[J]. Journal of Agro-Environment Science, 2007, 26(3):1049-1053. |
| [20] | Mack J, Bolton J R. Photochemistry of nitrite and nitrate in aqueous solution:A review[J]. Journal of Photochemistry and Photobiology A:Chemistry, 1999, 128(1):1-13. |
| [21] | Ohtsubo T, Takeda H, Tsuda S, et al. Formulation factors of fenvalerate microcapsules influencing insecticidal efficacy and fish toxicity[J]. Journal Pesticide Science, 1989, 14(2):235-239. |
 2015, Vol. 34
2015, Vol. 34