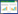文章信息
- 王蕾, 代静玉, 王英惠
- WANG Lei, DAI Jing-yu, WANG Ying-hui
- 不同处理对生物质炭与活性有机物质矿化行为的影响
- Effects of Different Elution Pretreatments on Mineralization of Biochars in Presence of Active Organic Matters
- 农业环境科学学报, 2015, 34(8): 1542-1549
- Journal of Agro-Environment Science, 2015, 34(8): 1542-1549
- http://dx.doi.org/10.11654/jaes.2015.08.016
-
文章历史
- 收稿日期:2015-03-27
生物质炭(Biochar)是生物质在完全或部分缺氧的条件下热解而成的固体物质[1]。它具有孔隙结构多、容重小、比表面积大、吸附性强等特点[2, 3, 4, 5],具有较高的化学稳定性、热稳定性和微生物稳定性[6],在环境中的降解速率非常缓慢[7, 8]。
生物质炭的稳定性因制备材料、热解温度、热解方式的不同而不同[9]。生物质炭的矿化受环境温度[10]、水分[11]、微生物[12]等多种因素的影响,还与外源有机物质有关。Hamer等[13]以石英砂作基质,将生物质炭与葡萄糖共培养,结果发现添加葡萄糖培养的生物质炭矿化程度高于未添加处理,且差异达到显著水平;Kuzyakov等[14]以土壤为基质,将14C标记的生物质炭与葡萄糖共培养,培养初期生物质炭的降解速率高出未添加葡萄糖处理的6倍以上。以上两种结果均被认为是葡萄糖与生物质炭共代谢造成的,葡萄糖与生物质炭的相互作用加速了生物质炭的矿化。研究表明向土壤中加入生物质炭能够促进土壤有机质的矿化[15],土壤CO2释放量增加[16, 17]。例如,Pereira等[17]将不同原料在不同温度下制取的生物质炭加入土壤中短期培养110 h,结果发现添加生物质炭后土壤CO2释放量显著提高,这说明生物质炭的添加促进了CO2的释放,研究者认为这种结果既可能是生物质炭中不稳定组分分解所造成的,也不排除共代谢的作用。但也有学者研究发现,在土壤中加入14C标记的生物质炭抑制了土壤有机质的分解[18]。因此,在研究生物质炭在土壤中的矿化行为时,有必要探讨生物质炭与有机物的相互作用,以及这种相互作用对两者稳定性的影响。
生物质炭在制备过程中,除了生成固态的生物质炭,还会生成液态的醋液、焦油等物质附着在生物质炭表面[19, 20, 21],并且在培养过程中可能会优先矿化,从而影响对生物质炭本身矿化行为的研究[22]。为了排除这些因素的干扰,需要先去除附着在生物质炭表面的热解副产物。本文将生物质炭经酸、碱、醇、水四种溶液浸泡后与活性有机物质(葡萄糖、谷氨酸)进行共培养,探讨不同洗脱方法对生物质炭与活性有机物质矿化行为的影响,为研究生物质炭进入土壤后的环境效应提供理论基础。 1 材料与方法 1.1 生物质炭的制备
将水稻稻壳在低温(50±1)℃下烘干至恒重后,装入18 cm×15 cm×5 cm金属容器中,填满并压实后密封。将金属容器放入马弗炉内加热,设定终温为400 ℃,达到终温后继续加热2 h,待冷却至室温后取出。样品研磨后取粒径在0.15~0.25 mm的颗粒待用。 1.2 生物质炭的洗脱方法
生物质炭样品研磨后,分别用0.5 mol·L-1 HCl、0.5 mol·L-1 NaOH、无水乙醇、纯水按固液比1∶10浸泡24 h,离心去除上清液,反复浸泡至上清液无色,再用纯水洗至中性,直到上清液的总有机碳(TOC)低于检出限,TOC检测方法参照土壤农化分析[23]。将生物质炭低温(50±1)°C烘干,取粒径在60~100目的生物质炭待用。 1.3 生物质炭理化性质的测定
生物质炭基本性质(pH、灰分等)的测定参考常规分析方法[23],比表面积的测定采用乙二醇乙醚法[24]。表面官能团测定采用贝姆滴定法[25],阳离子交换量的测定采用1 mol·L-1乙酸铵交换法[23]。 1.4 生物质炭与活性有机物质的培养方法
取生物质炭(60~100目)与石英砂(40~70目)的混合物(质量比1∶10)置于1000 mL的培养瓶中,加入4 mL接种物(采集南京农业大学花圃新鲜土壤,并以固液比1∶2浸提,过滤后,稀释100倍得到接种物)和2 mL营养液[60 g (NH4)2SO4和6 g KH2PO4溶于1 L水中]。培养物的含水率为其饱和含水率的60%。将放置定量NaOH溶液的玻璃管置入培养瓶中,室温下密闭培养[13]。
在培养开始前,培养物中添加不同活性有机物质(葡萄糖、谷氨酸),浓度分别为葡萄糖20 mg·g-1、葡萄糖60 mg·g-1、谷氨酸2 mg·g-1、谷氨酸6 mg·g-1(活性有机物质浓度设置参照该物质在土壤中含量[26, 27, 28])。将单独培养的生物质炭、活性有机物质设为对照。培养期间,利用酸碱滴定法测定CO2释放量。每个处理设3个平行。 1.5 数据分析
培养实验中利用酸碱滴定法计算CO2释放量:
x=(C0V0-C1V1)/2 m
式中x代表了单位生物质炭培养过程CO2释放量,C0、V0分别为NaOH的初始浓度、体积,C1、V1分别为滴定时消耗的HCl的浓度、体积,m为生物质炭质量。实验数据采用SPSS 13.0进行差异性检验。 2 结果与讨论 2.1 不同洗脱处理生物质炭的矿化行为
生物质炭在热解制备的过程中,除了生成固态的生物质炭外,还会产生固态的无机盐和液态的焦油、醋液等副产物[19, 20, 21]。这些副产物会混入生物质炭中或者附着在生物质炭表面,由于其性质较活跃,有可能对生物质炭的矿化过程产生影响。为了准确反映生物质炭本身的稳定性,参考郭悦等[22]的研究方法,将生物质炭分别用水、稀酸溶液、稀碱溶液、无水乙醇四种溶液浸泡,然后进行培养,以CO2释放量为指标,观察不同洗脱处理得到的生物质炭矿化过程的差异。
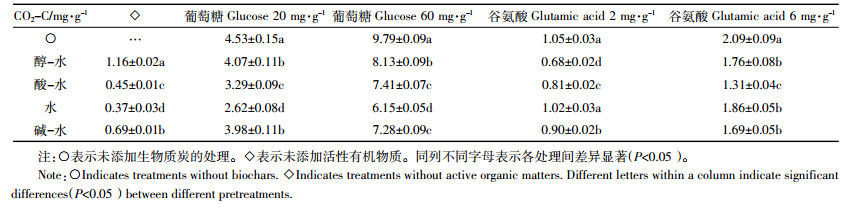
从不同处理的生物质炭CO2释放量(图 1)可以看出,所有处理CO2释放量在100 d左右趋于稳定,但不同的洗脱手段的生物质炭矿化行为有差异,表现在:酸-水处理和水处理生物质炭的矿化存在延滞期,在培养第3 d时矿化速率达到最大值,而碱-水处理和醇-水处理的生物质炭矿化速率均随时间的增加而减小,在培养第1 d时矿化速率最大。为了更直观地表示不同洗脱处理对生物质炭矿化行为的影响,以CO2累积释放量为指标作图(图 2)。
|
| 图 1 不同洗脱处理的生物质炭 CO2 释放量 Figure 1 Emissions of CO2 from biochar after different elution pretreatments |
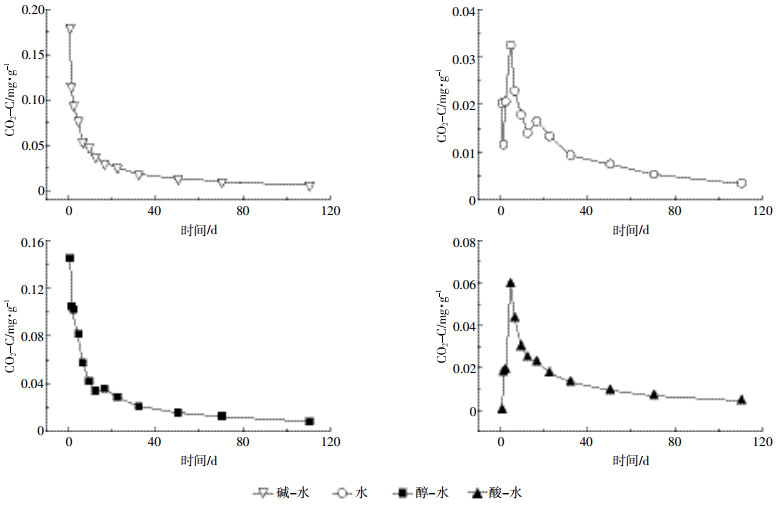
|
| 图 2 不同洗脱处理的生物质炭 CO2 累积释放量 Figure 2 Cumulative CO2 emissions from biochar after different elution pretreatments |
在培养16 d后,四种不同洗脱处理得到的生物质炭CO2累积释放量从大到小依次为醇-水处理>碱-水处理>酸-水处理>水处理,这说明洗脱方法会对生物质炭的矿化造成影响。研究表明生物质炭的矿化首先发生于表面[29],因此我们猜测可能是不同洗脱处理生物质炭的表面性状存在差异,进而引起CO2累积释放量的不同。
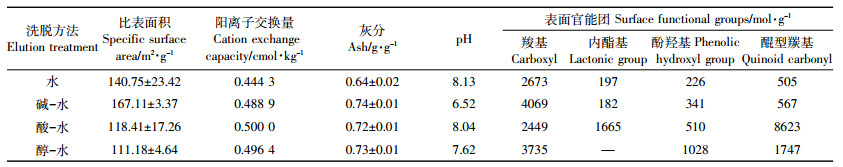
从不同洗脱处理得到的生物质炭的理化性质(表 1)可以看出,四种洗脱处理得到的生物质炭比表面积、pH、表面官能团含量均不一样。其中碱-水处理的生物质炭pH最低,酸-水处理的生物质炭pH较高,这可能是因为新制备的生物质炭表面呈碱性[30],其中起作用的主要是-COO(-COOH)、-O(-OH)和碳酸盐[31]。在强碱性环境下,生物质炭表面非解离态的R-COOH发生解离导致pH降低,而在强酸性条件下则难以解离,水洗后会使质子与解离的基团相结合,这与贝姆滴定法测定表面官能团含量的结果[32]相符。
 |
不同洗脱处理的生物质炭培养110 d后累积CO2-C释放量存在差异(表 2),这表明洗脱处理会通过改变生物质炭的表面性状从而影响生物质炭的矿化,但是总的碳释放量均在1.0 mg·g-1以下,说明生物质炭本身稳定性很高,累积矿化量不同可能主要是因为洗脱造成的生物质炭表面性状的不同以及生物质炭未洗净的部分对矿化产生的影响。
 |
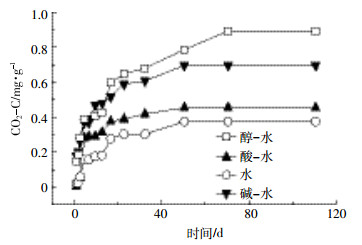
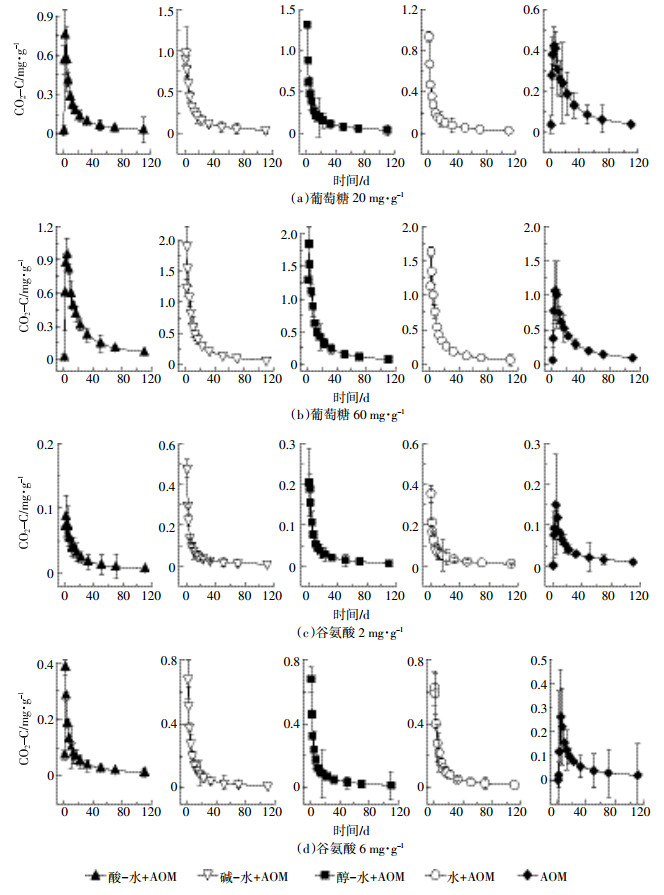
施入土壤中的生物质炭具有固碳的功能[33, 34, 35],一方面是因为生物质炭本身的稳定性很高,此外也可能存在生物质炭与其他物质的相互作用。研究表明,添加高温制备生物质炭的土壤CO2累积释放量低于未添加生物质炭的土壤处理[36]。可能是因为高温制备的生物质炭对土壤中易矿化有机物质有一定的保护作用。为验证这一猜想,将400 °C热解制得的稻壳生物质炭经不同洗脱处理后与活性有机物质(葡萄糖、谷氨酸)在相同条件下共同培养,CO2释放量见图 3。
|
| 图 3 生物质炭与活性有机物质 (AOM) 共培养处理的 CO2 释放量 Figure 3 Emissions of CO2 from different elution pretreated biochars incubated with various active organic matters (AOM) |
从矿化速率可以看出,添加不同种类和浓度的活性有机物质后,同一种生物质炭的矿化速率存在差异,并且在添加相同浓度的同种活性有机物质后,经过不同洗脱处理的生物质炭的矿化速率同样也存在差异。
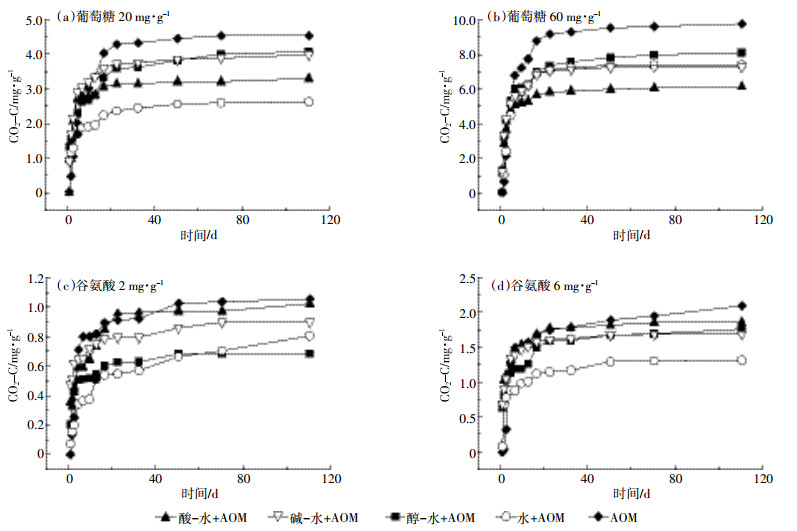
CO2累积释放量(图 4)表明,生物质炭与不同种类、不同浓度的活性有机物质共培养时,CO2累积释放量均低于单独培养的活性有机物质处理,这说明生物质炭对活性有机物质有一定的保护作用。由于活性有机物质添加量的差异,CO2累积释放量随活性有机物质添加量增大而增大,且添加物为葡萄糖时,CO2累积释放量远远大于添加物为谷氨酸的处理。
|
| 图 4 生物质炭与活性有机物质 (AOM) 共培养 CO2 累积释放量 Figure 4 Cumulative CO2 emissions from different elution pretreated biochars incubated with various active organic matters(AOM) |
不同洗脱处理的生物质炭对同种活性有机物质的保护能力不同。培养110 d后,醇-水处理、酸-水处理、水处理、碱-水处理与20 mg·g-1葡萄糖共培养处理的CO2累积释放量比葡萄糖单独培养的处理分别减少了10.22%、27.34%、42.16%、12.28%(图 4a),葡萄糖含量增加至60 mg·g-1时,则分别减少了16.97%、24.30%、37.19%、25.56%(图 4b)。添加谷氨酸2 mg·g-1的处理培养110 d后,醇-水处理、酸-水处理、水处理、碱-水处理与谷氨酸共培养的处理CO2累积释放量比谷氨酸单独培养的处理分别减少了35.36%、23.65%、3.03%、15.02%(图 4c),谷氨酸含量增加至6 mg·g-1时培养110 d后,CO2累积释放量分别减少了15.92%、37.25%、11.36%、19.39%(图 4d)。
不同洗脱处理的生物质炭与相同活性有机物质共培养时,CO2累积释放量存在差异(表 2)。不同洗脱处理使生物质炭表面性质各不相同,这种差异可能是由生物质炭表面与活性有机物质的相互作用引起的,生物质炭可通过表面性状影响活性有机物质的矿化。
不同洗脱处理的生物质炭单独培养110 d后,矿化程度(CO2累积释放量)从大到小的顺序依次为:醇-水处理>碱-水处理>酸-水处理>水处理。添加葡萄糖20 mg·g-1培养110 d后,矿化程度从大到小的顺序依次为:醇-水处理>碱-水处理>酸-水处理>水处理,葡萄糖含量增加至60 mg·g-1时,矿化程度从大到小的顺序依次为:醇-水处理>酸-水处理≥碱-水处理>水处理;添加谷氨酸2 mg·g-1时,矿化程度从大到小的顺序依次为:水处理>碱-水处理>酸-水处理>醇-水处理,谷氨酸含量为6 mg·g-1,矿化程度从大到小的顺序依次为:水-处理>醇-水处理>碱-水处理>酸-水处理。与生物质炭单独培养的处理相比,添加葡萄糖的处理矿化程度顺序变化不大,而添加谷氨酸后矿化程度的顺序则有明显改变,并且两种活性有机物质均表现为浓度不同时矿化程度的顺序也不相同。这种顺序的变化表明活性有机物质与生物质炭的相互作用对生物质炭的矿化同样存在影响,这种相互作用不仅与生物质炭表面性状有关,还会随着活性有机物质种类和浓度的变化而变化。
比较四种洗脱处理的生物质炭与不同浓度、种类的有机物质共培养时CO2累积释放量(表 2),添加谷氨酸2 mg·g-1时,四种洗脱处理的生物质炭CO2累积释放量均呈显著性差异,当添加谷氨酸6 mg·g-1时,四种洗脱处理的生物质炭CO2累积释放量仅有1组处理与其他处理之间出现显著性差异,这可能是因为添加低浓度活性有机物质的生物质炭的矿化受生物质炭本身性质的影响较大,而添加高浓度活性有机物质的生物质炭的矿化行为可能与活性有机物质本身有关。比较葡萄糖(20 mg·g-1和60 mg·g-1)与四种洗脱处理生物质炭共培养的CO2累积释放量,均有2组处理与其他处理之间呈现显著性差异,表明不同洗脱方法可能是影响生物质炭矿化的主要因素。当添加物分别为葡萄糖和谷氨酸时,不同洗脱处理生物质炭的CO2累积释放量显著性差异表现不一致,可能与C/N比有关,尽管培养开始前已经添加(NH4)2SO4调节C/N比,但是葡萄糖较大的添加量以及谷氨酸中N的存在,都会对C/N比造成影响,进而影响微生物的生长,导致培养过程中的矿化行为有所差异。 2.3 生物质炭与活性有机物质共培养过程中的相互作用
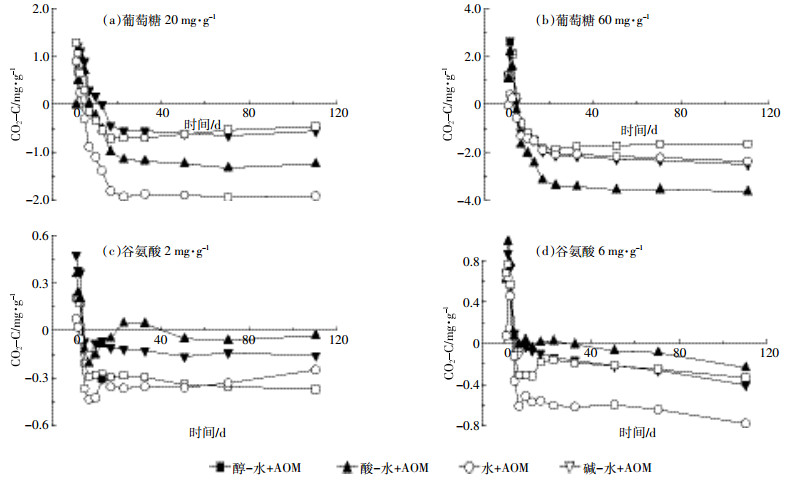
为了明确这种相互作用究竟是共稳定还是共代谢,将生物质炭和活性有机物质共培养处理与活性有机物质单独培养的对照处理的CO2累积释放量相减,以所得差值的平均值作图(图 5)。
|
| 图 5 生物质炭和活性有机物质共培养处理与活性有机物质单独培养的对照处理的 CO2 累积释放量差值 Figure 5 Differences in cumulative CO2 emissions between active organic matters with and without biochar |
培养的最初阶段,所得差值为正值,表明生物质炭与活性有机物质共同作用释放的CO2量高于活性有机物质单独培养的释放量。生物质炭是一种惰性炭,加入活性有机物质后,两者之间可能存在一定的激发效应,使培养初期生物质炭与活性有机物质之间互相促进矿化。培养后期,所有差值均为负值,表明生物质炭抑制了活性有机物质的矿化,即培养一段时间后生物质炭与活性有机物质的相互作用表现为共稳定机制。 3 结论
(1)四种洗脱处理改变了生物质炭的表面性质,并且这种改变影响着生物质炭的矿化行为,但是对生物质炭稳定性没有太大影响。四种洗脱处理的生物质炭与不同活性有机物质共同培养约110 d后,CO2累积释放量皆低于活性有机物质单独培养的处理,表明生物质炭对活性有机物质有一定保护作用。
(2)生物质炭与活性有机物质之间可能存在相互作用,这种相互作用受生物质炭表面性状、活性有机物质的浓度和种类的影响。添加低浓度活性有机物质的生物质炭的矿化受生物质炭本身性质的影响较大,而添加高浓度活性有机物质的生物质炭的矿化行为可能与活性有机物质本身有关。
(3)生物质炭与活性有机物质之间的相互作用能够影响两者的矿化行为,这种相互作用在培养初期表现为互相促进矿化,后期则体现为一种共稳定机制,但具体机理仍有待探讨。
| [1] | Antal M J, Gronli M. The art, science, and technology of charcoal production[J]. Industrial & Engineering Chemistry Research, 2003, 42(8):1619-1640. |
| [2] | 徐仁扣, 赵安珍, 肖双成, 等. 农作物残体制备的生物质炭对水中亚甲基蓝的吸附作用[J]. 环境科学, 2012, 33(1):142-146. XU Ren-kou, ZHAO An-zhen, XIAO Shuang-cheng, et al. Adsorption of methylene blue from water by the biochars generated from crop residues[J]. Environmental Science, 2012, 33(1):142-146. |
| [3] | 何娇, 孔火良, 韩进, 等. 秸秆生物质环境材料的制备及对水中多环芳烃的处理性能[J]. 环境科学, 2011, 32(1):135-139. HE Jiao, KONG Huo-liang, HAN Jin, et al. Preparation method of stalk environmental biomaterial and its sorption ability for Polycyclic Aromatic Hydrocarbons in water[J]. Environmental Science, 2011, 32(1):135-139. |
| [4] | 林晓芬, 张军, 尹艳山, 等. 生物质炭孔隙分形特征研究[J]. 生物质化学工程, 2009, 43(3):9-12. LIN Xiao-fen, ZHANG Jun, YIN Yan-shan, et al. Study on fractal characteristics of biomass char[J]. Biomass Chemical Engineering, 2009, 43(3):9-12. |
| [5] | Zhu D Q, Kwon S, Pignatello J J. Adsorption of single-ring organic compounds to wood charcoals prepared under different thermochemical conditions[J]. Environmental Science & Technology, 2005, 39(11):3990-3998. |
| [6] | Glaser B, Lehmann J, Zech W. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal: A review[J]. Biology and Fertility of Soils, 2002, 35(4):219-230. |
| [7] | Liang B, Lehmann J, Solomon D, et al. Stability of biomass-derived black carbon in soils[J]. Geochimica et Cosmochimica Acta, 2008, 72(24):6069-6078. |
| [8] | Masek O, Brownsort P, Cross A, et al. Influence of production conditions on the yield and environmental stability of biochar[J]. Fuel, 2013, 103:151-155. |
| [9] | Singh B P, Cowie A L, Smernik R J. Biochar carbon stability in a clayey soil as a function of feedstock and pyrolysis temperature[J]. Environmental Science & Technology, 2012, 46(21):11770-11778. |
| [10] | Cheng C H, Lehmann J, Thies J E, et al. Oxidation of black carbon by biotic and abiotic processes[J]. Organic Geochemistry, 2006, 37(11):1477-1488. |
| [11] | Nguyen B T, Lehmann J. Black carbon decomposition under varying water regimes[J]. Organic Geochemistry, 2009, 40(8):846-853. |
| [12] | Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon(biochar)[J]. Environmental Science & Technology, 2010, 44(4):1295-1301. |
| [13] | Hamer U, Marschner B, Brodowski S, et al. Interactive priming of black carbon and glucose mineralisation[J]. Organic Geochemistry, 2004, 35(7):823-830. |
| [14] | Kuzyakov Y, Subbotina I, Chen H, et al. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling[J]. Soil Biology and Biochemistry, 2009, 41(2):210-219. |
| [15] | Farrell M, Kuhn T K, Macdonald L M, et al. Microbial utilisation of biochar-derived carbon[J]. Science of the Total Environment, 2013, 465:288-297. |
| [16] | Ameloot N, Graber E R, Verheijen F G A, et al. Interactions between biochar stability and soil organisms:Review and research needs[J]. European Journal of Soil Science, 2013, 64(4):379-390. |
| [17] | Calvelo P R, Kaal J, Camps A M, et al. Contribution to characterisation of biochar to estimate the labile fraction of carbon[J]. Organic Geochemistry, 2011, 42(11):1331-1342. |
| [18] | Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated[J]. Soil Biology and Biochemistry, 2011, 43(8):1723-1731. |
| [19] | 张齐生, 周建斌, 屈永标. 农林生物质的高效、无公害、资源化利用[J]. 林产工业, 2009, 36(1):3-8. ZHANG Qi-sheng, ZHOU Jian-bin, QU Yong-biao. High efficiency and pollution-free resources utilization of agricultural and forest biomass[J]. China Forest Products Industry, 2009, 36(1):3-8. |
| [20] | 周建斌, 张合玲, 叶汉玲, 等. 几种秸秆醋液组分中活性物质的分析[J]. 生物质化学工程, 2009, 43(2):34-43. ZHOU Jian-bin, ZHANG He-ling, YE Han-ling, et al. Analysis of active substances of several kinds of straw vinegar[J]. Biomass Chemical Engineering, 2009, 43(2):34-43. |
| [21] | Hockaday W C, Grannas A M, Kim S, et al. The transformation and mobility of charcoal in a fire-impacted watershed[J]. Geochimica et Cosmochimica Acta, 2007, 14(71):3432-3445. |
| [22] | 郭悦, 唐伟, 代静玉, 等. 洗脱处理对生物质炭吸附铜离子行为的影响[J]. 农业环境科学学报, 2014, 33(7):1405-1413. GUO Yue, TANG Wei, DAI Jing-yu, et al. Influence of elution of biochar on its adsorption of Cu(Ⅱ)[J]. Journal of Agro-Environment Science, 2014, 33(7):1405-1413. |
| [23] | 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000:152-173. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing :China Agriculture Press, 2000:152-173. |
| [24] | Cerato A B, Lutenegger A J. Determination of surface area of fine-grained soils by the ethylene(EGME) method[J]. Geotechnical Testing Journal, 2002, 25(3):315-321. |
| [25] | Boehm H P. Surface oxides on carbon and their analysis:A critical assessment[J]. Carbon, 2002, 40(2):145-149. |
| [26] | 陈水挟, 钟月明, 王将克. 一些土壤样品的氨基酸初步分析[J]. 中山大学学报(自然科学版), 1996, 35(6):106-109. CHEN Shui-xia, ZHONG Yue-ming, WANG Jiang-ke. A preliminary analysis of amino acids in some soil samples[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 1996, 35(6):106-109. |
| [27] | 高华筠, 周亚敏, 王明晖. 土壤中氨基酸的检测及组成[J]. 氨基酸和生物资源, 1995, 17(4):22-26. GAO Hua-yun, ZHOU Ya-min, WANG Ming-hui. Determination and composition of soil amino acids[J]. Amino Acids & Biotic Resources, 1995, 17(4):22-26. |
| [28] | 黄昌勇. 土壤学[M]. 北京:中国农业出版社, 2000:32-36. HUANG Chang-yong. Soil Science[M]. Beijing:China Agriculture Press, 2000:32-36. |
| [29] | 章明奎, 王浩, 郑顺安. 土壤中黑碳的表面化学性质及其变化研究[J]. 浙江大学学报(农业与生命科学版), 2009(3):278-284. ZHANG Ming-kui, WANG Hao, ZHENG Shun-an. Preliminary study of surface chemical properties and transform of black carbon in soils[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2009(3):278-284. |
| [30] | Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 2009, 174(2):105-112. |
| [31] | Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3):3488-3497. |
| [32] | Chan K Y, Van Zwieten L, Meszaros I, et al. Agronomic values of greenwaste biochar as a soil amendment[J]. Australian Journal of Soil Research, 2007, 45(8):629-634. |
| [33] | Windeatt J H, Ross A B, Williams P T, et al. Characteristics of biochars from crop residues:Potential for carbon sequestration and soil amendment[J]. Journal of Environmental Management, 2014, 146:189-197. |
| [34] | Hu Y L, Wu F P, Zeng D H, et al. Wheat straw and its biochar had contrasting effects on soil C and N cycling two growing seasons after addition to a Black Chernozemic soil planted to barley[J]. Biology and Fertility of Soils, 2014, 50(8):1291-1299. |
| [35] | Homagain K, Shahi C, Luckai N, et al. Biochar-based bioenergy and its environmental impact in Northwestern Ontario Canada:A review[J]. Journal of Forestry Research, 2014, 25(4):737-748. |
| [36] | 王英惠, 杨旻, 胡林潮, 等. 不同温度制备的生物质炭对土壤有机碳矿化及腐殖质组成的影响[J]. 农业环境科学学报, 2013, 32(8):1585-1591. WANG Ying-hui, YANG Min, HU Lin-chao, et al. Effects of biochar amendments synthesized at varying temperatures on soil organic carbon mineralization and humus composition[J]. Journal of Agro-Environment Science, 2013, 32(8):1585-1591. |
 2015, Vol. 34
2015, Vol. 34