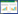文章信息
- 赵听, 张凯煜, 谷洁, 张社奇, 王小娟, 宋雯, 史龙翔, 闫法威, 潘洪加
- ZHAO Ting, ZHANG Kai-yu, GU Jie, ZHANG She-qi, WANG Xiao-juan, SONG Wen, SHI Long-xiang, YAN Fa-wei, PAN Hong-jia
- 复合菌群FWD1的木质纤维素降解特性及其微生物多样性研究
- Characteristics of Lignocellulose Degradation and the Microbial Diversity of FWD1
- 农业环境科学学报, 2015, 34(8): 1582-1588
- Journal of Agro-Environment Science, 2015, 34(8): 1582-1588
- http://dx.doi.org/10.11654/jaes.2015.08.022
-
文章历史
- 收稿日期:2015-02-11
2. 西北农林科技大学资源与环境学院, 陕西 杨凌 712100;
3. 农业部西北植物营养与农业环境重点实验室, 陕西 杨凌 712100
2. College of Resources and Environment, Northwest A&F University, Yangling 712100, China;
3. Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100, China
我国每年的秸秆产量高达6~7亿t [1],其中小麦秸秆占21%[2, 3]。小麦秸秆为木质纤维素资源,直接还田可以培肥地力,但因直接还田分解难度大,分解周期长,制约了秸秆在培肥地力方面的应用[4, 5]。在收获季节,大量的小麦秸秆在田间任意堆弃或焚烧,既浪费了宝贵的资源,又污染了环境。如何使秸秆变废为宝,对于环境建设和节能减排均有重要意义。
自然界中木质纤维素的降解是由多种微生物分泌多种活性酶协同完成的[6]。纯培养的单一菌株产生的酶种类较少或配比不均衡,因此将木质纤维素降解单菌进行组合及构建复合菌群是降解木质纤维素的有效途径[7]。而现阶段,国内外对人工组配菌群的研究主要集中于2~3种纯菌混合培养[8, 9, 10],超过5种以上菌种混合培养的报道很少。同时,还约有99%的微生物目前无法培养[11],所以人工组配的复合菌群并不符合自然状态下木质纤维素的分解条件和规律,其木质纤维素降解效率也不高。一些学者模拟自然条件下木质纤维素的分解过程,以原生态环境样品为接种物,采用限制性培养条件,构建了高效降解滤纸、水稻秸秆和纸浆废物等的复合菌群[12, 13, 14, 15, 16]。但目前对能够高效降解小麦秸秆的复合菌群的报道较少。
秦岭林地地面覆盖大量植物凋落物,该地区必定蕴含丰富的木质纤维素降解菌。本文以该地区具有较高木质纤维素降解能力的冷杉林地土壤样品(QLI)为菌种来源,连续继代培养获得了稳定高效小麦秸秆分解复合菌群FWD1,研究其降解特性,同时利用高通量测序技术分析复合菌群FWD1和菌种来源土壤样品QLI中的细菌群落组成,可为研究其协同作用机理和优化菌群奠定基础。 1 材料与方法 1.1 研究区概况
研究区位于陕西省境内太白山北坡,太白山北坡海拔800~3000 m,采样地点位于海拔800~2600 m。海拔800~1500 m,属温带季风气候,年平均气温约11 ℃,活动积温3200~3500 ℃,夏季平均气温20~23 ℃,极端最高气温35~37 ℃,冬季最冷月平均气温-7 ℃~ -2 ℃,积雪与土壤结冻期常在3个月以上。海拔1500~3000 m,全年无夏,春秋短促,冬季漫长,气候冷湿,多雨多雾。年平均气温6 ℃。活动积温1900~2500 ℃,无霜期仅140 d左右,年降水量多达750~1000 mm。 1.2 样品采集
2013年9月在秦岭山区选取竹林、槐林、栗林、柏林、槲林、华山松、锐齿栎、油松和冷杉9个土壤样品,按照五点采样法采集5~25 cm土层土样,去除石头等杂物,每个样品分为两份,一份置于4 ℃保存,另一份置于-80 ℃保存。各土壤的基本状况和性质详见表 1。
自然收获的隔年小麦秸秆经1.5% NaOH碱液浸泡48 h,用自来水冲洗数次,用清水浸泡1~2 d,用盐酸调节pH为7.0左右,105 ℃烘干后备用。 1.4 筛选培养基
Mandels培养基:(NH4)2SO4 1.4 g·L-1,MgSO4·7H2O 0.3 g·L-1,KH2PO4 2.0 g·L-1,CaCO3 2.0 g·L-1,FeSO4·7H2O 5.0 g·L-1,MnSO4 1.6 mg·L-1,ZnCl2 1.7 mg·L-1,CoCl2 1.7 mg·L-1,蛋白胨2.5 g·L-1,pH 7.0。小麦秸秆作为碳源,添加量为0.5%。 1.5 试验方法 1.5.1 土壤性质测定
pH值使用PHS-3C型数字pH计测定(土壤m∶水V=1 g∶10 mL),含水量采用减重法测定。 1.5.2 复合菌群FWD1的驯化培养
取采集到的9份土壤样品各4 g分别接种于80 mL的液体培养基中,于不同时间观察小麦秸秆分解情况,测定培养至16 d的秸秆分解率,选取对小麦秸秆分解效果最好的培养物进行连续传代培养。当肉眼看到小麦秸秆的主体结构被分解成丝状后即转接传代,利用聚合酶链式-变性梯度凝胶电泳(PCR-DGGE)[17]检测微生物群落结构的变化,直到分子指纹图谱稳定,获得结构稳定的复合菌群为止,命名为FWD1。初始菌源富集培养为1代,以后转接依次为2、3、4…n代,每10 d转接一代。以下试验操作都是在复合菌群FWD1结构稳定后以第23代培养物为对象进行的。 1.5.3 小麦秸秆分解率的测定[18]
发酵前称量添加干秸秆的质量,发酵结束后,发酵剩余物8000 r·min-1离心10 min,弃去上清液,然后用去离子水洗2次,收集沉淀物于105 ℃烘干至恒重,计算麦秸失重和分解率,以不接菌处理作为对照,设置3个重复。 1.5.4 小麦秸秆降解液组成分析
发酵液12 000 r·min-1离心10 min后用0.45 μm微孔滤膜过滤,用日本岛津GC-14C型气相色谱测定。色谱条件为:色谱柱为DB-WAX毛细管柱(30 m×0.320 mm×0.5 μm),FID氢火焰检测器,载气为氮气,柱温190 ℃,进样口温度220 ℃,检测器温度为250 ℃。程序升温过程如下:60 ℃保持2 min,然后以15 ℃·min-1升至110 ℃,再以l0 ℃·min-1升至180 ℃。
分别称取乙醇、乙酸、丙酸和丁酸各1 g,用超纯水定容到500 mL容量瓶中,得标准储备液(2000 mg·L-1)。使用时,分别取1、2、3、4、5 mL标准储备液到100 mL容量瓶中,定容混匀,该曲线浓度分别为20、40、60、80、100 mg·L-1,绘出混合液的标准曲线,采用外标法测定发酵液中乙醇和各种有机酸浓度。混合标准溶液的气相色谱图如图 1所示。
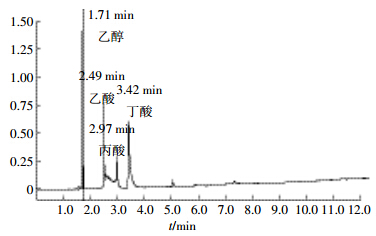
|
| 图 1 混合标准溶液的气相色谱图 Figure 1 Gas chromatogram of mixed standard solution |
采用Soil DNA Kit试剂盒(OMEGA公司)提取土壤样品及第23代培养物的DNA,1%琼脂糖凝胶电泳检测DNA完整性。利用细菌16S rRNA基因的通用引物515(5′-GTGCCAGCMG-CCGCGG- 3′)和907R(5′- CCGTCAATTCMTTTRAGTTT-3′)扩增其V4-V5区基因片段,修饰后的通用引物含有不同的Tag标签用以区分不同样品。扩增程序如下:95 ℃预变性2 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,25个循环,72 ℃终延伸10 min后结束。PCR产物经过切胶纯化、等摩尔数混合后以备高通量测序分析。
高通量数据分析采用Quantitative Insights Into Microbial Ecology(QIIME)。只有序列长度大于50 bp,平均质量得分大于20,连续相同碱基小于6,模糊碱基小于2的序列才能进行后续分析[19]。利用一个自定义代码通过完全连锁聚类运算,读段聚集成为最小分类单元(OTU)[20]。选取相似度在97%条件下的OTU,得到稀释曲线、细菌多样性指数和群落结构。高通量分析具体流程参考已有的方法[21]。 1.6 数据处理与分析
所有试验数据采用Excel 2007进行均值和标准差计算并作图,采用DPS 7.05统计分析软件对数据进行单因素方差分析,采用t-test检测显著性差异(LSD)。 2 结果与分析 2.1 复合菌群FWD1的构建及其分解效果
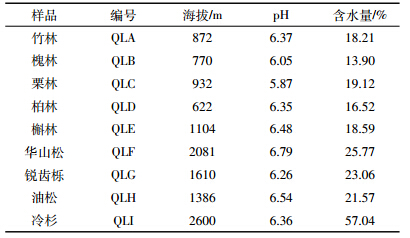
9份土壤样品在富集培养16 d后,QLI样品对秸秆的分解率最高,达到41.28%(表 2),以该样品为菌种来源进行复合菌群的筛选。筛选过程中,以第7代、第9代、第11代、第15代和第23代培养物的基因组DNA为模板,对其16S rRNA基因的V3区域进行细菌PCR-DGGE分析,以检测该菌群的群落结构变化。结果表明,第9代、第11代、第15代和第23代的主要细菌组成条带位置和亮度均未发生变化(图 2),表明至第9代时,培养物中细菌的群落组成结构已经稳定,至此获得了结构稳定的小麦秸秆分解复合菌群FWD1。该菌群在10 d内对小麦秸秆的分解率达到76.92%(表 2),与QLI样品有极显著差异。
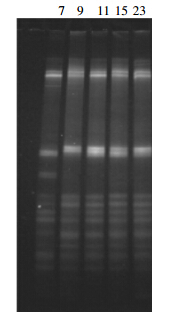
|
| 图 2 16S rRNA 基因 PCR-DGGE 图谱 Figure 2 PCR-DGGE patterns of 16S rRNA gene from different generations |
由图 3可见,复合菌群FWD1分解小麦秸秆过程中发酵液成分主要为乙酸、丙酸、丁酸和乙醇,其中乙酸的含量最高。培养过程中,乙酸浓度呈现出先升高后降低,再升高的趋势。在发酵第1 d时乙酸的含量为140.14 mg·L-1,第3 d时就达到了最大值655.54 mg·L-1;而乙醇、丙酸和丁酸分别在第1、3、7 d时达到最大值18.87、127.17、27.47 mg·L-1。
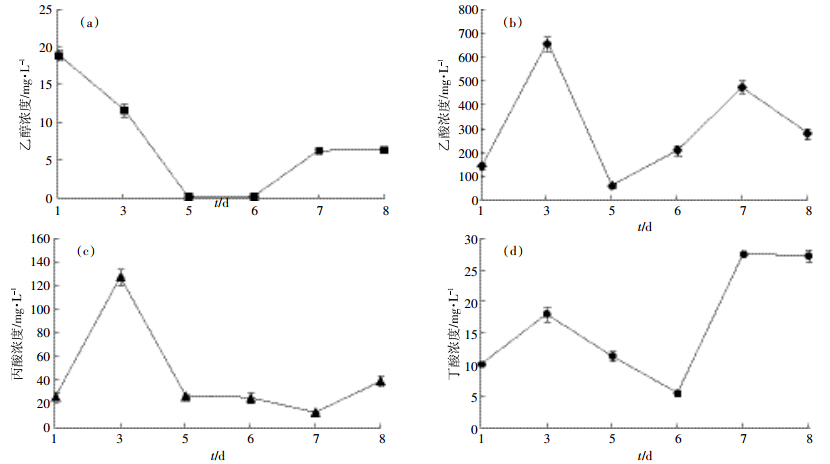
|
| 图 3 发酵过程中乙醇和有机酸浓度变化 Figure 3 Changes of organic acids and ethanol concentrations during wheat straw degradation |
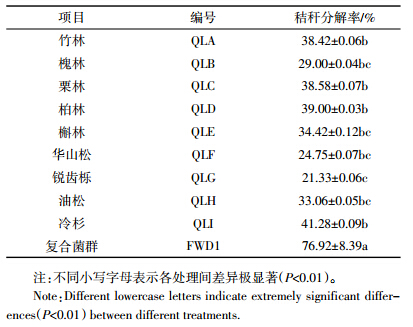
对FWD1和QLI中的细菌16S rRNA基因序列进行高通量测序的结果表明(图 4),删除低质量序列后,在97%的序列相似度水平上,FWD1和QLI获得的细菌OTU分别为44和382,序列读数分别为23 912和10 248。
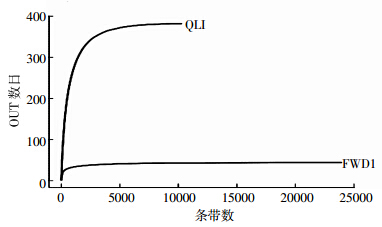
|
| 图 4 相似度为 0.97 条件下 FWD1 和 QLI 的稀释曲线 Figure 4 Rarefaction curves of OTUs clustered at 97% sequence identity across FWD1 and QLI |
稀释曲线可以用来说明样本的测序数据量是否合理。从图 4可以看出,FWD1和QLI的稀释曲线均趋向于平缓,说明测序数据量合理,能够比较真实地反映样品的细菌群落,代表细菌群落多样性。 2.4 FWD1和QLI中细菌群落多样性指数分析
FWD1和QLI中细菌群落的丰富度指数(Chao)、均匀度指数(Ace)和多样性指数(Shannon和Simpson)见表 3。就物种丰富度而言,QLI比FWD1高,表明FWD1中细菌的物种数量可能减少。Ace指数变化显示FWD1中细菌群落均匀度下降,反映出FWD1中某些细菌种群发育较好,在群落中的优势度上升,相反原本在QLI中生长发育良好的细菌受到抑制甚至消失。FWD1中细菌种群优势度的变化可能与其丰富度的变化有关,但这也反映出在选择性底物作用下只富集了特定的微生物菌群。较高的Shannon指数表明,与稳定的复合菌群相比,原始土壤样品具有更高的微生物多样性。
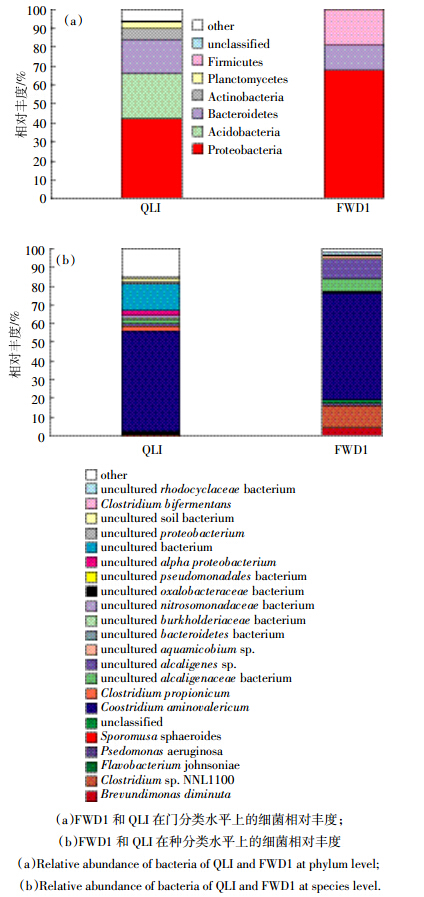
FWD1和QLI在门和种分类水平上的细菌相对丰度如图 5所示。
|
| 图 5 FWD1 和 QLI 在门和种分类水平上的细菌相对丰度 Figure 5 Relative abundance of bacteria of FWD1 and QLI at both phylum and species levels |
在门的分类水平上(图 5a),小麦秸秆分解复合菌群FWD1中的细菌种类相对较少,主要含有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),分别占细菌总量的67.41%、19.25%和13.34%。QLI中的细菌类型丰富,主要包括变形菌门、酸杆菌门(Acidobacteria)、拟杆菌门、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)等菌群,其中变形菌门、酸杆菌门和拟杆菌门在土壤细菌中相对丰度较高,分别为41.61%、24.04%和18.03%。经过长期筛选进化,FWD1中富集了变形菌门和厚壁菌门。
在种的分类水平上(图 5b),FWD1中共确定出21种细菌,其中Clostridium sp. BNL1100,uncultured Alcaligenes sp.,uncultured Alcaligenaceae bacterium和Brevundimonas diminuta为优势菌,分别占细菌总量的11.80%、10.30%、6.70%和3.60%。QLI中的细菌主要由uncultured bacterium,uncultured Bacteroidetes bacterium和uncultured alpha-proteobacterium等组成。在选择性底物作用下,FWD1中富集了以Clostridium sp. BNL1100为主的菌株,其所占比例从0.01%上升到11.80%。 3 讨论
在自然界中,木质纤维素的降解是多种微生物协同作用的结果,微生物不同降解效率不同[32] 。本文筛选和驯化了小麦秸秆分解复合菌群FWD1,该菌群10 d内对秸秆的分解率达到76.92%,代谢产物主要为乙酸、丙酸、丁酸和乙醇,其中乙酸含量最高。研究表明适宜甲烷发酵的最佳发酵产物顺序为一碳有机化合物、乙酸、乙醇和丁酸[22],因此可以将复合菌群FWD1应用于提高甲烷发酵的效果,例如将复合菌群作为甲烷发酵系统中水解酸化相的接种物,提高水解酸化程度,进而提高产沼气速率[23, 24];或者在发酵反应器启动过程中添加复合菌群,从而加快启动速度[25]。
高通量测序结果表明,FWD1中主要含有变形菌门、厚壁菌门和拟杆菌门,与杜然等[26]、Wongwilaiwalin等[27]和乔江涛等[28]的研究结果相似,说明微生物协同降解木质纤维素的机制可能相似。更细化分类水平上,FWD1中主要包括丰度最高的Clostridium sp. BNL1100和一些不同需氧程度的uncultured Alcaligenes sp.,uncultured Alcaligenaceae bacterium和Brevundimonas diminuta。研究表明Clostridium sp. BNL1100分离自以玉米秸秆为碳源的富集培养物中,是重要的纤维素降解菌[29, 30]。从微生物组成上可以看出,除了具有纤维素降解能力的梭菌存在外,菌群中还有其他的具有木质纤维素降解活性或不具有该活性的菌株。这与Mitchell等[31]在不同的生物质降解环境中能同时检测到厌氧的木质纤维素降解菌株和兼性厌氧的非功能菌株的结果是一致的。其中的非功能好氧菌可能在为木质纤维素降解功能菌提供厌氧环境、生长促进因子及中和pH方面起着至关重要的作用[32, 33],另外部分菌株在生长过程中产生的表面活性剂类代谢产物也会在一定程度上促进木质纤维素降解[34, 35],正是在这些菌群的共同作用下实现了木质纤维素的高效降解。
经过长期筛选进化,复合菌群FWD1细菌多样性下降,然而在选择性底物作用下富集了特定的微生物菌群,在门的级别上富集了变形菌门和厚壁菌门,在种的级别上富集了以Clostridium sp. BNL1100为主的纤维素降解菌。这也进一步解释了在木质纤维素分解能力上,复合菌群FWD1相对于原始土壤样品QLI具有显著优势的原因。
复合菌群FWD1高效的木质纤维素降解能力,必然与菌群中木质纤维素降解酶的协同降解作用密切相关。因此,可以进一步利用宏基因组技术对该菌群中相关的木质纤维素降解酶基因进行克隆表达,并利用表达产物对木质纤维素进行直接酶解糖化,从而有效发挥复合菌群在农业废弃物能源转化方面的潜能。 4 结论
本实验采用限制性培养条件和连续继代培养,构建了小麦秸秆分解复合菌群FWD1。该菌群在10 d内对小麦秸秆的分解率达到76.92%,代谢产物以乙酸为主。
高通量测序结果表明,复合菌群FWD1中主要含有变形菌门、厚壁菌门和拟杆菌门,在种的分类水平上Clostridium sp. BNL1100,uncultured Alcaligenes sp.,uncultured Alcaligenaceae bacterium和Brevundimonas diminuta为优势菌群。在选择性底物作用下,富集了变形菌门和厚壁菌门,更细化分类水平上,富集了以Clostridium sp. BNL1100为主的纤维素降解菌。
| [1] | 中国农业年鉴编辑委员会.中国农业年鉴[M].北京:中国农业出版社,2005:177.Editorial committee of agricultural yearbook Chinese.Chinese agricultural yearbook[M].Beijing:China Agriculture Press,2005:177. |
| [2] | 张荣成,李秀金.作物秸秆能源转化技术研究进展[J].现代化工,2005,25(6):14-17.ZHANG Rong-cheng,LI Xiu-jin.Advances in research on energy conversion technologies for crop stalks[J].Modern Chemical Industry,2005,25(6):14-17. |
| [3] | 高祥照,马文奇,马常宝,等.中国作物秸秆资源利用现状分析[J].华中农业大学学报,2002,21(3):242-247.GAO Xiang-zhao,MA Wen-qi,MA Chang-bao,et al.Analysis on the current status of utilization of crop straw in China[J].Journal of Huazhong Agricultural University,2002,21(3):242-247. |
| [4] | McKendry P.Energy production from biomass (part 1):Overview of biomass[J].Bioresource Technology,2002,83(1):37-46. |
| [5] | 孙颉,胡敏,谢笔钧.秸秆还田的效果与方法[J].精细化工,2000,17(7):431-434.SUN Jie,HU Min,XIE Bi-jun.The effects and methods of straw-fertilizing-field[J].Fine Chemicals,2000,17(7):431-434. |
| [6] | MartínezÁT,Speranza M,Ruiz-Dueñas F J,et al.Biodegradation of lignocellulosics:Microbial,chemical and enzymatic aspects of the fungal attack of lignin[J].International Microbiology,2010,8(3):195-204. |
| [7] | Lynd L R,Weimer P J,Van Zyl W H,et al.Microbial cellulose utilization:Fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506-577. |
| [8] | Gutierrez-Correa M,Portal L,Moreno P,et al.Mixed culture solid substrate fermentation of Trichoderma reesei with Aspergillus niger on sugar cane bagasse[J].Bioresource Technology,1999,68(2):173-178. |
| [9] | Thierie J,Penninckx M J.Modeling of competitive mutualistic relationships:Application to cellulose degradation by Streptomyces sp.Strains[J].Current Microbiology,2007,55:507-511. |
| [10] | 卢月霞,陈凯.纤维素降解菌的筛选及相互作用分析[J].安徽农业科学,2007,35(1):11,17.LU Yue-xia,CHEN Kai.Screening of cellulose decomposition microorganisms and analysis of their reciprocity[J].Journal of Anhui Agricultural Sciences,2007,35(1):11,17. |
| [11] | Amann R I,Ludwig W,Schleifer K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169. |
| [12] | Haruta S,Cui Z,Huang Z,et al.Construction of a stable microbial community with high cellulose-degradation ability[J].Applied Microbiology and Biotechnology,2002,59(4-5):529-534. |
| [13] | Feng Y,Yu Y,Wang X,et al.Degradation of raw corn stover powder (RCSP) by an enriched microbial consortium and its community structure[J].Bioresource Technology,2011,102(2):742-747. |
| [14] | Wang W,Yan L,Cui Z,et al.Characterization of a microbial consortium capable of degrading lignocellulose[J].Bioresource Technology,2011,102(19):9321-9324. |
| [15] | Wongwilaiwalin S,Rattanachomsri U,Laothanachareon T,et al.Analysis of a thermophilic lignocelluloses degrading microbial consortium and multi-species lignocellulolytic enzyme system[J].Enzyme and Microbial Technology,2010,47(6):283-290. |
| [16] | 秦莉,高茹英,徐亚平,等.堆肥中高效降解纤维素及金霉素和土霉素的复合菌系的构建[J].农业环境科学学报,2014,33(3):465-470.QIN Li,GAO Ru-ying,XU Ya-ping,et al.Construction of a high-efficiency complex microbial system to degrade cellulose and chlortetracycline and oxytetracycline in compost[J].Journal of Agro-Environment Science,2014,33(3):465-470. |
| [17] | 刘真,邵宗泽.南海深海沉积物烷烃降解菌的富集分离与多样性初步分析[J].微生物学报,2007,47(5):869-873.LIU Zhen,SHAO Zong-ze.The diversity of alkane degrading bacteria in the enrichments with deep sea sediment of the South China Sea[J].Acta Microbiologica Sinica,2007,47(5):869-873. |
| [18] | AHAP (American Public Heath Association,American Water Works Association,Water Environment Federation).Standard methods for the examination of water and wastewater[M].20th ed.Washington:AHAP American Public Heath Association,1998. |
| [19] | 田地,马欣,李玉娥,等.利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J].环境科学,2013,34(10):4096-4104.TIAN Di,MA Xin,LI Yu-e,et al.Research on soil bacteria under the impact of sealed CO2 leakage by high-throughput sequencing technology[J].Environmental Science,2013,34(10):4096-4104. |
| [20] | Edgar R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461. |
| [21] | 周文萍,向丹,胡亚军,等.长期围封对不同放牧强度下草地植物和AM真菌群落恢复的影响[J].生态学报,2013,33(11):3383-3393.ZHOU Wen-ping,XIANG Dan,HU Ya-jun,et al.Influences of long-term enclosure on the restoration of plant and AM fungal communities on grassland under different grazing intensities[J].Acta Ecologica Sinica,2013,33(11):3383-3393. |
| [22] | 任南琪,王爱杰,马放.产酸发酵微生物生理生态学[M].北京:科学出版社,2005.REN Nan-qi,WANG Ai-jie,MA Fang.Physiological ecology of acidogens in anaerobic biotreatment process[M].Beijing:Science Press,2005. |
| [23] | Mshandete A,Bjrnsson L,Kivaisi A K,et al.Enhancement of anaerobic batch digestion of sisal pulp waste by mesophilic aerobic pre-treatment[J].Water Research,2005,39(8):1569-1575. |
| [24] | Hagesawa S,Shiota N,Katsura K,et al.Solubilization of organic sludge by thermophilic aerobic bacteria as a pretreatment for anaerobic digestion[J].Water Science and Technology,2000,41(3):163-169. |
| [25] | Bagi Z,Acs N,Bálint B,et al.Biotechnological intensification of biogas production[J].Applied Microbiology and Biotechnology,2007,76(2):473-482. |
| [26] | 杜然,李十中,章晓庆,等.兼性厌氧复合菌群H纤维素降解和产乙醇能力及生态组成初探[J].生物工程学报,2010,26(7):960-965.DU Ran,LI Shi-zhong,ZHANG Xiao-qing,et al.Cellulose hydrolysis and ethanol production by a facultative anaerobe bacteria consortium H and its identification[J].Chinese Journal of Biotechnology,2010,26(7):960-965. |
| [27] | Wongwilaiwalin S,Laothanachareon T,Mhuantong W,et al.Comparative metagenomic analysis of microcosm structures and lignocellulolytic enzyme systems of symbiotic biomass-degrading consortia[J].Applied Microbiology and Biotechnology,2013,97(20):8941-8954. |
| [28] | 乔江涛,郭荣波,袁宪正,等.玉米秸秆厌氧降解复合菌系的微生物群落结构[J].环境科学,2013,34(4):1531-1539.QIAO Jiang-tao,GUO Rong-bo,YUAN Xian-zheng,et al.Phylogenetic analysis of methanogenic corn stalk degrading microbial communities[J].Environmental Science,2013,34(4):1531-1539. |
| [29] | Li L L,Taghavi S,Izquierdo J A,et al.Complete genome sequence of Clostridium sp.strain BNL1100,a cellulolytic mesophile isolated from corn stover[J].Journal of Bacteriology,2012,194(24):6982-6983. |
| [30] | Mu W,Zhang W,Fang D,et al.Characterization of a d-psicose-producing enzyme,d-psicose 3-epimerase,from Clostridium sp.[J].Biotechnology Letters,2013,35(9):1481-1486. |
| [31] | Mitchell W J.Physiology of carbohydrate to solvent conversion by clostridia[J].Advances in Microbial Physiology,1997,39:31-130. |
| [32] | Kato S,Haruta S,Cui Z J,et al.Stable coexistence of five bacterial strains as a cellulose-degrading community[J].Applied and Environmental Microbiology,2005,71(11):7099-7106. |
| [33] | Kato S,Haruta S,Cui Z J,et al.Network relationships of bacteria in a stable mixed culture[J].Microbial Ecology,2008,56:403-411. |
| [34] | 曾晶,叶媛,龚大春,等.表面活性剂对纤维素酶水解过程的影响[J].酿酒科技,2009(12):38-40.ZENG Jing,YE Yuan,GONG Da-chun,et al.Effects of the use of surface active agents on the hydrolysis of cellulase[J].Liquor-Making Science&Technology,2009(12):38-40. |
| [35] | Jan B K,Johan B,Maria H B,et al.Use of surface active additives in enzymatic hydrolysis of wheat straw lignocelluloses[J].Enzyme and Microbial Technology,2006,7(14):1-8. |
 2015, Vol. 34
2015, Vol. 34