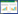文章信息
- 王京文, 李丹, 柳俊, 侯昌萍, 张奇春
- WANG Jing-wen, LI Dan, LIU Jun, HOU Chang-ping, ZHANG Qi-chun
- 耐镉菌株对土壤镉形态及土壤微生物群落结构的影响
- Effects of Cadmium Tolerant Bacteria on Soil Cadmium Forms and Microbial Community Structure
- 农业环境科学学报, 2015, 34(9): 1693-1699
- Journal of Agro-Environment Science, 2015, 34(9): 1693-1699
- http://dx.doi.org/10.11654/jaes.2015.09.010
-
文章历史
- 收稿日期: 2015-04-07
2. 浙江大学环境与资源学院, 杭州 310058
2. College of Environmental and Resource Sciences, Zhejiang University, Hangzhou 310058, China
镉因移动性大、毒性高、污染面积广被称为“五毒之首”。矿产资源的不合理开采及废物排放等因素导致我国土壤镉污染严重[1]。目前,重金属的修复方法主要有化学修复、生物修复和动物修复[2]。微生物特别是细菌数量多、比表面积大、带电、代谢活动旺盛,在修复被重金属污染的土壤方面具有独特的作用,不仅可以通过吸附和累积重金属降低土壤中重金属的毒性,以此来净化有毒金属污染或回收有经济价值的金属[3, 4],而且可以通过其代谢活动及代谢产物促进重金属的溶解,使土壤中呈固态的重金属活化成为可溶态或交换态[5, 6],便于植物吸收富集,因而大幅度提高植物修复效率,解决植物修复技术(Phytoremediation)中土壤重金属低生物有效性的限制。许多研究者对土壤中的耐镉菌进行了研究,但已报道的大部分微生物修复技术只局限在科研和实验室水平,实例研究还不多。
土壤中微生物数量巨大、种类繁多,是土壤中最为活跃的生物群体[7]。土壤微生物在土壤的物质循环和能量流动等方面发挥着巨大作用,推动着土壤有机质的矿化。但是土壤微生物具有复杂性,当外源微生物添加之后,必然会引起土壤微生物群落结构的变化,但目前对其原因及发生变化微生物的种类都不明确。Biolog-ECO微平板技术是以碳源利用为基础的定量分析,为描述微生物群落功能多样性提供了一种行之有效而快速的方法,并且已被广泛应用[8, 9]。磷脂脂肪酸(PLFA)是活生物体细胞膜的重要成分,不同种类的微生物可以通过不同的生化途径生成不同的磷脂脂肪酸,磷脂构成的变化能够反映样品中微生物群落结构的变化,通过此方法可以对不同土壤微生物群落,如表征细菌、真菌、放线菌、革兰氏阳性细菌、革兰氏阴性细菌的磷脂脂肪酸标进行识别和定量描述[10, 11, 12]。因此,本研究联合运用Biolog法和PLFA法,在筛选和鉴定对镉具有活化作用的细菌基础上,研究其对土壤镉形态以及土壤微生物群落结构的影响,弄清土壤微生物与耐镉菌之间的相互关系,对于微生物在修复被重金属污染的土壤方面具有重要的指导意义。
1 材料与方法 1.1 样品采集土壤样品采自浙江省富阳电镀厂附近土壤(采样深度0~20 cm),共采集5个混合样。该地区属亚热带季风气候,冬季多偏北风和西北风,风速较大;夏季多东南风及西南风,风速较小。年均气温16.1℃,7—8月最热,1月最冷,年均日照时数1 927.7 h,无霜期约231 d,年均降雨量1 441.9 mm。供试土壤基本理化性质及重金属含量如表 1。
取10 g土样4份,无菌条件下将其置于装有适量玻璃珠和90 mL无菌水的三角瓶中,在旋转式摇床上150 r·min-1、28℃振荡30 min后稀释到10-3 、10-4、10-5,分别取200 μL 涂布在含有100 mg·L-1镉的牛肉膏蛋白胨培养基平板上,于28℃培养箱中倒置培养2~3 d。将平板表面形态有差异单菌落挑出,然后在含100 mg·L-1镉的平板上划线,经过七次划线培养,分离出耐镉的纯种细菌菌株并制成菌液。分别准确吸取各菌液 1 mL 接入 100 mL 预先灭菌的牛肉膏蛋白胨液体培养基,培养基含镉浓度为 100 mg·L-1(先将3CdSO4·8H2O溶液单独灭菌,然后将一定体积的该溶液加入到牛肉膏蛋白胨液体培养基中,使培养基中镉的终浓度为100 mg·L-1,培养液中可见一定的沉淀物),于28℃下振荡培养 48 h。取 5 mL 培养液,10 000 r·min-1 离心 10 min,取 1 mL 上清液,用火焰光度计测定镉的浓度,计算活化率,筛选活化率最高的菌株。
1.3 耐镉菌株16S rDNA的PCR扩增和序列测定将筛选出的菌株摇床培养至对数期,离心并收集菌体,抽取基因组DNA。采用细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-TACCTTGTTACGACTT-3′)对菌株分别扩增总DNA中的细菌16S rDNA片段。
PCR反应条件:94℃变性5 min;94℃ 30 s,55℃ 45 s,72℃ 45 s,35个循环;最后72℃延伸7 min。PCR扩增体系20 μL,各组分如下:2x Easytap MIX 10 μL;引物27f(10 μmol·L-1)1 μL;引物1492r(10 μmol·L-1)1 μL;DNA模板1 μL;ddH2O 7 μL。扩增产物用DNA回收试剂盒(上海生工)回收后连接到pMD18-Tector(大连宝生物工程)转化到E.coli DH5α中,挑取阳性克隆子,由上海生工生物工程公司进行测序。测得的DNA序列经NCBI(National Center for Biotechnology Information)BLAST引擎搜索后,用CLUSTAL X (Ver.1.8)软件将这些序列与若干个近缘种以及其他几个系统发育相关属的16S rRNA基因序列进行排列比对。利用MEGA 5.05软件构建细菌的系统进化树,综合各菌株的理化性质测定结果确定分类地位。
1.4 耐镉菌株对土壤镉形态及微生物影响的培养试验处理T:将鉴定的菌株制成菌悬液,28℃ 培养18 h,接入富阳电镀厂被镉污染的土壤中,使菌株的细胞数量达到8.0×106~9.0×106 CFU·g-1土。处理C:不加菌液,加液体培养基。各处理均为5个重复,分别为T1~T5和C1~C5。28℃ 恒温培养5 d后进行土壤重金属Cd的形态和微生物群落功能和结构多样性分析。
土壤重金属Cd的形态采用Tessier多级连续提取法[13, 14],土壤微生物功能多样性采用含有31种碳源的Biolog-ECO微平板培养技术测定。具体方法为:称取新鲜土样5.00 g,加入45 mL无菌水在摇床上振荡30 min,然后将土壤样品稀释1000倍,再从中取150 μL该悬浮液接种到Biolog-ECO 微平板的每一个孔中,于1 h内测定第一次吸光值,最后将接种的微平板放在28℃的恒温培养箱中暗培养152 h,每隔12 h采用BIOLOG读数仪(BIOLOG,Hayward,USA)测定各孔在750 nm 和590 nm 波长下的光吸收值。土壤微生物结构多样性采用传统的PLFA法[15],称取土样2.0 g于试管内,用氯仿-甲醇-柠檬酸缓冲液(体积比1∶2∶0.8)振荡提取脂类,通过硅胶柱层析分离得到磷酸酯脂肪酸,碱性甲酯化后用气相色谱分析各种脂肪酸的含量。
1.5 数据处理以每孔平均吸光度(Average well color development,简称AWCD)作为整体活性的有效指数之一。采用Excel 2003计算土壤微生物AWCD值及多样性指数,并采用SPSS 19.0进行方差分析和主成分分析。
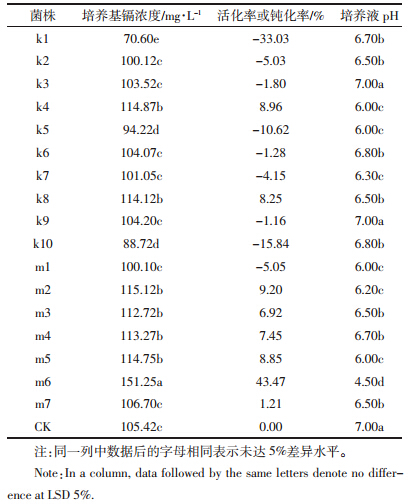
2 结果与讨论 2.1 耐镉细菌的筛选与鉴定从污染土壤样品中共分离到生长良好的耐镉菌17株,生长较快的用k命名,生长较慢的用m命名,分别命名为k1~k10和m1~m7。这些菌株呈杆状,末端呈圆形。在LB琼脂平板上,k1~k10耐镉菌表面光滑湿润,边缘整齐,生长快,颜色为白色或暗黄;m1~m10耐镉菌表面粗糙干燥,边缘整齐,生长慢。从表 2可以看出,分离的17株耐镉菌株中9株表现出对液体中镉的浓度具有不同程度的钝化作用,占到分离菌株的53%。从表 2中可以看出,大部分使镉浓度降低的菌是以k命名的,说明生长较快的菌表现出对镉的钝化。研究[16] 表明微生物特别是细菌,数量多、比表面积大、带电、代谢活动旺盛,可通过多种方式对重金属进行生物吸附。耐镉菌中k1对液体中有效镉吸附能力较强,使液体中有效镉的浓度降低了33%。对比k1,其他菌株对有效镉的吸附能力一般。除了9株耐镉菌对有效镉表现出吸附能力,其他8株菌一致表现出对液体培养基中重金属镉的活化作用。从表 2还可以看出,接种耐镉菌分别使培养液中有效态镉的浓度增加了1.21%~43%,其中耐镉菌m6使培养液中有效态镉增加了43.47%,为活化率最高值。不接菌的培养液pH值为7.0,接种耐镉菌株m6的培养液pH值为4.5,说明这些菌株在生长代谢过程中产生大量酸性物质,而这些酸性物质可能会使培养基中原来处于沉淀态的重金属被活化成为可溶态离子[17]。根据本实验目的,选择活化率最高的m6菌株进行分析。将m6的16S rDNA部分序列(Gene Bank上的注册号为KM349307)在NCBI上进行BLAST比较,结果表明m6与Arthrobacter的16S rDNA序列具有99%的同源性,从系统进化树(图 1)可以看出,m6菌株同Arthrobacter scleromae和Arthro-bacter aurescens两个种关系密切。在系统发育地位上属于Bacteria,Actinobacteria,Actinobacteridae,Actinomycetales,Micrococcineae,Arthrobacter。节杆菌(Arthrobacter)属于革兰氏阳性菌,是所有土壤细菌中最为常见的细菌之一,有明显的生长周期,不形成芽孢,不运动,专性好氧,化能异氧,呼吸代谢,不发酵。综上可见,m6代表了在系统发育上明显不同的类群。
 |
|
| 图 1 细菌m6的16S rDNA序列的系统发育树 Figure 1 Phylogenetical tree based on 16S rDNA sequence of strain m6 |
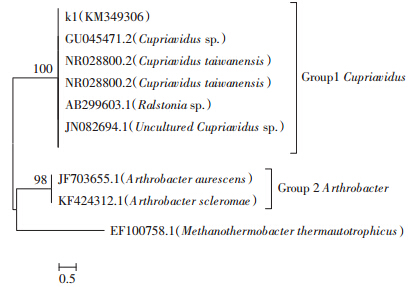
供试土壤为富阳电镀厂附近被镉污染的土壤,平均总镉浓度为4.15 mg·kg-1,可见研究区内重金属镉的含量较高,既超过全国土壤背景值(0.097 mg·kg-1)[18],也超过国家土壤环境质量二级标准0.6 mg·kg-1(pH>7.5)。根据改进的Tessier连续提取法,将重金属镉形态分为水溶态、可交换态、铁锰氧化物结合态、有机物结合态及残渣态。一般认为,水溶态和可交换态是生物可利用态;有机态和铁锰态为生物潜在可利用态;残渣态重金属为生物不可利用态。如表 3所示,不管是菌株处理前还是处理后,土壤重金属镉各形态均表现为铁锰氧化物结合态>残渣态>可交换态>有机态>水溶态。培养处理前铁锰氧化物结合态所占比例为67%,残渣态为29%,可交换态、有机态和水溶态分别占总量的5%、3.7%和0.08%。由于供试土壤重金属镉水溶态和可交换态含量低,镉迁移性不大,不容易被生物吸收利用,但铁锰氧化物结合态和残渣态含量高,说明土壤中不但生物不可利用态含量较高,而且生物潜在可利用态最高,如果在比较强的酸性介质以及适当的环境条件下可以增加镉的利用性。经过菌株m6处理后,土壤中水溶态镉增加了2倍多,可交换态镉增加了16%,而铁锰态和有机态镉却不同程度地下降,说明菌株m6可使土壤中难溶态镉向有效态镉转化,能够作为较好的试验材料应用于抗性菌株强化植物富集重金属镉的研究中。
 |
已有研究[19, 20] 表明外源菌液施入农田土壤明显改变了土著土壤微生物区系。目前已对耐镉菌的微生态进行了一些研究,如刘爱民等[21]应用PCR-DGGE技术研究表明镉铜污染尾矿物添加耐镉、铜菌剂可提高尾矿中土著微生物的活性和群落丰富度,为进一步了解耐镉菌株添加后对土壤微生物功能和群落结构的影响,本文采用Biolog法和PLFA法对培养前后的土壤微生物功能多样性和结构多样性进行了初步研究。
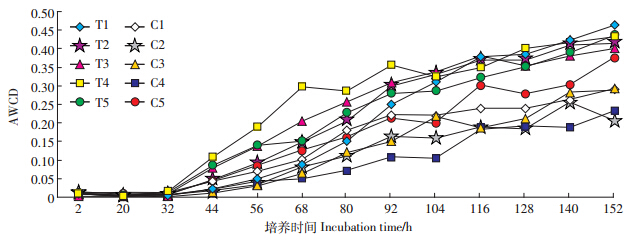
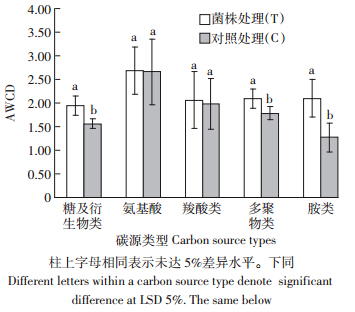
Biolog-ECO法通过土壤微生物对不同碳源利用能力差异的研究,可深入了解微生物群落的结构组成,是描述土壤微生物群落特征的一个重要指标,土壤微生物群落功能多样性可反映群落总体的动态变化。图 2为Biolog-ECO微平板样品的AWCD值随培养时间的变化情况。在32 h之内,AWCD值很小,几乎没有变化,表明此时能源碳基本上未被利用,此后AWCD值不断增加。在相同的培养时间点,T1~T5的AWCD值均高于对照,分别比C1~C5提高14%~146%,说明外源添加耐镉菌株后土壤的微生物活性明显增强,代谢加快。土壤微生物多样性反映了群落总体的变化,但不能反映群落代谢的详细信息,研究土壤微生物对不同碳源的利用能力大小可反映出微生物群落的结构组成差异,有助于更全面地了解土壤微生物群落代谢功能特性[22]。结合有机化合物化学官能团、微生物生理代谢途径和生态功能三方面,将Biolog-ECO微平板上的31种碳源划分为糖及其衍生物类、氨基酸类、羧酸类、酚酸类、多聚物类和胺类六大类型[23]。从对碳源的综合利用情况分析,施入菌液后土壤微生物群落对碳源的利用能力增强 ,主要表现对糖及衍生物、胺类碳源和多聚物类利用程度显著增加(图 3)。
|
| 图 2 菌株处理(T)和对照处理(C)土壤在BIOLOG 测试中AWCD随培养时间的变化 Figure 2 Average well color development(AWCD) in different treatments over incubation time(T:Strain inoculation; C:Control) |
|
| 图 3 菌株处理土壤微生物群落对不同碳源的利用强度 Figure 3 Carbon metabolic intensity of soil microbial community in different treatments |
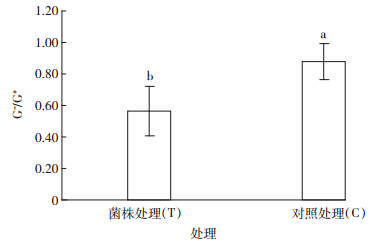
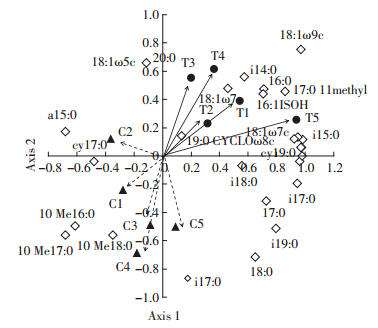
我们进一步运用磷脂脂肪酸法(PLFA),对接种耐镉菌株的土壤微生物群落结构多样性进行定量描述。各个处理中通过磷脂脂肪酸(PLFA)法检测出了从C14到C20共26种脂肪酸(数据未列出)。与不接种m6(C)相比,接种土壤的脂肪酸的总量增加了23.65%,i14∶0、i15∶0、a15∶0、15∶0、i16∶0、i17∶0、a17∶0、cy17∶0、17∶00、i18∶0、18∶1ω9c、18∶1ω7c等脂肪酸含量都有不同程度的增加,增幅在5%~20%之间。接种处理(T)土壤中G-/G+为0.54,比对照降低38.6%,说明经过接种处理土壤中的革兰氏阳性菌的比例增加,而革兰氏阴性菌的比例下降(图 4)。对各个磷脂脂肪酸含量进行主成分分析(PCA)可知,第一主成分(PC1)对PLFA数据变异的贡献率是40.13%,第二主成分(PC2)对总PLFA数据变异的贡献率是19.65%。接种各处理分布在主成分分析图的第一象限,与PC1成正比,对照不接种处理主要分布在第三象限,与PC1成反比,表明接种前后土壤微生物群落结构有明显的差异(图 5)。从主成分的图中可以看出代表真菌的特征脂肪酸如18∶2ω6,9、16∶1ω5c、18∶1ω9c主要分布在第一象限,而代表放线菌的特征脂肪酸如l0Me16∶0、l0Me17∶0和10Me18∶0主要分布在第三象限。这说明对镉具有活化作用的耐镉菌株的加入增加了土壤真菌的群落多样性,减少了放线菌的群落多样性。
|
| 图 4 不同处理G-/G+细菌 Figure 4 Ratio of G- to G+ PLFAs in different antibiotic treatments |
|
| 图 5 接种后土壤的磷脂脂肪酸图谱主成分分析 Figure 5 PCA showing variations in PLFA patterns and loading values for individual PLFAs after inoculation of strain |
(1)从污染土壤样品中分离到对重金属镉具有强活化作用的m6菌株,该菌鉴定为Micrococcineae Arthrobacter。
(2)菌株m6可使土壤中难溶态Cd向可溶态Cd转化,因而该菌株能够作为较好的试验材料应用于抗性菌株强化植物富集重金属镉的研究中。
(3)菌株m6可提高土壤的微生物活性和群落结构的多样性,使土壤代谢加快,主要表现对糖及衍生物、胺类碳源和多聚物类利用程度增加,但是降低了土壤中放线菌的群落结构多样性。
| [1] | 董 萌, 赵运林, 库文珍, 等. 蒌蒿(Aremisia selengensis L. )修复洞庭湖土壤 Cd 污染的强化措施研究[J]. 长江流域资源与环境, 2013, 22(7):937-944. DONG Meng, ZHAO Yun-lin, KU Wen-zhen, et al. Strengthen measures used for Artemisia selengensis L. to repair Cd contaminated soil of Dongting Lake Wetland[J]. Resources and Environment in the Yangtze Basin, 2013, 22(7):937-944. |
| [2] | 梁家妮, 马友华, 周 静. 土壤重金属污染现状与修复技术研究[J]. 农业环境与发展, 2009, 26(4):45-49. LIANG Jia-ni, MA You-hua, ZHOU Jing. Soil heavy metal pollution and remediation technology research[J]. Agro-Environment and Development, 2009, 26(4):45-49. |
| [3] | Aderhold D, Williams C J, Edyvean R G. The removal of heavy metal ions by seaweeds and their derivatives[J]. Biores Technol, 1996, 58:1-6. |
| [4] | 杨成德, 李振东, 陈秀蓉, 等. 高寒草地珠芽蓼内生拮抗固氮菌Z19 的鉴定及其固氮功能[J]. 微生物学通报, 2014, 41(2):267-273. YANG Cheng-de, LI Zhen-dong, CHEN Xiu-rong, et al. Identification, pathogen inhibiting and nitrogen fixation of endophytic bacterium Z19 of Polygonum viviparum[J]. Microbiology, 2014, 41(2):267-273. |
| [5] | Sager M, Park J H, Chon H T. The effect of soil bacteria and perlite on plant growth and soil properties in metal contaminated samples[J]. Water Air Soil Pollut, 2007, 179:265-281. |
| [6] | 戴栋梁, 黄 涛, 张俊会. 土著重金属抗性细菌强化对尾矿重金属的活化作用[J]. 生物学杂志, 2013, 30(2):51-55. DAI Dong-liang, HUANG Tao, ZHANG Jun-hui. Bioaugmentation with indigenous metal-resistant bacteria to enhance metal mobility of Mei-Keng, a Pb/Zn tailing[J]. Journal of Biology, 2013, 30(2):51-55. |
| [7] | 秦晓波, 李玉娥, 石生伟, 等. 稻田温室气体排放与土壤微生物菌群的多元回归分析[J]. 生态学报, 2012, 32(6):52-59. QIN Xiao-bo, LI Yu-e, SHI Sheng-wei, et al. Multivariate regression analysis of greenhouse gas emissions associated with activities and populations of soil microbes in a double-rice paddy soil[J]. Acta Ecologica Sinica, 2012, 32(6):52-59. |
| [8] | 董立国, 蒋 齐, 蔡进军, 等. 基于Biolog-ECO技术不同退耕年限苜蓿地土壤微生物功能多样性分析[J]. 干旱区研究, 2011, 28(4):630-637. DONG Li-guo, JIANG Qi, CAI Jin-jun, et al. Analysis on functional diversity of edaphon communities in Medicago sativa fields of different growth years based on Biolog-ECO plates[J]. Arid Zone Research, 2011, 28(4):630-637. |
| [9] | 胡婵娟, 傅伯杰, 刘国华, 等. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性[J]. 生态学报, 2009, 29(2):727-733. HU Chan-juan, FU Bo-jie, LIU Guo-hua, et al. Soil microbial functional and diversity under typical artificial woodlands in the hilly area of the Loess Plateau[J]. Acta Ecologica Sinica, 2009, 29(2):727-733. |
| [10] | 夏志超, 孔垂华, 王 朋, 等. 杉木人工林土壤微生物群落结构特征[J]. 应用生态学报, 2012, 23(8):2135-2140. XIA Zhi-chao, KONG Chui-hua, WANG Peng, et al. Characteristics of soil microbial community structure in Cunninghamia lanceolata plantation[J]. Chinese Journal of Applied Ecology, 2012, 23(8):2135-2140. |
| [11] | 林 生, 庄家强, 陈 婷, 等. 不同年限茶树根际土壤微生物群落PLFA生物标记多样性分析[J]. 生态学杂志, 2013, 32(1):64-71. LIN Sheng, ZHUANG Jia-qiang, CHEN Ting, et al. Microbial diversity in rhizosphere soils of different planting year tea trees:An analysis with phospholipid fatty acid biomarkers[J]. Chinese Journal of Ecology, 2013, 32(1):64-71. |
| [12] | Dong H Y, Kong C H, Wang P, et al. Temporal variation of soil frie-delin and microbial community under different land uses in a long-term agroecosystem[J]. Soil Biol Biochem, 2014, 69:275-281. |
| [13] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2000:470-482. LU Ru-kun. Analysis methods of soil and agricultural chemistry[M]. Beijing:China Agricultural Science and Technology Press, 2000:470-482. |
| [14] | Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7):844-851. |
| [15] | Frosteggtrd A, Tunlid A, Baath F. Phospholipid fatty acid composition, biomass and activity of microbial communities from two soil types experiment ally exposed to different heavy metals[J]. Applied Environ Microb, 1993, 59(11):3605-3617. |
| [16] | Hassan S H A, Kim S J, Jung AY, et al. Biosorptive capacity of Cd(Ⅱ)and Cu(Ⅱ) by lyophilized cells of Pseudomonas stutzeri[J]. J Gen Appl Microbiol, 2009, 55:27-34. |
| [17] | Petanen T, Romantsehuk M.Use of biohminescent bacterial sensors as an ahemative method for measuring heavy metals in soil extracts[J]. Analytica Chimical Acta, 2002, 456:55-61. |
| [18] | 赵 宾, 欧阳建平, 李方林, 等. 长江(公安段)不同地貌成因类型冲积土中Cd的分布特征[J]. 地质科技情报, 2008, 27(5):43-46. ZHAO Bin, OUYANG Jian-ping, LI Fang-lin, et al. Distribution characters of element Cd in different physiognomy type alluvial soils of Yangtze River(Gong'an Segment)[J]. Geological Science and Technology Information, 1979, 51(7):844-851. |
| [19] | 刘琼光, 杨 艳. 番茄品种抗性与青枯菌和土壤微生物的关系[J]. 仲恺农业技术学院学报, 2006, 19(3):31-34. LIU Qiong-guang, YANG Yan. The relationship between tomato resistance and the quantity of ralstonia solanacearum and rhizosphere microbes[J]. Journal of Zhongkai University of Agriculture and Technology, 2006, 19(3):31-34. |
| [20] | 张信娣, 史永军, 陈银科. 光合细菌和有机肥对土壤主要微生物类群的影响[J]. 中国土壤与肥料, 2007,3:59-62. ZHANG Xin-di, SHI Yong-jun, CHEN Yin-ke. Change and availability of soil in organic phosphorus components influenced by phosphorus fertilizer application[J]. Soil and Fertilizer Sciences in China, 2007, 3:59-62. |
| [21] | 刘爱民, 黄为一. 镉铜污染尾矿土中添加耐镉铜菌剂J5后微生物区系多样性的变化[J]. 生态毒理学报, 2006, 1(3):266-271. LIU Ai-min, HUANG Wei-yi. Study on the change of microbial community diversity in contaminated soils of cadmium-copper mine tailings after the tolerant-cadmium and tolerant-copper strain J5 added[J]. Asian Journal of Ecotoxicology, 2006, 1(3):266-271. |
| [22] | Insam H, Mitchell C C, Dormaar J F. Relationship of soil microbial bio-mass and activity with fertilization practice and crop yield of three ultisols[J]. Soil Biol Biochem, 1991, 23(5):459-464. |
| [23] | Choi K H, Dobbs F C. Comparison of two kinds of Biolog micro plates(GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. J Microb Methods, 1999, 36:203-213. |
 2015, Vol. 34
2015, Vol. 34