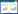文章信息
- 张春梅, 张长锋, 朱青青, 贾永霞, 罗弦, 张世熔, 李云, 李婷
- ZHANG Chun-mei, ZHANG Chang-feng, ZHU Qing-qing, JIA Yong-xia, LUO Xian, ZHANG Shi-rong, LI Yun, LI Ting
- 马缨丹对铜的生理响应及亚细胞分布特征
- Physiological response and subcellular distribution of copper in Lantana camara L.
- 农业环境科学学报, 2016, 35(1): 21-28
- Journal of Agro-Environment Science, 2016, 35(1): 21-28
- http://dx.doi.org/10.11654/jaes.2016.01.003
-
文章历史
- 收稿日期: 2015-07-21
2. 四川农业大学园艺学院, 四川 温江 611130;
3. 四川农业大学环境学院, 四川 温江 611130
2. College of Horticulture, Sichuan Agricultural University, Wenjiang, Sichuan 611130, China;
3. College of Environment Science, Sichuan Agricultural University, Wenjiang, Sichuan 611130, China
铜(Cu)是植物生长所必需的营养元素,广泛参与植物体内一些含铜蛋白及酶的合成,如金属硫蛋白、铜锌超氧化物歧化酶等,与植物的耐性密切相关[1]。然而,Cu也是环境污染的重金属元素,易被植物吸收并积累。当植物体内Cu浓度提高至某一阈值时,其细胞内色素合成、蛋白质代谢及膜透性等会受到不良影响,导致植物的生长发育受阻甚至死亡[2]。
近年来,植物的逆境耐性已成为逆境生态学研究的热点。研究表明,植物重金属耐性一般通过两条基本途径实现,一是金属外部排斥机制,即避免过量有毒重金属被吸收进入植物细胞或在植物体内运输,如旱柳和金丝柳[3]等主要通过限制根部对Cu的吸收,避免过量的Cu在其体内积累,从而提高对Cu的耐受性;商陆[4]、骆驼蓬[5]、盐生草[6]等则主要通过根系对Cu的固持作用,限制Cu向地上部的运输,有效降低Cu对地上部的伤害。另一途径是内部耐受机制,即通过一系列的解毒机制使重金属在植株内以不具生物活性的解毒形式存在,如小飞蓬[7]和轮叶黑藻[8]等将吸收的Cu固定在细胞壁上,减少Cu离子的跨膜运输,以降低Cu对细胞原生质体的伤害;紫鸭跖草[9]、车前草[10]等则主要利用细胞原生质体中的氨基酸、蛋白质等结合大量的Cu,以降低其生物毒性。过多的重金属进入原生质体的毒害作用主要表现为活性氧物质(ROS)大量积累,丙二醛(MDA)和细胞质膜透性显著增加[11, 12]。然而,植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等能够在一定范围内清除ROS,减弱氧化损伤[13, 14, 15]。Cu胁迫下,豌豆幼苗[11]内MDA大量积累,SOD、POD和CAT活性显著降低;而海州香糯[14]、玉米[15]体内的SOD、POD和CAT等活性有所提高,植株有效缓解了Cu胁迫引起的氧化损伤。这表明,不同植物对重金属Cu的耐性机制不同,且重金属亚细胞分布和抗氧化酶在提高植物重金属耐性上有重要作用,对植物逆境耐性研究具有重要意义。
马缨丹(Lantana camara L.),别名五色梅,马鞭草科马缨丹属常绿小灌木,原产于美洲热带,其生物量大,生态适应性强,在我国四川地区广泛分布,是四川汉源铅锌矿区的一种自然植被。本研究组前期研究发现,马缨丹能够在Cu浓度达到316.11~615.73 mg·kg-1的矿区土壤中正常生长,对Cu具有较强的耐性,但其对Cu的耐性机制尚不明确。因此,本文以汉源铅锌矿区的马缨丹为试验材料,通过盆栽试验,研究Cu在其组织器官和亚细胞中的分布特征以及Cu胁迫下其抗氧化酶活性的变化,探讨其耐Cu机制,以期为植物逆境生理学研究提供一定的理论基础。
1 材料与方法 1.1 供试材料试验材料为马缨丹,采自四川省汉源县富泉铅锌矿区。马缨丹株高1~3 m,茎枝带刺,叶对生,花冠有红、粉红、黄、橙黄、白等多种颜色,故又称五色梅。其株型美观,观赏期长,可植于公园、庭院中做花篱、花丛,也可于道路两侧、旷野形成绿化覆盖植被。
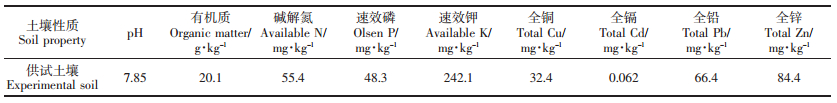
试验所用土壤采自四川省成都市温江区公平镇轻壤质潮土,其理化性质如表 1所示。
试验于2014年4—10月在四川农业大学温江校区塑料大棚内进行。试验土壤经风干、压碎、过5 mm筛后,装入30 cm×40 cm塑料盆中,每盆装土8.0 kg并添加复合肥3 g,以供植物生长所需。根据前期对马缨丹生长环境Cu浓度的测定,设置0(对照,不添加Cu)、100、300、600、900、1200、1500、1800 mg·kg-1共 8个Cu处理,每个处理设置3个重复。将相应量的CuSO4·5H2O(分析纯)配制成溶液,与土壤混合均匀,平衡4周待用。经测定,平衡后土壤pH为7.50~7.85。
马缨丹采用扦插方式育苗。2014年4月中下旬,剪取当年生长势一致的嫩枝作插穗,长度15 cm左右,保证每个插穗带2~3片叶,以便进行光合作用。待扦插成活长出2~3片新叶后(30~40 d),选取长势基本一致的幼苗随机移栽至上述8个Cu处理土壤中,每盆4株,植于根袋内,以便于收集根系。盆底加托盘,避免重金属流失和环境污染。所有处理随机摆放,定期相互更换位置,以减少环境影响。试验期间,每天18:00—19:00根据水分损失情况合理浇灌,使土壤水分含量保持在20%~25%(根据气温变化调节),以保证植株生长所需水分,观察并记录其生长状况,60 d后采样进行各项指标的测定。
1.3 测定方法 1.3.1 生物量的测定将采集的植物样品用自来水冲洗干净,并将根部在1% HCl中浸泡5 min,去除根表吸附的重金属,用蒸馏水冲洗3~4次后擦干。洗净的植株分为根、茎、叶三部分,分别测定鲜重,然后在105 ℃下杀青30 min,再经70 ℃烘干至恒重,测其干重。
1.3.2 铜含量分析植物中Cu含量测定参照Zhang等[16]的湿灰化法:分别称取粉碎混匀的根、茎、叶干样各0.300 0 g于锥形瓶,加入HNO3/HClO4(4∶1)混合液消化至无色透明,用蒸馏水定容至25 mL容量瓶,过滤,待测。采用原子吸收光谱仪(AAS)测定待测液中Cu的含量。
1.3.3 亚细胞分级亚细胞组分分离参照Fu等[17]的分级方法:将各盆中的植物鲜样分为根、茎、叶三部分,每部分全部剪碎混匀,各称取3.00 g,采用预冷溶液(0.25 mol·L-1蔗糖,0.05 mol·L-1 Thris-HCl缓冲液,10 mmol·L-1半胱氨酸,1 mmol·L-1氯化镁,pH 7.8)将鲜样研磨匀浆,通过差速离心法分离为细胞壁、细胞器、可溶性部分及细胞膜四个组分。所有匀浆和分离过程温度控制为4 ℃。每个组分用HNO3/HClO4(4∶1)混合液消煮至无色透明,定容至25 mL容量瓶,采用原子吸收光谱仪(AAS)测定各组分Cu含量。
1.3.4 抗氧化酶活性的测定取新鲜叶片和根系各0.5 g,加入5 mL 50 mol·L-1 pH 7.8的磷酸缓冲液研磨匀浆,于4 ℃ 4000 r·min-1离心15 min,得上清液后置于低温环境备用。SOD、POD和CAT活性测定参照李玲等[18]的方法,SOD以抑制氮蓝四唑(NBT)还原50%为一个酶活性单位(U),POD和CAT以每分钟吸光度值变化0.01为一个酶活性单位(U);APX活性测定参照 Rao等[19]的方法,以每分钟吸光度值变化0.01为一个酶活性单位(U)。
1.3.5 丙二醛及细胞质膜透性的测定MDA含量的测定采用硫代巴比妥酸法[18],以μmol·g-1 FW表示MDA含量。细胞质膜透性采用相对电导率法用DDS-12A 型电导仪测定[18],以相对电导率表示细胞质膜透性的大小。
1.4 数据处理与分析试验所得数据经Microsoft Excel和SPSS 20软件处理,用单因子方差分析法(ANOVA)和最小差异显著法(LSD)进行组间差异性检验。
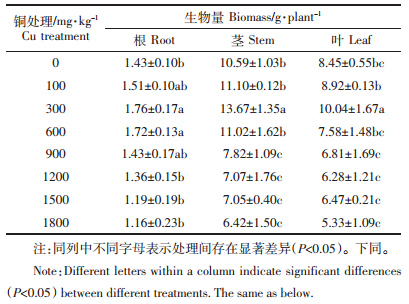
2 结果与分析 2.1 铜胁迫对马缨丹生长的影响通过表 2分析可知,随着Cu处理浓度的增加,马缨丹根、茎和叶的生物量均呈先增加后降低的趋势。在Cu处理浓度为300 mg·kg-1时,其根、茎和叶的生物量均达到最大值,分别为对照的1.23、1.29倍和1.19倍;Cu处理浓度高于600 mg·kg-1后,其茎和叶的生物量显著低于对照,并在1800 mg·kg-1Cu处理时达到最小值,分别仅为对照的61%和63%,而根部无显著下降,表明马缨丹根部对铜的耐性强于地上部。
 |
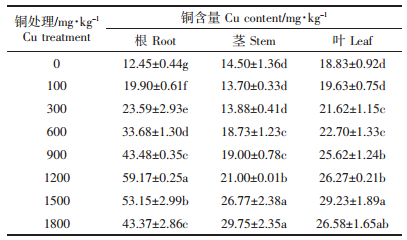
从表 3可知,外源Cu处理下,马缨丹根系中Cu含量随着外源Cu处理浓度的增加先增加后降低,并于1200 mg·kg-1外源Cu处理时达到最大值,为对照的4.75倍;高于此浓度时,根系中Cu含量显著降低。然而,其茎和叶中Cu含量随着外源Cu处理浓度的增加逐渐增加:茎中Cu含量于1800 mg·kg-1外源Cu处理时达到最大值,为对照的2.05倍;叶中Cu含量于1500 mg·kg-1外源Cu处理时达到最大值,为对照的1.55倍,虽然在1800 mg·kg-1外源Cu处理时有小幅度下降,但并不显著。根、茎、叶不同之处在于Cu处理浓度高于1200 mg·kg-1后,根中Cu含量显著降低,而茎和叶中Cu含量显著增加。这可能是因为浓度高于1200 mg·kg-1的Cu处理下马缨丹根系对Cu的固持能力降低,Cu向地上部转移。
 |
如图 1所示,马缨丹体内的Cu在根、茎、叶各亚细胞组分中的分配比例及变化趋势不同。从分配比例来看,Cu在根中主要分布于可溶性部分,占总量的37%~64%;其次是细胞壁,占总量的23%~29%,细胞器和细胞膜中的分配比例较低;随着Cu处理浓度的增加,可溶性部分中Cu的分配比例增加,而细胞壁、细胞器和细胞膜中的分配比例降低。与根中的分布不同,茎中Cu主要分布于细胞壁,占总量的40%~43%;其次是可溶性部分,占总量的35%~37%,细胞器和细胞膜中的分配比例最低;随着Cu处理浓度的增加,各亚细胞组分的分配比例变化不大。然而,叶中Cu在细胞壁和可溶性部分的分配比例相当,分别占总量的29%~38%和30%~34%,且随着Cu处理浓度的增加,可溶性部分和细胞器中的分配比例升高,而细胞壁和细胞膜中的比例降低。这表明,茎和叶中可溶性部分铜的分配比例相当,而细胞壁中的比例差异却较大,与小麦[20]上的研究结果相似,其原因可能是植株不同部位的特点和功能不同,对铜的亚细胞分布有一定影响。
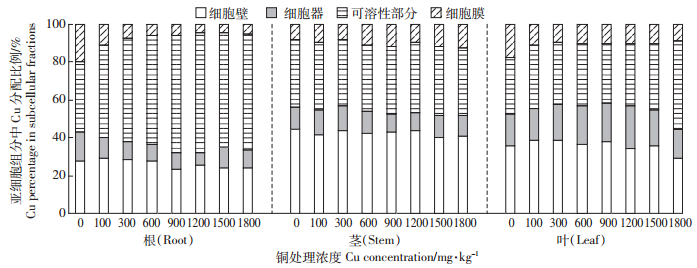
|
|
图中不同字母表示各处理间差异显著(P<0.05)。下同 Different small letters indicate significant differences(P < 0.05)between different treatments.The same below 图 1 不同浓度铜胁迫下马缨丹各器官亚细胞组分中铜的分配比例 Figure 1 Percentages of Cu in different subcellular fractions of L. Camara organs under different Cu concentrations |
如图 2所示,马缨丹根系和叶片中SOD、CAT和APX活性均随Cu处理浓度的增加呈先增加后降低的趋势。根系中APX活性于Cu处理浓度为300 mg·kg-1时达到最大值,且在Cu处理浓度高于1500 mg·kg-1后显著低于对照;SOD和CAT活性均于Cu处理浓度为600 mg·kg-1时达到最大值,并均于Cu处理浓度达到1800 mg·kg-1时显著低于对照。叶片中APX和SOD活性均于Cu处理浓度为300 mg·kg-1时达到最大值,且APX活性在Cu处理浓度高于600 mg·kg-1后显著低于对照,而SOD活性虽然逐渐降低,但与对照无显著差异;CAT活性于600 mg·kg-1 Cu处理时达到最大值,并在Cu处理浓度高于1500 mg·kg-1后显著低于对照。不同的是,根系中POD活性随Cu处理浓度的增加先增加后降低,且均显著高于对照;而叶片中POD活性却随Cu处理浓度的增加逐渐降低,并在300 mg·kg-1 Cu处理时显著低于对照。这可能与根和叶对铜的耐受性不同有关。
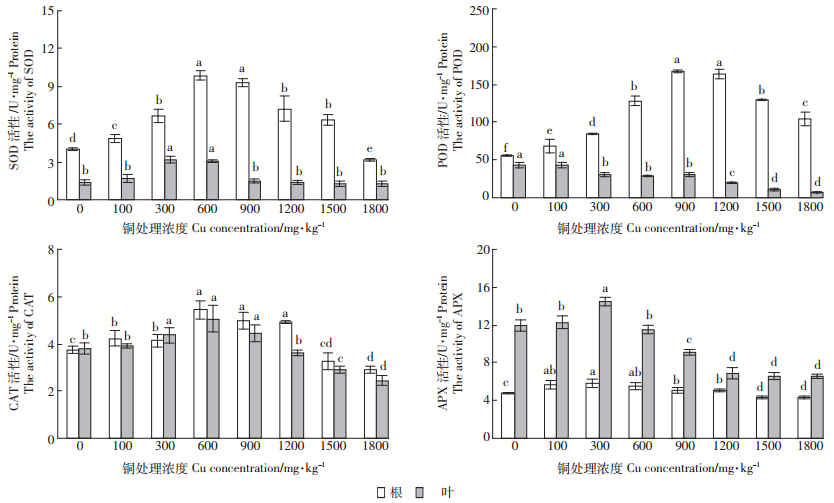
|
| 图 2 不同浓度铜胁迫下马缨丹根系和叶片抗氧化酶活性 Figure 2 Antioxidant enzyme activities of roots and leaves of L. camara exposed to different Cu concentrations |
如图 3所示,马缨丹根系和叶片中MDA含量和细胞质膜透性均随着Cu处理浓度的增加逐渐增加。根系中MDA含量和细胞质膜透性分别于Cu处理浓度为600 mg·kg-1和900 mg·kg-1时显著高于对照,而叶片中MDA含量和细胞质膜透性分别于Cu处理浓度为300 mg·kg-1和900 mg·kg-1时显著高于对照。随着Cu处理浓度增加,根系中MDA含量和细胞质膜透性的增加幅度小于叶片,可能是因为根对铜的耐受性强于叶。
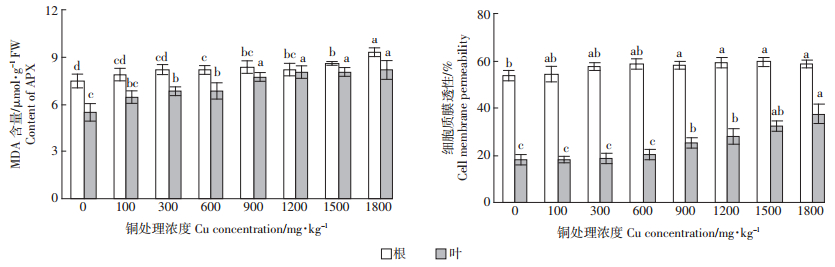
|
| 图 3 不同浓度铜胁迫下马缨丹根系和叶片中丙二醛含量和细胞质膜透性 Figure 3 MDA content and cell membrane permeability in roots and leaves of L. camara under different Cu concentrations |
作为植物生长发育的必需元素,适量的Cu能够促进植株的生长,而过量的Cu会对植株产生毒害作用,导致其生长受阻甚至死亡[21, 22]。本研究发现,0~600 mg·kg-1的Cu处理促进了马缨丹的生长,其根、茎、叶的生物量分别比对照增加了6%~23%、4%~29%、6%~19%;浓度高于600 mg·kg-1的Cu处理却显著抑制了其茎和叶的生长,导致茎和叶的生物量分别比对照降低了26%~39%和19%~37%(表 2),但其对根部生物量的影响较小,表明马缨丹根部对Cu的耐性强于地上部。这与刘鑫等[23]对紫苏的研究结果相似,其原因可能是浓度高于600 mg·kg-1 的Cu处理超过了马缨丹对Cu的忍耐极限,植株受到毒害,导致生长受到抑制。
研究表明,重金属胁迫抑制植物生长的途径之一是破坏植物体内ROS代谢平衡,使ROS大量积累,引起细胞膜质过氧化,从而导致代谢紊乱[24, 25]。MDA是一种高活性的脂质过氧化产物,能交联脂类、核酸及蛋白质等,从而破坏膜结构,导致电解质渗漏严重。本研究发现,高于600 mg·kg-1的 Cu处理下,马缨丹根系和叶片中MDA含量和细胞质膜透性均显著增加(图 3),Cu胁迫打破了其体内的活性氧代谢平衡,引起过氧化伤害,细胞膜的完整性遭到破坏。为了缓解重金属诱导的氧化胁迫,植物会启动由SOD、POD、CAT、APX等抗氧化酶组成的自身保护系统,在一定范围内清除ROS,提高自身的耐性。其中,SOD通过酶促反应将超氧阴离子歧化为氧化能力较弱的H2O2和O2,而H2O2则由POD、CAT和APX等催化或歧化生成H2O和O2,从而彻底清除ROS;只有SOD、POD、CAT和APX 协同作用,才能维持机体内活性氧代谢的动态平衡[26, 27]。研究表明,Cu胁迫下,骆驼蓬[5]、盐生草[6]和玉米[15]体内SOD、POD、CAT活性较对照均有所提高,其植株能够有效缓解Cu胁迫引起的氧化损伤。在本试验中,马缨丹根系中SOD、POD、CAT、APX活性和叶片中SOD、CAT、APX活性均随着Cu处理浓度的增加呈先升高后降低的趋势(图 2)。这符合植物应对胁迫反应的典型特征,即当Cu处理浓度低于600 mg·kg-1时,马缨丹启动了自身抗氧化系统,根系和叶片中的SOD、CAT和APX活性较对照显著增加(图 2),植株抗氧化能力增强,有效缓解了Cu处理诱导的氧化胁迫。高于600 mg·kg-1的Cu处理诱导的氧化胁迫则超出了其叶片的忍受能力,叶片中POD、CAT和APX活性显著降低(图 2),H2O2不能被及时清除,积累的H2O2可能与未被分解的超氧阴离子在Cu等的催化下形成氧化伤害更强的羟自由基[14],加剧叶片的氧化伤害,使MDA含量和细胞质膜透性显著升高(图 3),地上部生长受到抑制(表 2)。然而,根系中SOD、POD和CAT活性在浓度高于600 mg·kg-1的Cu处理下均较高,抗氧化能力较强,MDA含量和细胞质膜透性小幅度增加,根系受到的伤害较小。这可能是马缨丹根部耐性较强的原因。
植物对重金属的另一耐性机制是其对重金属的吸收和分布。根部作为重金属的主要吸收部位,有其特有的排斥和积累机制。研究表明,杞柳和金丝柳[3]等根部对Cu的吸收具有较强的限制作用,其体内铜含量极低;而紫苏[23]和节节草[28]等能够吸收较多的铜,但主要将其固定在根部,以提高地上部的耐性。本研究发现,铜胁迫下马缨丹根、茎、叶中Cu含量仅为12.45~59.17 mg·kg-1,且根中的铜含量大于茎和叶(表 3)。这说明马缨丹不仅限制了根系对Cu的吸收,还限制了铜向地上部的转运,可能是其忍耐Cu胁迫的重要机制。其体内铜含量较低的原因还可能是试验土壤pH较高(表 1),铜的移动性和有效性受到抑制,阻碍了其对铜的吸收;且铜含量在马缨丹旺盛生长期测定,生长稀释作用也可能是其铜含量较低的另一原因。
植物细胞壁被认为是保护原生质体免受金属离子毒害的第一道屏障。研究发现,穗花狐尾藻[8]及紫鸭跖草根系[9]中分别有60%和33%以上的Cu被固定于细胞壁。其原因可能是细胞壁中含有多种能与金属离子配位结合的多糖、蛋白质等,能够与大量的金属离子结合,从而减少金属离子的跨质膜运输,降低其对原生质体的伤害[7, 8]。本研究发现,马缨丹根、茎、叶中分别有23%~29%、40%~43%、29%~38%的Cu固定于细胞壁(图 1),表明其细胞壁对Cu具有较强的束缚作用,是其耐铜机制之一。对于已进入原生质体的金属离子,还可以向液泡中输送,使金属离子在细胞内区隔化,从而降低其移动性和生理毒性,减轻或避免其对细胞内叶绿体、线粒体等重要功能性单位的损伤[29, 30]。在马缨丹根、茎、叶中,可溶性部分的Cu分别占总量的37%~64%、35%~37%和30%~34%(图 1),而可溶性组分以液泡为主,表明液泡区隔化可能是其细胞内部主要的Cu耐性机制,且随着Cu处理浓度的增加,其根系和叶片中可溶性部分Cu的比例增加,细胞壁中的比例降低,而细胞器组分中Cu的比例变化不大(图 1)。这与秦建桥等[31]对五节芒的研究结果相似,其原因可能是随着植物体内Cu浓度的升高,细胞壁上的重金属结合位点达到饱和,细胞壁对Cu的固持作用减弱,于是将其余的Cu离子转运到细胞可溶性部分,通过液泡区隔化来减弱Cu对植株的伤害。可见,细胞壁固持及液泡区隔化是阻止Cu向细胞器运输、维持细胞核心功能、增强马缨丹Cu耐性的重要机制。
4 结论(1)马缨丹是一种铜耐性植物,低于600 mg·kg-1的Cu处理促进其生长,高于600 mg·kg-1的Cu处理则显著抑制其茎和叶的生长,但根部的耐性强于地上部,受到的影响较小。
(2)马缨丹根系对铜吸收和转运的限制降低了其根部和地上部的铜含量,且根系的可溶性部分和茎、叶的细胞壁对铜的固定有效地阻止了Cu向细胞膜和细胞器转运,是马缨丹重要的耐性机制。
(3)马缨丹能有效缓解低于600 mg·kg-1 Cu处理诱导的氧化胁迫,高于600 mg·kg-1 Cu处理诱导的氧化胁迫则超出了其叶片的抗氧化能力,叶片受到氧化伤害,但根系的抗氧化能力较强,受到的影响较小,是马缨丹根部耐性较强的原因之一。
| [1] | Xu W H, Li W Y, He J P, et al. Effects of insoluble Zn, Cd, and EDTA on the growth, activities of antioxidant enzymes and uptake of Zn and Cd in Vetiveria zizanioides[J]. Journal of Environmental Sciences, 2009, 21(2):186-192. |
| [2] | 翁南燕, 周东美, 武 敬, 等. 铜镉复合胁迫下温度对小麦幼苗生长及其对铜、镉和矿质营养元素吸收与各元素在亚细胞分布的影响[J]. 生态毒理学报, 2011, 6(6):607-616. WENG Nan-yan, ZHOU Dong-mei, WU Jing, et al. Uptake, subcellular distributions of Cu, Cd and mineral elements, and plant growth for wheat seedlings under stress of Cu and Cd as affected by temperature[J]. Asian Journal of Ecotoxicology, 2011, 6(6):607-616. |
| [3] | 施 翔, 陈益泰, 吴天林, 等. 7 个柳树无性系在 Cu/Zn 污染土壤中的生长及对 Cu/Zn 的吸收[J]. 中国环境科学, 2010, 30(12):1683-1689. SHI Xiang, CHEN Yi-tai, WU Tian-lin, et al. Plant growth and metal uptake by seven Salix clones on Cu/Zn contaminated environment[J]. China Environmental Science, 2010, 30(12):1683-1689. |
| [4] | 黄五星, 高境清, 黄 宇, 等. 商陆对镉锌铜胁迫的生理响应与金属积累特性[J]. 环境科学与技术, 2010, 33(1):77-79. HUANG Wu-xing, GAO Jing-qing, HUANG Yu, et al. Bioaccumulation and physiological response to cadmium, zinc and copper stress in Phytolacca acinosa[J]. Environmental Science & Technology, 2010, 33(1):77-79. |
| [5] | 鲁 艳, 李新荣, 何明珠, 等. Ni和Cu胁迫对骆驼蓬抗氧化酶活性的影响[J]. 草业学报, 2012, 21(3):147-155. LU Yan, LI Xin-rong, HE Ming-zhu, et al. Effects of Ni and Cu on antioxidative enzymes in Peganum haimala[J]. Acta Prataculturae Sinica, 2012, 21(3):147-155. |
| [6] | 鲁 艳, 李新荣, 何明珠, 等. 矿业废弃地先锋植物盐生草在镍、铜处理下抗氧化酶系统的变化[J]. 中国沙漠, 2013, 33(1):118-125. LU Yan, LI Xin-rong, HE Ming-zhu, et al. Impact of single Ni and Cu treatment on activities of antioxidative enzymes of Halogeton glomeratus, a pioneer plant growing in Ni/Cu mining wastland[J]. Journal of Desert Research, 2013, 33(1):118-125. |
| [7] | 丁佳红, 王 洲, 薛正莲. 小飞蓬的铜毒害和抗性机制研究[J]. 土壤通报, 2010, 41(1):200-205. DING Jia-hong, WANG Zhou, XUE Zheng-lian. Studies on copper toxicity and mechanisms of resistance in Conyza Canadensis[J]. Chinese Journal of Soil Science, 2010, 41(1):200-205. |
| [8] | 薛培英, 李国新, 赵全利. 轮叶黑藻和穗花狐尾藻对铜的吸收机制研究[J]. 环境科学, 2014, 35(5):1878-1883. XUE Pei-ying, LI Guo-xin, ZHAO Quan-li. Mechanisms of copper uptake by submerged plant Hydrilla verticillata(L. f.) Royle and Myriophyllum spicatum L.[J]. Environmental Science, 2014, 35(5):1878-1883. |
| [9] | 黄长干, 付 凌, 梁 英, 等. 紫鸭跖草细胞中铜的分配和化学形态特征研究[J]. 安徽农业科学, 2008, 36(33):14499-14502. HUANG Chang-gan, FU Ling, LIANG Ying, et al. Study on distribution and chemical characteristics of copper in cells of Setcreasea purpurea Boom[J]. Journal of Anhui Agricultural Sciences, 2008, 36(33):14499-14502. |
| [10] | 杨 樱, 张世熔, 李 婷, 等. 铜、铅在车前草中的亚细胞分配[J]. 环境科学学报, 2009, 29(9):1964-1969. YANG Ying, ZHANG Shi-rong, LI Ting, et al. Subcellular distributions of copper and lead in Herba plantaginis[J]. Acta Scientiae Circumstantiae, 2009, 29(9):1964-1969. |
| [11] | 王 蕊, 王应军, 马星宇. 镧、铈对铜胁迫下豌豆幼苗抗氧化酶系统的影响[J]. 核农学报, 2013, 27(6):873-878. WANG Rui, WANG Ying-jun, MA Xing-yu. Effect of La and Ce on antioxidant enzymes system of pea seedlings under copper stress[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(6):873-878. |
| [12] | 王 川, 李昆伟, 魏宇昆, 等. Cu2+胁迫对丹参生长及有效成分积累的影响[J]. 植物研究, 2012, 32(1):124-128. WANG Chuan, LI Kun-wei, WEI Yu-kun, et al. Effects of copper stress on seedlings growth and active ingredients of Salvia miltiorrhiza[J]. Bulletin of Botanical Research, 2012, 32(1):124-128. |
| [13] | 陈柳君, 冯海峰, 朱雪梅, 等. 铜锌复合污染对铜富集植物大聚藻抗氧化酶活性的影响[J]. 西北植物学报, 2014, 34(10):2056-2062. CHEN Liu-jun, FENG Hai-feng, ZHU Xue-mei, et al. Effect of Cu and Zn compound pollution on an antioxidant enzyme activity of Cu-enrichment plant Myriophyllum aquaticum[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(10):2056-2062. |
| [14] | 朱昌华, 穆怀彬, 钱 猛. 抗氧化系统在海州香薷耐铜机制中的作用[J]. 植物生理学报, 2011, 47(11):1079-1085. ZHU Chang-hua, MU Huai-bin, QIAN Meng. Antioxidative defence systems in a copper tolerant plant, Elsholtzia haichowensis, under copper stress[J]. Plant Physiology Journal, 2011, 47(11):1079-1085. |
| [15] | 王晓维, 黄国勤, 徐健程, 等. 铜胁迫和间作对玉米抗氧化酶活性及丙二醛含量的影响[J]. 农业环境科学学报, 2014, 33(10):1890-1896. WANG Xiao-wei, HUANG Guo-qin, XU Jian-cheng, et al. Effects of copper stresses and intercropping on antioxidant enzyme activities and malondialdehyde contents in maize[J]. Journal of Agro-Environment Science, 2014, 33(10):1890-1896. |
| [16] | Zhang S R, Lin H C, Deng L J, et al. Cadmium tolerance and accumulation characteristics of Siegesbeckia orientalis L.[J]. Ecological Engineering, 2013, 51(2):133-139. |
| [17] | Fu X P, Dou C M, Chen Y X, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 2011, 186(1):103-107. |
| [18] | 李 玲, 李娘辉, 蒋素梅, 等. 植物生理学模块实验指导[M]. 北京:科学出版社, 2009. LI Ling, LI Niang-hui, JIANG Su-mei, et al. The plant-physiology module experiment instructs[M]. Beijing:Science Press, 2009. |
| [19] | Rao M V, Hale B A, Ormrod D P. Amelioration of ozone-induced oxidative damage in wheat plants grown under high carbon dioxide(Role of antioxidant enzymes)[J]. Plant Physiology, 1995, 109(2):421-432. |
| [20] | 张 双, 肖 昕, 贾红霞, 等. 铜在拔节期小麦中的亚细胞分布[J]. 环境科学与技术, 2011, 34(5):56-60. ZHANG Shuang, XIAO Xin, JIA Hong-xia, et al. Subcellular distribution of Cu in jointing wheat[J]. Environmental Science & Technology, 2011, 34(5):56-60. |
| [21] | Cambrollé J, Mancilla-Leytón J M, Muñoz-Vallés S, et al. Tolerance and accumulation of copper in the salt-marsh shrub Halimione portulacoides[J]. Marine Pollution Bulletin, 2012, 64(4):721-728. |
| [22] | Cambrollé J, García J L, Ocete R, et al. Growth and photosynthetic responses to copper in wild grapevine[J]. Chemosphere, 2013, 93(2):294-301. |
| [23] | 刘 鑫, 张世熔, 朱 荣, 等. 镉铜胁迫下紫苏的生长响应和富集特征研究[J]. 农业环境科学学报, 2009, 28(11):2264-2269. LIU Xin, ZHANG Shi-rong, ZHU Rong, et al. Effect of cadmium and copper stress on the growth response and accumulation characteristics of Perilla frutescens(L.)Britt[J]. Journal of Agro-Environment Science, 2009, 28(11):2264-2269. |
| [24] | Upadhyay R K, Panda S K. Zinc reduces copper toxicity induced oxidative stress by promoting antioxidant defense in freshly grown aquatic duckweed Spirodela polyrhiza L.[J]. Journal of Hazardous Materials, 2010, 175(1):1081-1084. |
| [25] | Salazar M J, Rodriguez J H, Nieto G L, et al. Effects of heavy metal concentrations(Cd, Zn and Pb) in agricultural soils near different emission sources on quality, accumulation and food safety in soybean[Glycine max(L.)Merrill][J]. Journal of Hazardous Materials, 2012, 233(10):244-253. |
| [26] | Lin W J, Xiao T F, Wu Y Y, et al. Hyperaccumulation of zinc by Corydalis davidii in Zn-polluted soils[J]. Chemosphere, 2012, 86(8):837-842. |
| [27] | Golam J A, Ruan Y P, Zhou J, et al. Brassinosteroid alleviates polychlorinated biphenyls-induced oxidative stress by enhancing antioxidant enzymes activity in tomato[J]. Chemosphere, 2013, 90(11):2645-2653. |
| [28] | 李 影, 王友保. 4种蕨类草本植物对Cu的吸收和耐性研究[J]. 草业学报, 2010, 19(3):191-197. LI Ying, WANG You-bao. Research on Cu uptake and tolerance of four pteridophyta plants[J]. Acta Prataculturae Sinica, 2010, 19(3):191-197. |
| [29] | Fu X P, Dou C M, Chen Y X, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 2011, 186(1):103-107. |
| [30] | Xu Q S, Min H L, Cai S J, et al. Subcellular distribution and toxicity of cadmium in Potamogeton crispus L.[J]. Chemosphere, 2012, 89(1):114-120. |
| [31] | 秦建桥, 赵华荣, 胡 萌, 等. 铅胁迫下不同生态型五节芒(Miscanthus floridulus)的抗氧化系统的差异研究[J]. 生态环境学报, 2011, 20(3):525-531. QIN Jian-qiao, ZHAO Hua-rong, HU Meng, et al. Physiological metabolism and protective enzyme activity of different ecotypes of Miscanthus floridulus under Pb stress[J]. Ecology and Environmental Sciences, 2011, 20(3):525-531. |
 2016, Vol. 35
2016, Vol. 35