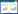文章信息
- 刘英杰, 朱雪梅, 林立金, 杨远祥, 杨占彪, 邵继荣
- LIU Ying-jie, ZHU Xue-mei, LIN Li-jin, YANG Yuan-xiang, YANG Zhan-biao, SHAO Ji-rong
- 冬季农田杂草荠菜对铅的生理响应及积累特性研究
- Physiological responses and lead accumulation of the winter weed Capsella bursa-pastoris under lead stress
- 农业环境科学学报, 2016, 35(1): 29-36
- Journal of Agro-Environment Science, 2016, 35(1): 29-36
- http://dx.doi.org/10.11654/jaes.2016.01.004
-
文章历史
- 收稿日期: 2015-06-24
2. 成都市环境监测中心站, 成都 610072;
3. 四川农业大学果蔬研究所, 成都 611130;
4. 四川农业大学生命科学学院, 四川 雅安 625014;
5. 天府新区成都管委会经济发展局, 成都 610213
2. Chengdu Environmental Monitoring Center, Chengdu 610072, China;
3. Institute of Pomology and Olericulture, Sichuan Agricultural University, Chengdu 611130, China;
4. College of Life Science, Sichuan Agricultural University, Ya'an 625014, China;
5. Tianfu New Area Chengdu Management Committee Economic Development Board, Chengdu 610213, China
重金属铅(Pb)不仅是最有毒性的重金属元素之一,也是植物的非必需元素。土壤遭受铅污染不仅会改变原有土壤结构、恶化土壤微生物生存环境,还会严重威胁农作物的产量与质量,甚至通过食物链危害人体健康[1]。因此,对铅污染土壤进行生态修复显得十分迫切。植物修复作为一种费用低廉、不破坏土壤结构、不造成二次污染的绿色修复技术[2],已成为国内外重金属污染治理研究的热点。
植物修复的核心是利用超富集植物或富集植物对土壤中重金属的高富集特性来净化土壤环境,而该技术的关键则是筛选具有较高实际应用价值的超富集植物或富集植物。尽管在全球范围内开展的超富集植物与富集植物筛选工作取得了一定成果[3],如Agrostis ovina[4]、Thiaspi rotundifolium[5]、Brassica jouncea[6]和密毛白莲蒿[7]等被界定为铅超富集植物,但在利用已知超富集植物与富集植物进行实际修复中却暴露出植物生长缓慢、植株矮小、对不同类型土壤适应能力差以及生物入侵等问题[8, 9],更值得注意的是以上植物大部分为夏季生长的植物,在冬季低温条件下生长的甚少[10],这极大地限制了它们在实际应用中的修复范围和修复效率。为此,寻找适合农田土壤环境、生长快速、繁殖能力强、能够避免物种入侵问题,同时能够应用于冬季低温环境的新超富集植物与富集植物,已成为植物修复技术急需解决的问题。
农田杂草是一类生物量大、生长迅速、具有较强的抗逆境能力和争夺环境资源能力的植物类群[11, 12]。目前,国内学者从农田杂草中筛选出的铅富集植物仅有香根菜、裂叶荆芥、羽叶鬼针草等[13],而铅超富集植物仅有金丝草[14]。因此,从冬季农田杂草中筛选重金属超富集植物,不仅可以弥补现有冬季超富集植物的不足,而且可以就地取材,就地使用,避免了引种过程中存在的潜在问题。
荠菜[Capsella bursa-pastoris(L.)Medic]是十字花科荠菜属一年生草本植物,适宜生长于温带地区冬季低温环境,广泛分布于全国各地,常见于田间、山坡。荠菜能耐受-5 ℃低温,但不耐22 ℃以上高温。3~4 ℃低温条件能促进解除荠菜种子的休眠,荠菜种子发芽后,在5~20 ℃较短日照条件下生长迅速。荠菜对土壤的选择不严,一般土质疏松、排水良好的土壤均可生长,但以肥沃、疏松、湿润的土壤条件为佳。
在前期初步研究中发现,荠菜能够在铅浓度约为100 mg·kg-1的土壤中正常生长,且表现出较强的铅富集特性,可能是一种铅富集植物。本研究在此基础上通过盆栽试验,研究荠菜在不同浓度铅处理下的生长状况、生理响应、铅富集能力,旨在为植物修复技术提供新的富集植物品种。
1 材料与方法 1.1 材料来源2012年1月,发现在前期铅污染试验中废弃的土壤中长出几种植物:荠菜、车前、通泉草、多茎鼠麹草。这些植物当中,荠菜长势最好,生物量较大,处于开花初期,而其他三种植物生物量小,长势一般。由于车前、通泉草和多茎鼠麹草的生物量太小,达不到重金属测定量,只对荠菜植株铅含量和土壤铅含量进行了测定。测定结果显示,土壤全铅平均含量100.25 mg·kg-1,荠菜的地上部、根部铅含量分别为69.72、86.03 mg·kg-1。荠菜表现出对铅较强的富集特性,初步判定可能是铅富集植物。
本次试验荠菜种子于2013年3月采集于四川农业大学雅安和温江校区试验农田。
1.2 盆栽试验盆栽试验于2013年10—12月在四川农业大学温江校区实验大棚内进行。供试土壤为水稻土,土壤基本理化性质为:pH 6.29,全氮1.09 g·kg-1,全磷1.2 g·kg-1,全钾22 g·kg-1,速效氮68.12 mg·kg-1,速效磷16.22 mg·kg-1,速效钾156.2 mg·kg-1,铅全量16.08 mg·kg-1。土样经风干、压碎、过5 mm筛,然后装入塑料盆中(盆直径20 cm,高20 cm),每盆装入2.0 kg土。土壤中以Pb(CH3COO)2·3H2O溶液形式加入的铅质量浓度分别为0、200、400、600、800、1000、1200、1400、1600 mg·kg-1,保持土壤田间持水量的80%,混匀并静置30 d。
挑选饱满芥菜种子,分别用0.1%NaClO浸泡消毒30 min,然后用蒸馏水冲洗干净,平铺于垫有滤纸的培养皿中,置于光照培养箱中催芽。选择长势一致、长出三片真叶的幼苗,移栽到经铅处理的盆中,每盆种植5株,每个处理重复3次。根据盆栽土壤缺水情况,不定期浇水保持土壤田间持水量80%,待植物生长45 d后整株收获。
1.3 研究方法 1.3.1 样品采集将植株从盆中取出,先用自来水清洗,然后用去离子水反复冲洗,再将植物分为地上部与根系两部分。采集部分新鲜叶片,测定酶活性、叶绿素含量、丙二醛含量、活性氧自由基。将根浸泡在0.01 mol·L-1 HCl中10 min,再用去离子水清洗。将植物各部分鲜样于105 ℃下杀青30 min,80 ℃下烘干至恒重,称重,粉碎,过100目尼龙筛备用。
1.3.2 分析方法荠菜生长性状(株高、根长、叶长和生物量)采用常规方法测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法[15],过氧化氢酶(CAT)活性采用分光光度法[16],叶绿素含量采用丙酮-乙醇浸提法[17],丙二醛(MDA)含量采用硫代巴比妥酸比色法[18],超氧阴离子自由基(O2-)含量采用羟胺法[19],过氧化氢(H2O2)含量采用分光光度计法[16]测定。转运系数(TF) =地上部铅含量/根系铅含量[20],富集系数(BCF) =地上部(根系)铅含量/土壤铅含量[20]。植物样品铅含量采用HNO3-HClO4消煮,ICAP 6300型ICP光谱仪(Thermo Scientific,USA)测定[21]。土壤样品铅含量采用HNO3-HF-HCl消煮,ICAP 6300型ICP光谱仪测定[21]。
1.3.3 数据处理采用SPSS 13.0统计分析软件对数据进行统计分析,并利用最小显著性差异检验(LSD)法进行差异显著性检验,用Origin 8.1软件作图。
2 结果与分析 2.1 铅处理对荠菜生长的影响经试验观察发现,在各水平铅处理下(200~1600 mg·kg-1)荠菜均正常生长,无明显中毒症状。试验结果表明,荠菜的株高、根长、叶长、地上部生物量和根系生物量均表现为随铅处理浓度的增加呈先升高后降低的趋势(表 1)。在铅处理浓度为800 mg·kg-1时,荠菜的株高、根长、叶长和地上部生物量、根系生物量均达到最大值,分别为51.2、19.8、13.9 cm和0.88、0.28 g·株-1,且几乎所有铅处理组的株高、根长、叶长、地上部生物量和根系生物量(除1600 mg·kg-1处理组的地上部生物量外)均显著大于对照组(P<0.05),增幅分别达53.8%、39.9%、12.1%、22.2%、75%。综上所述,铅处理下荠菜的生长响应表现出低促高抑的规律,总体上呈促进作用。在铅处理浓度为800 mg·kg-1时,荠菜的生长状况最佳。这表明荠菜对铅具有较高的耐性。
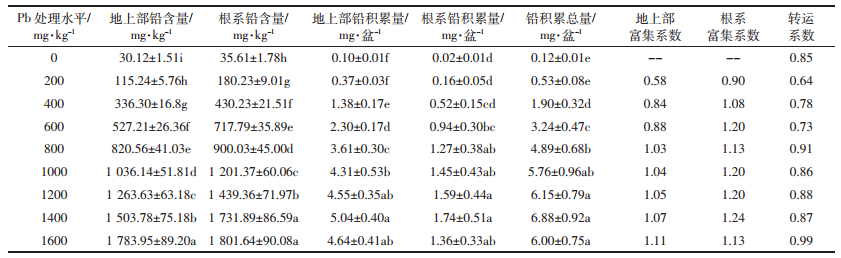
从表 2可知,不同水平铅处理荠菜叶绿素a、叶绿素b、叶绿素(a+b)含量总体上呈现先升高后降低的趋势。低浓度(200~400 mg·kg-1)铅处理时,叶绿素a、叶绿素b、叶绿素(a+b)含量较对照有所增加但未达显著水平(P>0.05);中浓度(600~1000 mg·kg-1)铅处理时,叶绿素a、叶绿素b、叶绿素(a+b)含量迅速上升,在处理浓度为1000 mg·kg-1时达到峰值,分别是对照的1.38、1.13、1.32倍,均显著高于对照(P<0.05);高浓度(1200~1600 mg·kg-1)铅处理时,叶绿素a、叶绿素b、叶绿素(a+b)含量急剧下降,且随处理浓度的升高,下降幅度增大,但与对照相比未达显著水平(P>0.05)。这表明在铅处理下,荠菜叶绿素的合成表现出较强的浓度效应,呈现出低促高抑的规律,在中浓度(600~1000 mg·kg-1)时效果最佳。同时,根据叶绿素a/b值变化趋势可知,各处理组(除200~400 mg·kg-1铅处理组外)叶绿素a/b值显著高于对照组,表明铅能刺激荠菜叶片的光合作用,提升叶片的光合速率。
 |
MDA是脂过氧化反应的最终分解产物之一,其含量的高低间接表明植物体内的活性氧水平和细胞的受损程度。通常MDA含量越高,表明植物体内活性氧水平越高,膜脂过氧化受损越严重。本研究发现,荠菜叶片MDA含量总体上随着铅处理浓度的升高而增加(表 3)。低浓度(200~400 mg·kg-1)铅处理时,MDA含量虽有小幅升高,但较对照无显著性差异(P>0.05),表明该阶段荠菜叶片细胞膜未遭受明显的伤害;中浓度(600~1000 mg·kg-1)铅处理时,MDA含量显著高于对照(P<0.05),是对照的2.87~3.02倍,且各处理组间无显著差异(P>0.05),表明该阶段荠菜叶片细胞膜虽已遭受明显伤害,但依靠植物体内各种抗氧化机制,有效降低了氧化伤害;高浓度(1200~1600 mg·kg-1)铅处理时,MDA含量显著升高(P<0.05),表明氧化胁迫加剧,细胞膜受损加重。
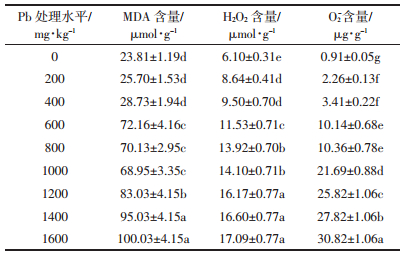 |
植物体内活性氧自由基的水平直接表明植物遭受过氧化胁迫的程度。荠菜叶片O-2和H2O2含量的变化规律总体上与MDA含量变化规律相似(表 3)。低浓度(200~400 mg·kg-1)铅处理时,与对照相比,O-2和H2O2含量虽显著升高,但各铅处理组间无显著性差异(P>0.05),表明低浓度铅虽能诱发荠菜叶片O-2和H2O2的大量产生,但植物体内的活性氧清除系统随即启动,有效地清除过量的活性氧。综合来看,低浓度(200~400 mg·kg-1)铅处理时,荠菜叶片并未遭受过氧化胁迫,植物体内仍保持着活性氧的动态平衡。
2.2.3 对荠菜叶片SOD与CAT活性的影响本研究显示,荠菜叶片SOD、CAT活性均随处理浓度的升高呈现先升高后降低的趋势(图 1)。低、中浓度(200~1000 mg·kg-1)处理下,SOD、CAT活性显著升高,分别在1000、800 mg·kg-1时达到峰值。高浓度(1200~1600 mg·kg-1)处理下,SOD、CAT活性均显著降低,在1600 mg·kg-1时降至最低,但二者的活性仍高于对照。由此可见,这两种酶在保护植物免受氧化损害的过程中具有重要作用。
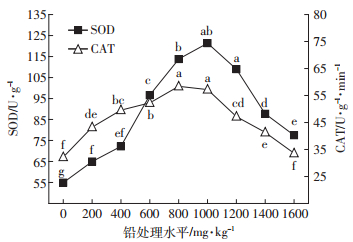
|
| 图 1 铅处理对荠菜叶片SOD、CAT活性的影响 Figure 1 Effects of lead treatments on activities of SOD and CAT in leaves of C.bursa-pastoris |
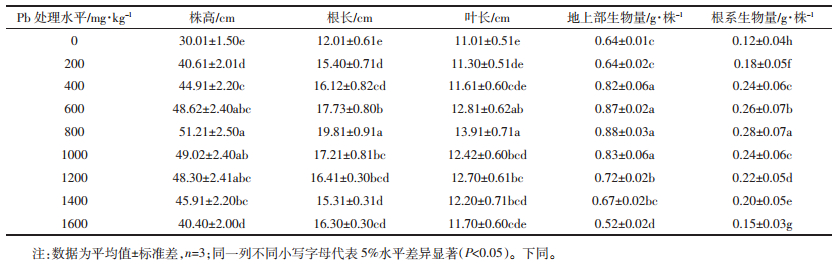
研究显示,荠菜地上部和根系的铅含量均随着处理浓度的升高而增加(表 4),各处理组均显著高于对照(P<0.05),且处理间(除1400~1600 mg·kg-1处理的根系铅含量外)差异显著。当铅处理浓度为1000 mg·kg-1时,荠菜地上部、根系的铅含量分别达到1 036.14、1 201.37 mg·kg-1,是对照的34.4、33.74倍,高于铅超富集植物的临界值。当铅处理浓度为1600 mg·kg-1时,荠菜地上部、根系的铅含量达到峰值,分别为1 783.95 、1 801.64 mg·kg-1,是对照的59.23、50.59倍,是铅超富集植物临界值的1.78、1.8倍。这表明荠菜对铅的吸收和累积具有一定的潜力,初步达到了铅超富集植物标准。
富集系数是评价植物吸收富集重金属效率的一个重要指标,超富集植物的富集系数应大于1。本研究发现,荠菜地上部、根系的富集系数均随处理浓度的升高而增加,地上部富集系数在铅处理浓度≥800 mg·kg-1时大于1,根系富集系数在铅处理浓度≥400 mg·kg-1时大于1。这表明荠菜对铅有较强的富集能力,且随处理浓度的升高而增强。
重金属迁移系数表明了植物从根系向地上部转运重金属的能力。荠菜的转运系数虽均小于铅超富集植物的评价阈值1,但在中、高浓度(800~1600 mg·kg-1)时,荠菜的转运系数平均为0.902,十分接近于1,表明荠菜具有一定的铅转移能力。
综合来看,荠菜虽不能被界定为铅超富集植物,但其表现出的较强的富集能力和稳定的转移能力,使其具有修复铅污染土壤的潜力,可作为铅富集植物。
3 讨论 3.1 铅处理对荠菜生长发育的影响铅是一种植物非必需元素,对植物有潜在和直接的伤害作用[22],抑制植物的生长[23]。植物受铅的毒害症状表现为根系萎缩、叶片褪绿变褐甚至枯烂、生物量下降等。但也有研究表明,低、中浓度铅处理反而会刺激植物的生长[24]。王红旗等[25]发现100 mg·L-1铅处理能促进羽叶鬼针草的生长,表现为株高、生物量较对照有所增加,Belimov等[26]发现100 mg·L-1铅处理能促进印度芥菜根系的生长,生物量与对照相比有所增加。本研究显示,铅处理对荠菜的生长起到低促高抑的作用。这与铅富集植物东南景天[27]的表现类似。当铅浓度≤800 mg·kg-1时,荠菜生长受到的促进作用明显,且在800 mg·kg-1时株高、根长、叶长、地上部和根系生物量均达到峰值。当铅浓度>800 mg·kg-1时,荠菜的生长虽受到抑制,但几乎所有生长指标(除1600 mg·kg-1处理组的地上部生物量外)仍高于对照组。植物在中、高浓度处理下生长受抑制可能是因为在高浓度胁迫下,植物需要通过消耗其有效能量来保持细胞的正常功能,从而造成生长效率降低。总体而言,铅处理对荠菜的生长发育起到促进作用。
耐性临界值是表示植物在保持正常生长状态下修复潜力的关键数据,耐性临界值高的植物其体内能够吸收大量重金属。耐性临界值分为上限和下限。下限以生物量减少10%为标准,上限以生物量减少20%为标准。根据上述标准判定,荠菜在铅最高处理浓度下(1600 mg·kg-1)仍未达到耐性临界值的上限。这表明荠菜具有较强的耐铅性,且荠菜对铅的耐性临界值不低于1600 mg·kg-1。一般来说,自然条件下铅污染土壤浓度往往低于1600 mg·kg-1,同时自然条件下荠菜的生长并不会受盆栽试验的限制而能更好的生长,因此荠菜在自然条件下能够表现出更高的耐铅性,具有修复铅污染土壤的潜力。
3.2 铅处理对荠菜逆境生理的影响研究表明,重金属会抑制植物光和系统中的电子传递和卡尔文循环的再生阶段,使植物长势减弱,生物量减少[28]。叶绿素则是卡尔文循环的重要组成部分,其含量的增减与光合作用的强弱以及物质合成速率的高低息息相关[29]。因此,植物叶绿素含量的增减不仅能直接反应光合作用水平的强弱,还能间接表明植株是否遭受重金属的毒害。有研究报道,铅处理下植物的叶绿素含量会下降。例如,袁红艳等[30]发现费菜在铅处理22d后,其叶绿素a、叶绿素b和总叶绿素均随处理浓度的增加而显著降低。但对于铅超富集植物或富集植物而言,适量的铅对植物叶绿素含量并无显著影响或能刺激叶绿素含量的增加。孟晓霞等[31]发现鱼腥草在铅浓度<400 mg·L-1时,其叶绿素含量与对照相比无显著变化;龙巍等[32]发现西南山梗菜在300~4000 mg·kg-1铅处理下,其叶绿素含量均高于对照,并在4000 mg·kg-1时达到最大值。本研究显示,低、中浓度处理时,荠菜的叶绿素a、叶绿素b、叶绿素总量总体上呈增长趋势,且三者均在1000 mg·kg-1时达到峰值。这表明低、中浓度处理可能没有破坏植物体内叶绿体的结构,减缓叶绿素的合成过程,反而可能刺激了合成叶绿素的关键酶活性(叶绿素酸酯还原酶)和物质含量(氨基-r-酮戊酸)[33],致使植物的叶绿素含量增加。以上结果从植物生长代谢层面揭示了荠菜正常生长于铅胁迫环境的原因,表明荠菜本身具有较高的耐铅性。
活性氧是植物体内正常代谢产物,主要产生于叶绿体和线粒体。正常情况下,植物细胞内活性氧的产生与清除处于动态平衡,而一旦植物遭受逆境胁迫该平衡势必被打破,使活性氧自由基迅速积累[34]。过量的活性氧自由基将引起膜脂过氧化的链式反应,产生大量的膜脂过氧化产物,严重损伤细胞膜的结构和功能。因此,及时地清除过量活性氧,迅速地缓解氧化胁迫对细胞膜的损伤,是植物耐逆境胁迫的关键所在。多数研究显示,铅能诱发植物体内活性氧与MDA的大量产生和积累[35, 36]。张兆金等[37]发现土荆芥在铅处理(50~450 mg·kg-1)15 d后,MDA含量显著升高。本研究显示,低浓度处理对荠菜叶片MDA含量影响有限,与对照相比无显著性差异。同时,O-2与H2O2含量在相同浓度处理时,各处理间差异也不显著。这表明低浓度(200~400 mg·kg-1)铅处理时,植物体内的活性氧总体水平不高,并未形成积累之势,对细胞膜的伤害作用较小。而中浓度处理时,O-2与H2O2含量不断增加,表明在该阶段植物受到的氧化胁迫加剧,活性氧大量产生并已形成积累。但MDA含量在该阶段却呈小幅降低的趋势,且各处理间差异不显著。这表明虽然铅浓度的升高刺激了植物体内活性氧的大量产生和积累,但植物依靠自身的抗氧化保护系统,有效地抵抗了因过量活性氧积累而造成的过氧化胁迫,减轻了活性氧对细胞膜的伤害作用,减缓了膜脂过氧化反应。高浓度处理时,植物遭受的过氧化胁迫进一步加剧,然而H2O2含量在该阶段各处理间差异不显著,则又表明荠菜的抗氧化保护系统即使在高氧化胁迫下仍能保持高效的清除能力。综合而言,荠菜在低、中浓度铅处理时表现出很好的抗氧化胁迫能力,保持了细胞的正常功能,为植物的生长发育提供了有效保障,同时证明荠菜能够正常生长于低、中浓度铅胁迫的环境中,表现出较高的耐铅性。
荠菜之所以在低、中浓度处理下受到的氧化胁迫程度较低,是因为荠菜抗氧化酶的积极响应,而抗氧化酶的积极响应恰好是植物在逆境胁迫下的内在应激和调节机制[38]。SOD和CAT在植物体内组成了一个有效的活性氧清除系统,能够有效地清除活性氧自由基[8, 39]。这两种酶的抗氧化能力直接决定植物对逆境胁迫的响应程度[40]。SOD与CAT的酶活性变化规律总体相似,均为在低、中浓度铅处理时迅速升高,表现出一定的协同作用。结合O-2、H2O2、MDA含量在该浓度阶段的变化可以看出,这两种酶在降低细胞内O-2、H2O2、MDA含量、维持细胞氧化平衡过程中起到了重要作用。从酶功能上看,SOD是唯一能将O-2转变成为H2O2的酶,它构成了植物清除活性氧自由基的第一道防线;CAT可以在无底物的情况下直接催化H2O2向H2O转化,这构成了第二道防线。两种酶功能的不同,表明了刺激两者活性上升的原因各不相同。前者可能是因为活性氧自由基的产生和积累激活了更多的SOD[41],也可能是因为编码SOD的基因表达增强,进而产生了更多的SOD[28];而后者可能与CAT在清除H2O2时不需要电子供体且反应速度快相关。
综合上述逆境生理指标可以发现,荠菜自身具有良好的抵御低、中浓度铅胁迫的能力,为植物在铅胁迫环境中正常生长提供了先决条件。
3.3 荠菜对铅的富集能力植物吸收、积累和转运重金属的能力不仅作为判断该种植物是否为超富集植物或富集植物的重要标准,也直接表明了该种植物能否用于修复重金属污染土壤。目前对铅超富集植物的界定主要采用Baker和Brooks提出的标准:一是植物地上部分铅含量大于1000 mg·kg-1;二是植物的富集系数与转运系数均大于 l。由于能满足上述要求的铅超富集植物并不多,国外发现的有Agrostis ovina[4]、Thiaspi rotundifolium[5]、Brassica jouncea[6],国内有密毛白莲蒿[7]等,多数植物被界定为铅耐性植物。本研究显示,荠菜地上部、根系铅含量与铅处理浓度呈一次线性变化,具有显著的正相关性(P<0.05),表明荠菜对铅的吸收与土壤中铅浓度密切相关。这与多数铅超富集植物或富集植物表现相似[14]。在铅处理浓度≥1000 mg·kg-1时,荠菜地上部铅含量为1 036.14 mg·kg-1,达到了铅超富集植物的临界值(1000 mg·kg-1)。同时,在不同铅处理条件下,荠菜没有表现出明显中毒症状,其根系及地上部富集系数几乎都大于1,但转运系数均小于1。这说明荠菜地上部与根系均能吸收大量的铅,但根系吸收能力强于地上部。究其原因,可能是因为植物根系对吸收进入体内的铅具有吸持、钝化或沉淀作用,使根系所吸收的铅很难向地上部运输[32]。按照铅超富集植物的定义,荠菜没有达到铅超富集植物的标准,因此不是铅超富集植物,而是铅富集植物。与其他铅超富集植物如柳叶箬、金丝草[42]相比,荠菜地上部铅含量相对较低,但其地上部铅提取量明显大于根系铅提取量,铅积累量最大值达到了6.88 mg·盆-1(土壤铅含量为1400 mg·kg-1),显示出较强的修复力,能够用于铅污染土壤的修复。
4 结论(1)铅处理条件下,随土壤铅浓度的增大,荠菜地上部、根系的铅含量均呈增加趋势,地上部铅含量达到铅超富集植物的临界值,地上部、根系富集系数大于1,但转运系数小于1,是一种新的铅富集植物。
(2)铅处理条件下,荠菜能正常生长,未出现任何中毒症状。同时,荠菜作为一种冬季农田杂草,不仅具有很强的耐寒性,而且生长迅速,适应能力强,全国各地分布广泛。本次研究材料均属于当地农田自生植物,这就有效地避免了因引种带来的生物入侵问题。因此,荠菜作为一种针对冬季铅污染农田的修复材料,具有现实利用价值。
(3)低浓度铅处理时,荠菜体内未形成明显的氧化胁迫,抗氧化酶(SOD、CAT)活性较高。然而,中、高浓度铅处理对荠菜造成了明显的氧化伤害,使其抗氧化酶活性不断下降,表明浓度的变化是引发荠菜氧化损伤的一个关键因素,且浓度越高,氧化伤害越强。
| [1] | 陈兴兰, 杨成波. 土壤重金属污染、生态效应及植物修复技术[J]. 农业环境与发展, 2010, 27(3):58-62. CHEN Xing-lan, YANG Cheng-bo. Soil heavy metal pollution, ecological effect and phytoremediation technology[J]. Agro-Environment & Development, 2010, 27(3):58-62. |
| [2] | Mcgrath S, Zhao J, Lombi E. Phytoremediation of metals, metalloids and radionuclides[J]. Advances in Agronomy, 2002, 75:1-56. |
| [3] | Maestri E, Marmiroli M, Visioli G. Metal tolerance and hyperaccumulation:Costs and trade-offs between traits and environment[J]. Environmental and Experimental Botany, 2010, 68(1):1-13. |
| [4] | Nanda Kumar P, Dushenkov S, Salt D. Crop Brassicas and phytoremediation:A novel environmental technology[J]. Cruciferae Newsl Eucarpia, 1994, 16:18-19. |
| [5] | Reeves R, Brooks R. Hyperaccumulation of lead and zinc by two metallophytes from mining areas of Central Europe[J]. Environmental Pollution Series A, Ecological and Biological, 1983, 31(4):277-285. |
| [6] | Reeves R, Baker A, Brooks R. Abnormal accumulation of trace metals by plants[R]. Southborough: International Business Communications, 1996:1-10. |
| [7] | 罗于洋, 赵 磊, 王树森. 铅超富集植物密毛白莲蒿对铅的富集特性研究[J]. 西北林学院学报, 2010, 25(5):37-40. LUO Yu-yang, ZHAO Lei, WANG Shu-sen. Absorption characteristics of Artemisia sacrorum var. messerschmidtiana to lead[J]. Journal of Northwest Forestry University, 2010, 25(5):37-40. |
| [8] | Ensley B D, Raskin I. Phytoremediation of toxic metals:Using plants to clean up the environment[M]. New York: John Wiley & Sons, 2000:13-23. |
| [9] | Wu L, Li H, Luo Y. Nutrients can enhance phytoremediation of copper-polluted soil by Indian mustard[J]. Environmental Geochemistry and Health, 2004, 26(2):331-335. |
| [10] | 林立金, 宁 博, 廖明安. 冬季农田杂草繁缕对镉的积累特性研究[J]. 生态环境学报, 2014, 23(4):673-678. LIN Li-jin, NING Bo, LIAO Ming-an. Cadmium accumulation characteristics of winter farmland weed Stellaria media[J]. Ecology and Environmental Sciences, 2014, 23(4):673-678. |
| [11] | 赵立新. 杂草对重金属的生物积累特性的研究[J]. 环境保护科学, 2005, 30(5):43-45. ZHAO Li-xin. Study on the bioaccumulation character of weeds for heavy metals in polluted soil[J]. Environmental Protection Science, 2005, 30(5):43-45. |
| [12] | 魏树和, 周启星, 刘 睿. 重金属污染土壤修复中杂草资源的利用[J]. 自然资源学报, 2005, 20(3):432-440. WEI Shu-he, ZHOU Qi-xing, LIU Rui. Utilization of weed resources in heavy metal soil remediation[J]. Journal of Natural Resources, 2005, 20(3):432-440. |
| [13] | 聂俊华, 刘秀梅, 王庆任. Pb (铅) 富集植物品种的筛选[J]. 农业工程学报, 2004, 20(4):255-258. NIE Jun-hua, LIU Xiu-mei, WANG Qing-ren. Screening of lead accumulators[J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20(4):255-258. |
| [14] | 吴双桃, 吴晓芙, 胡曰利. 铅锌冶炼厂土壤污染及重金属富集植物的研究[J]. 生态环境, 2004, 13(2):156-157, 160. WU Shuang-tao, WU Xiao-fu, HU Yue-li. Study on lead and zinc soil pollution and heavy metal accumulator[J]. Ecology and Environmental Sciences, 2004, 13(2):156-157, 160. |
| [15] | 杨居荣, 黄 翌. 植物对重金属耐性机理[J]. 生态学杂志, 1994, 13(6):20-26. YANG Ju-rong, HUANG Yi. Mechanism of heavy metal tolerance of plants[J]. Chinese Journal of Ecology, 1994, 13(6):20-26. |
| [16] | 李 玲, 李娘辉, 蒋素梅. 植物生理学模块实验指导[M]. 北京:科学出版社, 2009:45-50. LI Ling, LI Niang-hui, JIANG Su-mei. Plant physiology experiment module[M]. Beijing:Science Press, 2009:45-50. |
| [17] | Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology, 1994, 144(3):307-313. |
| [18] | 李合生, 孙 群, 赵世杰. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2004:35-40. LI He-sheng, SUN Qun, ZHAO Shi-jie. Experimental principle and technology of plant physiology and Biochemistry[M]. Beijing:Higher Education Press, 2004:35-40. |
| [19] | 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, 26(6):55-57. WANG Ai-guo, LUO Guang-hua. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communications, 1990, 26(6):55-57. |
| [20] | Zhang X F, Xia H P, Li Z A. Identification of a new potential Cd-hyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method[J]. Journal of Hazardous Materials, 2011, 189(1):414-419. |
| [21] | 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000:31-40. BAO Shi-dan. Soil agro-chemistrical analysis[M]. Beijing:China Agriculture Press, 2000:31-40. |
| [22] | Książek M, Woźny A, Młodzianowski F. Effect of Pb(NO3)2 on poplar tissue culture and the ultrastructural localization of lead in culture cells[J]. Forest Ecology and Management, 1984, 8(2):95-105. |
| [23] | Pongrac P, Zhao F, Razinger J. Physiological responses to Cd and Zn in two Cd/Zn hyperaccumulating Thlaspi species[J]. Environmental and Experimental Botany, 2009, 66(3):479-486. |
| [24] | Ye H B, Yang X E, He B. Growth response and metal accumulation of Sedum alfredii to Cd/Zn complex-polluted ion levels[J]. Acta Botanica Sinica, 2002, 45(9):1030-1036. |
| [25] | 王红旗, 李 华, 陆泗进. 羽叶鬼针草对Pb的吸收特性及修复潜力[J]. 环境科学, 2006, 26(6):143-147. WANG Hong-qi, LI Hua, LU Si-jin. Bidens maximowicziana's adsorption ability and remediation potentail to lead in soils[J]. Environmental Science, 2006, 26(6):143-147. |
| [26] | Belimov A, Hontzeas N, Safronova V. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.)[J]. Soil Biology and Biochemistry, 2005, 37(2):241-250. |
| [27] | He B, Yang X E, Ni W Z. Sedum alfredii:A new lead-accumulating ecotype[J]. Acta Botanica Sinica, 2001, 44(11):1365-1370. |
| [28] | Baker A, Brooks R. Terrestrial higher plants which hyperaccumulate metallic elements:A review of their distribution, ecology and phytochemistry[J]. Biorecovery, 1989, 1(2):81-126. |
| [29] | 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007, 23(1):105-110. YIN Yong-qiang, HU Jian-bin, DENG Ming-jun. Latest development of antioxidant system and responses to stress in plant leaves[J]. Chinese Journal of Eco-Agriculture, 2007, 23(1):105-110. |
| [30] | 袁红艳, 刘嘉琦, 陆小平. 铅胁迫对费菜叶绿素含量及抗氧化酶活性的影响[J]. 安徽农业科学, 2010, 23:12445-12447. YUAN Hong-yan, LIU Jia-qi, LU Xiao-ping. Effect of lead stress on the content of chlorophyll and the activity of antioxidant enzyme of Sedum aizoon L.[J]. Journal of Anhui Agricultural Sciences, 2010, 23:12445-12447. |
| [31] | 孟晓霞. 鱼腥草对铅的吸收特性及耐性研究[D]. 成都:四川农业大学, 2005:38-40. MENG Xiao-xia. Lead tolerance and accumulation in Houttuynia cordata Thunb[D]. Chengdu:Sichuan Agricultural University, 2005:38-40. |
| [32] | 龙 巍. 西南山梗菜对Pb的累积特性及耐性研究[D]. 成都:四川农业大学, 2009:23-31. LONG Wei. Study on accumulation characteristics and tolerance of Lobelia sequinii Lévl. et Vant to lead[D]. Chengdu:Sichuan Agricultural University, 2009:23-31. |
| [33] | Zengin F K, Munzuroglu O. Toxic effects of cadmium(Cd2+) on metabolism of sunflower(Helianthus annuus L.) seedlings[J]. Acta Agriculturae Scandinavica Section B-Soil and Plant Science, 2006, 56(3):224-229. |
| [34] | Chaparzadeh N, D'Amico M L, Khavari-Nejad R A. Antioxidative responses of Calendula officinalis under salinity conditions[J]. Plant Physiology and Biochemistry, 2004, 42(9):695-701. |
| [35] | Liu D, Islam E, Li T Q. Comparison of synthetic chelators and low molecular weight organic acids in enhancing phytoextraction of heavy metals by two ecotypes of Sedum alfredii Hance[J]. Journal of Hazardous Materials, 2008, 153(1):114-122. |
| [36] | Gupta D, Nicoloso F, Schetinger M. Lead induced responses of Pfaffia glomerata, an economically important Brazilian medicinal plant, under in vitro culture conditions[J]. Bulletin of Environmental Contamination and Toxicology, 2011, 86(3):272-277. |
| [37] | 张兆金. 土荆芥对铅胁迫的生理响应及其对铅污染土壤的修复[D]. 南京: 南京林业大学, 2006:23-31. ZHANG Zhao-jin. Heavy metal accumulation and physiological responses of Chenopodium ambrosioides L. under lead stress[D]. Nanjing: Nanjing Forestry Univeristy, 2006:23-31. |
| [38] | Sharma N C, Sahi S V, Jain J C. Sesbania drummondii cell cultures:ICP-MS determination of the accumulation of Pb and Cu[J]. MicroChemical Journal, 2005, 81(1):163-169. |
| [39] | Kubota H, Takenaka C. Field Note:Arabis gemmifera is a hyperaccumulator of Cd and Zn[J]. International Journal of Phytoremediation, 2003, 5(3):197-201. |
| [40] | 刘 鹏, 杨玉爱. 钼、硼对大豆叶片膜脂过氧化及体内保护系统的影响[J]. 植物学报:英文版, 2000, 42(5):461-466. LIU Peng, YANG Yu-ai. Effects of molybdenum and boron on membrane lipid peroxidation and endogenous protective systems of soybean leaves[J]. Journal of Integrative Plant Biology, 2000, 42(5):461-466. |
| [41] | Shen Z G, Liu Y L. Progress in the study on the plants that hyperaccumulate heavy metal[J]. Plant Physiology Communications, 1998, 34:133-139. |
| [42] | 侯晓龙, 常青山, 刘国峰. Pb超富集植物金丝草、柳叶箬[J]. 环境工程学报, 2012, 6(3):989-994. HOU Xiao-long, CHANG Qing-shan, LIU Guo-feng. Two lead-hyperaccumulator:Pogonatherum crinitum and Lsache globosa[J]. Chinese Journal of Environmental Engineering, 2012, 6(3):989-994. |
 2016, Vol. 35
2016, Vol. 35