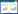文章信息
- 王子莹, 邱梦怡, 杨妍, 孙可
- WANG Zi-ying, QIU Meng-yi, YANG Yan, SUN Ke
- 不同生物炭吸附乙草胺的特征及机理
- Sorption of acetochlor by biochars derived from wood dust and swine manure at different pyrolytic temperatures
- 农业环境科学学报, 2016, 35(1): 93-100
- Journal of Agro-Environment Science, 2016, 35(1): 93-100
- http://dx.doi.org/10.11654/jaes.2016.01.013
-
文章历史
- 收稿日期: 2015-07-24
乙草胺(Acetochlor),是酰胺类最具代表性的除草剂之一,化学名称为2-甲基-6-乙基-N-乙氧基甲基-α-氯化乙酰替苯胺,主要用于玉米、大豆、花生、棉花和马铃薯等作物的杂草防除[1],是我国除草剂使用量最大的品种之一[2]。大量施用的酰胺类除草剂(包括乙草胺)引起了全球范围的污染[3, 4],有证据证明乙草胺可以归为内分泌干扰物(EDC)[5],美国环保局(EPA)将其定为B-2类致癌物质。乙草胺在土壤中的吸附行为可以显著地影响其在环境中的分布、迁移、转化、生物有效性和归宿,对乙草胺在天然有机质(NOM)上的吸附行为已有报道。Bedmar等[4]研究了土壤对乙草胺的吸附行为,结果表明吸附强度(Freundlich模型中的参数Kf)不仅与土壤中的有机碳(OC)含量成正比,也与农药的疏水性有关。Spokas等[6]报道了将少量(质量分数为5%)生物炭(Biochar)加入土壤中,可以提高土壤对乙草胺和阿特拉津的吸附能力,从而减少这些农药的扩散率。
生物炭是生物质在无氧条件下经热解作用得到的性质稳定、不易分解的OC化合物[7],通常认为生物炭属于黑炭(BC)的一种[8]。由于生物炭可以改良土壤,提高土壤肥力[9],缓解气候变化[10],对有机污染物有很显著的吸附效果[9, 11],近年来其结构和性质引起了广泛的关注。生物炭的理化性质随着热解温度和生物质来源不同呈现较大差异,因而影响其对土壤中有机污染物的吸附行为和吸附机制[12, 13, 14, 15]。目前关于不同来源以及不同热解温度下生产的生物炭对乙草胺的吸附特征的报道相对有限。因此,本研究考察了在不同温度下制备的松树木屑和猪粪便来源生物炭对乙草胺的吸附特征,并探讨了其中可能存在的吸附机理,为进一步评价乙草胺在土壤生态环境中的归趋提供依据,并为有效利用生物炭作为工程吸附剂提供参考,从而有助于降低环境中有机污染物的生态风险。
1 材料与方法 1.1 吸附质乙草胺的分子结构式如图 1所示。基本理化性质:分子量(MW)269.77,溶解度(SW,20 ℃)282 mg·L-1,辛醇-水分配系数(lgKow)4.14[6],且是不挥发的非电解质,在土壤中的半衰期为14 d。试验所用乙草胺(98.5%)购于Dr. Ehrenstorfer GmbH(Augsburg,Germany)。
|
| 图 1 乙草胺的分子结构式 Figure 1 Molecular structure of acetochlor |
生物炭的制备过程简述如下[17]:以松树木屑(Wood dust,采自黑龙江哈尔滨市)和脱水的猪粪便(Swine,采自北京市郊养殖场)为原料,粉碎至粒径小于1.5 mm,然后将其置于坩埚中,放入马弗炉,在缺氧的条件下升温至目标温度(250、300、350、400、450、500、600 ℃)并保持1 h。用1 mol·L-1的盐酸酸洗所得的生物炭,以去除其中一些营养物(如可溶性盐和含钾的组分)、碳酸盐和溶解性有机质(DOM,主要包括碳水化合物和富里酸),从而排除pH或DOM对生物炭吸附乙草胺的影响。酸洗后离心去除上清液,固体部分用去离子水水洗,直至液体部分达到中性,然后在105 ℃下烘干,最后过0.25 mm筛(60目)存储备用。按照上述方法得到14种生物炭,以WDX和SWX表示样品名,其中WD和SW分别表示原始材料的英文名首字母,X表示其加热温度(250、300、350、400、450、500、600 ℃),用WD0和SW0表示未经处理的原料。下文中,松树木屑来源的生物炭简称WDBs,猪粪便来源的生物炭简称SWBs。
1.3 生物炭的表征用Vario EI型元素分析仪测定生物炭样品中C、H、N和O四种元素的百分含量。生物炭的灰分含量为样品在750 ℃下加热4 h后得到的残余物的质量占加热前样品质量的百分比。为了获得生物炭样品的化学结构组成,采用Bruker Avance 300 NMR型核磁共振分析仪获得13C-NMR谱图[16]。采用Kratos AXIS Ultra X射线光电子能谱(XPS)分析仪分析样品的表面官能团结构以及样品表面各元素的原子比例,电子源为225 W的Al Kα[16, 17]。样品比表面积和孔径的测定采用273 K下的CO2吸附脱附等温线,通过非定域函数理论(NLDFT)和巨正则系蒙特卡罗方法(GCMC)计算得到具体的参数。
1.4 吸附试验采用序批平衡方法进行吸附试验,得到乙草胺的吸附等温线。背景溶液中加入0.01 mol·L-1的CaCl2控制离子强度,200 mg·L-1的NaN3抑制微生物的生长。用背景溶液配制乙草胺的初始溶液,浓度范围是100~100 000 μg·g-1,甲醇和水的体积比控制在0.1%以内,避免甲醇的共溶剂效应。通过预实验确定合适的吸附质/吸附剂之比,控制吸附量为吸附质初始浓度的20%~80%。将乙草胺的初始溶液加入到8 mL已经装有预先称重的吸附剂样品的玻璃瓶内,并用内衬聚四氟乙烯垫的盖子旋紧密封,放在振荡速度为120 r·min-1的回转摇床上,在(23±1)℃条件下振荡平衡7 d,吸附平衡后将样品竖直静置24 h,并用滴管取出上层清液至2 mL自动进样瓶内,用高效液相色谱仪(HPLC)测定。液相色谱分析采用C18反相色谱柱(5 μm,4.6 mm×250 mm)和紫外检测器(紫外光波长222 nm),流动相为75∶25(V∶V)的乙腈和去离子水。
从空白实验组的结果可知,实验用瓶对乙草胺的吸附量影响不明显,乙草胺的损失可以忽略,因此被吸附在固相(生物炭)上的乙草胺量(Qe)可通过原始溶液中初始的乙草胺浓度(C0)和平衡时液相中的乙草胺浓度(Ce)之差得到。为了保证结果的准确性,所有样品都进行平行的吸附实验。
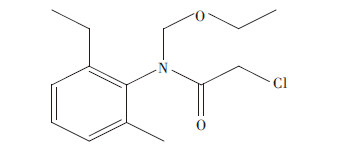
1.5 数据分析采用Freundlich模型对吸附实验数据进行拟合,模型公式如下:
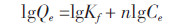
式中:Qe为吸附平衡后吸附质在固相上的浓度,μg·g-1;Ce为吸附平衡后吸附质在液相中的浓度,μg·L-1;Kf为Freundlich吸附能力参数,μg·g-1·(μg·L-1)-n;n为吸附等温线的非线性因子。
吸附分配参数(Kd)和单点OC标准化的Kd值(Koc)通过下列公式计算得到:
式中:foc是OC含量,本文分别计算了Ce=0.01Sw、0.1Sw、1Sw的lgKd和lgKoc值。
乙草胺在生物炭上的吸附参数和生物炭性质之间的相关关系通过SPSS计算Pearson相关系数确定。
2 结果与讨论 2.1 生物炭的性质分析表 1给出了生物炭的总元素组成、原子比、灰分含量和比表面积。WDBs的OC含量随着温度的升高而升高,SWBs的OC含量并没有这个趋势,且其OC含量低于WDBs,可能是由于SWBs具有较高的灰分含量。生物炭的碳化水平可以用H/C原子比评价,较低的H/C值意味着较高的碳化水平[18]。由表 1数据可看出,两类生物炭的H/C原子比均随温度的升高而下降,表明生物炭的碳化程度随着温度的升高而升高。O/C和(O+N)/C的原子比例可以作为评价生物炭样品极性和亲水性的指标[12]。随着温度的升高,O/C和(O+N)/C的原子比下降,表明生物炭极性官能团的减少和疏水性的增加[13]。以上结果与Novak等[12]的结果一致,即低温产生的生物炭有更强的极性。除250 ℃制备的生物炭之外,相比于WDBs,SWBs具有更高的O/C和(O+N)/C原子比,可能是由于SWBs具有更多的矿物,这些矿物可以在生物炭的裂解过程中保护有机质上的极性官能团,从而使这些官能团不易被去除。
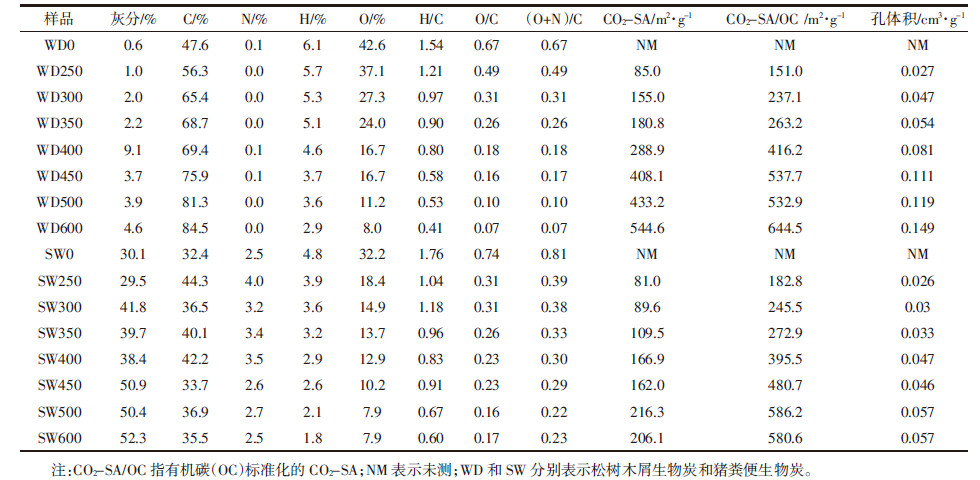 |
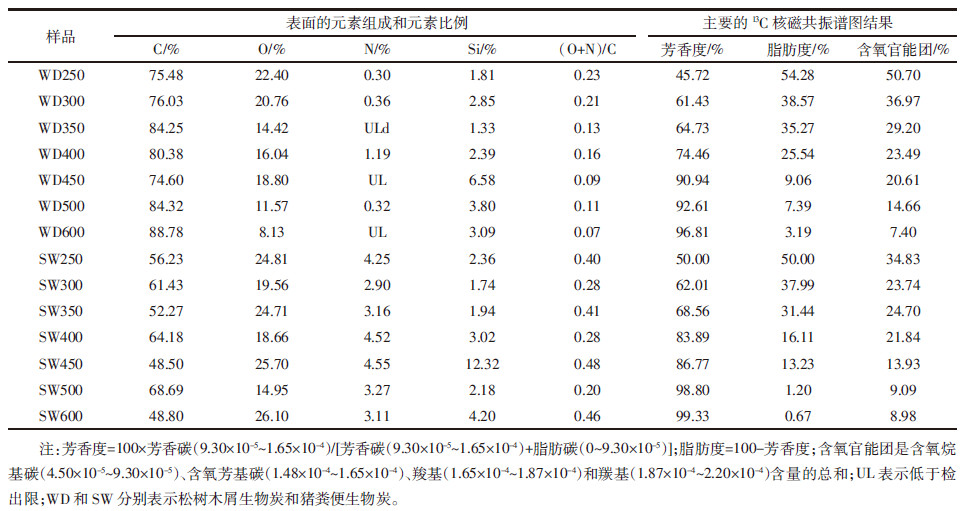
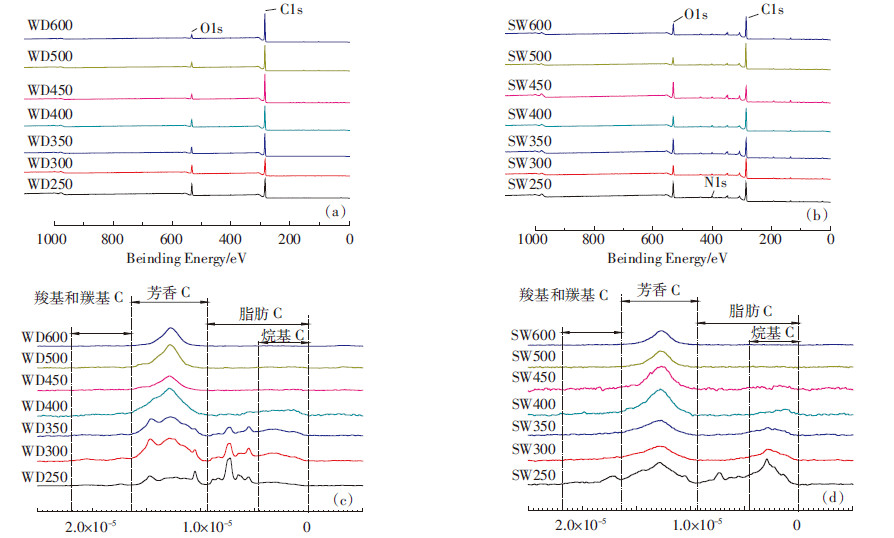
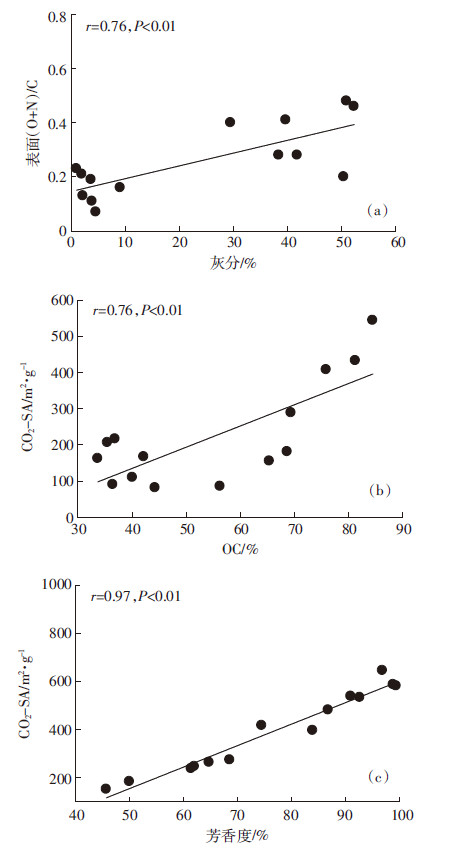
生物炭样品的主要表面元素组成见表 2,XPS的谱图如图 2a和图 2b所示。样品表面元素的组成和整体元素的组成有明显的区别,对比表 1和表 2发现,生物炭的表面OC含量高于相应的整体OC含量。这说明,生物炭的OC可能主要集中于样品表面,而样品中的矿物被有机质包裹在内部[16]。此外,生物炭的表面极性和整体极性也有明显的差异:低温WDBs(热解温度 < 450 ℃)的表面极性小于其整体极性,表明这些样品的疏水官能团很大一部分在样品表面;高温WDBs(热解温度≥450 ℃)则相反,表明随着热解温度的升高,这些生物炭的结构发生了变化。生物炭的表面极性和灰分含量之间有正相关关系(图 3a),且灰分含量较高的SWBs的表面极性大于灰分含量较低的WDBs的表面极性,可能是由于矿物有助于极性官能团暴露在生物炭表面。
 |
|
| 图 2 生物炭的XPS谱图(a和b)和13C-NMR(c和d)谱图 Figure 2 XPS(a and b) and 13C-NMR(c and d) spectra of biochars |
固态13C核磁共振谱图和主要的积分结果如图 2c、图 2d和表 2所示,可以看出生物炭的结构组成随着热解温度的升高发生了显著的变化。图谱积分方法如下[19]:烷基C(0~4.5×10-5)、含氧烷基C(4.5×10-5~9.3×10-5)、芳基C(9.3×10-5~1.48×10-4)、含氧芳基C(1.48×10-4~1.65×10-4)、羧基C(1.65×10-4~1.87×10-4)和羰基C(1.87×10-4~2.20×10-4)。随着热解温度的升高,生物炭的含氧官能团逐渐减少,同样品的极性变化趋势一致,同时生物炭的脂肪度减少,而芳香度显著升高,表明随生物炭碳化程度的升高,生物炭从软碳质逐渐过渡到硬碳质。这与元素分析中H/C原子比减小的结果一致,而且已有研究报道,随着温度的升高,生物炭由不定性的结构逐渐转变为由无机灰分、紧致的多孔乱层石墨组成的结构[20, 21]。当热解温度≥ 450 ℃时,所有与脂肪C相关的特征逐渐减少,大部分的官能团逐渐消失,两类生物炭的图谱变得十分相似[21]。
随着温度的升高,生物炭的CO2-SA显著升高(表 1),与Keiluweit等[22]的报道一致,而WDBs的CO2-SA高于SWBs的,可能是由于WDBs具有更高的OC含量,因为所有生物炭的CO2-SA值与其OC值之间存在显著的正相关关系(图 3b)。将WDBs和SWBs的CO2-SA用OC归一化之后,仍存在明显的差异(表 1),由此推断还有其他因素决定生物炭的比表面积。我们发现CO2-SA/OC和生物炭的芳香度存在明显的正相关关系(图 3c),也说明了生物炭的芳香组分在其孔隙结构上所起的作用[22]。
|
| 图 3 生物炭的性质之间的相关关系 Figure 3 Relationships between properties of biochars |
乙草胺在生物炭上的吸附等温线可用Freundlich模型很好地拟合(图 4),模型拟合相关参数见表 3。所有非线性指数n值均小于1,表明乙草胺在生物炭上的吸附等温线均为非线性的。从表 3可以看出,所有的原样均比生物炭有更高的n值,WDBs和SWBs的n值均随温度的升高而降低。这表明,热解温度越高,生物炭对乙草胺的吸附等温线的非线性越强。n值越小,表明吸附剂的玻璃态、凝聚态的吸附区域越多,高能量吸附位点越多[23]。该结论可以解释n值和生物炭的H/C之间存在的正相关关系(图 5a),以及n值和芳香度之间的负相关关系(图 5b)。此外,n和CO2-SA/OC之间的负相关关系(图 5c),与Pignatello等[23]所报道的结果(有机质的孔隙度越大导致吸附等温线的非线性越大)一致。
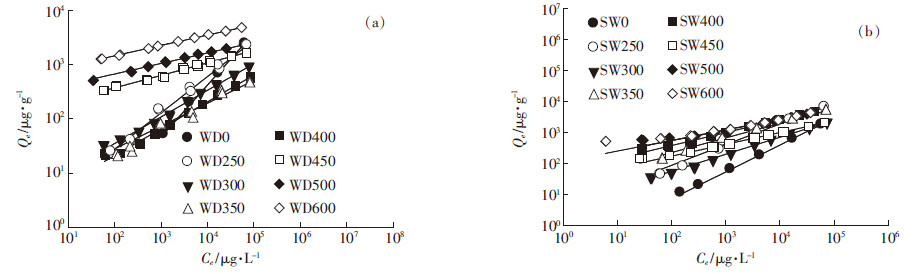
|
| 图 4 乙草胺在生物质原料和生物炭上的吸附等温线 Figure 4 Adsorption isotherms of acetochlor on raw materials and their biochars |
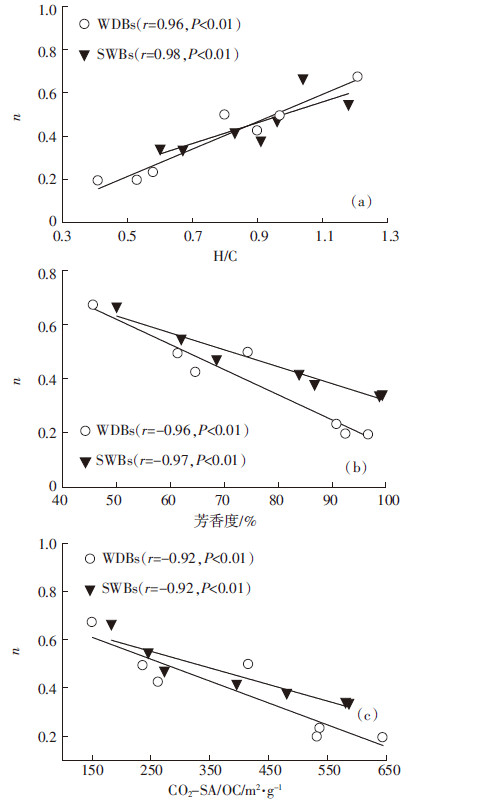
|
| 图 5 生物炭吸附乙草胺的吸附等温线非线性因子(n)和生物炭性质之间的相关关系 Figure 5 Relationships between nonlinear adsorption coefficients(n) of acetochlar adsorption on biochars and biochar properties |
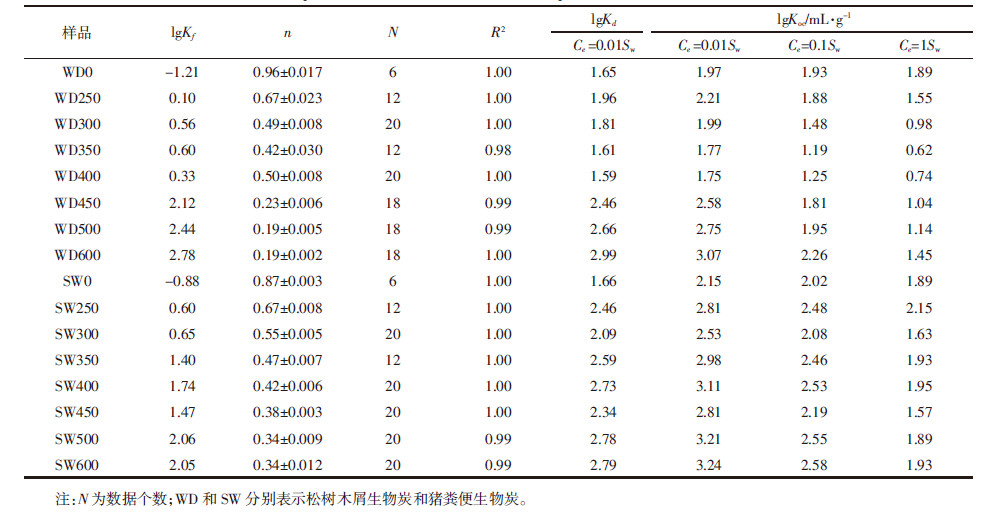 |
对比两类生物炭可知,SWBs吸附乙草胺的lgKoc(Ce= 0.01 Sw)高于WDBs(表 3),生物炭的灰分含量与lgKoc值之间存在显著的正相关关系(图 6a)。这表明SWBs的高灰分含量可能是导致其具有更高吸附能力的原因。
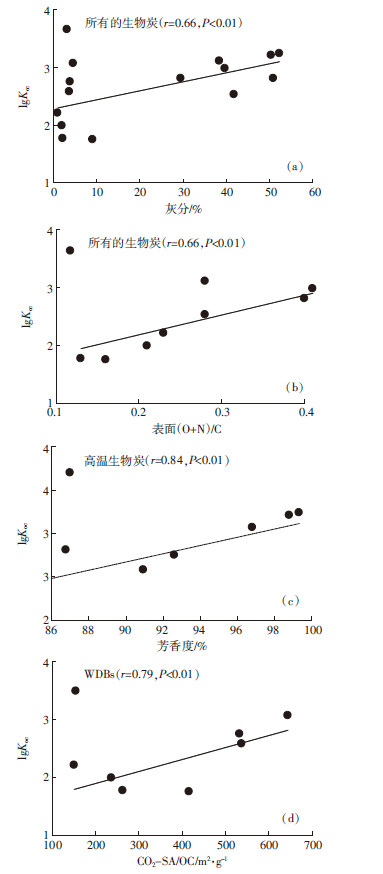
|
| 图 6 乙草胺在生物炭上吸附的lgKoc值和生物炭性质 之间的相关关系 Figure 6 Relationships between Koc of acetochlar adsorption on biochars and biochar properties |
从整体上看,高温生物炭对乙草胺的吸附能力高于低温生物炭(表 3)。这与已有的报道一致[13, 18],较高温度的生物炭对于吸附和固定土壤中的有机污染具有更好的效果。然而,观察表 3的数据发现,乙草胺在低温WDBs(热解温度 < 450 ℃)上吸附的lgKoc值随温度升高呈降低的趋势,可能是由于氢键对极性吸附质吸附行为的作用[24]。乙草胺分子中的氧原子可以作为形成氢键的电子受体,而低温生物炭中的含氧官能团以及含氮的组分可以参与形成氢键,因此可以假设低温生物炭(热解温度 < 450 ℃)能通过氢键吸附乙草胺。低温生物炭的表面(O+N)/C和lgKoc之间显著的正相关关系(图 6b)验证了上述假设,由于生物炭的表面极性随着温度的升高而降低,降低了氢键形成的可能性,导致低温WDBs的吸附能力随温度的升高而降低。对于高温生物炭(热解温度≥450 ℃),其lgKoc值和芳香度之间存在正相关关系(图 6c),因此随着热解温度的升高,芳香碳组分可能是主导生物炭吸附的因素。随着热解温度的升高,生物炭结构中增加的石墨层结构为π-π电子供体受体(EDA)作用提供了可能[25]。理论上,高温生物炭中的芳香碳结构在π-π EDA反应中,既可以充当电子供体也可以充当电子受体[24];由于乙草胺的苯环是一个缺电子的体系,其可以作为π电子受体参与EDA反应。
除了氢键以及π-π EDA反应之外,Chun等[18]报道了孔填充作用可能是疏水性有机污染物在生物炭上吸附的主导因素。WDBs吸附乙草胺的lgKoc值与WDBs的CO2-SA/OC之间存在正相关关系(图 6d)。对于SWBs,虽然lgKoc与CO2-SA/OC之间没有上述关系,但是两类生物炭吸附乙草胺的n值均与CO2-SA/OC存在显著的负相关关系(图 5c)。因此,基于上述结果,CO2-SA/OC可能是影响生物炭吸附乙草胺的因素之一。
3 结论(1)生物炭的理化性质因原料来源以及热解温度不同会有明显的变化。随着热解温度的升高,生物炭的碳化程度逐渐升高,极性官能团含量降低,芳香度升高,比表面积显著增加,SWBs比WDBs具有更多的极性官能团以及灰分含量。生物炭样品的表面与整体的元素组成以及官能团量有明显的区别,表面的OC含量高于总体OC含量。
(2)SWBs对乙草胺的吸附能力大于WDBs,可能是因为SWBs具有更高的灰分含量。低温和高温生物炭的吸附机制有所不同,对于低温WDBs,其表面的极性官能团可以与乙草胺产生氢键,而芳香碳组分是控制高温生物炭吸附乙草胺的主要因素。此外,孔填充效应可能是影响生物炭吸附乙草胺的作用之一。
(3)本研究结果可以为理解原料和热解温度对生物炭的物理化学性质产生的影响提供帮助,更重要的是,可以为有效利用生物炭作为吸附剂提供参考。
| [1] | Breaux E J. Identification of the initial metabolites of acetochlor in corn and soybean seedlings[J]. Journal of Agricultural and Food Chemistry, 1986, 34(5):884-888. |
| [2] | 李晓薇, 滕春红, 于洋飞, 等. 不同添加剂对土壤中乙草胺吸附/解吸的影响[J]. 农业环境科学学报, 2009, 28(4):696-701. LI Xiao-wei, TENG Chun-hong, YU Yang-fei, et al. Impact of different additives on the sorption and desorption behavior of acetochlor in soil[J]. Journal of Agro-Environment Science, 2009, 28(4):696-701. |
| [3] | Barbash J E, Thelin G P, Kolpin D W, et al. Major herbicides in ground water[J]. Journal of Environmental Quality, 2001, 30(3):831-845. |
| [4] | Bedmar F, Daniel P E, Costa J L, et al. Sorption of acetochlor, S-metolachlor, and atrazine in surface and subsurface soil horizons of Argentina[J]. Environmental Toxicology and Chemistry, 2011, 30(9):1990-1996. |
| [5] | Veldhoen N, Helbing C C. Detection of environmental endocrine-disruptor effects on gene expression in live Rana catesbeiana tadpoles using a tail fin biopsy technique[J]. Environmental Toxicology and Chemistry, 2001, 20(12):2704-2708. |
| [6] | Spokas K, Koskinen W, Baker J, et al. Impacts of woodchip biochar additions on greenhouse gas production and sorption/degradation of two herbicides in a Minnesota soil[J]. Chemosphere, 2009, 77(4):574-581. |
| [7] | Verheijen F, Jeffery S, Bastos A. Biochar application to soils:A critical scientific review of effects on soil properties, processes and functions[M]. Publications Office, 2010. |
| [8] | 李 力, 刘 娅, 陆宇超, 等. 生物炭的环境效应及其应用的研究进展[J]. 环境化学, 2011, 30(8):1411-1421. LI Li, LIU Ya, LU Yu-chao, et al. Review of environmental effects and applications of biochar[J]. Environmental Chemistry, 2011, 30(8):1411-1421. |
| [9] | Yang Y, Sheng G. Enhanced pesticide sorption by soils containing particulate matter from crop residue burns[J]. Environmental Science & Technology, 2003, 37(16):3635-3639. |
| [10] | Lehmann J, Gaunt J, Rondon M. Bio-char sequestration in terrestrial ecosystems: A review[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11(2):395-419. |
| [11] | Cao X, Ma L, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 2009, 43(9):3285-3291. |
| [12] | Novak J M, Lima I, Xing B, et al. Characterization of designer biochar produced at different temperatures and their effects on a loamy sand[J]. Annals of Environmental Science, 2009, 3(1):195-206. |
| [13] | Chen B, Zhou D, Zhu L. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science & Technology, 2008, 42(14):5137-5143. |
| [14] | Lattao C, Cao X, Mao J, et al. Influence of molecular structure and adsorbent properties on sorption of organic compounds to a temperature series of wood chars[J]. Environmental Science & Technology, 2014, 48(9):4790-4798. |
| [15] | Zhang H, Voroney R, Price G. Effects of temperature and processing conditions on biochar chemical properties and their influence on soil C and N transformations[J]. Soil Biology and Biochemistry, 2015, 83:19-28. |
| [16] | Sun K, Kang M, Zhang Z, et al. Impact of deashing treatment on biochar structural properties and potential sorption mechanisms of phenanthrene[J]. Environmental Science & Technology, 2013, 47(20):11473-11481. |
| [17] | Yang Y, Shu L, Wang X, et al. Impact of de-ashing humic acid and humin on organic matter structural properties and sorption mechanisms of phenanthrene[J]. Environmental Science & Technology, 2011, 45(9):3996-4002. |
| [18] | Chun Y, Sheng G, Chiou C T, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 2004, 38(17):4649-4655. |
| [19] | Zhang G, Zhang Q, Sun K, et al. Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures[J]. Environmental Pollution, 2011, 159(10):2594-2601. |
| [20] | Bourke J, Manley-Harris M, Fushimi C, et al. Do all carbonized charcoals have the same chemical structure? 2. A model of the chemical structure of carbonized charcoal[J]. Industrial & Engineering Chemistry Research, 2007, 46(18):5954-5967. |
| [21] | Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon(biochar)[J]. Environmental Science & Technology, 2010, 44(4):1247-1253. |
| [22] | Han L, Sun K, Jin J, et al. Role of structure and microporosity in phenanthrene sorption by natural and engineered organic matter[J]. Environmental Science & Technology, 2014, 48(19):11227-11234. |
| [23] | Pignatello J J, Xing B. Mechanisms of slow sorption of organic chemicals to natural particles[J]. Environmental Science & Technology, 1995, 30(1):1-11. |
| [24] | Sun K, Jin J, Keiluweit M, et al. Polar and aliphatic domains regulate sorption of phthalic acid esters(PAEs) to biochars[J]. Bioresource Technology, 2012, 118:120-127. |
| [25] | Keiluweit M, Kleber M. Molecular-level interactions in soils and sediments:The role of aromatic π-systems[J]. Environmental Science & Technology, 2009, 43(10):3421-3429. |
 2016, Vol. 35
2016, Vol. 35