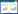文章信息
- 游萍, 贾蓉, 曲东, 唐珺瑶
- YOU Ping, JIA Rong, QU Dong, TANG Jun-yao
- 控制光照条件下生物炭对水稻土中铁还原过程的影响
- Effect of biochar on iron reduction in paddy soils under controlled illumination condition
- 农业环境科学学报, 2016, 35(1): 101-108
- Journal of Agro-Environment Science, 2016, 35(1): 101-108
- http://dx.doi.org/10.11654/jaes.2015.01.014
-
文章历史
- 收稿日期: 2015-07-13
生物炭是指动植物残体或者其他生物质在完全或部分缺氧的情况下,以相对“低温”( < 700 ℃)热解炭化后产生的一类高度芳香化难熔性固态高聚产物[1, 2]。多年来,生物炭在农业上的应用不仅为解决大量农林废弃物露天焚烧造成的环境污染和资源浪费问题提供了新途径,而且已成为“永久固碳”的新思路。目前,针对生物炭农业应用的研究十分广泛,主要表现在改良土壤[3]、污染防控[4]、温室气体减排[5, 6]和促进作物生长[7, 8]等方面。研究同时发现,生物炭能够为微生物提供良好的环境空间,对土壤微生物的生长、发育和代谢活动具有一定影响[9, 10, 11]。众所周知,土壤中生物学过程是影响土壤质量的重要因素。在稻田生态系统中,由于淹水产生的厌氧环境可导致土壤中铁锰氧化物发生微生物介导的异化还原,鉴于铁在土壤中具有较高丰度,所以铁的氧化还原过程受到关注[12]。另一方面,与水生态环境密切相关的光合微生物及其代谢过程亦能够对稻田环境产生影响[13, 14, 15]。光合微生物的产氧过程可改变土壤的氧化还原体系,使Mn(Ⅱ)和Fe(Ⅱ)氧化[16, 17],从而影响到养分的有效性和重金属的形态。另外,水稻土在厌氧光照培养时可产生大量的蓝细菌[16],蓝细菌产生的藻毒素也会增加稻田土壤的环境风险[18, 19]。因此,生物炭的应用是否会对稻田铁循环及光合微生物的生长产生影响将成为新的问题。本研究选择3种水稻土样品,采用土壤泥浆厌氧恒温培育方法,在控制光照条件下研究添加不同粒径生物炭对光合细菌生长及Fe(Ⅲ)还原过程的影响,以期明确生物炭对铁还原微生物和光合微生物的作用机理,阐明水稻土中不同生物菌群之间的生态功能和调节机制,为生物炭的农业利用提供必要的理论依据。
1 材料与方法 1.1 供试土壤和生物炭供试水稻土分别采自天津市塘沽区四道桥农场(用TJ表示)、四川省邛崃市回龙镇柏杨村(用SC表示)和宁夏中卫市沙坡头区滨河镇新墩村(用NX表示)。采集收获后的稻田0~20 cm土样,自然风干,磨细,过1 mm土壤筛。土壤性质见表 1。TJ土壤样品属于滨海盐土,盐分含量较高;SC土壤样品为下蜀黄土母质发育的石灰性土壤;NX土壤样品为黄土母质发育的石灰性土壤,耕作方式为水旱轮作。
试验所用的生物炭为林果木枝条生物炭,购于陕西亿鑫能源科技有限公司。生产工艺流程为干燥除水,挤压成形,装釜加热(550 ℃,6~8 h)和停火冷却。生物炭样品过2 mm筛。生物炭基本组成见表 2。
以3种不同来源的水稻土为供试样品,称取过1 mm筛的风干土样5.000 g若干份,置于容积为15 mL的血清瓶内,分别加入 < 0.25 mm、0.25~0.5 mm、0.5~1 mm及1~2 mm四种不同粒径的生物炭0.200 g(按4%的添加量计),以未添加生物炭的土壤为对照(CK)。按液土比为1∶1加入去离子水,充氮除氧,用橡胶盖及铝盖密封,于30 ℃下恒温培养。设置光照培养(Light)与避光培养(Dark)2种方式,光照培养在光照培养箱中进行,并模拟自然昼夜条件设置光暗周期(12 h∶12 h),光照培养箱的最大光照度为30 000 lx。分别于培养的第0、1、3、5、7、10、15、20、25、30、35、40 d采样,测定土壤泥浆中Fe(Ⅱ)浓度及泥浆pH值,通过Fe(Ⅱ)含量及pH值变化,比较不同粒径生物炭对铁还原过程和体系pH值的影响。光合微生物生长采用测定其光合色素含量的方法表征[16],通过叶绿素a(Chl a)含量变化,比较生物炭粒度对光合微生物生长的影响程度。
1.3 采样及测定方法采样时各个处理分别取出4瓶,用涡旋仪充分摇匀。其中1瓶用于Fe(Ⅱ)和pH值测定,另外3瓶用于Chl a测定。Fe(Ⅱ)测定时分别吸取0.4 mL土壤泥浆3份,溶于4.6 mL浓度为0.5 mol·L-1的盐酸中,在30 ℃下浸提24 h。于3500 r·min-1离心10 min后,取上清液用邻菲罗啉分光光度法测定Fe(Ⅱ)浓度[20],剩余泥浆用pH计测定pH值。泥浆中叶绿素含量测定时,将整瓶泥浆用20 mL无水乙醇定量地洗入研钵中(乙醇的终浓度为80%),然后迅速研磨,4000 r·min-1离心10 min,取上清液分别于663 nm和645 nm波长下测定吸光度,计算Chl a浓度[21],并折算出每千克风干土中Chl a含量。
1.4 数据处理采用Origin 8.0进行数据处理与作图。利用Logistic生长模型对光合微生物生长过程的Chl a含量随时间的变化进行拟合,计算体系中Chl a产生量的最大潜势(a),最大生长速率(Vmax)及最大生长速率对应的时间(TVmax),拟合分析利用Curve Expert 1.3软件进行。用SPSS 17.0统计软件进行方差分析和多重比较(LSD法)。采用CANOCO 4.5进行典范对应分析[22](CCA),以便探讨不同环境因子对光合作用及氧化铁还原能力的影响。
2 结果与分析 2.1 添加生物炭对水稻土中铁还原过程的影响添加不同粒度生物炭时3种类型水稻土厌氧培养过程中Fe(Ⅱ)产生量变化如图 1所示。在避光培养的水稻土中,Fe(Ⅱ)随着培养时间增加明显产生累积,生物炭的添加可以促进Fe(Ⅱ)产生,在SC和NX水稻土中比较明显,而TJ水稻土中比较微弱。同时发现,避光处理下生物炭粒度对Fe(Ⅱ)累积的作用并不明显。在光照培养条件下,3种水稻土中Fe(Ⅱ)含量在10 d前呈不断增加趋势,与避光处理的变化基本相似,15 d后Fe(Ⅱ)含量开始迅速降低。生物炭粒度对光照条件下Fe(Ⅱ)的影响在三种水稻土中有一定的区别,在SC水稻土淹水20 d后即表现出随着添加生物炭粒度的增大Fe(Ⅱ)累积量增大的趋势,而在TJ和NX水稻土中的影响不显著。对比培养周期结束时TJ、SC、NX水稻土避光与光照处理间的Fe(Ⅱ)累积量发现,光照培养分别使各体系Fe(Ⅱ)累积量显著降低6.009~6.415、3.037~3.693、1.473~2.058 mg·g-1,表明光照促进了土壤中光合微生物的生长,光合微生物产氧可直接导致泥浆中Fe(Ⅱ)的重新氧化。
|
| -□-CK -●- < 0.25 mm -△-0.25~0.5 mm -▼-0.5~1 mm -◇-1~2 mm图 1 添加不同粒度生物炭时水稻土厌氧培养过程中Fe(Ⅱ)产生量的变化 Figure 1 Changes in Fe(Ⅱ) concentrations in paddy soils under anaerobic incubation after adding different particle sizes of biochar |
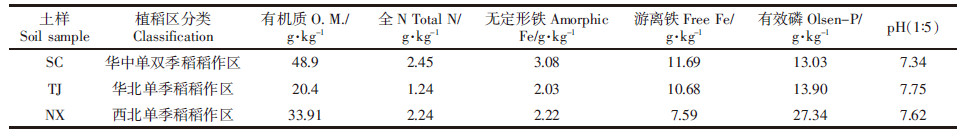
添加不同粒度生物炭处理的3种土壤厌氧培养过程中pH值的变化如图 2所示。生物炭的添加提高体系pH值,但不同粒径生物炭对pH的影响差异不大。避光培养时,总体上3种土壤的pH值均呈现为先下降后趋于中性,pH值剧烈变化均出现在厌氧培养的前5 d。光照培养时,三种水稻土的pH值呈现出先逐渐降低后于淹水第10 d逐渐升高并于第30 d时基本趋于稳定的趋势,至培养期结束时体系pH值分别达到8.0、7.8和7.5左右。对避光与光照处理间的Fe(Ⅱ)含量变化(△Fe(Ⅱ),代表铁氧化量)和pH值变化(△pH)进行相关性分析(n=12)看出,△Fe(Ⅱ)与△pH之间显著相关,相关系数分别为0.956**(TJ)、0.951**(NX)和0.702*(SC),表明体系pH上升越高,被氧化的Fe(Ⅱ)越多。
|
| -□-CK -●- < 0.25 mm -△-0.25~0.5 mm -▼-0.5~1 mm -◇-1~2 mm图 2 添加不同粒度生物炭时水稻土厌氧培养过程中pH值的变化 Figure 2 Changes of pH values in paddy soils under anaerobic incubation after adding different particle sizes of biochar |
添加不同粒度生物炭处理的3种土壤厌氧光照培养过程中Chl a含量变化如图 3所示。TJ、NX、SC水稻土光照厌氧培养体系中Chl a累积量均于培养7 d开始增长,并分别于30、35、15 d趋于稳定。向TJ、NX、SC水稻土添加生物炭分别使体系Chl a含量显著降低35.63%~67.47%、39.66%~70.56%、46.82%。但生物炭粒径对Chl a产生的影响在不同土壤中呈现出差异,NX水稻土中,不同粒径生物炭的抑制效果无差异,而TJ、SC水稻土培养体系中,< 0.25 mm、0.25~0.5 mm两个处理对光合色素产生量抑制程度小于0.5~1 mm、1~2 mm处理。对TJ、NX、SC水稻土体系中Chl a含量、△Fe(Ⅱ)和△pH进行相关性分析(n=12),得到Chl a含量与△Fe(Ⅱ)的相关系数分别为0.944**、0.868**和0.675*;Chl a含量与△pH极显著正相关,相关系数分别为0.986**、0.954**和0.979**,表明水稻土中光合微生物生长越多,体系pH上升越高,被氧化的Fe(Ⅱ)越多。
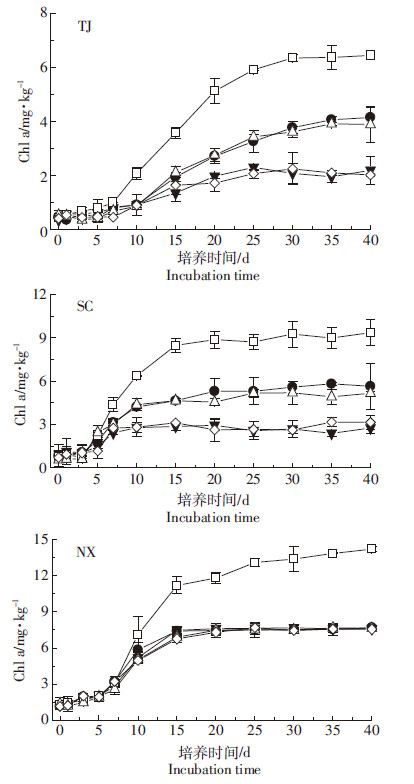
|
| -□-CK -●- < 0.25 mm -△-0.25~0.5 mm -▼-0.5~1 mm -◇-1~2 mm图 3 添加不同粒度生物炭时水稻土厌氧培养过程中 Chl a产生量的变化 Figure 3 Changes in Chl a amount in paddy soils under anaerobic incubation after adding different particle sizes of biochar |
对三种水稻土中Chl a为表征的微生物光合作用过程进行动力学拟合,如表 3所示。向TJ、NX、SC水稻土中添加生物炭使Chl a积累量a分别显著降低2.200~4.303、5.801~5.950、3.523~7.351 mg·kg-1;光合微生物最大生长速率Vmax显著降低0.170~0.254、0.356~0.468、0.307~0.731 mg·kg-1·d-1。但生物炭粒度对三种水稻土中光合作用过程影响不同。TJ水稻土中表现为 < 0.25 mm、0.25~0.5 mm两个处理中Chl a积累量a和最大生长速率对应的时间TVmax显著高于0.5~1 mm、1~2 mm处理。SC水稻土中生物炭粒度主要影响的是Chl a积累量a和最大生长速率Vmax,表现为: < 0.25 mm处理≈0.25~0.5 mm处理 < 0.5~1.0 mm处理≈1.0~2.0 mm处理。而NX水稻土中生物炭粒度仅在最大生长速率对应的时间TVmax上表现出一定差异。
 |
光照环境促进了土壤中光合微生物的生长,光合作用使体系中CO2被同化利用,并且在分解H2O的过程中释放O2,改变了厌氧泥浆的氧化还原状态,可导致泥浆中还原态的Fe(Ⅱ)发生氧化。在泥浆体系中可能包括以下化学平衡过程的改变:
光合微生物生长越快,产氧量增加越多,Fe(Ⅱ)的氧化加剧,消耗的H+量越大,导致体系中CO32-积累量增加。Schneider等[23]研究也证实,CO2及HCO3-的消耗与CO32-的增加是引起pH值剧增的原因。在本试验中观察到光照处理的pH值增加与光合微生物的迅速生长有关。所以,光照过程不仅促进了光合微生物生长,同时也导致体系中Fe(Ⅱ)的氧化并伴随pH值升高。然而,在泥浆体系中Fe(Ⅱ)的氧化与Fe(Ⅲ)的还原依然处于动态平衡状态,铁还原微生物会不断地进行铁还原过程,而光合微生物又通过产氧增加Fe(Ⅱ)的氧化。在本试验的泥浆反应体系中,光照是外部因素,泥浆的受光表面会制约光合微生物的生长。在泥浆内部,光照的影响微弱,微生物铁还原过程依然占主导地位,铁氧化过程将依赖O2的传输能力。另一方面,泥浆中电子的传递过程依然遵守热力学原理[24],O2将是泥浆中优势电子受体,通过竞争电子也能够抑制铁还原过程进行。
3.2 添加不同粒度生物炭对铁氧化还原过程的影响比较光照培养过程中三种水稻土添加不同粒度生物炭后的铁氧化过程(图 4)发现,Fe(Ⅱ)氧化的发生主要在培养的10 d以后,不同水稻土中发生的铁氧化量不同,表现为TJ > SC> NX。从变化趋势分析,在培养的40 d中,TJ和NX水稻土的铁氧化量已基本趋于平缓,而SC水稻土中仍然处于直线上升阶段,说明土壤环境对铁氧化过程亦存在影响。结合图 1的结果比较,添加生物炭对TJ和SC水稻土中光合微生物生长的影响十分显著,而在NX水稻土中尽管粒度处理之间差异不显著,但添加生物炭的处理与CK相比抑制作用明显。这可能与试验体系中生物炭对光照的遮挡及其吸收作用有关。然而,图 4中添加生物炭对水稻土中Fe(Ⅱ)氧化作用并非像对Chl a的影响那么突出。在铁氧化的高峰期(15~40 d),不同生物炭粒度处理在TJ水稻土中区别不大,在NX水稻土中表现出后期对铁氧化有一定促进作用,而SC水稻土中粒度增大时对铁氧化过程具有微弱的抑制。究其原因,影响铁氧化的关键因素可能与培养体系中O2的扩散有关。在试验采用的静置光照培养过程中,氧的扩散速率较微生物铁还原速率小,所以氧化的仅是与光合微生物接触或相近部位的Fe(Ⅱ),大量的氧或许参与了土壤中游离的碳(CH4)及硫(H2S,S2-,S)等物质的化学及生物氧化过程[25, 26]。对于生物炭与土壤中甲烷氧化的关系也是需要进一步深入探讨的问题。
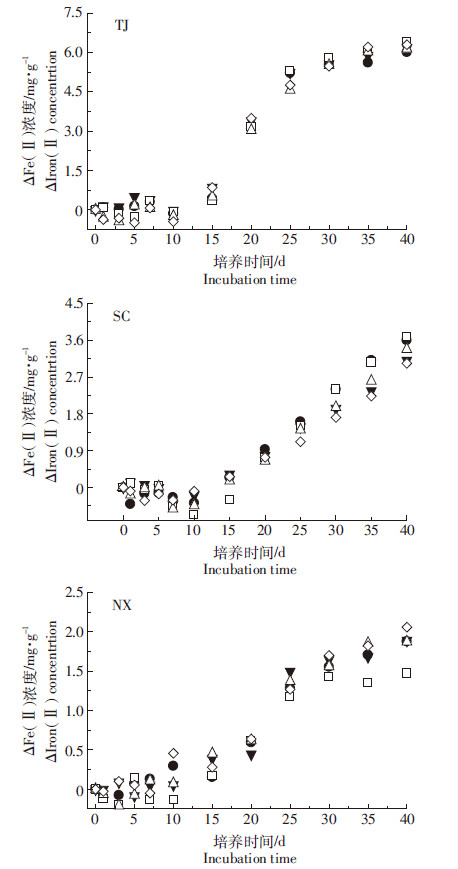
|
| □ CK ● < 0.25 mm △ 0.25~0.5 mm ▼ 0.5~1 mm ◇ 1~2 mm图 4 添加不同粒度生物炭时水稻土光照厌氧培养过程中 △Fe(Ⅱ)量的变化 Figure 4 Changes of △Fe(Ⅱ) in paddy soils under lighted anaerobic incubation after adding different particle sizes of biochar |
采用典范对应分析(CCA)对TJ、SC和NX三种水稻土中不同生物炭处理与土壤理化性质进行关联分析(图 5),排序参数包括:a、Vmax、TVmax、△pH、△Fe(Ⅱ)、培养体系初始pH值(pH-0)、有机质(OM)、总氮(TN)、有效磷(AP)、游离铁(F-Fe)及无定型铁(A-Fe)含量。1~5所代表处理分别是CK、 < 0.25 mm、0.25~0.5 mm、0.5~1.0 mm、1.0~2.0 mm。排序图中前两个排序轴的特征值分别为0.082和0.037,共同解释了三种水稻土五个处理分布特征的93.4%,能够较好地反映不同处理中微生物过程参数和环境背景值的关系。
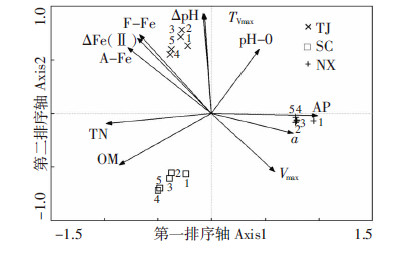
|
| 图 5 三种水稻土不同粒度生物炭处理与相关参数二维排序图 Figure 5 Bioplot of CCA ordinations for parameters of soil amended with different particle sizes of biochar |
从图 5看出,三种水稻土在排序图上彼此独立,形成三个集群,排序参数中土壤有效磷对排序分布贡献最大,其次是总氮、有机质、无定形铁和游离铁含量。与该图中第一排序轴相关系数较高的是有效磷(0.990)、总氮(-0.985)、有机质(-0.862)、Chl a含量(0.759),第一排序轴从左至右表示光合作用及铁氧化过程强度增加,说明有机质、全氮和速效磷所反映出的水稻土中资源分布特征同微生物生长密切相关[27, 28]。与第二排序轴关系密切的有△pH(0.934)、TVmax(0.931)、游离铁(0.736)、△Fe(Ⅱ)(0.706)及无定形铁(0.616),第二排序轴自下而上反映了铁氧化还原过程强度的增加。比较添加生物炭的处理,在三种土壤中均与CK处理有明显疏离,反映出添加生物炭对土壤生境可产生显著的影响。TJ和SC水稻土中,< 0.25 mm处理和0.25~0.5 mm处理聚为一簇,0.5~1.0 mm处理和1.0~2.0 mm处理聚为一个簇;NX水稻土中,添加生物炭的处理之间聚为一簇,表明添加不同粒度生物炭对不同土壤的影响程度不同。光照条件下不同土壤铁氧化能力的大小排序为:TJ>SC> NX,且不同粒度生物炭在不同土壤中对铁氧化过程影响不同。TJ和SC水稻土中 < 0.25 mm的处理和0.25~0.5 mm的处理对铁氧化的促进作用高于0.5~1.0 mm处理和1.0~2.0 mm处理,而NX水稻土中,尽管添加生物炭对铁氧化有促进作用,但生物炭粒度的影响不明显。
4 结论避光培养时生物炭的添加可以促进水稻土中氧化铁的微生物还原能力,但不同生物炭粒度处理对Fe(Ⅲ)还原的作用不明显。光照条件下,光合微生物的产氧过程可导致厌氧培养体系中Fe(Ⅱ)的氧化。添加生物炭后,由于对光合微生物生长产生显著的抑制作用,导致光合色素(Chl a)累积量显著降低,生物炭粒度越大对光合微生物生长抑制作用越明显。光合色素(Chl a)累积量、体系pH的改变及Fe(Ⅱ)的氧化过程之间存在显著的相关性。生物炭对Fe(Ⅱ)氧化过程的影响与水稻土性质和生物炭粒度有关。TJ和SC水稻土中 < 0.25 mm处理和0.25~0.5 mm处理对铁氧化的促进作用高于0.5~1.0 mm处理和1.0~2.0 mm处理,而NX水稻土中,尽管添加生物炭对铁氧化有促进作用,但生物炭粒度的影响不明显。
| [1] | Glasser B, Haumaier L, Guggenberger G, et al. Black carbon in density fractions of anthropogenic soils of the Brazilian Amazon region[J]. Organic Geochemistry, 2000, 31(7/8):669-678. |
| [2] | Van Zwieten L, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J]. Plant and Soil, 2010, 327(1/2):235-246. |
| [3] | 张文玲, 李桂花, 高卫东. 生物质炭对土壤性状和作物产量的影响[J]. 中国农学通报, 2009, 25(17):153-157. ZHANG Wei-ling, LI Gui-hua, GAO Wei-dong. Effect of biomass charcoal on soil character and crop yield[J]. Chinese Agriculture Science Bulletin, 2009, 25(17):153-157. |
| [4] | Sun K, Gao B, Ro K S, et al. Assessment of herbicide sorption by biochars and organic matter associated with soil and sediment[J]. Environmental Pollution, 2012, 163(4):167-173. |
| [5] | Case S D C, Mcnamara N P, Reay D S, et al. Can biochar reduce soil greenhouse gas emissions from a Miscanthus bioenergy crop?[J]. Global Change Biology Bioenergy, 2014, 6(1):76-89. |
| [6] | Xie Z, Xu Y, Liu G, et al. Impact of biochar application on nitrogen nutrition of rice, greenhouse-gas emissions and soil organic carbon dynamics in two paddy soils of China[J]. Plant and Soil, 2013, 370(1/2):527-540. |
| [7] | Woolf D, Amonette J E, Street-Perrott F A, et al. Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010, 1(5):56. |
| [8] | 张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义[J]. 农业环境科学学报, 2009, 28(12):2459-2463. ZHANG A-feng, PAN Gen-xing, LI Lian-qing. Biochar and the effect on C stock enhancement, emission reduction of greenhouse gases and soil reclaimation[J]. Journal of Agro-Environment Science, 2009, 28(12):2459-2463. |
| [9] | Pietikainen J, Kiikkila O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2):231-242. |
| [10] | Quilliam R S, Glanville H C, Wade S C, et al. Life in the “charosphere”:Does biochar in agricultural soil provide a significant habitat for microorganisms?[J]. Soil Biology and Biochemistry, 2013, 65(6):287-293. |
| [11] | Kappler A, Wuestner M L, Ruecker A, et al. Biochar as an electron shuttle between bacteria and Fe(Ⅲ) minerals[J]. Environmental Science and Technology Letters, 2014, 1(8): 339-344. |
| [12] | Lovley D R. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reducing prokaryotes[J]. Prokaryotes, 2006, 2:635-658. |
| [13] | Singh V P, Trehan K. Effect of extracellular products of Aulosira fertilissima on the growth of rice seedlings[J]. Plant and Soil, 1973, 38(2):457-464. |
| [14] | Gafur M A, Parvin S. Distribution of blue-green algae in soils of Chittagong University campus and their nitrogen fixing capacity[J]. Ban -gladesh Journal of Botany, 2008, 37(1):49-53. |
| [15] | Nain L, Rana A, Joshi M, et al. Evaluation of synergistic effects of bacterial and cyanobacterial strains as biofertilizers for wheat[J]. Plant and Soil, 2010, 331(1-2):217-230. |
| [16] | 孙丽蓉, 曲 东, 卫亚红. 光照对水稻土中氧化铁还原的影响[J]. 土壤学报, 2008, 45(4):628-634. SUN Li-rong, QU Dong, WEI Ya-hong. Effect of illumination on iron oxide reduction in anaerobic paddy soils[J]. Acta Pedologica Sinica, 2008, 45(4):628-634. |
| [17] | 王旭刚, 郭大勇, 张 苹, 等. 水稻土中铁氧化还原循环的光照水分效应[J]. 土壤学报, 2014, 51(4):853-859. WANG Xu-gang, GUO Da-yong, ZHANG Ping. Effect of illumination and water condition on iron redox cycle in paddy soil[J]. Acta Pedologica Sinica, 2014, 51(4):853-859. |
| [18] | Chen J Z, Ye J Y, Zhang H Y, et al. Freshwater toxic cyanobacteria induced DNA damage in apple(Malus pumila), rape(Brassica napus)and rice(Oryza sativa)[J]. Journal of Hazardous Materials, 2011, 190(1/3):240-244. |
| [19] | Prieto A, Campos A, Cameán A, et al. Effects on growth and oxidative stress status of rice plants(Oryza sativa) exposed to two extracts of toxin-producing cyanobacteria(Aphanizomenon ovalisporum and Microcystis aeruginosa)[J]. Ecotoxicology and Environmental Safety, 2011, 74(7):1973-1980. |
| [20] | Schnell S, Ratering S, Jansen K H. Simultaneous determination of iron(Ⅲ), iron(Ⅱ), and manganese(Ⅱ) in environmental samples by ion chromotography[J]. Environmental Science and Techonology, 1998, 32(14):1530-1537. |
| [21] | Arnon D I. Copper enzyme in isolated chloroplasts:Polyphenol-oxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1):1-15. |
| [22] | Hoy C W, Grewal P S, Lawrence J L, et al. Canonical correspondence analysis demonstrates unique soil conditions for entomopathogenic nematode species compared with other free-living nematode species[J]. Biological Control, 2008, 46(3):371-379. |
| [23] | Schneider J, Le Campion-Alsumard T. Construction and destruction of carbonates by marine and freshwater cyanobacteria[J]. European Journal of Phycology, 1999, 34(4):417-426. |
| [24] | 曲 东, 张一平, Schnell S, 等. 水稻土中铁氧化物的厌氧还原及其对微生物过程的影响[J]. 土壤学报, 2003, 40(6):858-863. QU Dong, ZHANG Yi-ping, Schnell S, et al. Reduction of iron oxides and its effect on microbial processes in anaerobic paddy soil[J]. Acta Pedologica Sinica, 2003, 40(6):858-863. |
| [25] | Melton E D, Schmidt C, Kappler A. Microbial iron(Ⅱ) oxidation in littoral freshwater lake sediment:The potential for competition between phototrophic vs. nitrate-reducing iron(Ⅱ)-oxidizers[J]. Frontiers in Microbiology, 2012, 3:197. |
| [26] | 易维洁, 孙丽蓉, 曲 东. 控制光照条件下添加SO42-对水稻土中Fe(Ⅲ) 还原的影响[J]. 农业环境科学学报, 2011, 30(8):1580-1585. YI Wei-jie, SUN Li-rong, QU Dong. Effect of sulfate on microbial iron(Ⅲ) reduction in paddy soil under the conditions of controlled illumination[J]. Journal of Agro-Environment Science, 2011, 30(8):1580-1585. |
| [27] | Beauregard M S, Hamel C, Atul-Nayyar, et al. Long-term phosphorus fertilization impacts soil fungal and bacterial diversity but not AM fungal community in Alfalfa[J]. Microbial Ecology, 2009, 59(2):379-389. |
| [28] | Ramirez K S, Lauber C L, Knight R, et al. Consistent effects of nitrogen fertilization on soil bacterial communities in contrasting systems[J]. Ecology, 2010, 91(12):3463-3470. |
 2016, Vol. 35
2016, Vol. 35