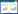文章信息
- 黄旺洲, 张生伟, 滚双宝, 姚拓, 朱建勋
- HUANG Wang-zhou, ZHANG Sheng-wei, GUN Shuang-bao, YAO Tuo, ZHU Jian-xun
- 高效纤维素分解菌群及锯末对动物粪便降解纤维素酶活与除臭效果的影响
- Effects of cellulose-decomposing microbes and sawdust on cellulose enzyme activity and odor during animal waste degradation
- 农业环境科学学报, 2016, 35(1): 186-194
- Journal of Agro-Environment Science, 2016, 35(1): 186-194
- http://dx.doi.org/10.11654/jaes.2016.01.025
-
文章历史
- 收稿日期: 2015-07-23
2.甘肃农业大学草业学院, 兰州 730070
2.Pratacultural College of Gansu Agricultural University, Lanzhou 730070, China
我国是世界上畜禽粪便产出量最大的国家[1],且以猪粪、牛粪和鸡粪为主[2]。尽管部分规模化养殖场通过物理法、化学法、生物法(堆沤、沼气发酵)等方式对畜禽粪便进行处理,利用其中的有机质(纤维素、半纤维素、木质素等)及氮、磷、钾等营养元素生产饲料、能源、肥料等[3],但也有相当一部分畜禽养殖场对粪污的综合利用和治理尚未达到国家排放标准,不仅使土壤、空气、水等受到严重污染[4],也使得畜禽粪便废弃物成为没有得到充分利用的生物质资源库[5]。怎样有效处理畜禽粪便,减少其对环境的污染,最大限度提高资源利用率是当下急需解决的重大问题。
国内外学者在生物发酵处理粪污方面做了大量的研究工作。吴银宝等[7]研究发现,当生态养猪的垫料含水量为50%~65% 时,菌种活动最为活跃;降低堆肥的pH值、增加微生物对NH+4-N的固定等是控制臭气的有效措施。王道泽等[8]在鸡粪堆肥中接种微生物菌剂发现,微生物菌剂脱水快,且能一定程度控制pH的升高而使氮释放量减少。Shen等[9]认为,堆肥过程中会因有机氮发生强烈的矿化分解产生大量 NH3,从而引起堆肥pH值的显著升高,加之堆肥持续高温,pH值亦保持在较高值。Nakasaki等[10]研究表明,堆肥过程中pH值会影响微生物增长和蛋白质及葡萄糖分解速率,pH值为7~8时微生物增长和蛋白质分解速率最佳,pH值为6~9时葡萄糖分解速率最高。也有研究表明,畜禽粪便堆放过程中加入稻草、秸秆和锯末等调理剂能够降低有害物质(NH3和H2S)的释放,并且对物料的化学成分、C/N比、含水率、物理结构等起到调节作用[11]。Vuorinen[12]通过研究麦秸和泥炭与猪粪和牛粪混合物的堆肥结果表明,调理剂的种类对物料的降解影响很明显。Kirchmann等[13]在研究新鲜猪粪堆肥过程中发现,加入燕麦秆能够有效降低NH3的挥发,但所需的用量较大(为30%)。Liang等[14]研究表明,以纸类为调理剂的堆肥,其NH3释放量明显高于秸秆、木屑。Lopez Zavala等[15]以锯末为调理剂对人粪渣进行堆肥试验发现,混合物料的含水率被调节至65%时,有机物降解速率最大。席北斗等[16]研究表明,锯末能够有效吸收物料中的水分,比树叶和秸秆更有利于实现厨余垃圾的高效快速降解。周文兵等[17]按猪粪与锯末重量比为(9~10)∶1进行堆肥,取得了较好的效果。
以上研究反映出:添加发酵菌和调节剂是改善畜禽粪便发酵效果的重要途经;由于不同区域饲料及环境条件不同,畜禽粪便物理结构及其所含的有机物质和微生物不同,从而使不同种类及添加量的发酵菌和调节剂对畜禽粪便发酵效果的影响存在较大差异。因此,在生产中不能完全照搬推广已有研究成果,有必要结合当地实际进一步开展相关研究。本课题组立足当地气候及资源条件,前期筛选出了一种纤维分解菌群,并对其特性进行了初步研究。研究表明,该菌群具有较强的纤维素分解及酸碱调节能力,并能够利用畜禽粪便分解纤维素,并具有抗外来杂菌性强的特点[18, 19]。本研究以不同比例的锯末为调节剂,研究添加该菌种对当地猪粪与牛粪降解效果的影响,以便为提高本地区动物粪便的资源化利用效率和减少动物粪便对环境的污染提供参考。
1 材料及方法 1.1 材料供试材料性质见表 1。高效纤维素分解菌剂为本项目自主培养,猪粪取自兰州宝鑫养殖公司,牛粪来源于甘肃农业大学牛场。
PCS培养基参考文献[19]和[20]的方法配制:将蛋白胨5 g、酵母膏5 g、纤维素(双圈牌滤纸)5 g、NaCl 5 g、CaCO3 2 g、K2HPO4 1 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.5 mg、MnSO4·H2O 0.16 mg、ZnSO4·7H2O 0.16 mg、CoCl2 0.2 mg与1000 mL 蒸馏水混合,其pH7.0,经121 ℃灭菌 26 min。
1.2 方法 1.2.1 试验设计采用2×4两因子试验设计,2个因子分别为不同比例锯末(0、5%、10%、15%)和接种高效纤维分解菌(0、5%),每种粪便构成4个处理,每个处理3个重复。即将5 kg猪粪(P)或牛粪(C)分别与0(CK因子)、5%、10%、15%的锯末(为猪粪的鲜重比)混合均匀装入高30 cm、直径30 cm的圆桶,每个处理装6桶,3桶中接种高效纤维素分解菌群(Y因子),3桶作为对照不接菌(N因子),在对照组中加入与接种量等量的灭菌水,调节含水率为60%~65%。CKN-P表示不添加锯末不接菌的猪粪,CKY-P表示不添加锯末接菌的猪粪,其他处理用同样的方法表示。每5 d取样一次进行相应指标的测定,共计5次。
1.2.2 菌群的活化及扩大培养将供试菌种在无菌条件下接入培养基,放入摇床进行培养,当滤纸糊化后接入新的培养基进行继代培养,分解稳定后扩大培养待用。
1.2.3 指标测定(1)含水率、pH测定:将样品放入105 ℃ 烘箱内烘干称量,恒重,计算出含水率。同样取少量样品于小烧杯中,加入适量的去离子水,搅拌均匀,静置1 h后用pH计测定酸碱度。
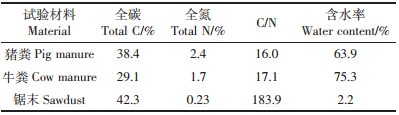
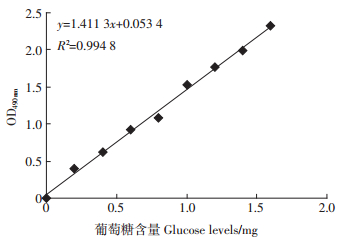
(2)羧甲基纤维素酶活力(CMC酶活力)测定:采用DNS法[21, 22, 23]。首先准确称取1 g分析纯葡萄糖(干燥至恒重),用蒸馏水溶解并定容至1000 mL,即1 mg·mL-1葡萄糖标准溶液,再分别取标准液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,依次加入20 mL刻度试管中,用蒸馏水补加到2 mL,再加入DNS(3,5-二硝基水杨酸)试剂1.5 mL,于沸水中煮沸5 min,冷却后定容至20 mL摇匀,在490 nm波长处比色,以葡萄糖量为横坐标、吸光度为纵坐标绘制标准曲线,如图 1。取3 g待测样品加入适量的0.1 mol·L-1醋酸缓冲液混匀,于30 ℃水浴浸提60 min,5000 r·min-1低温离心15 min,上清液即为粗酶液。吸取0.5 mL粗酶液,加入羧甲基纤维素钠缓冲液1.5 mL混匀,在50 ℃ 恒温水浴中糖化30 min,取出后加入DNS试剂1.5 mL 摇匀,在沸水浴中加热5 min,取出于冷水浴中冷却到室温。空白对照取与处理相同的稀释酶液0.5 mL,于沸水浴中煮沸5 min,钝化纤维素酶,其余处理与酶液处理相同。将处理好的酶液及空白对照在分光光度计490 nm波长比色,记录OD值,根据葡萄糖标准曲线,求出溶液中的葡萄糖含量,计算酶活力。
|
| 图 1 葡萄糖标准曲线 Figure 1 Calibration curve for glucose |
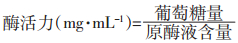
式中:葡萄糖量为从标准曲线上查得的葡萄糖值,mg;原酶液含量为1 mL待测液中原酶液的含量,为1/4 mL。
(3)NH3、H2S测定:在圆桶中放入盛有30 mL 2% 硼酸溶液的无菌小烧杯,用于吸收NH3,用保鲜膜密封后盖上桶盖,每个处理3个重复,每5 d参照文献[23]的方法用硼酸吸收凯氏法测定NH3的释放量。放入盛有30 mL 锌胺络盐溶液的无菌小烧杯,用于吸收H2S,每个处理3个重复,每5 d参照文献[24]的方法用锌胺络盐吸收比色法测定H2S的释放量。测定周期均为25 d。
1.3 数据分析采用 Microsoft Excel 2003 软件对数据进行处理和绘图,采用SPSS 19.0统计分析软件对数据进行统计分析。
2 结果分析 2.1 菌群对含水率的影响由图 2可知,试验期间各处理组都处于密封状态,水分含量总体变化不大。前5 d各试验组水分含量略有增加,随后开始下降,但各处理组下降速度不同,CKN-P组下降速度最慢,含水率下降5.63%,降幅显著低于CKY-P组(P<0.05),而CKN-C组和CKY-C组之间含水率下降速度差异不显著(P>0.05),第20 d之后各组含水率保持在相对稳定的水平。
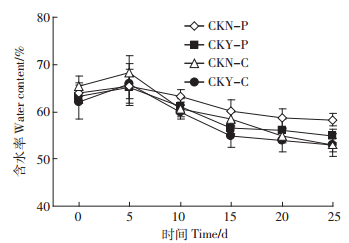
|
| 图 2 菌群对含水率的影响 Figure 2 Effect of microbial addition on moisture content of animal wastes during composting |
由图 3可知,在第5~10 d各组pH值均上升,随后CKY-C和CKY-P保持相对稳定的pH值至试验期的第20 d左右,而CKN-P和CKN-C组的pH值在第15 d分别下降0.54和0.25,幅度显著高于CKY-P和CKY-C(P<0.05)。试验第15 d后各组pH值均逐步上升,第25 d时,各组pH均显著高于试验初始值(P<0.05),且集中在8.32~8.38之间。
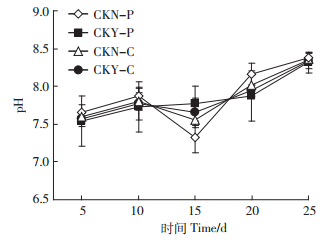
|
| 图 3 菌群对pH的影响 Figure 3 Effect of microbial addition on pH in animal wastes during composting |
由图 4可知,接入纤维素分解菌群后,第5、10、15、20、25 d测得的CMC酶活力(以下简称酶活力)均高于不接菌组。CKN-P组、CKY-P组的酶活力在前15 d均逐步增强,第15 d都达到最高,分别为2.17、2.45 mg·mL-1,两者差异显著(P<0.05),随后逐渐降低。CKN-C组的酶活力在第5 d最大(2.41 mg·mL-1),CKY-C组的酶活力在第15 d最低(2.21 mg·mL-1),其他阶段酶活力较稳定,除第25 d外,两组差异均不显著(P>0.05)。
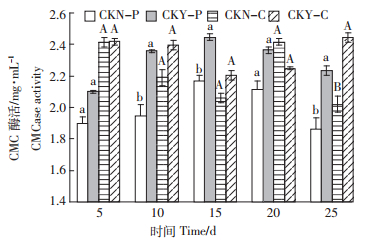
|
| 图中不同小写字母表示猪粪处理不同时间差异显著(P<0.05),
不同大写字母表示牛粪处理不同时间差异显著(P<0.05) Different small letters indicate significant difference in pig manure treatments between different time at 0.05 level and different capital letters indicate significant difference in cow manure treatments between different time at 0.05 level 图 4 菌群对CMC酶活力的影响 Figure 4 Effect of microbial addition on CMC enzyme activity |
由图 5可知,不接菌的反应中,对于猪粪的降解,CKN-P组在各阶段的酶活力均高于添加锯末各组的酶活力,第15、20 d酶活力显著高于(P<0.05)其他各组,且在第15 d最大。5%N组与10%N-P组的酶活力处于较平稳的状态。在牛粪降解过程中,各组在前20 d为先下降后上升趋势,且CKN-C组的酶活力均大于添加锯末的处理组。15%N-C组的酶活力在第15 d(1.82 mg·mL-1)显著低于其他各组(P<0.05),之后迅速上升,第25 d时酶活力达到2.55 mg·mL-1,明显高于其他各组,而CKN-C组的酶活力降到最低(2.02 mg·mL-1)。
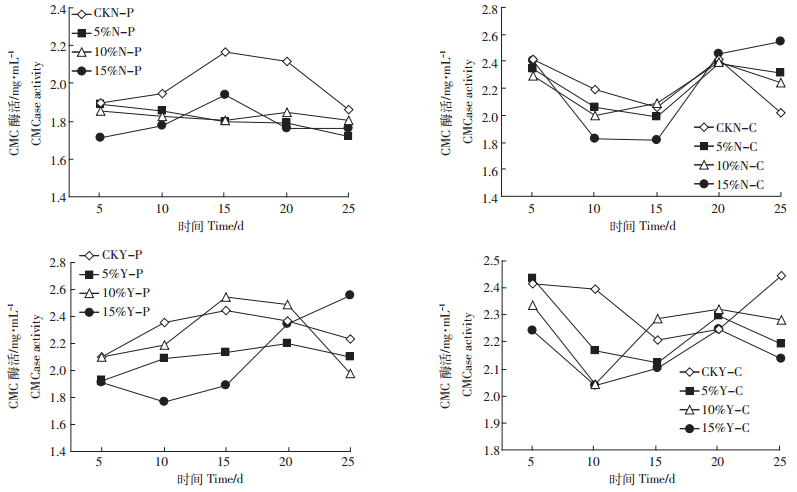
|
| 图 5 不同锯末添加量对猪粪、牛粪降解过程中CMC酶活力的影响 Figure 5 Effects of sawdust rates on CMC enzyme activity during pig and cow manure composting |
接菌处理的反应中,对于降解猪粪而言,CKY-P与10%Y-P组在前15 d酶活力均上升,在第15 d都达到了最大值,分别为2.45、2.54 mg·mL-1,且10%Y-P组酶活力显著(P<0.05)高于5%Y-P与15%Y-P组。CKY-P及5%Y-P、10%Y-P组在第20 d后的酶活力下降,其中10%Y-P组降幅为0.52,但15%Y-P组的酶活力在第10 d后一直处于上升状态,第25 d最大(2.55 mg·mL-1),明显高于其他各组。对于牛粪,总体酶活力变化趋势较为平缓,各组在前10 d酶活力一直下降,而10%Y-C与15%Y-C组在第10 d后上升,在此过程中CMC酶活力达到最大(2.33 mg·mL-1),较其他各组差异不明显。
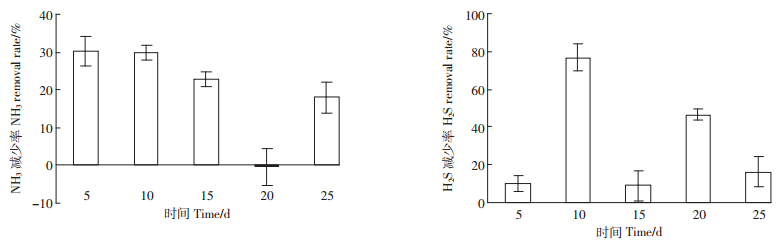
2.4 NH3及H2S释放量 2.4.1 接菌对NH3及H2S释放量的影响由图 6可知,高效纤维素分解菌群在猪粪降解过程中对NH3和H2S的释放有抑制作用。在第5、10、15、25 d NH3的减少率在18.0%以上,最高的达到30%,在第20 d时,氨气的释放量较不接菌组略有增加;而H2S的释放量在第5、15、25 d减少率较低,在第10 d减少率达到76.6%。
|
| 图 6 猪粪接菌后对NH3、H2S释放的减少率 Figure 6 Reduction of NH3 and H2S release by bacterial inoculation to pig manure |
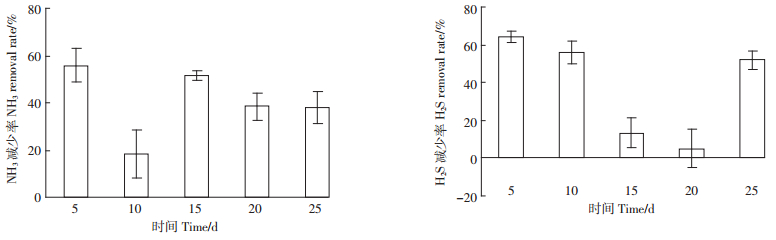
由图 7可知,加入高效纤维素分解菌群后,各阶段一定程度上都抑制了牛粪降解时NH3和H2S的释放,NH3和H2S释放的减少率都在第5 d最大,分别为56%、64%。
|
| 图 7 牛粪接菌后对NH3、H2S释放的减少率 Figure 7 Reduction of NH3 and H2S release by bacterial inoculation to cow manure |
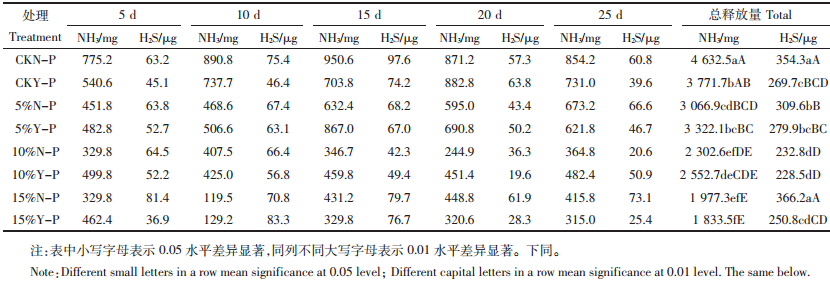
由表 2可知,CKN-P、5%N-P、5%Y-P组在前15 d NH3释放量呈增长趋势,10%Y-P、15%N-P、15%Y-P组在第5~10 d NH3释放量最低,分别为425.0、119.5、129.2 mg,之后上升,15%Y-P组NH3释放总量最小(1 833.5 mg),极显著低于CKN-P、CKY-P、5%N-P、5%Y-P组。CKN-P、CKY-P、5%N-P、5%Y-P组H2S释放的增加期在前15 d,而10%N-P、10%Y-P、15%Y-P组则在前10 d。CKN-P、15%N-P组H2S的释放总量极显著高于其他各组,分别为354.3、366.2 μg,10%N-P、10%Y-P则显著低于除15%Y-P组以外的其他各组。
 |
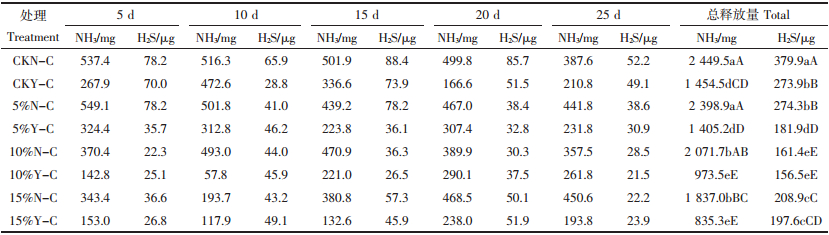
由表 3可知,CKN-C、5%N-C、5%Y-C组NH3释放量在前5 d最大,分别为537.4、549.1、324.4 mg,之后逐渐下降;10%Y-C组在5~10 d NH3释放量最小(57.8 mg),与15%Y-C组NH3释放总量极显著的小于其他各组。CKN-C、CKY-C、5%N-C、15%N-C组H2S释放量在第10~15 d最大,分别为88.4、73.9、78.2、57.3 μg,而5%Y-C、10%N-C、10%Y-C组H2S释放的增加期在前10 d,其中10%N-C、10%Y-C组H2S释放总量极显著小于其他各组。
 |
为了加速猪粪、牛粪中纤维素的分解,接种具有特定功能的菌剂是目前基于生态养殖及环保采用的生物处理措施。特定菌剂的添加可增加畜禽粪便降解时反应中的微生物数量,提高微生物活性,加快粪便中纤维素的降解,从而使发酵加速。含水率、pH等将会影响微生物的生长。大量研究[7, 25]表明,若含水量过高,就会挤走垫料基质中的氧气,造成菌种单一性厌氧发酵,在发酵效率降低的同时产生恶臭;当含水量过低时,菌种的活性降低,发酵过程则会被抑制。本试验在密封状态下进行,水分散失较少,在接种高效纤维素分解菌群后,猪粪与牛粪在降解过程中,含水率呈下降趋势,但均保持在50%以上,适合微生物的生长繁殖。随着降解的进行,微生物的生长活动需要水,同时动物粪便的降解和细胞内源呼吸会产生水,因此可在最后阶段保持含水率平稳。若pH偏低,该平衡转向铵根离子方向,NH3的挥发减少,但此时功能菌群的发酵效率较弱,致使粪便的降解速率几乎为0;若pH偏高,则导致NH3的大量挥发,也不利于畜禽粪便的充分发酵分解[25, 26]。含水率与pH都能够直接影响臭气的挥发,但两者并无直接关系,在此试验中材料及通风条件对pH有影响,而含水率与温度及通气条件有关[7]。Wu等[27]认为,pH在6~8的范围内稳定增大,与畜禽粪便中腐植酸的分解有关。王得武等[19]研究表明该高效纤维素分解菌群具有较强的适应及调节pH能力,pH最终稳定在7.8~8.6。本试验中高效纤维素分解菌群降低了反应环境的pH,在前25 d均集中在8.32~8.38之间,与张学峰等[28]的研究接近。pH均集中在8.0左右,说明该菌种在降解粪便的过程中稳定生长,可有效调节酸碱度。第15 d的pH下降,可能是因为有机质降解为有机酸或无机酸所致,之后在微生物作用下有机酸的分解和氨化产生的NH3不能挥发,而CKN-P在第15~25 d pH上升迅速,也可能因为猪粪中微生物对反应pH的调节能力较此菌群差,导致pH升高。
3.2 CMC酶活力的变化酶活性是反映环境中微生物数量及活动强度变化的重要参数之一。酶活力受到很多因素(含水率、温度、pH等)的影响,并且纤维素的降解需要多种微生物的共同作用[7]。戴芳等[29]认为,猪粪在生态养猪垫料中降解的一切生物化学过程也都是在酶的参与下进行的,因此垫料中酶活性的大小可以反映垫料环境降解猪粪的能力。朴哲等[30]研究表明,纤维素酶活性的变化可以反映环境中碳素物质的降解情况。本试验中,高效纤维素分解菌群对猪粪降解时CMC酶活力有明显的提高作用,而对牛粪降解过程中的CMC酶活力影响不明显,可能由于新鲜的牛粪中含有大量的微生物,对该菌种有一定的影响,对此有待进一步研究。猪粪降解过程中CMC酶活力在pH为7.5~8.0范围内最大,符合堆肥时pH在8.0左右能获得最大堆肥速率的条件[4];牛粪降解时,CMC酶活力先降低后升高,与Kim等 [31]研究一致。出现这一现象的原因可能是牛粪中还有大量的瘤胃微生物,其也具有较强的纤维素分解能力,与添加的外源菌群有一定的竞争作用,之后通过微生物的调节作用,达到较适宜的环境条件,酶活力迅速上升。pH在8.0以上时CMC酶活力最大。
添加锯末几乎都使畜禽粪便降解过程中的CMC酶活力减弱。在前15 d添加锯末量越多,酶活力越低,可能是由于锯末的木质化程度较高,而木质素最不容易降解,使得锯末的加入降低了微生物与纤维素的接触面积。添加10%锯末的猪粪与牛粪接种菌群后,降解过程中酶活力最大,分别为2.54、2.33 mg·mL-1,虽比不接菌群有明显的提高,但与国内外已报道的高酶活菌群相比仍较低[32, 33]。酶的活性受很多因素的制约,所以在微生物菌群产酶条件的优化、微生物量及种类方面有待开展进一步的研究。
3.3 NH3和H2S的释放量恶臭气体有很多种,Takuya[34]将其分为五大类:一是含硫的化合物,如硫化氢、硫醚类、硫醇类等;二是含氮的化合物,如氨、胺类、酰胺、吲哚类等;三是卤素及其衍生物,如氯气、卤代烃等;四是烃类,如烷烃、烯烃、炔烃、芳香烃等;五是含氧官能团组成的化合物,如低级醇、醛、酮、脂肪酸。而臭气产生的主要形式是NH3和H2S[7]。王岩等[35]在以牛粪为原料、锯末为添加剂的堆肥保氮试验中发现,牛粪与锯末的处理在发酵504 h后累计挥发氮量为1.0 g·kg-1,显著高于本试验接菌后NH3挥发量。本试验接菌后有效抑制了NH3和H2S的释放,在前15 d NH3释放量减少率占试验总减少率的82.7%(猪粪)、62%(牛粪),H2S达到60.4%(猪粪)、70%(牛粪),之后由于pH的上升导致臭气的释放量增加。在第20 d时CKN-P组比CKY-P组释放的NH3少,是因为CKY-P组微生物的矿化作用,在较高pH条件下,致使NH3的释放量增加。吴银宝等[7]和Stevens等[36]认为,降低堆肥pH值是减少NH3挥发损失的有效措施。
由于锯末是一种优质的调理剂,添加不同比例锯末后,都有效降低了NH3和H2S的释放量,倪娒娣等[37]的研究也表明,猪粪加木屑堆肥体系在堆制后期总氮呈增加趋势,有利于氮素的保存。 但接入菌群后,对猪粪中NH3和H2S的释放抑制不显著,牛粪中NH3释放量显著下降,H2S释放量下降不明显。Koivula等[38]在研究中发现,提高堆体的O2浓度和pH值,能有效地减少臭气的释放,尤其是H2S的挥发。本试验在密封条件下进行,使得O2浓度较低,从而H2S释放较多。经过多重比较分析可知,接入菌群使添加10%锯末的猪粪与牛粪在降解过程中显著(P<0.05)抑制了H2S的释放,添加15%锯末的牛粪在降解过程中极显著抑制了NH3的释放(P<0.01),是因为锯末对NH3有很强的吸附能力,故减少氮的损失。由于各处理组H2S的释放量在第10~15 d处于增长期,可以在这一阶段采取相应的方法控制H2S的释放。
| [1] | 朱凤莲, 马友华, 周 静, 等. 我国畜禽粪便污染和利用现状分析[J]. 安徽农学通报, 2008, 14(13):48-50. ZHU Feng-lian, MA You-hua, ZHOU Jing, et al. Analysis on present situation of pollution and animal excrement in China[J]. Anhui Agricultural Science Bull, 2008, 14(13):48-50. |
| [2] | 杨 帆, 李 荣, 崔 勇, 等. 我国有机肥料资源利用现状与发展建议[J]. 中国土壤与肥料, 2010(4):77-81. YANG Fan, LI Rong, CUI Yong, et al. Utilization and develop strategy of organic fertilizer resources in China[J]. Soil and Fertilizer Sciences in China, 2010(4):77-81. |
| [3] | 高 伟, 郑国砥, 高 定, 等. 堆肥处理过程中猪粪有机物的动态变化特征[J]. 环境科学, 2006, 27(5):986-990. GAO Wei, ZHENG Guo-di, GAO Ding, et al. Transformation of organic matter during thermopiles composting of pig manure[J]. Environmental Science, 2006, 27(5):986-990. |
| [4] | 汤江武. 猪粪好氧堆肥高效菌筛选、工艺优化及应用研究[D]. 杭州:浙江大学, 2008. TANG Jiang-wu. The efficient bacteria screening, process optimization and application research in pig manure composting[D]. Hangzhou:Zhejiang University, 2008. |
| [5] | Schubert C. Can biofuels finally take center stage?[J]. Nat Biotechnol, 2006, 24(7):777-784. |
| [6] | 吕学斌. 微生物发酵菌群的组合及其应用研究[D]. 天津:天津大学, 2005. LÜ Xue-bin. The combination of the microorganism fermentation bacteria and its application research[D]. Tianjin:Tianjin University, 2005. |
| [7] | 吴银宝, 汪植三, 廖新俤, 等. 猪粪堆肥臭气产生与调控的研究[J]. 农业工程学报, 2001, 17(5):85-86. WU Yin-bao, WANG Zhi-san, LIAO Xin-di, et al. Study on the odor production and control of swine manure composting[J]. Transaction of the Chinese Society of Agricultural Engineering, 2001, 17(5):85-86. |
| [8] | 王道泽, 谢国雄, 李 丹, 等. 不同微生物菌剂在鸡粪堆肥中的应用效果[J]. 浙江农业学报, 2013, 25(5):1074-1078. WANG Dao-ze, XIE Guo-xiong, LI Dan, et al. Application of microorganism agents in the composting of chicken manure[J]. Acta Agricultural Zhejiangensis, 2013, 25(5):1074-1078. |
| [9] | Shen Y J, Ren L M, Li G X, et al. Influence of aeration on CH4, N2O and NH3 emissions during aerobic composting of a chicken manure and high C/N waste mixture[J]. Waste Management, 2011, 31:33-38. |
| [10] | Nakasaki K, Yaguchi H, Sasaki Y, et a1. Effect of pH control on composting of garbare[J]. Waste Management & Research, 1993, 1l(2):117-125. |
| [11] | Mason I G, Mollah M S, Zhong M F, et al. Composting high moisture content bovine manure using passive aeration[J]. Compost Science & Utilization, 2004, 12(3):249-267. |
| [12] | Vuorinen A H. Effect of the bulking agent on acid and alkaline phosphomonoesterase and β-glucosidase activities during manure composting[J]. Bioresource Technology, 2000, 75(2):133-138. |
| [13] | Kirchmann H, Witter E. Ammonia volatilization during aerobic and anaerobic manure decomposition[J]. Plant and Soil, 1989, 115(1):35-41. |
| [14] | Liang Y, Leonard J J, Feddes J J R, et al. Influence of carbon and buffer amendment on ammonia volatilizationin composting[J]. Bioresour Technol, 2006, 97(5):748-761. |
| [15] | Lopez Zavala M A, Funamizu N. Effect of moisture content on the composting process in a biotoilet system[J]. Compost Science & Utilization, 2005, 13(3):208-216. |
| [16] | 席北斗, 刘鸿亮, 孟 伟, 等. 厨余垃圾堆肥蓬松剂技术研究[J]. 安全与环境学报, 2003, 3(3):41-45. XI Bei-dou, LIU Hong-liang, MENG Wei, et al. An improvement to domestic waste composting by adding different bulking agents[J]. Journal of Safety and Environment, 2003, 3(3):41-45. |
| [17] | 周文兵, 刘大会, 朱端卫. 不同调理剂对猪粪堆肥过程及其养分状况的影响[J]. 华中农业大学学报, 2004, 23(4):421-425. ZHOU Wen-bing, LIU Da-hui, ZHU Duan-wei. The effect of different conditions on composting process of pig feces and their nutrients status[J]. Journal of Huazhong Agricultural University, 2004, 23(4):421-425. |
| [18] | 杨巧丽, 姚 拓, 王得武, 等. 木质纤维分解菌群筛选及其对秸秆分解与畜禽粪便除臭能力评价[J]. 草业学报, 2015, 24(1):196-203. YANG Qiao-li, YAO Tuo, WANG De-wu, et al. Screening of lignocellulose degrading degrading microbial communities for their ability to deodorize livestock and poultry wastes[J]. Acta Prataculturae Sinica, 2015, 24(1):196-203. |
| [19] | 王得武, 姚 拓, 滚双宝, 等. 高效木质纤维素分解菌群筛选及其酸碱调节能力研究[J]. 中国生态农业学报, 2013, 21(5):621-627. WANG De-wu, YAO Tuo, GUN Shuang-bao, et al. Characteristics and selection of efficient lignocellulose degradation microbial community[J]. Chinese Journal of Eco-Agriculture, 2013, 21(5):621-627. |
| [20] | 王伟东, 崔宗均, 牛俊玲, 等. 一组木质纤维素分解菌复合系的筛选及培养条件对分解活性的影响[J]. 中国农业大学学报, 2004, 9(5):8-11. WANG Wei-dong, CUI Zong-jun, NIU Jun-ling, et al. Construction of a composite microbial system of lignocelluloses degrading and effect of cultural condition on the system capability[J]. Journal of China Agricultural University, 2004, 9(5):8-11. |
| [21] | 芦光新, 陈秀蓉, 杨成德, 等. 一株纤维素分解菌的鉴定及对两种草坪草凋落物分解活性的研究[J]. 草业学报, 2011, 20(6):170-179. LU Guang-xin, CHEN Xiu-rong, YANG Cheng-de, et al. Identification of cellulose decomposing fungi strain F1 and decomposition activity to two kinds of lawn grass litter[J]. Acta Prataculturae Sinica, 2011, 20(6):170-179. |
| [22] | Lungisa M, Brendan S W, Brett I P. Celluloses(CMCases) and polyphone oxidizes from thermopiles Bacillus spp. isolated from compost[J]. Soil Biol Biochem, 2006, 38:2963-2966. |
| [23] | 房兴堂, 陈 宏, 赵雪锋. 秸秆纤维素分解菌的酶活力测定[J]. 生物技术通讯, 2007, 18(4):628-630. FANG Xing-tang, CHEN Hong, ZHAO Xue-feng, et al. Determination of enzyme activity of straw cellulose-decomposing microorganisms[J]. Letters in Biotechnology, 2007, 18(4):628-630. |
| [24] | 高 华, 秦清军, 谷 洁. 除臭菌剂在家禽粪便无害化处理中的效果研究[J]. 西北农林科技大学学报:自然科学版, 2004, 2(3):59-64. GAO Hua, QIN Qing-jun, GU Jie, et al. Study on the effects of deodorizing microorganism on poultry manure composting[J]. Journal of Northwest Sci-Tech University of Agriculture and Forest:Natural Science Edition, 2004, 2(3):59-64. |
| [25] | 周 波, 李明辉, 孟庆翔, 等. 不同比例垫料的肉牛深层生物垫床技术参数比较[J]. 家畜生态学报, 2010, 31(6):44-48. ZHOU Bo, LI Ming-hui, MENG Qing-xiang, et al. Technical parameters comparison of deep litter system for beef cattle with bedding materials in different proportions[J]. Journal of Domestic Animal Ecology, 2010, 31(6):44-48. |
| [26] | Zhu N. Effect of low initial C/N ratio on aerobic composting of swine manure with rice straw[J]. Bioresource Technology, 2007, 98(1):9-13. |
| [27] | Wu L, Ma L Q. Martinez a comparison of methods for evaluating stability and maturity of biosolids compost[J]. Environmental Quality, 2000, 29(2):424-432. |
| [28] | 张学峰, 周贤文, 陈 群, 等. 不同深度垫料对养猪土著微生物发酵床稳定期微生物菌群的影响[J]. 中国兽医学报, 2013, 33(9):1458-1462. ZHANG Xue-feng, ZHOU Xian-wen, CHEN Qun, et al. The influence of padding of different depth in native microorganism fermentation bed of pigs on microbial flora during steady period[J]. Chinese Journal of Veterinary Science, 2013, 33(9):1458-1462. |
| [29] | 戴 芳, 曾光明, 牛承岗, 等. 堆肥化过程中生物酶活性的研究进展[J]. 中国生物工程杂志, 2005(增刊):148 -151. DAI Fang, ZENG Guang-ming, NIU Cheng-gang, et al. Advance in the studies on bioenzyme activity during the composting[J]. China Biotechnology, 2005(Suppl):148-151. |
| [30] | 朴 哲, 崔宗均, 苏宝林. 高温堆肥的生物化学变化特征及植物抑制物质的降解规律[J]. 农业环境保护, 2001, 20(4):206-209. PIAO Zhe, CUI Zong-jun, SU Bao-lin. Characterization of biochemistry and degradation of plant-inhibited materials during high-temperature composting[J]. Agro-Environmental Protection, 2001, 20(4):206-209. |
| [31] | Kim T I, Eong K H, Ham J S, et al. Isolation and characterization of cellulose secreting bacterium from cattle manure application to composting[J]. Compost Science and Utilization, 2004, 12(3):242-248. |
| [32] | 胡宏伟, 李吕木, 钱 坤, 等. 发酵菌剂接种量对堆肥理化性质和有关酶活的影响[J]. 农业环境科学学报, 2013, 32(6):1261-1270. HU Hong-wei, LI Lü-mu, QIAN Kun, et al. Effect of doses of fermentation inoculum on physico-chemical properties and related enzymic activities during the composting process[J]. Journal of Agro-Environment Science, 2013, 32(6):1261-1270. |
| [33] | Jang H D, Chen K S. Production and characterization of thermostable celluloses from Streptomyces transformant T3-1[J]. World Journal of Microbiology and Biotechnology, 2003, 19(3):263-268. |
| [34] | Takuya Y. Method for preventing malodor from livestock manure by utilization of refuse-derived solid fuels[J]. Fuel and Energy Abstracts, 2003, 44(4):271. |
| [35] | 王 岩, 王文亮, 霍晓婷. 家畜粪尿的堆肥化处理技术研究Ⅱ. 堆肥材料的发酵特性和氨气挥发[J]. 河南农业大学学报, 2002, 36(3):284-287. WANG Yan, WANG Wen-liang, HUO Xiao-ting. Study on composting treatment of livestock wastesⅡ. Decomposition of composting materials and emission of ammonium[J]. Journal of Henan Agricultural University, 2002, 36(3):284-287. |
| [36] | Stevens R J, Laughlimr J, Frost R P. Effect of acidulation with sulfuric acid on the volatilization of ammonia from cow and pig slurries[J]. Journal of Agricultural Science, 1989, 113:389-390. |
| [37] | 倪娒娣, 陈志银, 程绍明. 不同填充料对猪粪好氧堆肥效果的影响[J]. 农业环境科学学报, 2005, 24(增刊):204-208. NI Mei-di, CHEN Zhi-yin, CHENG Shao-ming. Effect of different bulking agents on aerobic composting of swine feces[J]. Journal of Agro-Environment Science, 2005, 24(Suppl):204-208. |
| [38] | Koivula N, Raikkonen T, Urpilainen S, et al. Ash in composting of source-separated catering waste[J]. Bioresource Technology, 2004, 93(3):291-299. |
 2016, Vol. 35
2016, Vol. 35