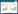文章信息
- 杜毅, 王建, 王宏青, 夏良树, 王祥科
- DU Yi, WANG Jian, WANG Hong-qing, XIA Liang-shu, WANG Xiang-ke
- 人工纳米材料吸附放射性核素的机理研究
- Research on sorption mechanism of radionuclides by manufactured nanomaterials
- 农业环境科学学报, 2016, 35(10): 1837-1847
- Journal of Agro-Environment Science, 2016, 35(10): 1837-1847
- http://dx.doi.org/10.11654/jaes.2016-0493
文章历史
- 收稿日期: 2016-04-12
2. 华北电力大学环境与化学工程系, 北京 102206
2. School of Environment and Chemical Engineering, North China Electric Power University, Beijing 102206, China
在核电生产、核武器使用等核能利用过程中,伴随着大量放射性污染物的排放。尤其是铀矿开采、冶炼、加工等环节所产生的工业废水、尾矿、废渣中放射性核素浓度远高于国家标准,从而对环境和人类生命健康构成巨大的威胁[1-4],同时存在双向危害,包含化学毒性与放射性。其中放射性对植物、动物甚至人体造成潜在的辐照性危害。此外,放射性废水具有很高的流动性,一旦进入土壤或者被植物吸收,最终会在人体内富集,给人类健康造成巨大伤害[5-7]。因此,如何快速高效地去除废水中的放射性核素有着重大的科学意义和应用价值。
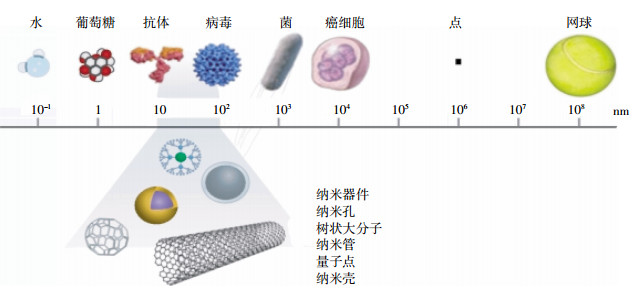
纳米材料是指至少在一个维度上小于100 nm的材料[8](图 1),按照其不同尺寸,可以分为零维(0D)、一维(1D)、二维(2D)和三维(3D)结构。从零维到三维结构,各种纳米材料得到广泛研究并逐步引入到工业和日常生活中[9-10]。在这个量级,纳米材料会产生一些特异效应[11],比如小尺寸效应、表面与界面效应、宏观量子隧道效应、量子尺寸效应等,由此派生出一些常规材料所不具有的性能。人工纳米材料(Manufactured nanomaterials,MNMs)是指具有这些特殊性能而被人工制造出来的纳米材料[12]。近年来,人工纳米材料作为一种新型材料,由于其具有反应活性高、比表面积大、吸附性能强等特点在环境污染治理中受到了极大的关注和研究[13],特别是在处理放射性核素以及重金属离子的治理中也起到了重要作用。通常用于放射性核素废水处理的纳米材料有纳米吸附材料(碳纳米材料、钛酸盐纳米材料、纳米金属氧化物)、纳米还原材料(纳米金属、纳米双金属)等[14],处理放射性废水的传统方法有电解法、萃取法、生物法、吸附法、膜分离法、化学沉淀法以及离子交换树脂法等[15],它们各有其优缺点,具体参见表 1。相比于其他方法,吸附法因其高效的去除率和经济性,以及在废水处理方面可观的应用价值,被认为是一种应用前景非常广阔的处理放射性废水的方法[16]。鉴于此,本文简单总结并介绍了人工纳米材料对废水中放射性核素[U(Ⅵ)、Eu(Ⅲ)、Co(Ⅱ)等]的吸附研究,系统讨论了吸附行为和反应机理,并对纳米材料处理废水中的放射性核素研究趋势和未来前景进行了展望。
研究有关放射性核素和纳米材料的相互作用和机理,对于评估放射性废水处理效果具有重要的科学意义。放射性核素的去除主要依赖于放射性核素在纳米材料与水界面发生吸附的过程,因而有必要研究吸附表面形成的物质和阐明所涉及的反应机理。然而,不同的纳米材料吸附不同放射性核素的反应机理也不同,一般的反应机理包括外层表面络合、内层表面络合、表面共沉淀、氧化还原反应等[17]。放射性核素的吸附取决于多种因素,如温度、pH值、氧化还原条件和与放射性核素形成络合物的无机或有机配体的浓度等[18]。此外,放射性核素和纳米材料之间的吸附过程将涉及到放射性核素在吸附表面的积累或通过氢键,分子间作用力或化学键力等进入纳米材料内部时发生的各种物理和化学反应[19]。本文采用多种分析技术如动力学分析、热力学分析、光谱技术、表面络合模型和理论计算等,对放射性核素在纳米材料上吸附形态和机理进行了分析和讨论。
2.1 动力学分析为了研究吸附机理以及吸附时间和速率,可运用动力学模型对实验数据进行分析。一般情况下,吸附反应在初始阶段发生迅速,然后逐渐减慢,最后达到吸附平衡状态。达到平衡所需的时间与吸附质、吸附剂、初始浓度和溶液等条件有关[20]。在吸附动力学的研究中有许多动力学模型[21],其中包括准一级、准二级、Ritchie和Elovich等动力学模型(表 2)。在固液界面吸附效率和迁移过程是由固体颗粒的表面特性和扩散阻力决定[22]的,利用适当的动力学模型对动力学吸附数据拟合,可以分析吸附过程并对吸附机理提供一些有用的信息。
磁性纳米粒子(Magnetic nanoparticles,MNPs)由于其易分离和低毒性等出色性能而受到了广泛的关注和应用[24-25],Yang等[26]通过化学共沉淀法合成了Fe3O4纳米颗粒以及负载了腐植酸(Humic acid,HA)的Fe3O4磁性复合材料(Fe3O4@HA),并对放射性核素Eu(Ⅲ)进行了吸附实验研究,结果表明准二级动力学模型较准一级动力学模型更加符合该材料对Eu(Ⅲ)的吸附过程。这种现象表明,此吸附过程是化学吸附而不是物理吸附。此外,在相同的实验条件下还发现,Fe3O4@HA对于Eu(Ⅲ)的吸附效果明显高于Fe3O4纳米颗粒,主要是因为HA增加了Fe3O4纳米颗粒与Eu(Ⅲ)表面的结合位点,提高了吸附效率。
吸附平衡时间是评估纳米材料在污水处理方面应用潜力的重要因素之一。Wang等[27]运用碳热还原的方法将Fe/Fe3C纳米颗粒和多孔碳合成了一种新材料,发现这种材料对放射性核素U(Ⅵ)的吸附在20 min内就能迅速达到吸附平衡。这主要是因U(Ⅵ)在材料表面发生了络合作用而能快速达到吸附动力学平衡,说明该材料对U(Ⅵ)有着非常好的吸附效率,在废水处理方面将有着良好的应用前景。
2.2 热力学分析热力学研究了包括吸热、放热等过程,而吸附等温线[28]通常是指在一定温度和pH下,吸附平衡时溶质分子在固液两相中浓度之间的关系曲线。结合等温线的物理化学参数和基本热力学假设可以更好地理解吸附机理以及吸附剂的亲和性程度。多年来,各种吸附等温线模型(如Brunauer-Emmett-Teller,Langmuir,Freundlich等)已经用来描述实验数据和其他更广泛的应用[29],不同动力学模型的描述和详细参数见表 3。另外,热力学参数如吉布斯自由能(ΔG)、熵变(ΔS)、焓变(ΔH)是理解放射性核素与纳米材料相互作用的关键。一般而言,纳米材料吸附放射性核素是一个自发吸热过程。
Xie等[30]运用动力学和热力学模型对磁性羟基磷灰石(Magnetic hydroxyapatite,Fe3O4/HAP)纳米粒子吸附放射性核素Co(Ⅱ)进行了研究,发现随着温度的升高,吸附率也在升高,表明该吸附是一个吸热过程。这是因为随着温度的升高使得材料孔径增大,导致表面吸附量增大。另外,温度的升高也提高了Co(Ⅱ)的溶解速率,降低了溶液黏度,所以高温有利于Fe3O4/HAP对Co(Ⅱ)的吸附。此外,在吸附热力学的研究中,Cheng等[31]的研究表明,相对于Freundlich和D-R等温线模型,β-环糊精-凹凸棒石(β-cyclodextrin-attapulgite,β-CD-APT)纳米材料对于放射性核素U(Ⅵ)的吸附更符合Langmuir等温线模型,说明U(Ⅵ)在β-CD-APT纳米棒上的吸附是一个单层吸附。相关热力学参数(ΔG、ΔS、ΔH)表明,该反应是一个自发吸热过程。
在纳米材料表面改性领域,等离子体处理技术是一种非常有效而且新颖的方法。特别是近几年,低温等离子诱导接枝技术以其高时效性和无溶剂的特性可在大范围内引入不同官能团的性质受到了极大的关注[32-33]。Yang等[34]通过此技术并在氮气保护下将N,N-二甲基丙烯酰胺(poly-N,N-dimethylacrylamide,PNDA)与多壁碳纳米管(Multiwalled carbon nanotube,MWCNT)合成了MWCNT/PNDA复合材料,研究了在20、40、60 ℃下MWCNT/PNDA对Co(Ⅱ)的吸附等温线,结果显示高温有利于对Co(Ⅱ)的吸附,表明这是一个吸热反应。由于Co(Ⅱ)可与-NH2,-O-和C=C键发生配位作用而结合,使得Co(Ⅱ)在纳米材料上发生了外层表面络合。另外,MWCNT/PNDA对Co(Ⅱ)的最大吸附量达到22.78 mg·g-1,比MWCNT的吸附量(9.02 mg·g-1)高2.5倍。这是因为MWCNT/PNDA表面的氨基官能团与Co(Ⅱ)发生了强有力的结合作用使得表面物理性质(比表面积和孔体积分布)发生了显著变化,说明低温等离子诱导接枝技术在不破坏材料结构的情况下,在纳米材料表面修饰功能化分子而明显提高了MWCNT对Co(Ⅱ)的吸附能力。
2.3 光谱技术分析为了更加可靠和长期地预测放射性核素的迁移行为、相互作用机理以及在固液界面发生的反应过程,需要在分子水平上更好地分析放射性核素在界面的形态和结构,光谱技术可用来直接分析放射性核素和表面吸附位点之间形成的表面复合物的结构和化学特性。随着对放射性核素更多研究工作的开展和研究的深入,光谱技术也得到了迅速的发展[35-36]。扩展X射线吸收精细结构光谱(Extended X-ray absorption fine structure spectroscopy,EXAFS),X射线光电子能谱(X-ray photoelectric spectroscopy,XPS),荧光时间衰减光谱(Time resolved laser fluorescence spectroscopy,TRLFS),傅里叶变换红外光谱法(Fourier transformed infrared spectroscopy,FTIR)等多种光谱技术[37]可以在分子水平上对放射性核素吸附机理进行分析。
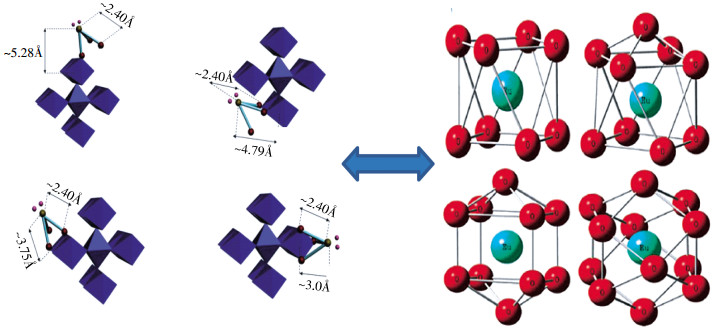
EXAFS技术由于其高能量可以确定X射线吸收中心原子的局部原子结构等关键信息,在分析放射性核素与纳米材料的相互作用机理和在纳米材料表面的化学形态和微观结果等分子水平上的信息方面,具有重要的帮助作用,其测量和分析过程如图 2所示。Sun等[38]采用静态法和EXAFS光谱法研究了氧化石墨烯(Graphene oxide,GO)纳米片对放射性核素Eu(Ⅲ)的吸附机理,发现随着pH从6.3增加到9.0,第一配位壳(Eu-O轨道)的配位数由6.69减少到6.02,Eu-C的键长也发生了变化,表明Eu(Ⅲ)和GO纳米片相互作用的机理主要是内层表面络合。此外,在EXAFS光谱分析对纳米凹凸棒石吸附Eu(Ⅲ)的研究[39]中发现,在HA存在的情况下,随着HA的增加,Eu-O的键长和配位数也随之发生了改变;HA的添加顺序不同时,也会使凹凸棒石吸附Eu(Ⅲ)的结果发生变化。这说明Eu(Ⅲ)存在着不同的结构(图 3),使得HA在不同的添加顺序下,凹凸棒石吸附Eu(Ⅲ)的机理和形态发生了改变。类似情况下,X射线吸收近边结构光谱(X-ray absorption near edge spectroscopy,XANES)可以提供有关几何形状和氧化态的图谱信息。Sun等[41]通过化学共沉淀法将纳米零价铁(Nanoscale zero-valent iron,nZVI)修饰到还原氧化石墨烯(Reduced graphene oxide,rGO)制备了nZVI/rGO复合物,XANES光谱分析结果表明,复合物的边缘位置和形状发生了细微的变化。这说明随着反应时间增加,U(Ⅵ)还原为U(Ⅳ)的程度也显著增加,使其与材料发生了内层表面络合作用,而rGO上的-OH官能团以及表面富集的Fe2+,提高了其对于U(Ⅵ)的反应速率和吸附能力。因此,光谱技术研究结果对于理解放射性核素在自然环境中的物理化学行为非常重要。
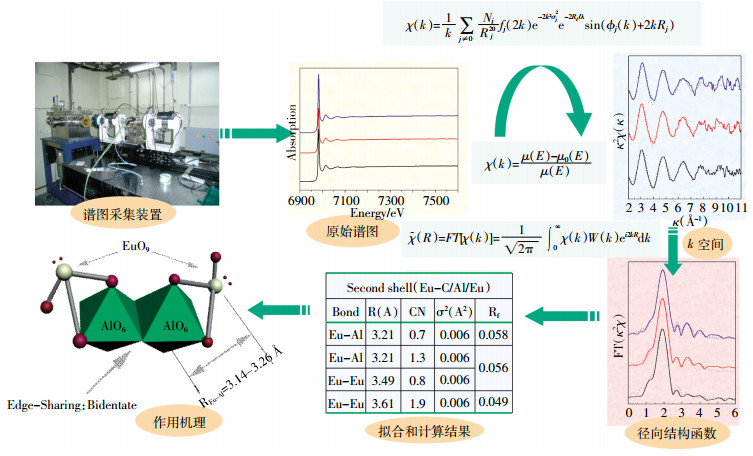
|
| 图 2 EXAFS光谱分析的应用过程 Figure 2 Application of EXAFS spectroscopy analysis |
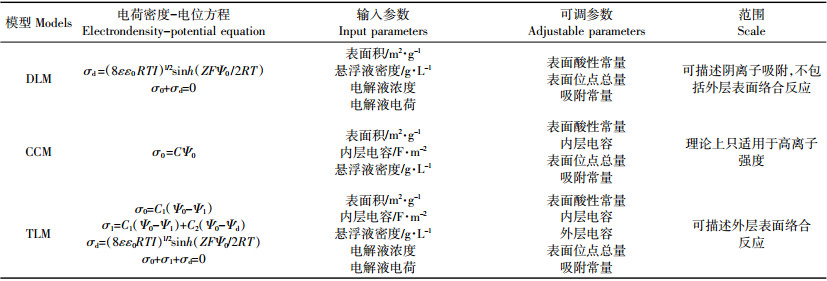
在过去的几十年间,表面络合模型(Surface complexation models,SCMs)已经用于描述固液界面的吸附过程,并在多个科学领域中得到了广泛的应用[42]。SCMs包括三种模型:扩散层模型(Diffuselayer model,DLM),恒定电容模型(Constant-capacitance model,CCM),三电层模型(Triplelayermodel,TLM)。不同的SCMs参数总结[17, 43]如表 4所示。其中,DLM是最简单也是对纳米材料吸附放射性核素应用最广的模型,而TLM是最复杂的模型,包括五个可调参数。DLM和TLM都可用于分析表面官能团和表面络合反应的质子化和去质子化过程。
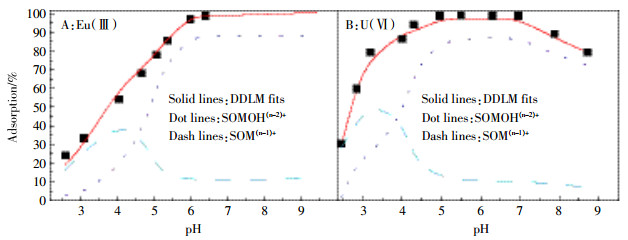
Ding等[44]采用双层扩散模型(Diffuse double layer model,DDLM)并在FITEQL软件的帮助下对Eu(Ⅲ)和U(Ⅵ)在GO纳米片上的吸附进行了研究,发现pH在2到9的范围内时,其主要的吸附反应可用下列反应式表示:
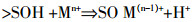 (1)
(1) 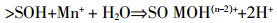 (2)
(2) 由图 4可知,DDLM模型可以很好地描述GO对于Eu(Ⅲ)和U(Ⅵ)的吸附过程,其吸附机理主要是由于GO上的含氧官能团的作用。另外发现U(Ⅵ)的lgK值是高于Eu(Ⅲ)的,证实了GO对于U(Ⅵ)的吸附量是大于Eu(Ⅲ)的,与其所做的静态实验和吸附等温线结果一致。
SCMs在模拟电位酸碱滴定和吸附实验中也有应用。Zhang等[45]用静态法结合XPS光谱法和DLM对碳纳米纤维(Carbon nanofibers,CNFs)吸附放射性核素U(Ⅵ)的吸附能力和机理进行了研究,实验结果表明,吸附等温线很好地拟合了DLM模型。当pH在3到5范围内变化时,吸附量随着pH值增加而增加,最大吸附率达95%,而随着离子强度的增大,吸附量几乎没有发生改变,说明CNFs对U(Ⅵ)的吸附受离子强度影响非常小,其吸附机理主要是内层表面络合。此外,解吸和再生实验表明,CNFs在常见的钠盐中具有良好的重复利用性和稳定性。因此,CNFs作为一种新型环保纳米材料,在环境污染治理中可得到广泛应用。
2.5 理论计算随着计算技术的发展和实验方法的完善,理论计算作为一种有效的工具在化学研究中经常使用。作为重要的理论计算工具之一,密度泛函理论(Density functional theory,DFT)因其以非常有效的方式计算相关能量和形态的能力在计算化学领域得到很好的推广[46]。DFT通常是用于描述在局部相互作用表面分子的吸收,结合光谱分析(TRLFS、EXAFS、XPS等)测量结果进行研究分析,能在原子水平上更好地解释纳米材料对放射性核素的吸附过程。
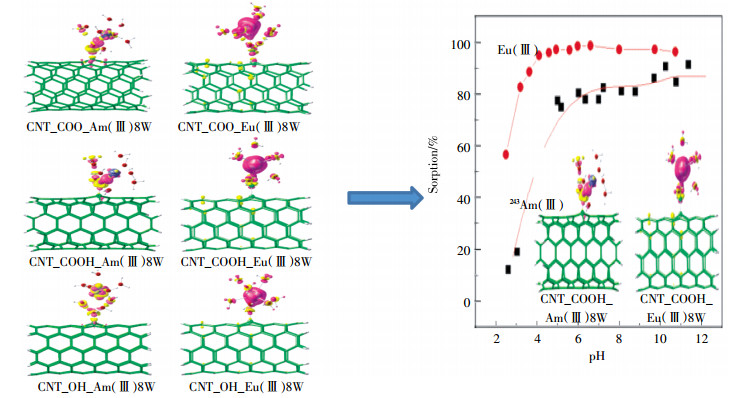
近年来,碳纳米管(Carbon nanotubes,CNTs)对Eu(Ⅲ)和243Am(Ⅲ)的吸附已有研究报道[47-48],Wang等[49]采用静态法结合光谱分析以及理论计算研究了Eu(Ⅲ)和243Am(Ⅲ)在CNTs的吸附,发现CNTs对于Eu(Ⅲ)的吸附明显强于对243Am(Ⅲ)的吸附,这表明CNTs对Eu(Ⅲ)和243Am(Ⅲ)可能存在着不同的反应机理(图 5),基于DFT的计算结果显示,Eu(Ⅲ)与CNTs的键能要比243Am(Ⅲ)与CNTs的键能高许多,说明Eu(Ⅲ)能与CNTs形成更稳定的官能团,解释了Eu(Ⅲ)和243Am(Ⅲ)与CNTs上不同含氧官能团的作用机理。研究结果对CNTs在环境污染净化中富集、迁移、分离三价镧系元素和锕系元素的应用有着重要的指导意义。
由于以GO为基体的材料在核废料处理中的应用前景广阔[50],研究GO与放射性核素的反应机理具有重要意义。Wu等[51]运用DFT计算研究了四种不同改性GO与锕系元素Np(Ⅴ)和Pu(Ⅳ,Ⅵ)离子的反应机理,结果表明:相对Np(Ⅴ)和Pu(Ⅵ)离子,Pu(Ⅳ)与改性GO形成了更多的共价配位键,因而更容易与改性GO相结合,进而更有效地被吸附去除。由它们在溶液中与GO的结合能可知,GO对于锕系元素的吸附能力遵循的顺序是:Pu(Ⅳ)>Pu(Ⅵ)>Np(Ⅴ)。这为开发更有效的GO类纳米材料来处理放射性废水可提供非常有用的信息。
综上所述,理论计算在理解和描述放射性核素的形态以及与纳米材料相互作用机理(例如,涉及到的表面吸附、外延生长和替代过程等)等方面发挥着重要作用,对于研究和评价放射性核素在环境中的化学行为也有一定的参考价值。
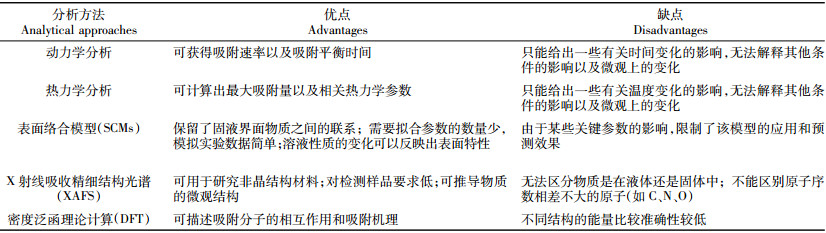
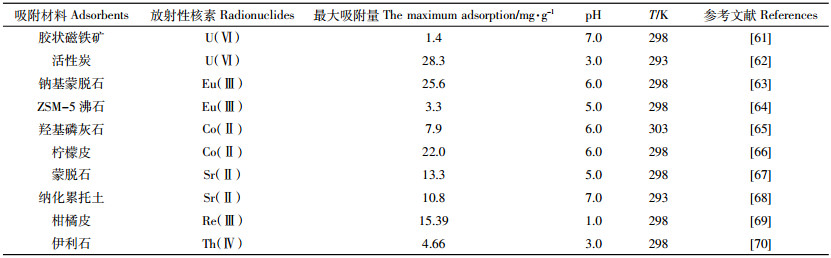
3 结论与展望本文概述了纳米材料对废水中放射性核素[U(Ⅵ)、Eu(Ⅲ)、Co(Ⅱ)等]的吸附及其研究现状,采用吸附动力学、吸附热力学、表面络合模型、光谱技术和理论计算等方法简单分析和讨论了主要的吸附机理。通过与其他材料的对比(表 5和表 6)可以发现,人工纳米材料的吸附性能明显优于一般吸附材料,人工纳米材料在放射性废水处理领域具有可观的应用前景,相信在不久的将来,纳米材料可能会成为废水净化和处理系统设施中不可缺少的组成部分。然而,随着纳米材料和纳米技术的迅速发展和应用,越来越多的负面问题也显现出来,比如,大量的纳米材料不可避免被排放到环境中,必将对环境产生一定的影响。此外,在保证安全和高效的前提下,放射性废水处理中如此大量的纳米材料投入使用,如何以一个经济可行的价格在工业中广泛应用也将会是一个现实的问题和瓶颈。因此,未来研究的方向应该是努力解决这些问题以及重点放在低成本、高选择性、更环保的功能性纳米材料上。另一方面,任何一种单一的分析方法都有着其自身的优点和缺点(表 7),比如DFT能很好地描述吸附反应和机理,但在计算不同结构的能量时,其准确性又比较低。因此,需要将多种不同的分析方法和技术结合起来进行相互补充,根据模拟、计算、实验、实践的结果来得到更加完善和精确的信息,同时期望未来能出现更多新颖的分析方法,以便进一步揭示纳米材料与放射性核素的作用机理。总之,随着纳米科学与技术的发展,更多的研究精力与兴趣将投入到纳米材料的开发和应用中,反过来,这也将推动纳米科学与技术更好的发展。
 |
 |
| [1] | Chakravarty R, Dash A. Nanomaterial-based adsorbents:The prospect of developing new generation radionuclide generators to meet future research and clinical demands[J]. Journal of Radioanalytical and Nuclear Chemistry , 2013, 299 (1) : 741–757. |
| [2] | Kitamura A, Kirishima A. Recent activities in the field of nuclear waste management[J]. Journal of Nuclear Science and Technology , 2014, 52 (3) : 448–450. |
| [3] | 唐世荣, 商照荣, 宋正国, 等. 放射性核素污染土壤修复标准的若干问题[J]. 农业环境科学学报 , 2007, 26 (2) : 407–412. TANG Shi-rong, SHANG Zhao-rong, SONG Zheng-guo, et al. Some issues related to cleanup standards for remediation of radionuclide contaminated soils[J]. Journal of Agro-Environment Science , 2007, 26 (2) : 407–412. |
| [4] | Shi W Q, Yuan L Y, Li Z J, et al. Nanomaterials and nanotechnologies in nuclear energy chemistry[J]. Radiochimica Acta , 2012, 100 (8/9) : 727–736. |
| [5] | Khin M M, Nair A S, Babu V J, et al. A review on nanomaterials for environmental remediation[J]. Energy & Environmental Science , 2012, 5 (8) : 1–33. |
| [6] | Savage N, Diallo M S. Nanomaterials and water purification:Opportunities and challenges[J]. Journal of Nanoparticle Research , 2005, 7 (4/5) : 331–342. |
| [7] | 王祥学, 李洁, 于淑君, 等. 放射性核素在天然黏土和人工纳米材料上的吸附机理研究[J]. 核化学与放射化学 , 2015, 37 (5) : 329–340. WANG Xiang-xue, LI Jie, YU Shu-jun, et al. Sorption mechanism of radionuclides on clay minerals and manmade nanamaterials[J]. Journal of Nuclear and Radiochemistry , 2015, 37 (5) : 329–340. |
| [8] | Amin M T, Alazba A A, Manzoor U. A review of removal of pollutants from water/wastewater using different types of nanomaterials[J]. Advances in Materials Science and Engineering , 2014, 2014 : 1–24. |
| [9] | Wu R, Zhou K, Yue C Y, et al. Recent progress in synthesis, properties and potential applications of SiC nanomaterials[J]. Progress in Materials Science , 2015, 72 : 1–60. DOI:10.1016/j.pmatsci.2015.01.003 |
| [10] | 钟来元, 沐杨昌, 杨杰文. 不同尺寸纳米针铁矿表面性质及其对Cr(Ⅵ)吸附量的比较[J]. 农业环境科学学报 , 2015, 34 (11) : 2120–2125. ZHONG Lai-yuan, MU Yang-chang, YANG Jie-wen. Surface properties and Cr(Ⅵ) adsorption of nano-goethite of different sizes[J]. Journal of Agro-Environment Science , 2015, 34 (11) : 2120–2125. |
| [11] | 朱世东, 周根树, 蔡锐, 等. 纳米材料国内外研究进展Ⅰ[J]. 热处理技术与装备 , 2010, 31 (3) : 1–5. ZHU Shi-dong, ZHOU Gen-shu, CAI Rui, et al. Research of the nanomaterials at home and abroadⅠ[J]. Heat Treatment Technology & Equipment , 2010, 31 (3) : 1–5. |
| [12] | Hischier R, Nowack B, Gottschalk F, et al. Life cycle assessment of façade coating systems containing manufactured nanomaterials[J]. Journal of Nanoparticle Research , 2015, 17 (2) : 1–13. |
| [13] | Xie K, Wang X X, Liu Z J, et al. Synthesis of flower-like α-Fe2O3 and its application in wastewater treatment[J]. Journal of Zhejiang University Science A , 2014, 15 (18) : 671–680. |
| [14] | 盛国栋, 杨世通, 郭志强, 等. 纳米材料和纳米技术在核废料处理中的应用研究进展[J]. 核化学与放射化学 , 2012, 34 (6) : 321–330. SHENG Guo-dong, YANG Shi-tong, GUO Zhi-qiang, et al. Research progress of nanomaterials and nanotechnology in the application to nuclear waste management[J]. Journal of Nuclear and Radiochemistry , 2012, 34 (6) : 321–330. |
| [15] | Li J X, Hu J, Sheng G D, et al. Effect of pH, ionic strength, foreign ions and temperature on the adsorption of Cu(Ⅱ) from aqueous solution to GMZ bentonite[J]. Colloids and Surfaces A , 2009, 349 (1-3) : 195–201. DOI:10.1016/j.colsurfa.2009.08.018 |
| [16] | Yang X, Yang S B, Yang S T, et al. Effect of pH, ionic strength and temperature on sorption of Pb(Ⅱ) on NKF-6 zeolite studied by batch technique[J]. Chemical Engineering Journal , 2011, 168 (1) : 86–93. DOI:10.1016/j.cej.2010.12.039 |
| [17] | Tan X L, Ren X M, Chen C L, et al. Analytical approaches to the speciation of lanthanides at solid-water interfaces[J]. TrAC Trends in Analytical Chemistry , 2014, 61 : 107–132. DOI:10.1016/j.trac.2014.06.010 |
| [18] | Sheng G D, Shen R P, Dong H P, et al. Colloidal diatomite, radionickel, and humic substance interaction:A combined batch, XPS, and EXAFS investigation[J]. Environmental Science and Pollution Research International , 2013, 20 (6) : 3708–3717. DOI:10.1007/s11356-012-1278-1 |
| [19] | Kentona R, Wooyong U, Markus F. Transport of strontium and cesium in simulated hanford tank waste leachate through quartz sand under saturated and unsaturated flow[J]. Environmental Science & Technology , 2010, 44 (21) : 8089–8094. |
| [20] | Yu S J, Wang X X, Tan X L, et al. Sorption of radionuclides from aqueous system onto graphene oxide-based materials:A review[J]. Inorganic Chemistry Frontiers , 2015, 2 (7) : 593–612. DOI:10.1039/C4QI00221K |
| [21] | Ho Y S. Review of second-order models for adsorption systems[J]. Journal of Hazardous Materials , 2006, 136 (3) : 681–689. DOI:10.1016/j.jhazmat.2005.12.043 |
| [22] | Wu F C, Tseng R L, Huang S C, et al. Characteristics of pseudo-second-order kinetic model for liquid-phase adsorption:A mini-review[J]. Chemical Engineering Journal , 2009, 151 (1-3) : 1–9. DOI:10.1016/j.cej.2009.02.024 |
| [23] | Zhao G X, Wu X L, Tan X L, et al. Sorption of heavy metal ions from aqueous solutions:A review[J]. The Open Colloid Science Journal , 2011, 4 : 19–31. DOI:10.2174/1876530001104010019 |
| [24] | Chen L, Xu J, Hu J. Removal of U(Ⅵ) from aqueous solutions by using attapulgite/iron oxide magnetic nanocomposites[J]. Journal of Radioanalytical and Nuclear Chemistry , 2012, 297 (1) : 97–105. |
| [25] | Liu M C, Chen C L, Hu J, et al. Synthesis of magnetite/graphene oxide composite and application for cobalt(Ⅱ) removal[J]. The Journal of Physical Chemistry C , 2011, 115 (51) : 25234–25240. DOI:10.1021/jp208575m |
| [26] | Yang S T, Zong P F, Ren X M, et al. Rapid and highly efficient preconcentration of Eu(Ⅲ) by core-shell structured Fe3O4@humic acid magnetic nanoparticles[J]. ACS Applied Materials & Interfaces , 2012, 4 (12) : 6891–6900. |
| [27] | Wang X X, Zhang S W, Li J X, et al. Fabrication of Fe/Fe3C@porous carbon sheets from biomass and their application for simultaneous reduction and adsorption of uranium(Ⅵ) from solution[J]. Inorganic Chemistry Frontiers , 2014, 1 (8) : 641–648. DOI:10.1039/C4QI00071D |
| [28] | Hu R, Wang X K, Dai S Y, et al. Application of graphitic carbon nitride for the removal of Pb(Ⅱ) and aniline from aqueous solutions[J]. Chemical Engineering Journal , 2015, 260 : 469–477. DOI:10.1016/j.cej.2014.09.013 |
| [29] | Foo K Y, Hameed B H. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal , 2010, 156 (1) : 2–10. DOI:10.1016/j.cej.2009.09.013 |
| [30] | Xie H Q, Wu D L, Jiao Z, et al. Kinetic and thermodynamic sorption study of radiocobalt by magnetic hydroxyapatite nanoparticles[J]. Journal of Radioanalytical and Nuclear Chemistry , 2011, 292 (2) : 637–647. |
| [31] | Cheng W C, Ding C C, Sun Y B, et al. The sequestration of U(Ⅵ) on functional β-cyclodextrin-attapulgitenanorods[J]. Journal of Radioanalytical and Nuclear Chemistry , 2014, 302 (1) : 385–391. DOI:10.1007/s10967-014-3180-4 |
| [32] | Ren X M, Yang S T, Shao D D, et al. Retention of Pb(Ⅱ) by a low-cost magnetic composite prepared by environmentally-friendly plasma technique[J]. Separation Science and Technology , 2013, 48 (8) : 1211–1219. DOI:10.1080/01496395.2012.726307 |
| [33] | Song W C, Wang X X, Wang Q, et al. Plasma-induced grafting of polyacrylamide on graphene oxide nanosheets for simultaneous removal of radionuclides[J]. Physical Chemistry Chemical Physics , 2015, 17 (1) : 398–406. DOI:10.1039/C4CP04289A |
| [34] | Yang S B, Shao D D, Wang X K, et al. Localized in situ polymerization on carbon nanotube surfaces for stabilized carbon nanotube dispersions and application for cobalt(Ⅱ) removal[J]. RSC Advances , 2014, 4 (10) : 48–56. |
| [35] | Sun Y B, Chen C L, Tan X L, et al. Enhanced adsorption of Eu(Ⅲ) on mesoporous Al2O3/expanded graphite composites investigated by macroscopic and microscopic techniques[J]. Dalton Transactions , 2012, 41 (43) : 13388–13394. DOI:10.1039/c2dt31510f |
| [36] | Ren X M, Yang S B, Hu F C, et al. Microscopic level investigation of Ni(Ⅱ) sorption on Na-rectorite by EXAFS technique combined with statistical F-tests[J]. Journal of Hazardous Materials , 2013, 252-253 : 1–10. DOI:10.1016/j.jhazmat.2013.02.008 |
| [37] | Yang S T, Zong P F, Sheng G D, et al. New insight into Eu(Ⅲ) sorption mechanism at alumina/water interface by batch technique and EXAFS analysis[J]. Radiochimica Acta , 2014, 102 (1/2) : 143–153. |
| [38] | Sun Y B, Wang Q, Chen C L, et al. Interaction between Eu(Ⅲ) and graphene oxide nanosheets investigated by batch and extended X-ray absorption fine structure spectroscopy and by modeling techniques[J]. Environmental Science & Technology , 2012, 46 (11) : 6020–6027. |
| [39] | Fan Q H, Tan X L, Li J X, et al. Sorption of Eu(Ⅲ) on attapulgite studied by batch, XPS, and EXAFS techniques[J]. Environmental Science & Technology , 2009, 43 (15) : 5776–5782. |
| [40] | Sheng G D, Yang S T, Li Y M, et al. Retention mechanisms and microstructure of Eu(Ⅲ) on manganese dioxide studied by batch and high resolution EXAFS technique[J]. Radiochimica Acta , 2014, 102 (1/2) : 155–167. |
| [41] | Sun Y B, Ding C C, Cheng W C, et al. Simultaneous adsorption and reduction of U(Ⅵ) on reduced graphene oxide-supported nanoscale zerovalent iron[J]. Journal of Hazardous Materials , 2014, 280 : 399–408. DOI:10.1016/j.jhazmat.2014.08.023 |
| [42] | Sun Y B, Li J, Wang X K. The retention of uranium and europium onto sepiolite investigated by macroscopic, spectroscopic and modeling techniques[J]. Geochimicaet Cosmochimica Acta , 2014, 140 : 621–643. DOI:10.1016/j.gca.2014.06.001 |
| [43] | 范桥辉. 放射性核素在固-液界面吸附行为研究[D]. 兰州大学. 2011. FAN Qiao-hui. The investigation of radionuclides sorption on solid-water interface[D]. Lanzhou University. 2011. |
| [44] | Ding C C, Cheng W C, Sun Y B, et al. Determination of chemical affinity of graphene oxide nanosheets with radionuclides investigated by macroscopic, spectroscopic and modeling techniques[J]. Dalton Transactions , 2014, 43 (10) : 3888–3896. DOI:10.1039/c3dt52881b |
| [45] | Zhang R, Chen C L, Li J X, et al. Investigation of interaction between U(Ⅵ) and carbonaceous nanofibers by batch experiments and modeling study[J]. Journal of Colloid and Interface Science , 2015, 460 : 237–246. DOI:10.1016/j.jcis.2015.08.073 |
| [46] | Wu Q Y, Wang C Z, Lan J H, et al. Theoretical investigation on multiple bonds in terminal actinide nitride complexes[J]. Inorganic Chemistry , 2014, 53 (18) : 9607–9614. DOI:10.1021/ic501006p |
| [47] | Wang X K, Chen C L, Hu W P, et al. Sorption of 243Am(Ⅲ) to multiwall carbon nanotubes[J]. Environmental Science & Technology , 2005, 39 (8) : 2856–2860. |
| [48] | Chen C L, Wang X K, Nagatsu M. Europium adsorption on multiwall carbon nanotube/iron oxide magnetic composite in the presence of polyacrylic acid[J]. Environmental Science & Technology , 2009, 43 (7) : 2362–2367. |
| [49] | Wang X X, Yang S T, Shi W Q, et al. Different interaction mechanisms of Eu(Ⅲ) and 243Am(Ⅲ) with carbon nanotubes studied by batch, spectroscopy technique and theoretical calculation[J]. Environmental Science & Technology , 2015, 49 (19) : 11721–11728. |
| [50] | Zhao G X, Wen T, Chen C L, et al. Synthesis of graphene-based nanomaterials and their application in energy-related and environmental-related areas[J]. RSC Advances , 2012, 2 (25) : 9286–9303. DOI:10.1039/c2ra20990j |
| [51] | Wu Q Y, Lan J H, Wang C Z, et al. Understanding the interactions of neptunium and plutonium ions with graphene oxide:Scalar-relativistic DFT investigations[J]. The Journal of Physical Chemistry A , 2014, 118 (44) : 10273–10280. DOI:10.1021/jp5069945 |
| [52] | Zhao Y G, Li J X, Zhang S W, et al. Amidoxime-functionalized magnetic mesoporous silica for selective sorption of U(Ⅵ)[J]. RSC Advances , 2014, 4 (62) : 32710–32717. DOI:10.1039/C4RA05128A |
| [53] | Shao D D, Hou G S, Li J X, et al. PANI/GO as a super adsorbent for the selective adsorption of uranium(Ⅵ)[J]. Chemical Engineering Journal , 2014, 255 : 604–612. DOI:10.1016/j.cej.2014.06.063 |
| [54] | Chen H, Shao D D, Li J X, et al. The uptake of radionuclides from aqueous solution by poly(amidoxime) modified reduced graphene oxide[J]. Chemical Engineering Journal , 2014, 254 : 623–634. DOI:10.1016/j.cej.2014.05.091 |
| [55] | Xing M, Xu L, Wang J L. Mechanism of Co(Ⅱ) adsorption by zero valent iron/graphene nanocomposite[J]. Journal of Hazardous Materials , 2016, 301 : 286–296. DOI:10.1016/j.jhazmat.2015.09.004 |
| [56] | Song W C, Hu J, Zhao Y, et al. Efficient removal of cobalt from aqueous solution using β-cyclodextrin modified graphene oxide[J]. RSC Advances , 2013, 3 (24) : 9514–9521. DOI:10.1039/c3ra41434e |
| [57] | Li J, Chen C L, Zhang R, et al. Reductive immobilization of Re(Ⅶ) by graphene modified nanoscale zero-valent iron particles using a plasma technique[J]. Science China Chemistry , 2015, 59 (1) : 150–158. |
| [58] | Gao Y, Chen C L, Chen H, et al. Synthesis of a novel organic-inorganic hybrid of polyaniline/titanium phosphate for Re(Ⅶ) removal[J]. Dalton Transactions , 2015, 44 (19) : 8917–8925. DOI:10.1039/C5DT01093D |
| [59] | Wen T, Wu X L, Liu M C, et al. Efficient capture of strontium from aqueous solutions using graphene oxide-hydroxyapatite nanocomposites[J]. Dalton Transactions , 2014, 43 (20) : 7464–7472. DOI:10.1039/c3dt53591f |
| [60] | Ding C C, Cheng W C, Sun Y B, et al. Novel fungus-Fe3O4 bio-nanocomposites as high performance adsorbents for the removal of radionuclides[J]. Journal of Hazardous Materials , 2015, 295 : 127–137. DOI:10.1016/j.jhazmat.2015.04.032 |
| [61] | Missana T, García G M, Fernńdez V. Uranium(Ⅵ) sorption on colloidal magnetite under anoxic environment:Experimental study and surface complexation modeling[J]. Geochimicaet Cosmochimica Acta , 2003, 67 (14) : 2543–2550. DOI:10.1016/S0016-7037(02)01350-9 |
| [62] | Mellah A, Chegrouche S, Barkat M. The removal of uranium(Ⅵ) from aqueous solutions onto activated carbon:Kinetic and thermodynamic investigations[J]. Journal of Colloid and Interface Science , 2006, 296 (2) : 434–441. DOI:10.1016/j.jcis.2005.09.045 |
| [63] | Tomohiko O, Yusuke E, Makoto O. Adsorption of Eu3+ to smectites and fluoro-tetrasilicic mica[J]. Clays and Clay Minerals , 2007, 55 (4) : 348–353. DOI:10.1346/CCMN.2007.0550402 |
| [64] | Tan X L, Fang M, Li J X, et al. Adsorption of Eu(Ⅲ) onto TiO2:Effect of pH, concentration, ionic strength and soil fulvic acid[J]. Journal of Hazardous Materials , 2009, 168 (1) : 458–465. DOI:10.1016/j.jhazmat.2009.02.051 |
| [65] | Huang Y, Chen L, Wang H L. Removal of Co(Ⅱ) from aqueous solution by using hydroxyapatite[J]. Journal of Radioanalytical and Nuclear Chemistry , 2011, 291 (3) : 777–785. |
| [66] | Bhatnagar A, Minocha A K, Sillanpää M. Adsorptive removal of cobalt from aqueous solution by utilizing lemon peel as biosorbent[J]. Biochemical Engineering Journal , 2010, 48 (2) : 181–186. DOI:10.1016/j.bej.2009.10.005 |
| [67] | Ma B, Oh S, Shin W S, et al. Removal of Co2+, Sr2+ and Cs+ from aqueous solution by phosphate-modified montmorillonite(PMM)[J]. Desalination , 2011, 276 (1-3) : 336–346. DOI:10.1016/j.desal.2011.03.072 |
| [68] | Zhao Y, Shao Z Y, Chen C L, et al. Effect of environmental conditions on the adsorption behavior of Sr(Ⅱ) by Na-rectorite[J]. Applied Clay Science , 2014, 87 : 1–6. DOI:10.1016/j.clay.2013.11.021 |
| [69] | Shan W J, Fang D W, Zhao Z Y, et al. Application of orange peel for adsorption separation of molybdenum(Ⅵ) from Re-containing industrial effluent[J]. Biomass and Bioenergy , 2012, 37 : 289–297. DOI:10.1016/j.biombioe.2011.11.015 |
| [70] | Zhang H X, Wang X Y, Liang H H, et al. Adsorption behavior of Th(Ⅳ) onto illite:Effect of contact time, pH value, ionic strength, humic acid and temperature[J]. Applied Clay Science , 2016, 127-128 : 35–43. DOI:10.1016/j.clay.2016.03.038 |
 2016, Vol. 35
2016, Vol. 35