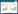文章信息
- 张继双, 唐昊冶, 刘钢, 朱建国
- ZHANG Ji-shuang, TANG Hao-ye, LIU Gang, ZHU Jian-guo
- 亚热带地区水稻(Oryza sativa L.)气孔臭氧通量和产量的响应关系
- Stomatal ozone flux-response relationships of rice(Oryza sativa L.) in subtropical area
- 农业环境科学学报, 2016, 35(10): 1857-1866
- Journal of Agro-Environment Science, 2016, 35(10): 1857-1866
- http://dx.doi.org/10.11654/jaes.2016-0594
文章历史
- 收稿日期: 2016-04-28
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
臭氧(O3)具有强氧化性,是对流层主要的二次空气污染物之一,对植物的生长发育产生不利影响[1-2]。近年来,伴随着我国经济的快速发展,氮氧化物(NOx)、一氧化碳(CO)和挥发性有机物(VOCs)等O3前体物排放量剧增,导致地表O3浓度以每年0.5%~2%的速率增加[3]。对流层O3浓度的日益升高,已经严重威胁到我国粮食生产安全[4]。因此,制定科学合理并适合我国农业特点的O3风险评估方法具有重要意义。
为了定量评价植物对O3的响应关系,科研人员开展了大量研究工作。20世纪80年代,美国农业部和环境保护局创建了全国农作物损失评价网,利用田间原位开顶式气候箱(OTCs)来研究农作物(主要有豆类、块茎类和禾本科作物等)对不同浓度O3水平的响应机制,并通过建立O3浓度(M7)与作物产量浓度响应模型,对作物产量损失进行评估[5]。随着研究的持续深入,发现O3对作物造成的负面影响主要是由O3的累积效应引起,由此提出了O3剂量的概念,并利用AOT40、SUM06和W126等不同暴露指标来反应O3剂量对作物伤害的阈值[6]。AOT40(大于40 nL·L-1的小时平均O3浓度与40 nL·L-1差值的累计值)将40 nL·L-1作为O3对作物产生伤害的临界值,超过临界值的O3将对作物产生负面效应[7-8],因其与作物的反应有良好的拟合关系,较好地反映了O3对作物的潜在威胁,所以曾被广泛用于O3风险评价当中[9]。然而,基于AOT40等暴露指标建立的作物产量损失的剂量响应模型,仅仅考虑了植物冠层水平的O3浓度变化,忽略了生物和气候因素对气孔O3吸收的调节作用[10],用于作物产量损失的评估时,存在一定局限性和不确定性。大量研究表明,O3对植物的伤害主要取决于植物的气孔O3吸收量[11],而气孔是O3进入植物体的主要通道,气孔开度大小对植物叶片O3吸收数量起着调节和限制作用[12]。为了准确评估O3对作物生长和产量的影响,基于气孔O3吸收通量的方法被提出并广泛应用于作物产量损失的评估中[13]。该方法以Jarvis气孔导度模型[14]为基础,既考虑了环境因素与植物自身因素,又考虑了植物对环境改变的生理响应,更接近实际水平,可避免过高估计O3污染对作物造成的伤害[15]。目前,我国O3污染研究多数是在OTCs实验条件下以暴露指标为主,缺乏自然环境条件下O3浓度升高对作物O3通量影响的研究[16]。大量研究表明,OTCs可以改变植物冠层的微气候条件,如温度、降雨、湿度和风速等自然环境条件,影响植物叶片气体交换、污染物吸收以及土壤养分供给等,改变植物对O3的敏感性,从这种模拟环境中取得的研究结果预测O3浓度升高对作物生长的影响,具有较多的不确定性。鉴于此,在开放系统下升高臭氧浓度,以尽可能接近自然环境的条件下,利用模型预测我国作物的气孔O3吸收通量和产量损失将有利于臭氧风险评价方法的进一步完善。
水稻是世界上重要的粮食作物,而中国是世界上最大的水稻生产国(水稻产量占全球30%)和消费国(年消费1.465亿吨)[17]。近年来许多研究表明水稻是对O3污染比较敏感的农作物品种[2]。由于人口的增长和农田减少,社会对水稻产量和质量的需求持续上升。本文根据中日合作建立的亚洲首个稻/麦轮作O3-FACE(Free-air concentration elevation of O3)平台,利用Jarvis气孔导度模型和通量模型,计算水稻叶片气孔O3吸收通量,建立气孔O3吸收通量与水稻产量的通量关系模型,综合分析了不同O3通量和水稻产量的拟合关系;同时根据计算的不同O3暴露剂量,比较分析了不同O3风险评价指标在水稻产量损失评估中的优劣,为政府制定相应的法律、法规、政策提供理论依据。
1 材料和方法 1.1 试验区概况试验于2007-2009年在中国O3-FACE研究基地进行。该基地位于江苏省江都市小纪镇马凌村良种场(32°35′5″N,119°42′0″E),海拔高度5 m,典型的亚热带海洋气候区,年均降雨量980 mm左右,年均蒸发量大于1100 mm,年均温度14.9 ℃,年日照时间大于2100 h,年无霜期220 d,耕作方式为水稻-冬小麦轮作,典型的轮作农田生态系统。
1.2 试验平台O3-FACE系统设置大气O3浓度升高圈(FACE,E)和对照处理圈(Ambient,A),每个处理各有三个重复,FACE圈之间以及FACE圈与对照圈之间的间隔大于70 m,以减少O3释放的圈际影响。FACE圈为直径14 m的正八边形,作物冠层上方50~60 cm处放置8根放气管道,管道上分布有锯齿状小孔,由计算机自动控制FACE圈气体的喷放。晴天每天09:00-18:00释放O3,使FACE圈内O3浓度始终比对照圈O3浓度高50%,雨天、雾天(避免水蒸发时水滴所在处O3被浓缩)、自然环境中O3浓度低于20 nL·L-1(低于可观察效应阈值40 nL·L-1)或高于250 nL·L-1(避免水稻叶片局部过度损伤)时暂停通气。在90%的放气时间内,平台控制区域O3浓度的误差在控制目标值的20%以内,3个对照圈无放气管道,环境条件与自然状态完全一致。
1.3 供试水稻2007年供试品种为武运粳15(WYJ15,粳稻)、扬稻6号(YD6,粳稻)、汕优63(SY63,杂交稻)和两优培九(LYPJ,杂交稻);2008、2009年供试品种相同,为武运粳21(WYJ21,粳稻)、扬稻6号、汕优63和两优培九。成熟期,每个小区取样2 m2,测定实产。
1.4 气孔导度模型本文采用Jarvis气孔导度模型[14]对水稻剑叶气孔导度进行模拟,模型公式如下:
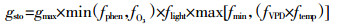
式中:gsto表示单位投影叶面积(PLA)[18]实际气孔导度(mmol O3·m-2 PLA·s-1);gmax表示最大气孔导度(mmol O3·m-2 PLA·s-1);fmin表示最小相对气孔导度值,为固定常数,由最小气孔导度和最大气孔导度的比值确定(本文取值0.01);fphen、fO3、flight、ftemp和fVPD分别是水稻物候期(phen)、O3吸收通量、光照(PPFD)、大气温度(T)和水汽压差(VPD)对气孔导度的限制函数,并以相对值的形式表示,取值范围为0≤f≤1,其中:O3吸收通量以小时O3浓度大于0 nmol O3·m-2 PLA·s-1累积O3浓度值(POD0)表示,累积时间采用有效积温形式计算,从开花前-350 ℃·d至开花后1000 ℃·d,并以0 ℃·d为基温,开花前为负值,开花后为正值。
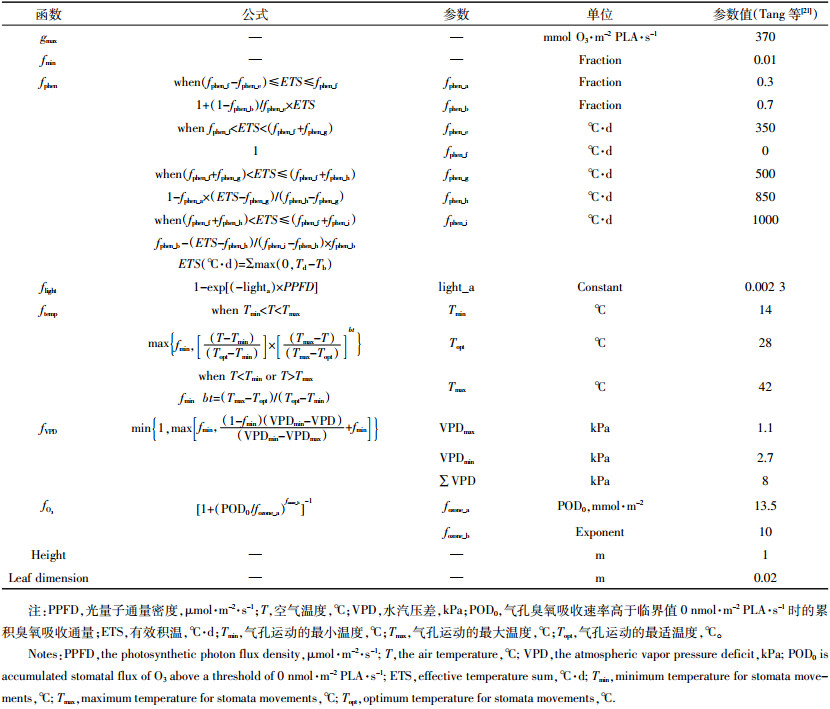
气孔导度模型公式及相关参数在表 1中列出。
 |
参考LATAP[18]的方法来计算水稻剑叶气孔O3通量,公式如下:
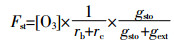
式中:Fst表示气孔O3吸收速率(nmol O3·m-2 PLA·s-1);[O3]表示冠层臭氧浓度;rb表示叶的边界层阻力;rc表示叶的气孔阻力;gext表示叶的非气孔导度。
叶边界层阻力rb和叶气孔阻力rc计算公式如下:
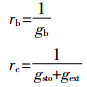
式中:gb表示叶边界层导度,通过冠层高度处风速(u,m·s-1)和叶片宽度(w,0.02 m)计算得到。计算公式如下[19]:
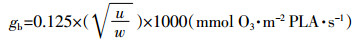
累积气孔臭氧通量计算公式如下:
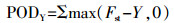
式中:PODY表示气孔臭氧吸收速率大于临界值Y时的累积气孔臭氧吸收通量(mmol·m-2);Y表示气孔臭氧吸收速率的临界值(nmol O3·m-2 PLA·s-1)。
1.6 数据处理根据Feng等[19]提供的方法,利用最小二乘法对水稻产量与O3通量/剂量指标进行线性回归分析,将回归线截矩作为理论产量,每个处理的实际产量与回归线截矩的比值作为相对产量(RY),以O3通量/剂量指标为横坐标,相对产量(RY)为纵坐标,进行通量/剂量效应分析,根据分析结果比较不同评价指标在水稻产量损失评估中的优劣。其中相对产量作为O3通量/剂量为零时的假设产量,使得每个处理间的产量具有可比性。
通量效应分析中,本文对水稻气孔O3吸收速率临界值Y从0~18进行连续取值,间隔为1,建立PODY与水稻产量间的通量响应关系模型,分析不同Y值条件下气孔O3通量PODY与相对产量之间的关系,以确定最合理的气孔O3吸收阈值。
同时计算了臭氧浓度指标AOTX,X从0~70进行连续取值,间隔为5,建立AOTX与水稻产量间的剂量响应关系模型,分析不同X值下AOTX与水稻相对产量之间的关系,其臭氧累积计算期间与通量指标PODY相同,而不是3个月的累积期。
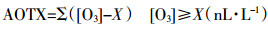
式中:AOTX为有效光照条件下(太阳总辐射≥50 W·m-2)大于X(nL·L-1)的小时平均O3浓度与X(nL·L-1)差值的累计值(nL·L-1·h)。
2 结果与分析 2.1 模型数据输入气象数据是模型运行的驱动因子,本研究所用的气象数据由FACE平台设置的气象监测站(Campbell Sci. North Logan,Utah,USA)监测得到(图 1),2007、2008、2009年三个水稻种植季节:日均最大和最小温度分别为27.3、20.7 ℃,27.4、21.0 ℃,27.2、20.4 ℃;日均最大光量子通量密度(PPFD)分别为1137、1147、1001 μmol·m-2·s-1;累积降雨量分别为421、392、511 mm。其中,2009年水稻季降雨量比2007和2008水稻季多,从而对2009年水稻季太阳辐射产生影响,使该季大气温度(T)和光量子通量密度(PPFD)小于前两季;水稻生长季节相对湿度(RH)保持在80%~100%之间,并与降雨量正相关。

|
| 图 1 水稻生长季内气象数据(2007—2009年) Figure 1 Meteorological data collected at the experiment site during the 2007, 2008, and 2009 growth seasons 日最大(虚线)最小温度(实线)(a、b、c); 日最大光量子通量密度(PPFD)(d、e、f); 降雨量(g、h、i); 相对湿度(RH)(j、k、l) Maximum (dot line) and minimum (solid line) daily temperature (a, b, c), daily maximum photosynthetic photon flux desity (PPFD)(d, e, f), and dailyprecipitation (g, h, i) and relative humidity (RH)(j, k, l) |
冠层高度臭氧浓度由O3分析仪(Thermo Electron 49i,Thermo Scientific Co.,USA)监测得到,每隔20 s记录一次。在水稻生长季节内,FACE圈的累积O3剂量指标AOT40稳定增长,FACE圈和对照圈AOT40差异明显,且差异随时间的增加而增加,2007、2008、2009年FACE圈分别比对照圈高93.8%、107%、136%,日7 h平均O3浓度FACE圈分别比对照圈高23.6%、23.1%、21.2%(图 2)。
|
| 图 2 2007年、2008年和2009年生长季内AOT40(a、b、c)(大于40 nL·L-1的小时O3浓度与40 nL·L-1差值的累计值)以及7 h均值M7(d、e、f)的季节变化 Figure 2 AOT40 (accumulated daytime [O3] above a threshold of 40 nL·L-1) in 2007(a), 2008(b), 2009(c) seasons and seasonal change in daily 7-h (9:00-16:00, Chinese Standard Time) mean [O3] in 2007(d), 2008(e), 2009(f) seasons |
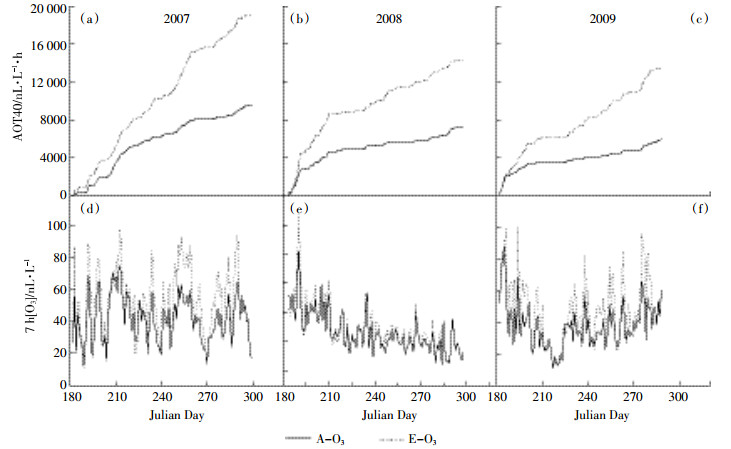
图 3表示在整个累积计算期间内各环境因子(PPFD、VPD、T)对气孔导度的限制作用(以YD6为例,不同品种间曲线略有不同)。当出现光照时,气孔张开,随着光照增强,其对气孔导度限制作用减弱;日出之前,温度最低,温度对气孔导度的限制作用最强,随着温度升高,其对气孔导度的影响逐渐趋于稳定,然后随着温度的下降,其对气孔导度的限制作用增强。2009年温度的影响强于其他年份,主要是因为当年水稻季降雨量多而导致环境温度下降造成的(图 1)。由于农田自然环境条件相对稳定,水汽压差(VPD)对气孔导度的影响变化不大。
|
| 图 3 水稻累积期间内环境变量(PPFD,VPD,T)对相对气孔导度(0~1,1表示最大气孔导度)影响的日变化曲线 Figure 3 The relative importance of environmental variables (PPFD, VPD, T) for relative stomata conductance(gsto)(0~1, where 1 represents gmax) expressed as average diurnal curves for the accumulated period of rice |
计算水稻气孔O3通量时,所有数据集(气象数据和O3浓度数据)均转换为小时均值的形式。
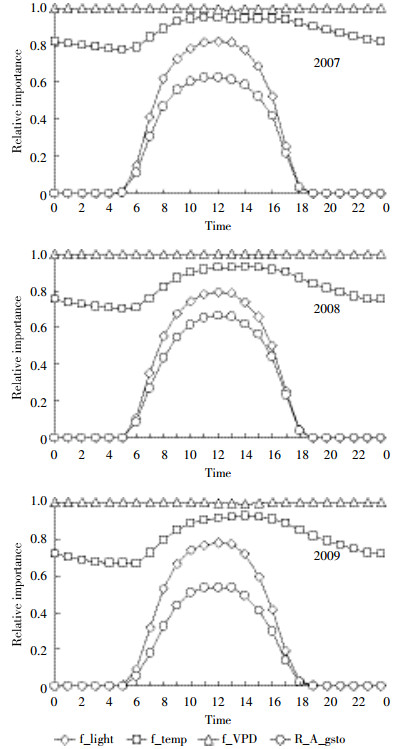
2.2 产量分析参考Zhu等[20]的分析方法,分别对FACE圈和对照圈水稻品种产量求均值,发现O3处理显著减少了14.3%的水稻产量(图 4),其中WYJ15、WYJ21、YD6、LYPJ和SY63分别减少9.9%、10.5%、9.1%、20.5%和16.5%。不同水稻品种产量有显著差异,其中LYPJ产量最高,WYJ21产量最低,品种间产量差异随季节而变化。不同品种对臭氧浓度升高表现出不同的响应,与粳稻相比,杂交稻对臭氧浓度升高更敏感,表现出更高的产量差异(图 4)。方差分析结果表明(表 2):O3×Cultivar展现出弱显著交互作用(P=0.068),而O3×Cultivar×Year交互作用不显著(P=0.131)。通过分析发现,这种现象由于FACE圈中SY63产量的不稳定性而引起,与对照圈相比,FACE圈中SY63各季产量分别下降了17.5%、27.5%和16.3%。当忽略SY63时,方差分析结果表明:O3×Cultivar的交互作用不显著(P=0.318),然而O3×Cultivar×Year或O3×Year的交互作用仍保持不显著(P值分别为0.878和0.612)。因此,考虑到SY63对O3表现出较大的年际变化,通量/剂量效应分析中该品种2008年产量被忽略。
|
| 图 4 对照圈和FACE圈水稻产量(n=3) Figure 4 Yield of rice(Oryza sativa L.) under A-O3 and E-O3(n=3) 无相同字母的条形柱表示两者有显著差异(P < 0.05),方差分析结果中*,**,***分别表示P < 0.05,P < 0.01,P < 0.001的显著性差异水平,ns表示无显著性差异 |
图 5展示了通量分析和剂量分析中R2值的变化,以及FACE圈和对照圈的相对产量的估计值(相对产量分别表示为A-RY和E-RY)。R2值随阈值Y增加而增加,当阈值Y等于11 nmol O3·m-2 PLA·s-1时,O3吸收通量(POD11)与水稻相对产量的相关性最大(图 5a)。当通量阈值Y=8~13 nmol O3·m-2 PLA·s-1时,获得高R2值取值范围(0.70~0.75),不同通量指标间R2值相差较小。同样,从图 5b可以看出,当X取值为46~58 nL·L-1时,可以得到较高的R2值范围(0.70~0.745)。
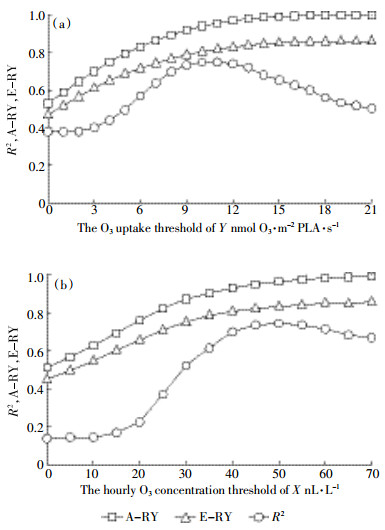
|
| 图 5 相对产量和气孔O3通量PODY或累积暴露剂量AOTX回归分析R2值与O3通量阈值Y(a)或O3暴露剂量阈值X(b)的关系,以及线性外推得到的对照圈和FACE圈相对产量的预测值 Figure 5 R2-values of the regressions between relative yield and PODY over a threshold of Y nmol O3·m-2 PLA·s-1(x-axis)(A) or relative yield(RY; y-axis) and AOTX over an hourly threshold concentration of Xppb(x-axis)(B). Also the values of RY at ambient(A-RY) and elevated O3(E-RY) were shown by linear extropolation |
通过分析发现,随着臭氧阈值的增加,水稻的相对产量呈现明显的下降趋势(图 6)。从图 6可以看出,通量POD6与相对产量剂量效应分析得到的R2值(0.57)明显小于POD9和POD11的R2值(0.73、0.75),且AOT40指标的剂量效应分析R2值介于POD6和POD9两指标通量效应分析R2值之间。随着通量阈值Y继续增加,点的聚集效应随之出现(图 6c)。通过对相对产量和通量(图 6a、图 6b)做残差分析(图 7a、图 7b)发现,POD9的残差分布比POD6更均匀。关于合理阈值的选择将在讨论部分给出。
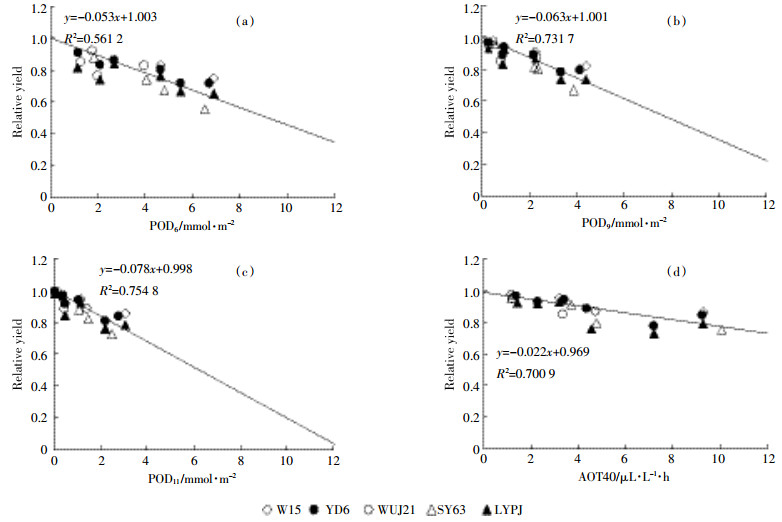
|
| 图 6 相对产量与POD6(a)、POD9(b)、POD11(c)和AOT40(d)的关系 Figure 6 Relationship between relative yield and POD6(a), POD9(b), POD11(c) and AOT40(d) |
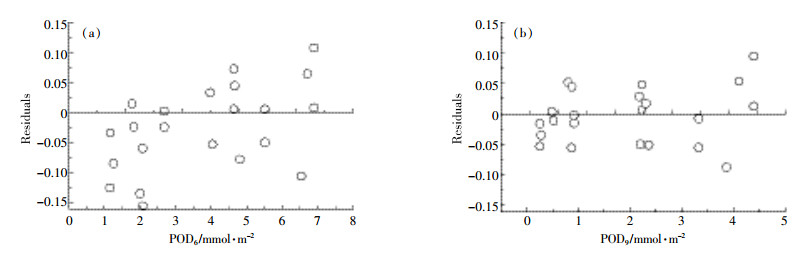
|
| 图 7 相对产量和POD6(a)、POD9(b)回归分析残差图 Figure 7 Residual plots for the regressions between relative yield and POD6(a) and POD9(b) |
目前,关于水稻气孔导度模型的研究仍然很少。本研究利用了Tang等[21]基于FACE实验数据修正的气孔导度模型来评估水稻剑叶的臭氧通量。与开顶式气室(OTC)不同,本研究是在开放式臭氧浓度增高环境(FACE)条件下进行,可以更好地代表未来环境臭氧浓度升高的情况,避免OTC试验中对冠层微气候的影响[22]。
与暴露剂量指标(AOT40)相比,通量指标最重要的提高在于对累积期间的界定[9]。大量研究表明,早期灌浆期间剑叶没有明显的衰老过程,但是在灌浆后期其叶绿素含量快速下降[23]。本研究中暴露剂量指标AOTX累积计算期间与通量指标计算期间相同(从开花前-350 ℃·d-1至开花后1000 ℃·d-1)。如在Pleijel等[24]实验中,作物生育周期少于三个月,导致其对臭氧风险的评估结果具较高的不确定性。另外,气孔导度模型综合考虑了生物和气候因素对气孔导度的影响,揭示了气孔导度与各环境限制因子的关系,基于气孔导度模型的气孔O3通量指标在水稻产量损失的评估方面比O3暴露指标更具优势。
对于AOTX和PODY来说,选择合适的阈值(X和Y)对于臭氧风险评估的结果至关重要,所以本文不仅比较R2值大小,而且通过分析比较水稻的产量损失来选择合适的O3风险评估阈值。在欧洲,当通量阈值Y为6 nmol O3·m-2 PLA·s-1时(对小麦、马铃薯等评估),相对产量和O3通量具有显著的相关性[13]。本研究中,当Y=6 nmol O3·m-2 PLA·s-1时,相对产量和POD6的相关性较低(R2=0.57,图 7A),不能很好反应水稻产量的变化,预测产量损失时可能存在较高的不确定性。根据EDU试验以及整合分析[2, 25]的结果,目前地表臭氧污染可能引起的水稻产量损失范围为5%~8%。从图 5可以看出,对照圈中POD9~10和AOT40~45产量损失的预测值在该区间,但前者R2(0.73~0.74)值要高于后者R2(0.64~0.69),表明基于气孔臭氧通量的评价指标能更好地反映水稻产量的变化。并且,随着通量阈值Y的升高,对照圈中具有低气孔臭氧吸收通量(POD10)的部分数据点出现集聚效应。同时考虑对照圈中可能的产量损失和R2值,通量阈值取为9 nmol O3·m-2 PLA·s-1时,能更好地评估亚热带地区的水稻产量损失。这与Yamaguchi等[26]研究结果相似(Y=10 nmol O3·m-2 PLA·s-1)。尽管该通量阈值要小于Feng等[19]对小麦通量阈值的研究结果(Y=12 nmol O3·m-2 PLA·s-1),但不能简单地认为亚热带地区水稻品种比小麦品种对O3更敏感,因为两者使用了不同的模型参数值。
通量和剂量效应关系中较高的R2值范围分别出现在POD8~13(R2=0.70~0.75)和AOT46~58(R2=0.70~0.74)。但是,当考虑到合理的阈值Y=9~10 nmol O3·m-2 PLA·s-1和X=40~45 nL·L-1时,通量指标POD9~10的R2值(0.73~0.74)明显高于剂量指标AOT40~45的R2值(0.64~0.69)。可见与暴露剂量指标相比,通量指标与产量损失有更好的相互关系,对产量损失的评估更为准确。因此,基于累积气孔O3通量的方法适合于定量评估O3污染对水稻作物的影响,尤其是缺乏O3风险评估方法的亚热带地区。
本研究选用了两种杂交稻和三种常规粳稻作为实验材料,通过分析发现杂交稻对O3污染更敏感。通过计算三个生长季节敏感性品种产量,其产量损失达到18%(图 4)。因此,可以判定一个地区水稻对O3的敏感特性变异,不仅和年际间气候变异有关而且与水稻品种有关,当评估O3污染对作物的影响时,应该充分考虑这些因素。最后,值得注意的是,O3风险评估的计算中忽略了一个或多个气孔导度的限制因素,都会导致过高估计其潜在风险,产生不确定性。因此,需要更多的O3观、监测站点和不同O3处理水平试验(低于对照处理的O3水平试验),以提高和改善O3风险评估方法。
4 结论研究表明,基于累积气孔O3通量的方法不仅考虑了环境O3浓度的变化对气孔导度的影响,而且考虑了环境和生物因子对气孔运动的调节作用,更接近于实际水平,是目前评估O3对植物伤害的更为可靠的方法。与剂量指标AOTX相比,通量指标PODY能更好地反映水稻产量的变化。根据试验观察的产量损失率区间,选用POD9评估对亚热带地区O3污染造成的水稻产量损失风险更为合适。
| [1] | Ashmore M R. Assessing the future global impacts of ozone on vegetation[J]. Plant Cell and Environment , 2005, 28 : 949–964. DOI:10.1111/pce.2005.28.issue-8 |
| [2] | Feng Z Z, Kobayashi K. Assessing the impacts of current and future concentrations of surface ozone on crop yield with meta-analysis[J]. Atmospheric Environment , 2009, 43 : 1510–1519. DOI:10.1016/j.atmosenv.2008.11.033 |
| [3] | Vingarzan R. A review of surface ozone background levels and trends[J]. Atmospheric Environment , 2004, 38 : 3431–3442. DOI:10.1016/j.atmosenv.2004.03.030 |
| [4] | Tang H Y, Takigawa M, Liu G, et al. A projection of ozone-induced wheat production loss in China and India for the years 2000 and 2020 with exposure-based and flux-based approaches[J]. Global Change Biology , 2013, 19 : 2739–2752. DOI:10.1111/gcb.2013.19.issue-9 |
| [5] | Heck W C, Adams R M. Reassessment of crop loss from ozone[J]. Environment Science and Technology , 1983, 17 : 572–581. DOI:10.1021/es00118a716 |
| [6] | Further J, Skarby L, Ashmore M R. Critical levels for ozone effect on vegetation in Europe[J]. Environmental Pollution , 1997, 97 : 91–106. DOI:10.1016/S0269-7491(97)00067-5 |
| [7] | Pleijel H, Berglen E A, Danielsson H, et al. Differential ozone sensitivity in an old and a modern Swedish wheat cultivar grain yield and quality, leaf chlorophyll and stomata conductance[J]. Environmental and Experimental Botany , 2006, 56 (1) : 63–71. DOI:10.1016/j.envexpbot.2005.01.004 |
| [8] | Mills G, Buse A, Gimeno B, et al. A synthesis of AOT40-based response functions and critical levels of ozone for agricultural and horticultural crops[J]. Atmospheric Environment , 2007, 41 : 2630–2643. DOI:10.1016/j.atmosenv.2006.11.016 |
| [9] | Pleijel H, Wallin G, Karlsson P E, et al. Ozone deposition to an oat crop(Avena sativa L.) grown in open-top chambers and in the ambient air[J]. Atmospheric Environment , 1994, 28 : 1971–1979. DOI:10.1016/1352-2310(94)90466-9 |
| [10] | 佟磊, 王效科, 苏德·毕力格, 等. 水稻气孔臭氧通量拟合及通量与产量关系的比较分析[J]. 农业环境科学学报 , 2011, 30 (10) : 1930–1938. TONG Lei, WANG Xiao-ke, Sudebilige, et al. Stomatal ozone uptake modeling and comparative analysis of flux-response relationships of rice[J]. Journal of Agro-Environment Science , 2011, 30 (10) : 1930–1938. |
| [11] | NouchiI. Responses of whole plants to air pollutants//Omasa K, Saji H, Youssefian S, et al. Eds. Air pollution and plant biotechnology-prospects for phytomonitoring and phytoremediation[M]. Springer-Verlag Tokyo, Tokyo, Japan, 2002:3-39. http://www.springer.com/us/book/9784431702160 |
| [12] | Heath R L, Lefohn A S, Musselman R C. Temporal processes that contribute to nonlinearity in vegetation responses to ozone exposure and dose[J]. Atmospheric Environment , 2009, 43 : 2919–2928. DOI:10.1016/j.atmosenv.2009.03.011 |
| [13] | Pleijel H, Danielsson H, Emberson L D, et al. Ozone risk assessment for agricultural crops in Europe:Further development of stomata flux and flux-response relationships for European wheat and potato[J]. Atmospheric Environment , 2007, 41 : 3022–3040. DOI:10.1016/j.atmosenv.2006.12.002 |
| [14] | Jarvis P G. The interpretation of the variations in leaf water potential and stomatal conductance found in canopies in the field[J]. Philosophical Transactions of the Royal Society, London B , 1976, 273 : 593–610. DOI:10.1098/rstb.1976.0035 |
| [15] | Mills G, Pleijel H, Braun S, et al. New stomata flux-based critical levels for ozone effects on vegetation[J]. Atmospheric Environment , 2011, 45 : 5064–5068. DOI:10.1016/j.atmosenv.2011.06.009 |
| [16] | 吴荣军, 郑有飞, 赵泽, 等. 基于气孔导度和臭氧吸收模型的冬小麦干物质累积损失评估[J]. 生态学报 , 2010, 30 (11) : 2799–2808. WU Rong-jun, ZHENG You-fei, ZHAO Ze, et al. Assessment of loss of accumulated dry matter in winter wheat based on stomata conductance and ozone uptake model[J]. Acta Ecologica Sinica , 2010, 30 (11) : 2799–2808. |
| [17] | 国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2013 . National Bureau of Statistics. China statistical yearbook[M]. Beijing: China Statistics Press, 2013 . |
| [18] | LRTAP Convention. Manual on methodologies and criteria for modeling and mapping critical loads & levels and air pollution effects, risk and trends//Chapter 3. Mapping Critical Levels for Vegetation(2010 Revision). Available at:http://icpvegetation.ceh.ac.uk. |
| [19] | Feng Z Z, Tang H Y, Uddling J, et al. A stomata ozone flux-response relationship to assess ozone-induced yield of winter wheat in subtropical China[J]. Environment Pollution , 2012, 164 : 16–23. DOI:10.1016/j.envpol.2012.01.014 |
| [20] | Zhu X K, Feng Z Z, Sun T F, et al. Effects of elevated ozone concentration on yield of four Chinese cultivars of winter wheat under fully open-airfield conditions[J]. Global Change Biology , 2011, 17 : 2697–2706. DOI:10.1111/j.1365-2486.2011.02400.x |
| [21] | Tang H Y, Pang J, Zhang G X, et al. Mapping ozone risks for rice in China for years 2000 and 2020 with flux-based and exposure-based doses[J]. Atmospheric Environment , 2014, 86 : 74–83. DOI:10.1016/j.atmosenv.2013.11.078 |
| [22] | Tang H Y, Liu G, Han Y, et al. A system for free-air ozone concentration elevation with rice and wheat:Control performance and ozone exposure regime[J]. Atmospheric Environment , 2011, 45 : 6276–6282. DOI:10.1016/j.atmosenv.2011.08.059 |
| [23] | Pang J, Kobayashi K, Zhu J G, et al. Yield and photosynthetic characteristics of flag leaves in Chinese rice(Oryza sativa LAtmospheric Environment[J]. Agriculture, Ecosystems and Environment , 2009, 132 : 203–211. DOI:10.1016/j.agee.2009.03.012 |
| [24] | Pleijel H. Statistical aspects of critical levels for ozone//Kärenlampi L, Skärby L. Eds. Critical levels for ozone in Europe:Testing and Finalising the Concepts[R]. UNECE Workshop Report. University of Kuopio, Department of Ecology and Environmental Science, University of Kuopio, 1996:130-150. |
| [25] | Wang X P, Denise L Mauzerall. Characterizing distributions of surface ozone and its impact on grain production in China, Japan and South Korea:1990 and 2020[J]. Atmospheric Environment , 2004, 38 : 4383–4402. DOI:10.1016/j.atmosenv.2004.03.067 |
| [26] | Yamaguchi M, Hoshino D, Inada H, et al. Evaluation of the effects of ozone on yield of Japanese rice(Oryza sativa L.) based on stomatal ozone uptake[J]. Environmental Pollution , 2014, 184 : 472–480. DOI:10.1016/j.envpol.2013.09.024 |
 2016, Vol. 35
2016, Vol. 35