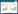文章信息
- 曹书苗, 王文科, 王非, 张军
- CAO Shu-miao, WANG Wen-ke, WANG Fei, ZHANG Jun
- 放线菌Act12对Pb胁迫下黑麦草根系生长及抗性生理的影响
- Effects of actinomycetes Act12 on the root growth and resistant physiology of perennial ryegrass under Pb stress
- 农业环境科学学报, 2016, 35(10): 1881-1887
- Journal of Agro-Environment Science, 2016, 35(10): 1881-1887
- http://dx.doi.org/10.11654/jaes.2016-0302
文章历史
- 收稿日期: 2016-03-09
2. 空军工程大学理学院, 西安 710054
2. College of Science, Air Force Engineering University, Xi'an 710054, China
黑麦草(Loliumperenne L.)因生长迅速、生物量大、再生能力强等特点,被认为是适合普遍种植的优质牧草和草坪草。研究报道,黑麦草是一种相对耐重金属的代表植物,可在Pb、Cd、Cu等重金属污染土壤中生长和吸收重金属,并对Pb有一定的富集能力[1-2]。因其生物量高且有较强的重金属耐性,被认为是一种很有潜力的重金属修复植物。然而,植物对重金属表现出富集能力的同时,也会引起植物体内一系列生理生化过程的紊乱。研究发现,高浓度Pb可降低黑麦草各项生理指标,如光合色素含量、植物抗性酶活性等[3-4],使其生长受阻,对黑麦草具有很强的毒性效应。因此,研究缓解Pb胁迫对植物毒性效应的方法,促进植物在含Pb土壤中生长,对植物修复效率的提高具有重要意义。
目前,利用有益菌来提高植物的耐Pb特性已有相关报道。扁豆根部接种4种耐Pb细菌可提高植物在Pb胁迫下叶片的3种抗氧化酶(CAT、SOD和POD)活性,促进植物生长[5];含Pb土壤种植的水稻接种一株内生真菌(EF0801),可增强Pb胁迫下叶片的抗氧化酶活性,降低Pb胁迫产生的丙二醛的含量,缓解Pb胁迫对植物的伤害[6]。然而,关于利用放线菌增强植物在Pb胁迫下的耐受性的研究很少,尤其对黑麦草在Pb污染土壤中的抗性生理罕有报道。而放线菌是土壤中三大类微生物之一,是抗生素的主要产生菌,其中密旋链霉菌具有促进植物根系发育、抗病促生等多种功能[7-8]。
本文以耐Pb性植物黑麦草为研究对象,采用盆栽试验,探索不同水平Pb胁迫下,一株放线菌对黑麦草根系生长和根系抗性生理的影响。通过测定在不同Pb胁迫下的根系生长情况,分析根系抗氧化酶活性、丙二醛含量和根系活力,阐明放线菌提高植物对Pb的耐受性机理,从而为提高植物修复Pb污染的效率提供科学依据。
1 材料与方法 1.1 供试材料供试放线菌为一株密旋链霉菌(Streptomyces pactum,Act12),是由西北农林科技大学微生物资源研究室从青藏高原、黄土高原土壤极端生境下的近万株微生物中分离筛选而来,该放线菌具有防病、促生、抗旱等多种功能[8]。将该菌通过固态发酵制成菌粉,用于本研究的盆栽试验,其活菌数量为4.6×1010 CFU·g-1。
黑麦草种子千粒重2.2 g,出苗率90%,在种植前先用0.5% NaClO室温下消毒10 min,再用蒸馏水冲洗后,均匀种植在花盆中,种子覆土约1 cm厚。
供试土壤采自长安区农田表层30 cm土壤,农田当季作物为小麦,风干后过5 mm尼龙筛备用。参照鲍士旦[9]的方法测定土壤基本理化性状,详见表 1[10]。
选用直径23 cm、高度21 cm的塑料花盆,为防止花盆底部小孔漏水,装土前盆内套两层塑料薄膜。每盆装土3 kg(风干土),土层填充高度约19 cm。
1.3 试验设计试验设2个处理:不接菌对照(CK)、菌剂接种。根据中国土壤Pb含量及分布情况、中国土壤环境质量标准(GB 15618-1995),并结合黑麦草对修复Pb污染的相关文献,每个处理设5个Pb胁迫浓度梯度,分别为0、200、300、500、1000 mg·kg-1,每个浓度水平设置3个重复。用硝酸铅[Pb(NO3)2]配制10 g·L-1的Pb原液,分别向5个大烧杯中加入0、360、540、900、1800 mL的Pb原液,补充蒸馏水至3600 mL。然后将烧杯中的Pb溶液分别均匀喷洒在5堆风干土壤中(每堆土重18 kg),搅拌均匀,使土壤与Pb溶液充分混匀(预试验中3600 mL的溶液加入18 kg风干土中,土壤湿度约为20%,接近田间土壤含水率),即得到实验设计所需的5堆Pb浓度梯度的土壤。用塑料薄膜密封,置于黑暗处保存3个月,使金属与土壤平衡稳定。装盆前将土样风干,每个Pb浓度土样等分成两份,不接菌对照按试验设计称重装盆,每盆装土3 kg;接菌处理5个Pb胁迫水平土样中,分别按1.5 g·kg-1干土的量加入菌剂,使菌剂与土样充分混匀后称重装盆。
黑麦草种子每盆种50粒,出苗后每盆统一保留15株。试验在日光温室进行,温度控制在22~25 ℃,每天夜间浇水一次(用称重法计算水分差),保持土壤湿度约为20%,观察记录生长情况,60 d后将地上部分和根系分开收获。植物根系先用自来水反复冲洗干净后,再用去离子水冲洗3遍,最后用吸水纸吸干根系表面的游离水,称总重。根鲜样保存在液氮中用于测定根系生理生化指标。
1.4 测试指标和方法超氧化物歧化酶(SOD)活性:参照Marklund等[11]的方法,由抑制氮蓝四唑(NBT)在光下的还原作用来确定,一个酶活单位以抑制NBT光还原的50%表示。
过氧化氢酶(CAT)活性:根据测量240 nm下吸光率的变化速度来反映过氧化氢分解,以1 min内减少0.1的酶量为1个酶活单位[12]。
过氧化物酶(POD)活性:按照Polle等[13]的方法测定。
丙二醛(MDA)含量:利用硫代巴比妥酸(TBA)在酸性条件下加热与组织中的丙二醛发生显色反应,生成红棕色的三甲川,分别在532、600、450 nm波长处测定其吸光度,计算出丙二醛的含量[12]。
根系活力:称取根尖样品0.5 g,加入0.4%TTC溶液和磷酸缓冲液,37 ℃暗保温约2 h,加1 mol·L-1硫酸停止反应,将根取出,吸干水分后加4 mL乙酸乙酯研磨,提取液在485 nm测定吸光度,求出TTC还原量,用四氮唑还原强度表示根系活力[14]。
1.5 数据处理相对增率(Δctrl%)是表示接菌处理与不接菌对照的差值占不接菌对照比值的百分数。
数据统计分析采用SPSS20.0(IBM,USA)软件,用Duncan法做差异显著性检验,在P < 0.05水平(表示差异达显著性水平)下进行分析。
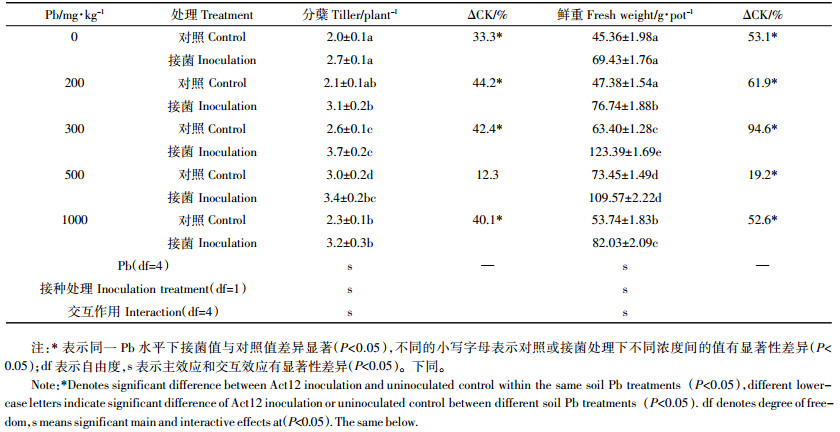
2 结果与分析 2.1 Pb胁迫下放线菌对黑麦草根系生长的影响由表 2可知,随着土壤Pb胁迫水平的升高,对照和接菌处理黑麦草根分蘖数和根鲜重均呈先增加后降低的趋势,在Pb含量为300~500 mg·kg-1时测定值最大。然而不同Pb胁迫水平下,土壤接入放线菌后,黑麦草根分蘖和根鲜重较对照分别增加了12.3%~44.2%和19.2%~94.6%,其中根分蘖数在土壤Pb加入量为200 mg·kg-1时增率最大,根鲜重在土壤Pb加入量为300 mg·kg-1时增率达最大。方差分析结果显示,放线菌Act12、Pb处理及其交互作用对黑麦草分蘖和根鲜重都有显著性影响,根分蘖除了500 mg·kg-1处理,其他Pb胁迫水平处理加菌均显著高于对照,根鲜重不同Pb胁迫下接菌均显著高于对照(P < 0.05)。这表明不同Pb胁迫下,土壤接入放线菌Act12增加了黑麦草根分蘖和根鲜重,对根系生长有显著的促进作用。
 |
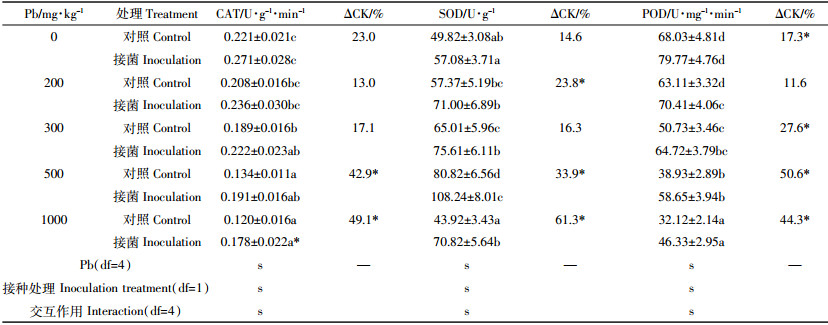
由表 3可知,对照和加菌处理下,黑麦草根系抗氧化酶CAT和POD的活性随Pb胁迫水平的升高而呈降低趋势,而SOD的活性呈先升高后降低的趋势。但土壤接入放线菌Act12后,在不同的Pb胁迫下3种抗氧化酶活性较对照都有一定程度的增加,CAT增加了13.0%~49.1%,SOD增加了14.6%~61.3%,POD增加了11.6%~50.6%;在土壤Pb加入量为500 mg·kg-1和1000 mg·kg-1时,3种抗氧化酶活性的增加均达显著性水平(P < 0.05)。方差分析显示,放线菌Act12、Pb处理及其交互作用对黑麦草根系3种抗氧化酶活性都有显著性影响(P < 0.05),表明根系抗氧化酶活性的变化与Pb胁迫水平有关,Pb胁迫增大可降低部分抗氧化酶活性。然而,放线菌Act12加入土壤后,不同程度地增强了抗氧化酶活性,特别是在高浓度Pb胁迫下,放线菌Act12对抗氧化酶活性作用明显,对缓解胁迫带来的氧化伤害非常重要。
 |
由表 4可知,放线菌Act12、Pb处理及其交互作用对黑麦草根系MDA含量和根系活力都有显著性影响(P < 0.05)。随着Pb胁迫水平的升高,对照和接菌处理黑麦草根系中MDA含量均呈增加的趋势。与对照相比,接菌显著降低了根系MDA含量,降幅达19.2%~35.3%(P < 0.05)。说明了Pb胁迫能引起细胞脂质过氧化,胁迫程度越大,脂质过氧化产生的MDA量越大,而土壤加入放线菌Act12能极大地降低这种脂质过氧化作用。
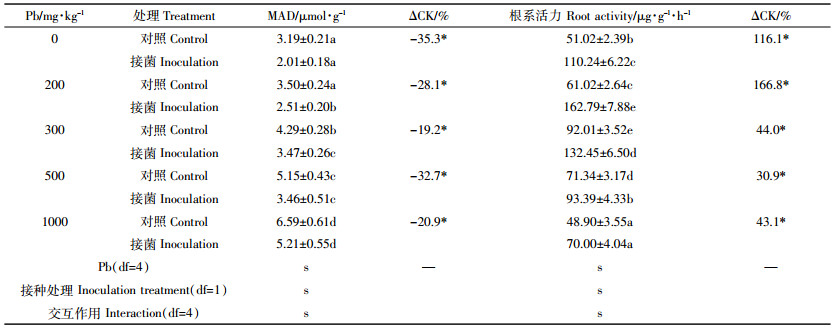 |
由表 4可知,对照处理黑麦草根系活力在低水平Pb胁迫下呈增加趋势,在高水平Pb胁迫下降低,300 mg·kg-1Pb胁迫时根系活力达最大;接菌处理也呈类似的变化趋势,但在200 mg·kg-1Pb胁迫下达最大值。与对照相比,接菌显著增加了黑麦草根系活力(P < 0.05),增幅达30.9%~166.8%,且在Pb加入量为200 mg·kg-1时增幅最大。说明了根系活力受Pb胁迫程度的影响很大,低水平Pb胁迫能刺激根系生长,但超过根系的耐受性后生长受阻,而放线菌Act12加入土壤后,对提高根系活力有积极的作用。
3 讨论Pb是植物生长的非必需元素,与根系作用直接影响植物的生长和生理状态。研究发现Pb易于在黑麦草根部吸收和积累,根中Pb浓度和积累均大于地上部[2]。因此,Pb对黑麦草根系的胁迫强度大于地上部,研究Pb胁迫下根系的生长和抗性生理具有重要意义。已有研究表明,低浓度Pb( < 500 mg·kg-1)对黑麦草生长有促进作用,高浓度时有显著的抑制作用[3],与本研究结果一致。这可能与黑麦草对Pb胁迫的耐受性有关。
Pb胁迫下土壤接入放线菌Act12后,促进了黑麦草根的分蘖,显著增加了根鲜重,对根系生长表现出明显的促进作用。这可能与该菌首先具有较强的Pb耐受性,能在含Pb土壤中良好繁殖有关;其次,放线菌在繁殖时,可能会产生如抗生素、有机酸、氨基酸、维生素、酶等代谢产物,分枝状的菌丝体能够产生各种胞外水解酶[8],这些物质本身可刺激植物根系发育及养分吸收。此外,放线菌Act12可调整植物根域土壤微生态平衡,抑制有害微生物的生长,促进有益微生物的繁殖,改善微生物区系[7, 15]。以往的研究中放线菌Act12对多种作物如甜瓜、黄瓜等均表现出良好的促生效果[8, 14],进一步证实Act12可能是一种广谱的促生菌。然而,在Pb胁迫下放线菌Act12对黑麦草生长的影响没有报道,我们将进一步深入研究该菌在Pb胁迫下的促生机理。
植物抗氧化酶(POD、SOD、CAT)能够维持自由基在植物体内产生和清除的动态平衡,它们是维持和提高植物耐重金属胁迫的物质基础之一,SOD可以将有活性和有毒性的超氧自由基转化成H2O2,随后H2O2可被CAT和POD转化为H2O和O2而清除[16-17]。本研究中黑麦草CAT和POD活性随着Pb胁迫水平增加而降低,而SOD活性呈先增加后降低。这表明CAT和POD活性受到Pb胁迫的抑制,其活性降低主要由Pb胁迫增强引起,这种抑制作用导致了黑麦草体内受Pb胁迫产生超氧自由基的积累。在低浓度Pb( < 500 mg·kg-1)胁迫下,黑麦草的抗氧化系统可产生适应性诱导反应,Pb能激活SOD活性和促使SOD活性快速升高,以减缓或消除Pb污染引起的氧化胁迫,使黑麦草对铅胁迫产生了一定的耐受性;然而当Pb胁迫强度增加,Pb在黑麦草体内的积累超过一定量时,细胞内的抗氧化防御系统就遭到了破坏,SOD活性降低,其防御功能也会下降。这与刘慧芹等[18]对黑麦草,刘碧英等[19]对沿阶草受到铅胁迫后SOD活性变化的研究结果一致。
土壤加入放线菌后提高了Pb胁迫下黑麦草体内3种抗氧化酶活性,尤其是在高浓度Pb胁迫下(500~1000 mg·kg-1),放线菌的增强作用显著。其可能的作用机理是:放线菌的代谢产物含有有机酸、氨基酸等小分子化合物,能以与根系中游离态的Pb形成螯合物的方式解毒[20],或者放线菌的加入促进了Pb从黑麦草根系向地上部转移,来缓解Pb胁迫对根系的毒害作用,因此CAT和POD活性受Pb胁迫的抑制程度降低;此外,放线菌在促进黑麦草在Pb污染土中生长时,也可能提高了黑麦草自身对Pb的耐受性,增强了抗氧化酶系统,使3种抗氧化酶活性均提高。Li等[6]对水稻接种内生真菌(EF0801),Jebara等[21]对扁豆(Lens culinaris)联合接种3种细菌,在Pb污染土壤中,提高了植物体内3种抗氧化酶活性,与本研究结果一致。而阎岩等[22]报道,4%的Act12可显著提高丹参毛状根中活性氧的含量,对丹参毛状根生物量产生抑制作用,与本研究中Act12对黑麦草的作用结果相反。这可能与植物的种类和根际土壤环境有关。本研究Act12的加入促进了黑麦草根系生长,而黑麦草根系在Pb的刺激下有机酸的分泌量增加[23],这种弱酸性环境能缓解Pb胁迫下活性氧的积累;而丹参受Act12刺激,培养基中pH上升,表现为细胞外碱化,进而引起了细胞内活性氧的积累,这种积累诱导了丹参酮的合成。
本研究中,Pb胁迫水平越高,黑麦草根系中MDA积累越多。MDA是质膜过氧化损伤的产物,是反映逆境胁迫下细胞膜受伤害程度的一个重要指标,其含量的高低可反映出细胞质膜过氧化的水平,重金属离子浓度越高,MDA积累越多,对植物毒害效应越强[24]。放线菌加入缓解了植株膜脂过氧化,可能是因为放线菌增强了黑麦草根系抗氧化系统,对Pb胁迫产生的自由基的清除能力增强,中断了自由基链式反应,降低了细胞质膜氧化损伤。
植物根系是活跃的吸收器官和合成器官,根系活力是根系生理的主要指标之一,直接影响地上部的生长和营养状况及产量水平。本研究中,低水平Pb( < 500 mg·kg-1)胁迫对黑麦草根系有刺激作用,高水平Pb(1000 mg·kg-1)胁迫下根系活力降低。放线菌Act12加入土壤对提高根系活力有显著的作用。这可能与放线菌既能促进根系养分吸收,又能改善根际环境有关,如调整根域微生态环境[7];另外,与根系抗氧化系统的增强和MDA积累降低直接相关。已有研究表明,根系活力的增加对根系生长和提高根系对Pb的吸收能力具有重要的贡献[25]。
4 结论(1)随着土壤Pb胁迫水平的升高,黑麦草根分蘖数和根鲜重呈先增加后降低的趋势,而土壤接入放线菌Act12后,增加了黑麦草根分蘖和根鲜重,对根系生长有显著的促进作用。
(2)黑麦草根系抗氧化酶CAT和POD的活性随Pb胁迫水平的升高而呈降低趋势,而SOD活性在低水平Pb胁迫的增加可能是植物应对胁迫自身的应答机制。但土壤接入放线菌Act12后,通过提高抗氧化酶活性,清除了Pb胁迫所产生氧自由基,增强根系耐毒性。
(3)随着Pb胁迫水平的升高,黑麦草根系中MDA积累增加,放线菌Act12接入显著降低了MDA含量。放线菌接入提高了根系活力,是放线菌接入引起根系抗性生理增强的综合体现。
| [1] | Bidar G, Pruvot C, Garçon G, et al. Seasonal and annual variations of metal uptake, bioaccumulation, and toxicity in Trifolium repens and Lolium perenne growing in a heavy metal-contaminated field[J]. Environmental Science and Pollution Research , 2009, 16 (1) : 42–53. DOI:10.1007/s11356-008-0021-4 |
| [2] | Lou Y, Luo H, Hu T, et al. Toxic effects, uptake, and translocation of Cd and Pb in perennial ryegrass[J]. Ecotoxicology , 2013, 22 (2) : 207–214. DOI:10.1007/s10646-012-1017-x |
| [3] | 姚婧, 王友保, 李文良, 等. 黑麦草对土壤中Pb的富积作用及耐受性研究[J]. 水土保持通报 , 2008, 28 (2) : 17–21. YAO Jing, WANG You-bao, LI Wen-liang, et al. A study on Pb accumulation and tolerance of Lolium prenne L. in soil[J]. Bulletin of Soil and Water Conservation , 2008, 28 (2) : 17–21. |
| [4] | 沈高峰. 模拟酸雨和Pb复合胁迫对2种草坪草生长及抗氧化生理的影响[J]. 安徽农业科学 , 2012, 40 (22) : 11283–11286. SHEN Gao-feng. Effects of simulated acid rain and Pb combined stress on growth and antioxidative physiology of two kinds of turf grass[J]. Journal of Anhui Agriculture Science , 2012, 40 (22) : 11283–11286. |
| [5] | Jebara S H, Saadani O, Fatnassi I C, et al. Inoculation of Lens culinaris with Pb-resistant bacteria shows potential for phytostabilization[J]. Environmental Science and Pollution Research , 2015, 22 (4) : 2537–2545. DOI:10.1007/s11356-014-3510-7 |
| [6] | Li X, Bu N, Li Y, et al. Growth, photosynthesis and antioxidant responses of endophyte infected and non-infected rice under lead stress conditions[J]. Journal of Hazardous Materials , 2012, 213/214 : 55–61. DOI:10.1016/j.jhazmat.2012.01.052 |
| [7] | 张鸿雁, 薛泉宏, 申光辉, 等. 放线菌制剂对人参生长及根域土壤微生物区系的影响[J]. 应用生态学报 , 2013, 24 (8) : 2287–2293. ZHANG Hong-yan, XUE Quan-hong, SHEN Guang-hui, et al. Effects of actinomycetes agent on ginseng growth and rhizosphere soil microflora[J]. Chinese Journal of Applied Ecology , 2013, 24 (8) : 2287–2293. |
| [8] | Zhao J, Xue Q H, Shen G H, et al. Evaluation of Streptomyces spp. for biocontrol of gummy stem blight(Didymella bryoniae) and growth promotion of Cucumis melo L.[J]. Biocontrol Science and Technology , 2012, 22 (1) : 23–37. DOI:10.1080/09583157.2011.636481 |
| [9] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000 . BAO Shi-dan. Soil agro-chemistrical analysis[M]. Beijing: Agriculture Press, 2000 . |
| [10] | 曹书苗, 王文科, 王非, 等. 放线菌对干旱胁迫下黑麦草生长及抗氧化特性的影响[J]. 西北植物学报 , 2016, 36 (4) : 751–756. CAO Shu-miao, WANG Wen-ke, WANG Fei, et al. Effects of actinomycetes on the growth and antioxidative characteristics of perennial ryegrass under drought stress[J]. Acta Botanica Boreali-Occidentalia Sinica , 2016, 36 (4) : 751–756. |
| [11] | Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J]. European Journal of Biochemistry , 1974, 47 (3) : 469–474. DOI:10.1111/ejb.1974.47.issue-3 |
| [12] | Li Y, Zhang S, Jiang W, et al. Cadmium accumulation, activities of antioxidant enzymes, and malondialdehyde(MDA) content in Pistia stratiotes L[J]. Environmental Science and Pollution Research , 2013, 20 (2) : 1117–1123. DOI:10.1007/s11356-012-1054-2 |
| [13] | Polle A, Otter T, Seifert F. Apoplastic peroxidases and lignification in needles of Norway spruce(Picea abies L.)[J]. Plant Physiology , 1994, 106 (1) : 53–60. DOI:10.1104/pp.106.1.53 |
| [14] | 段春梅, 薛泉宏, 赵娟, 等. 放线菌剂对黄瓜幼苗生长及叶片PPO活性的影响[J]. 西北农业学报 , 2010, 19 (9) : 48–54. DUAN Chun-mei, XUE Quan-hong, ZHAO Juan, et al. Effects of antimicrobial actinomyces on growth and PPO activity in cucumber[J]. Acta Agriculture Boreali-occidentalis Sinica , 2010, 19 (9) : 48–54. |
| [15] | 何斐, 张忠良, 崔鸣, 等. 生防放线菌剂对魔芋根域微生物区系的影响[J]. 应用与环境生物学报 , 2015, 21 (2) : 221–227. HE Fei, ZHANG Zhong-liang, CUI Ming, et al. Effect of biocontrol actinomyces agents on microflora in the root-zone of Amorphophallus konjac K. Koch ex N. E. Br[J]. Chinese Journal of Environmental Biology , 2015, 21 (2) : 221–227. |
| [16] | 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报 , 2007, 23 (1) : 105–110. YIN Yong-qiang, HU Jian-bin, DENG Ming-jun. Latest development of antioxidant system and responses to stress in plant leaves[J]. Chinese Agricultural Science Bulletin , 2007, 23 (1) : 105–110. |
| [17] | Duman F, Kar M. Evaluation of effects of exposure conditions on the biological responses of Gammarus pulex exposed to cadmium[J]. International Journal of Environmental Science and Technology , 2015, 12 (2) : 437–444. DOI:10.1007/s13762-013-0425-7 |
| [18] | 刘慧芹, 韩巨才, 刘慧平, 等. 铅梯度胁迫对多年生黑麦草幼苗生理生化特性影响[J]. 草业学报 , 2012, 21 (6) : 57–63. LIU Hui-qin, HAN Ju-cai, LIU Hui-ping, et al. Influence of lead gradient stress on the physiological and biochemical characteristics of perennial ryegrass(Lolium perenne)seedlings[J]. Acta Prataculturae Sinica , 2012, 21 (6) : 57–63. |
| [19] | 刘碧英, 潘远智, 赵杨迪. 沿阶草不同叶片对土壤铅胁迫的生理生化响应[J]. 草业学报 , 2011, 20 (4) : 123–128. LIU Bi-ying, PAN Yuan-zhi, ZHAO Yang-di. Physiology & biochemical responses of different leaves of Ophiopogon bodinieri to soil lead stress[J]. Acta Prataculturae Sinica , 2011, 20 (4) : 123–128. |
| [20] | Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany , 2002, 53 (366) : 1–11. |
| [21] | Jebara S H, Saadani O, Fatnassi I C, et al. Inoculation of Lens culinaris with Pb-resistant bacteria shows potential for phytostabilization[J]. Environmental Science and Pollution Research , 2015, 22 (4) : 2537–2545. DOI:10.1007/s11356-014-3510-7 |
| [22] | 阎岩, 赵欣, 张顺仓, 等. 活性氧在密旋链霉菌Act12诱导丹参毛状根中丹参酮积累中的作用[J]. 中国中药杂志 , 2014, 39 (11) : 1985–1991. YAN Yan, ZHAO Xin, ZHANG Shun-cang, et al. Roles of reactive oxygen species in Streptomyces pactum Act12-induced tanshinone production in salvia miltirrhiza hairy roots[J]. China Journal of Chinese Materia Medica , 2014, 39 (11) : 1985–1991. |
| [23] | 乔冬梅, 庞鸿宾, 齐学斌, 等. 黑麦草分泌有机酸的生物特性对铅污染修复的影响[J]. 农业工程学报 , 2011, 27 (12) : 195–199. QIAO Dong-mei, PANG Hong-bin, QI Xue-bin, et al. Effect of biological nature of organic acid exudation from ryegrass on phytoremediation of lead pollution[J]. Transactions of the CSAE , 2011, 27 (12) : 195–199. |
| [24] | Li Y, Zhang S, Jiang W, et al. Cadmium accumulation, activities of antioxidant enzymes, and malondialdehyde(MDA) content in Pistia stratiotes L[J]. Environmental Science and Pollution Research , 2013, 20 (2) : 1117–1123. DOI:10.1007/s11356-012-1054-2 |
| [25] | Islam E, Yang X, Li T, et al. Effect of Pb toxicity on root morphology, physiology and ultrastructure in the two ecotypes of Elsholtzia argyi[J]. Journal of Hazardous Materials , 2007, 147 (3) : 806–816. DOI:10.1016/j.jhazmat.2007.01.117 |
 2016, Vol. 35
2016, Vol. 35