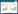文章信息
- 周丹丹, 梁妮, 李浩, 张迪, 吴敏, 潘波
- ZHOU Dan-dan, LIANG Ni, LI Hao, ZHANG Di, WU Min, PAN Bo
- 小分子有机酸对生物炭吸附Cu(Ⅱ)的影响
- Effect of low molecular weight organic acids on Cu(Ⅱ) adsorption by biochars
- 农业环境科学学报, 2016, 35(10): 1923-1930
- Journal of Agro-Environment Science, 2016, 35(10): 1923-1930
- http://dx.doi.org/10.11654/jaes.2016-0376
文章历史
- 收稿日期: 2016-03-23
生物炭(Biochar)是由生物质在完全或部分缺氧状态下热解(通常 < 700 ℃)产生的一类含碳量较高、比表面积大、孔隙度丰富及高度芳香化的固态物质。它可以通过络合作用、沉淀作用、离子交换作用和阳离子-π作用等对重金属(如镉、铜、铅、铬等)产生强的吸附能力[1-2]。因此,生物炭作为一种新型环保吸附剂,在重金属污染治理与修复方面具有大规模使用的潜力。目前大多数研究只关注于在特定条件下生物炭对重金属的吸附特征及机制,忽视了土壤环境条件的影响[3]。土壤环境尤其是根际土壤[4]含有大量的小分子有机酸(LMWOAs,分子量 < 250的有机酸),其为一类非常活泼的含羧基化合物,是土壤环境中常见的重要的有机配体,这些LMWOAs一方面可以与重金属络合,另一方面可在生物炭上吸附,既可能促进,也可能抑制重金属在生物炭上的吸附[5-6]。然而,促进和抑制的机制如何?什么情况下促进或者抑制重金属的吸附?这些问题还亟待研究解决。
我国农业生物质资源丰富,花生壳产量每年约180万t[7],除少量用作粗饲料外,大部分被烧掉或直接扔掉,既浪费资源,又污染环境。此外,我国是木材及木制品加工大国,但木材的综合利用率低,每年产生采伐剩余物约1.09亿t、木材加工剩余物约0.42亿t、木材产品抛弃物约0.6亿t[8],造成林业资源浪费的同时也污染环境。生物炭技术为这些生物质资源的浪费及其引起的环境问题提供了有效解决途径。因此,本研究选择花生壳和松木屑为生物质原料制备生物炭,同时以植物根系分泌物中常见且含量较多的草酸(二元酸)和柠檬酸(三元酸)为代表性LMWOAs,通过生物炭对草酸和柠檬酸等温吸附试验、草酸和柠檬酸影响生物炭吸附铜的试验,研究LMWOAs影响生物炭吸附重金属的机制,有助于揭示生物炭对重金属在根际土壤中迁移、转化规律的影响。
1 材料与方法 1.1 生物炭本研究利用花生壳(PS,取自云南省昆明市干货市场)和松木屑(PC,取自云南省昆明市某木材加工厂)为原料,采用限氧升温炭化法[9],于200、300、400、500 ℃在马弗炉中热解4 h制得生物炭。200、300、400、500 ℃条件下制备的花生壳生物炭分别标记为PS2、PS3、PS4、PS5;松木生物炭分别标记为PC2、PC3、PC4、PC5。
分别称取各生物炭(10 g)于聚乙烯瓶中,用100 mL 1 mol·L-1 HCl[10]溶液冲洗,过滤,重复4次,每次酸作用时间约为30 min;再用100 mL混合酸液(1 mol·L-1 HCl和1 mol·L-1 HF)冲洗,过滤,重复4次,每次酸作用时间为4 h[11];最后用去离子水洗涤至pH稳定后于烘箱中60 ℃下烘干,研磨过0.25 mm(60目筛),储存于干燥器中备用。
利用元素分析仪(vario MICRO cube,Elementar,德国)测定生物炭中C、H、O和N元素含量,通过全自动物理化学吸附仪(ASAP2020M,Micromeritics,美国)利用N2测定生物炭比表面积SBET。生物炭中水溶性K+、Ca2+、Mg2+利用火焰原子吸收光谱仪(FAAS)(Z-2000,Hitachi,日本)测定[12],水溶性SO42-和PO43-利用高效液相色谱仪(HIC-20Asuper,SHIMADZU,日本)测定[12]。生物炭样品与KBr充分研磨混合并压片,用傅里叶红外光谱(Varian640-IR)进行测定分析,扫描区域为4000~400 cm-1,分辨率4 cm-1。pH用pH计(AB15,Fisher Scientific,美国)测定[13]。灰分含量采用灼烧法测定[14]。
1.2 吸附实验方法 1.2.1 吸附质储备液配置采用Cu(NO3)2·3H2O在0.01 mg·L-1 NaNO3溶液中配制浓度为1000 mg·L-1的Cu(Ⅱ)储备溶液,其中Cu(NO3)2·3H2O为优级纯。
1.2.2 吸附等温线按照1 g·L-1的固液比,称取生物炭8 mg于8 mL螺口玻璃样品瓶中,分别加入8 mL浓度为0.5~50 mg·L-1的LMWOAs溶液,且含有0.01 mol·L-1 NaNO3作为背景电解质,用0.1 mol·L-1 HNO3或者0.1 mol·L-1 NaOH溶液调节溶液pH至(4.0±0.05),根据预试验吸附动力学平衡时间,于25 ℃下以120 r·min-1振荡48 h,悬浊液以2500 r·min-1离心10 min,过0.45 μm微孔滤膜,采用高效液相色谱法测定上清液中LMWOAs的含量。平行处理2个,并作空白对照。
根据文献中的方法[15],并对其进行修正用以测定LMWOAs含量。
高效液相色谱仪类型及色谱条件:Agilent 1200型高效液相色谱仪配备紫外检测器;色谱柱为C18反相柱(5 μm,4.6 mm×250 mm);柱温为25 ℃;流动相为0.02 mol·L-1 KH2PO4(用H3PO4调至pH2.85):甲醇=80:20;流速为1 mL·min-1;进样量为20 μL。草酸的检测波长为215 nm,柠檬酸的检测波长为210 nm。
通过方程(1)计算生物炭对LMWOAs的吸附量。
 (1)
(1) 式中:Qe为生物炭对有机酸的吸附量,mg·kg-1;C0和Ce分别为有机酸初始和吸附平衡时的浓度,mg·L-1;V为溶液体积,L;m为生物炭质量,kg。
吸附等温线以Langmuir和Freundlich模型拟合,公式如下:
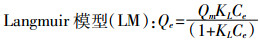 (2)
(2) 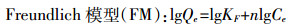 (3)
(3) 式中:Qe和Qm分别为固体平衡吸附量和最大吸附量,mg·kg-1;Ce为液相平衡浓度,mg·L-1;KL为Langmuir模型吸附系数,L·mg-1;KF为Freundlich模型吸附系数,(mg·kg-1)·(mg·L-1)n;n为Freundlich常数。
由于数据点的数量和模型中系数的数量不同,常用的确定系数r2不能直接比较结果[16]。通过式(4)将r2转化为radj2以进行比较:
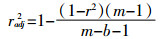 (4)
(4) 式中:m是用于拟合的数据点数量;b是方程中系数的数量。
1.2.3 LMWOAs对铜吸附的影响土壤中LMWOAs浓度范围一般在10-7~10-4 mg·L-1之间,根际土壤环境溶液中LMWOAs则更高。如刘博等[17]研究表明,在盛花期越橘根系分泌物中草酸最高可达51.25 mg·L-1。因此,本研究中草酸和柠檬酸的试验浓度范围均设置为0.5~50 mg·L-1。
按照1 g·L-1的固液比,称取8 mg生物炭于8 mL螺口玻璃样品瓶中,分别加入8 mL浓度为0.5~50 mg·L-1的LMWOAs(草酸或柠檬酸)和含5 mg·L-1 Cu(Ⅱ)的混合溶液[每个吸附曲线包括8个有机酸浓度,且每个有机酸浓度下含5 mg·L-1 Cu(Ⅱ)],同时含有0.01 mol·L-1 NaNO3的背景电解质,用0.1 mol·L-1 HNO3或者0.1 mol·L-1 NaOH溶液调节溶液的pH值到4.0±0.05,于25 ℃下以120 r·min-1振荡48 h,悬浊液以2500 r·min-1离心10 min,过0.45 μm微孔滤膜,利用火焰原子吸收光谱仪(FAAS)(Z-2000,Hitachi,日本)测定滤液中Cu(Ⅱ)的浓度。平行处理2个,并作空白对照。
2 结果与讨论 2.1 生物质及其制备的生物炭特性生物质(花生壳和松木屑)及其制备的生物炭物理化学性质见表 1。随热解温度升高,生物炭C含量、比表面积(SBET)增大,而O和H含量逐渐降低,说明高温生物炭的碳化程度更高[18];同时,生物炭的O/C、(O+ N)/C和H/C原子比逐渐降低,表明高温生物炭含氧官能团较少,芳香结构更完备[19]。随着热解温度的升高,生物炭中水溶性阳离子(K+、Ca2+和Mg2+)和阴离子(SO42-和PO43-)含量逐渐减少,说明热解温度越高越不利于生物炭中矿物组分的溶出。这是由高温生物炭中难溶钙、镁晶体矿物(如:焦磷酸钙、方解石、碱式硫酸镁等)的形成决定的。生物炭pH随热解温度升高而升高,则是由热解温度升高使生物炭芳香化增强而导致的。
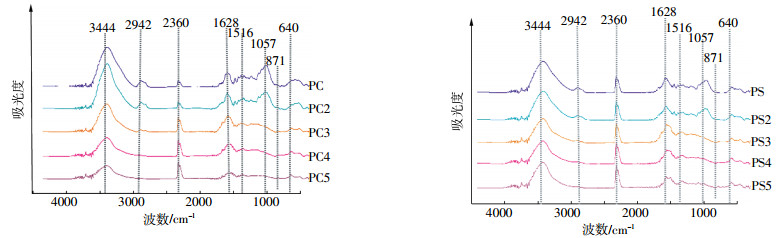
生物质及其制备的生物炭红外谱图如图 1所示。生物质及其制备的生物炭的表面含氧官能团种类差别不大,但其所含的不同含氧官能团的吸光度却略有差别,表明生物质原料及制备的生物炭中不同含氧官能团的含量存在差异。同种生物质原料,随着热解温度的变化,生物炭含氧官能团的种类和数量均发生变化。随着热解温度的升高,生物炭中位于波数3800~3200 cm-1的羟基伸缩振动峰减小,尤其是在高温条件下;当温度超过300 ℃后,脂肪族CH2吸收峰(2942、2904 cm-1)消失,而芳香族CH振动峰(640~874 cm-1)则逐渐明显,表明热解温度越高,生物炭所含的非极性脂肪族官能团越少,芳香性越强[20];位于波数1628 cm-1的羧基和酮类中的C=O或芳环C=C伸缩振动峰降低,这是因为羧基和酮类中的C=O容易被热解生成气体或液体副产物[21];C=C(1516、1512 cm-1)伸缩振动峰逐渐降低,当热解温度超过300 ℃后,C=C伸缩振动峰消失;超过200 ℃后,生物炭中PO43-(1057 cm-1)伸缩振动峰消失[22]。
|
| 图 1 生物质及其制备生物炭的傅立叶红外光谱图 Figure 1 Stacked FTIR spectra of biochars produced from biomass and their biochar |
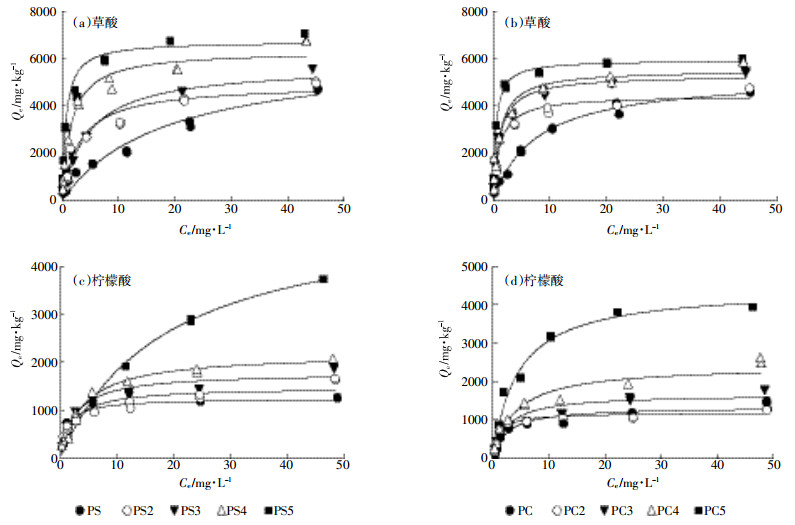
生物质及其制备生物炭对LMWOAs的Langmuir模型和Freundlich模型拟合吸附等温线如图 2所示,相应的拟合参数列于表 2。LM模型对生物质及其制备生物炭吸附LMWOAs数据的拟合可调可决系数均为0.90~0.99,而FM模型对其拟合的可调可决系数为0.72~0.99,绝大部分在0.91以下。因此,Langmuir模型更适合反应吸附剂(生物质及其制备的生物炭)对LMWOAs的吸附。花生壳生物炭对草酸或柠檬酸的吸附容量大于松木生物炭,如PC3对草酸和柠檬酸的吸附容量分别为(5299±634)mg·kg-1和(1738±326)mg·kg-1;而PS3对草酸和柠檬酸的吸附容量分别为(5697±899)mg·kg-1和(1784±143)mg·kg-1。这是由于花生壳生物炭与松木生物炭相比,表面积更大,孔隙度更为丰富,能够为LMWOAs提供更多的吸附位点。随着热解温度的升高,生物炭对LMWOAs的吸附容量增加(表 2)。这也与高温生物炭具有更大的比表面积和更为丰富的孔隙度有关[15]。
|
| 图 2 生物质及其制备生物炭对LMWOAs的吸附等温线 Figure 2 Adsorption isotherms of LMWOAs on biomass and their biochars |
 |
另外,不同吸附质由于吸附机理的不同在相同生物炭上展现出不同的吸附行为。不同LMWOAs浓度(0.5、50 mg·L-1)下,生物炭对LMWOAs的单点吸附系数(Kd,Qe /Ce)如表 2。随着LMWOAs浓度的增加,Kd明显下降,表明生物炭对LMWOAs的吸附为非线性吸附。此外,生物炭对草酸的吸附容量大于柠檬酸(表 2),如PC3对草酸的吸附容量为(5299±634)mg·kg-1,而对柠檬酸吸附容量为(1738±326)mg·kg-1。这与两者分子量及摩尔体积大小有关:柠檬酸分子量为192.14,分子摩尔体积为109 cm3·mol-1;而草酸分子量为90.03,分子摩尔体积为50.8 cm3·mol-1,且草酸分子为平面构型[23],使得草酸空间位阻较小易进入生物炭孔隙内被吸附[15]。
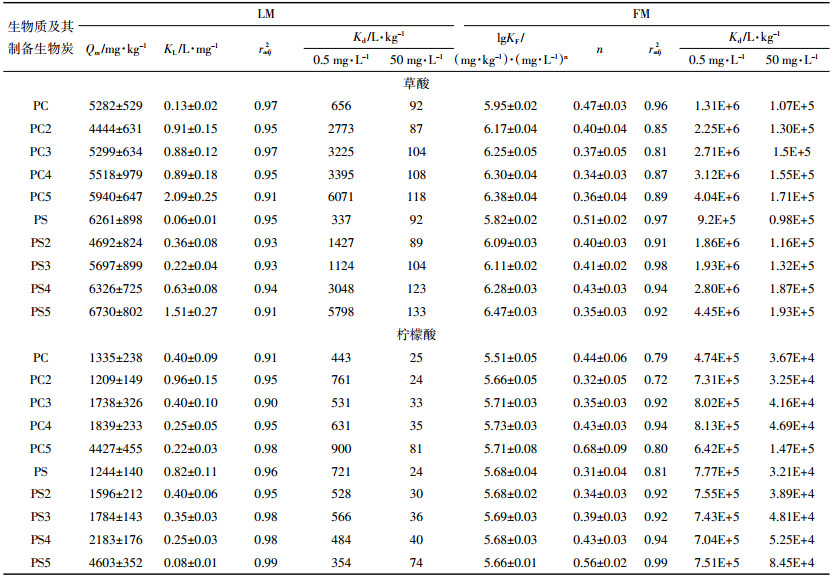
2.3 LMWOAs对生物炭吸附Cu(Ⅱ)的影响 2.3.1 柠檬酸对生物炭吸附Cu(Ⅱ)的影响柠檬酸浓度从0.5 mg·L-1增加到50 mg·L-1时,花生壳生物炭和松木生物炭对Cu(Ⅱ)的吸附量先增加后减少(图 3)。如柠檬酸浓度从0增加到3.61 mg·L-1时PC2对Cu(Ⅱ)的吸附量由(791±1)mg·kg-1增至(975±4)mg·kg-1,而当浓度继续增加到50 mg·L-1时,其吸附量降至(586±4)mg·kg-1,拐点出现在3.61 mg·L-1附近;同样地,柠檬酸浓度从0增加到25.85 mg·L-1时PS2对Cu(Ⅱ)的吸附量由(1165±14)mg·kg-1增至(3432±5)mg·kg-1,而当浓度继续增加到50 mg·L-1时,其吸附量下降至(1588±1)mg·kg-1,拐点出现在25.85 mg·L-1附近。
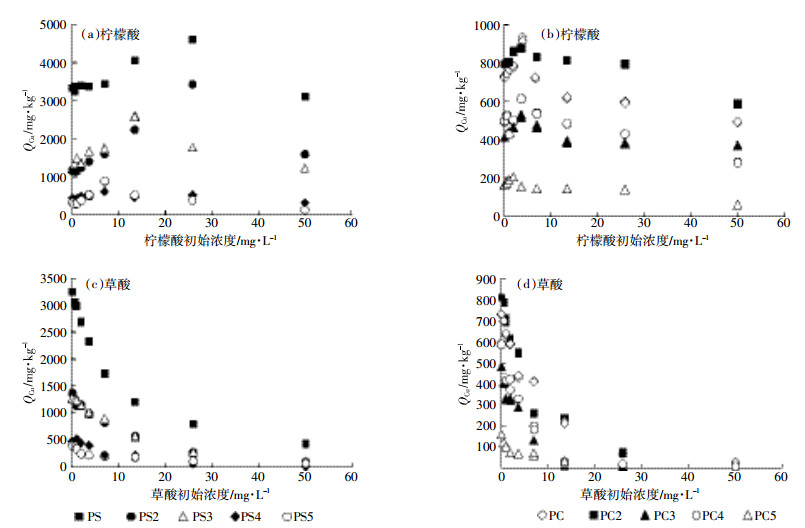
|
| 图 3 LMWOAs对生物炭吸附Cu(Ⅱ)的影响 Figure 3 Effect of LMWOAs on adsorption of Cu(Ⅱ) by biochar |
由此可知,低浓度柠檬酸促进生物炭对Cu(Ⅱ)的吸附,而高浓度柠檬酸抑制生物炭对Cu(Ⅱ)的吸附,这与柠檬酸对Cu2+ [24]在土壤上吸附的影响一致。柠檬酸对Cu(Ⅱ)吸附的促进,可能是因为柠檬酸在生物炭上的吸附为Cu(Ⅱ)提供了更多羧基或羟基吸附位点。有研究者认为是柠檬酸在生物炭上的吸附饱和以后,液相中大量的柠檬酸与Cu(Ⅱ)的络合,使Cu(Ⅱ)在固体颗粒上的吸附降低[25],从而出现高浓度柠檬酸抑制生物炭吸附Cu(Ⅱ)。如果是这样,则Cu(Ⅱ)吸附的拐点应该与柠檬酸在生物炭上饱和吸附的浓度有关。但是从本研究结果来看,这一推测与现象并不匹配,比如,PS5上Cu(Ⅱ)吸附的拐点在8 mg·L-1左右,但PS5上柠檬酸吸附饱和发生在50 mg·L-1以上;而且,生物炭烧制温度越高,拐点发生的浓度越低,与柠檬酸饱和吸附发生的浓度恰恰相反(图 2c)。因此,在本试验体系内,Cu(Ⅱ)吸附的抑制可能主要是由于大量柠檬酸的吸附占据了生物炭内部孔隙,或者堵塞了Cu(Ⅱ)进入生物炭内部孔隙的通道,而Zhu等[26]利用柠檬酸对生物炭进行改性的研究结果表明柠檬酸能够堵塞生物炭部分孔隙。
此外,由图 3可知在相同的实验条件下,花生壳(PS)及花生壳生物炭对Cu(Ⅱ)的平衡吸附量均远大于相同温度制备的松木屑(PC)及松木屑生物炭,如PS>>PC、PS3>>PC3等。这可能是由于花生壳及花生壳生物炭的灰分大于相同温度制备的松木屑及松木屑生物炭(表 1)。
2.3.2 草酸对生物炭吸附Cu(Ⅱ)的影响草酸浓度在0.5~50 mg·L-1范围内,松木生物炭和花生壳生物炭对Cu(Ⅱ)的吸附量随着草酸浓度的增加而减少(图 3),如草酸浓度从0.5 mg·L-1增加到50 mg·L-1时PC3对Cu(Ⅱ)的吸附量由(405±5)mg·kg-1降至(9.71±0.02)mg·kg-1,而PS3对Cu(Ⅱ)的吸附量由(1257±9)mg·kg-1降至100 mg·kg-1,且均低于未加入草酸时松木生物炭和花生壳生物炭对Cu(Ⅱ)的吸附量。
由此可知,在实验浓度范围内,草酸对生物炭吸附Cu(Ⅱ)具有明显的抑制作用,与草酸对Al在土壤上吸附影响较为一致[27]。这可以从两方面来解释:一方面可能是由于草酸的pKa1=1.25,pKa2=4.29,在试验pH条件下草酸以HC2O4-和C2O42-形态为主,液相中的草酸与Cu(Ⅱ)的强烈络合形成稳定的络合物,而草酸仅含的2个活性基团(羧基),与铜络合后没有多余的活性基团与生物炭上表面官能团结合;另一方面可能是固相吸附的草酸与Cu(Ⅱ)在吸附位点上的竞争,这个竞争作用可能发生于生物炭表面的含氧官能团,也可能发生于生物炭的内部孔隙[28]。Li等[28]研究结果表明吸附质中的羧基可以与纳米碳管上含氧官能团形成氢键。生物炭与纳米碳管均为碳质吸附剂,其表面亦存在含氧官能团(如-OH、-COOH等),能够与HC2O4-和C2O42-形成氢键,从而竞争Cu(Ⅱ)在生物炭上的吸附位点。同时,在试验pH条件下,以分子态存在的草酸能够与生物炭表面含氧官能团(如-OH)发生反应。这与Feng等[29]研究结果较为一致,草酸改性生物炭的TGA-DTG光谱分析结果表明,草酸分子能够与生物炭表面含氧官能团(如-OH)发生反应。
根据两个LMWOAs对生物炭吸附Cu(Ⅱ)的影响分析,绘制出LMWOAs影响生物炭吸附Cu(Ⅱ)机制的示意图,如图 4所示。LMWOAs影响生物炭吸附Cu(Ⅱ)机制主要包括以下3种:①LMWOAs含有3个或3个以上的活性基团(如羧基和羟基),在生物炭上的吸附为Cu(Ⅱ)提供了更多羧基或羟基吸附位点,促进生物炭对Cu(Ⅱ)的吸附;② LMWOAs含有2个活性基团(羧基或羟基),与溶液中的铜离子形成稳定络合物且没有多余的活性基团被生物炭吸附,从而抑制生物炭对Cu(Ⅱ)的吸附;③LMWOAs能堵塞生物炭中部分孔隙[26, 29],降低生物炭对Cu(Ⅱ)吸附量。
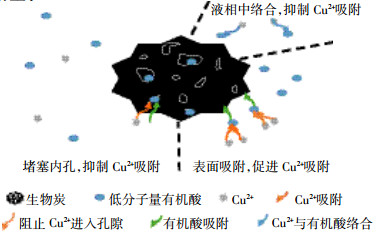
|
| 图 4 LMWOAs影响生物炭吸附Cu(Ⅱ)机制示意图 Figure 4 The schematic graph of Cu(Ⅱ) adsorption on biochars as affected by LMWOAs |
(1)生物炭对LMWOAs(草酸和柠檬酸)吸附等温线可以用Langmuir模型较好拟合,其可调可决系数均在0.90~0.99。同时,生物质原料和热解温度会影响生物炭对LMWOAs的吸附。随着热解温度的升高,生物炭对LMWOAs吸附量增加。
(2)LMWOAs种类和浓度影响生物炭对Cu(Ⅱ)的吸附。在试验浓度范围内,柠檬酸对生物炭吸附Cu(Ⅱ)既有促进作用又有抑制作用,柠檬酸浓度在10 mg·L-1以下时,促进了生物炭对Cu(Ⅱ)的吸附,较高浓度时抑制了吸附;而草酸对其影响始终为抑制作用。
| [1] | Zheng H, Wang Z, Zhao J, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures[J]. Environmental Pollution , 2013, 181 : 60–67. DOI:10.1016/j.envpol.2013.05.056 |
| [2] | 李力, 陆宇超, 刘娅, 等. 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报 , 2012, 31 (11) : 2277–2283. LI Li, LU Yu-chao, LIU Ya, et al. Adsoption mechanisms of cadmiun(Ⅱ), on biochars derived from corn straw[J]. Journal of Agro-Environment Science , 2012, 31 (11) : 2277–2283. |
| [3] | Beesley L, Moreno-Jiménez E, Gomez-Eyles J L, et al. A review of biochars, potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution , 2011, 159 (12) : 3269–3282. DOI:10.1016/j.envpol.2011.07.023 |
| [4] | Jones D L, Dennis P G, Owen A G, et al. Organic acid behavior in soils-misconceptions and knowledge gaps[J]. Plant Soil , 2003, 248 (1) : 31–41. |
| [5] | 孟昭福, 张院民, 邓晶. 草酸对不同土壤中Cd、Zn吸附及其交互作用影响的初步研究[J]. 农业环境科学学报 , 2011, 30 (11) : 2265–2270. MENG Zhao-fu, ZHANG Yuan-min, DENG Jing. Effects of oxalic acid on the adsorption and interation of Cd2+, Zn2+ in different soils[J]. Journal of Agro-Environment Science , 2011, 30 (11) : 2265–2270. |
| [6] | 吴成, 张晓丽, 李关宾. 低分子量有机酸对黑碳吸附Pb、Cd的影响[J]. 农业环境科学学报 , 2006, 25 (5) : 1383–1387. WU Cheng, ZHANG Xiao-li, LI Guan-bin. Effect of low molecular weight organic acids on Pb2+ and Cd2+ adsorption of black carbon[J]. Journal of Agro-Environment Science , 2006, 25 (5) : 1383–1387. |
| [7] | 刘德军, 邵志刚, 高连兴. 花生壳挤压碎裂力学特性实验[J]. 沈阳农业大学学报 , 2012, 43 (1) : 81–84. LIU De-jun, SHAO Zhi-gang, GAO Lian-xing. Experimental research of the peanut shell pulverizing mechanical characteristics[J]. Journal of Shenyang Agricultural University , 2012, 43 (1) : 81–84. |
| [8] | 徐杨, 杜祥哲, 齐英杰, 等. 浅析木材加工剩余物理的利用途径[J]. 林产工业 , 2015, 42 (5) : 40–44. XU Yang, DU Xiang-zhe, QI Ying-jing, et al. Utilization of wood processing residues[J]. China Forest Products Industry , 2015, 42 (5) : 40–44. |
| [9] | Chun Y, Sheng G, Chiou C, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology , 2004, 38 (17) : 4649–4655. |
| [10] | Chen B L, Zhou D D, Zhu L Z. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science & Technology , 2008, 42 (2) : 5137–5143. |
| [11] | Lu J H, Li J F, Li Y M, et al. Use of rice straw biochar simultaneously as the sustained release carrier of herbicides and soil amendment for their reduced leaching[J]. Journal of Agricultural and Food Chemistry , 2012, 60 (26) : 6463–6470. DOI:10.1021/jf3009734 |
| [12] | Cao X, Harris W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology , 2010, 101 (14) : 5222–5228. DOI:10.1016/j.biortech.2010.02.052 |
| [13] | Park J, Lee Y, Ryu C, et al. Slow pyrolysis of rice straw:Analysis of products properties, carbon and energy yields[J]. Bioresource Technology , 2014, 155 : 63–70. DOI:10.1016/j.biortech.2013.12.084 |
| [14] | Charrua A B, WANG Hang, LÜ Chun-xin, et al. Adsorption properties of pinus derived biochar for atrazine at different temperature[J]. Ecology and Environmental Sciences , 2015, 24 (3) : 505–510. |
| [15] | 宋金凤, 崔晓阳. 暗棕壤中低分子有机酸的吸附与生物降解研究[J]. 土壤通报 , 2007, 38 (6) : 1118–1122. SONG Jin-feng, CUI Xiao-yang. Sorption and biodegradation behavior of organic acids with low molecular weight in dark brown forest soils[J]. Chinese Journal of Soil Science , 2007, 38 (6) : 1118–1122. |
| [16] | Pan B, Xing B S. Adsorption kinetics of 17 alpha-ethinyl estradiol and bisphenol A on carbon nanomaterials:I. Several concerns regarding pseudo-first order and pseudo-second order models[J]. Journal of Soils and Sediments , 2010, 10 (5) : 838–844. DOI:10.1007/s11368-009-0184-8 |
| [17] | 刘博, 李亚东, 吴林, 等. 不同基质条件下越橘根系分泌物中有机酸组分与含量的分析[J]. 吉林农业大学学报 , 2009, 31 (5) : 581–583. LIU Bo, LI Ya-dong, WU Lin, et al. Effect of applying different substrates on ingredient and content of organic acid in blueberry root exudates[J]. Journal of Jilin Agricultural University , 2009, 31 (5) : 581–583. |
| [18] | Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon(biochar)[J]. Environmental Science Technology , 2010, 44 (4) : 1247–1253. DOI:10.1021/es9031419 |
| [19] | Wang Z Y, Zheng H, Luo Y, et al. Characterization and influence of biochars on nitrous oxide emission from agricultural soil[J]. Environmental Pollution , 2013, 174 : 289–296. DOI:10.1016/j.envpol.2012.12.003 |
| [20] | Zheng H, Wang Z Y, Zhao J, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures[J]. Environmental Pollution , 2013, 181 : 60–67. DOI:10.1016/j.envpol.2013.05.056 |
| [21] | Lu H L, Zhang W H, Yang Y X, et al. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar[J]. Water Research , 2012, 46 (3) : 854–862. DOI:10.1016/j.watres.2011.11.058 |
| [22] | Bustin R M, Guo Y. Abrupt changes(jumps) in reflectance values and chemical compositions of artificial charcoals an inertinite in coals[J]. International Journal of Coal Geology , 1999, 38 (3/4) : 237–260. |
| [23] | 耿志远, 王冬梅, 薄丽丽, 等. 草酸分子结构与性质的量子化学计算研究[J]. 西北师范大学学报(自然科学版) , 2005, 41 (3) : 58–62. GENG Zhi-yuan, WANG Dong-mei, BO Li-li, et al. Quantum study on configurations and charateristics of oxalic acid[J]. Jounal of Northwest Normal University(Natural Science) , 2005, 41 (3) : 58–62. |
| [24] | 胡红青, 刘华良, 贺纪正. 几种有机酸对恒电荷和可变电荷土壤吸附Cu2+的影响[J]. 土壤学报 , 2005, 42 (2) : 232–237. HU Hong-qing, LIU Hua-liang, HE Ji-zheng. effects of several organic acids on copper adsorption by soils with permanent and variable charges[J]. Acta Pedologica Sinica , 2005, 42 (2) : 232–237. |
| [25] | 高彦征, 贺纪正, 凌婉婷. 有机酸对土壤中镉的解吸及影响因素[J]. 土壤学报 , 2003, 40 (5) : 731–737. GAO Yan-zheng, HE Ji-zheng, LING Wan-ting. Effect of organic acids on cadium desorption from soils[J]. Acta Pedologica Sinica , 2003, 40 (5) : 731–737. |
| [26] | Zhu B, Fan T X, Zhang D. Adsorption of copper ions from aqueous solution by citric acid modified soybean straw[J]. Journal of Hazardous Materials , 2008, 153 (1/2) : 300–308. |
| [27] | 徐仁扣, 姜军. 低分子量有机酸对可变电荷土壤吸附铝的影响机制[J]. 生态环境 , 2005, 14 (2) : 253–256. XU Ren-kou, JIANG Jun. Effect mechanisms of low-molecular-weight organic acids on aluminum adsorption by variable charge soils[J]. Ecology and Environment , 2005, 14 (2) : 253–256. |
| [28] | Li X Y, Pignatello J J, Wang Y Q, et al. New insight into adsorption mechanism of ionizable compounds on carbon nanotubes[J]. Environmental Science & Technology , 2013, 47 (15) : 8334–8341. |
| [29] | Feng Y, Dionysiou D D, Wu Y H, et al. Adsorption of dyestuff from aqueous solutions through oxalic acid-modified swede rape straw:Adsorption process and disposal methodology of depleted bioadsorbents[J]. Bioresource Technology , 2013, 138 : 191–197. DOI:10.1016/j.biortech.2013.03.146 |
 2016, Vol. 35
2016, Vol. 35