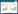文章信息
- 乔铖, 任磊, 贾阳, 樊双虎, 王俊欢, 闫艳春
- QIAO Cheng, REN Lei, JIA Yang, FAN Shuang-hu, WANG Jun-huan, YAN Yan-chun
- 节杆菌(Arthrobacter sp.)CN2对对硝基苯酚的趋化性研究
- Chemotaxis of Arthrobacter sp. CN2 towards p-nitrophenol
- 农业环境科学学报, 2016, 35(10): 1945-1952
- Journal of Agro-Environment Science, 2016, 35(10): 1945-1952
- http://dx.doi.org/10.11654/jaes.2016-0528
文章历史
- 收稿日期: 2016-04-17
对硝基苯酚(p-nitrophenol,PNP)作为重要的一类环境污染物,由于其水溶性好、极性强且稳定性良好[1],可在生产和使用过程中进入空气、土壤以及水体系统中,并可长期在生物体内富集,从而对微生物、动植物以及人体健康产生巨大危害[2]。因此,美国环保署(US-EPA)已将其在自然水体中的浓度限制在10 ng·L-1以下[3]。修复该类物质所造成的环境污染问题已成为近年来亟待解决的热点[4-7]。
趋化性(Chemotaxis)是具有运动功能的微生物感应并对某类化学物质产生趋向或趋离的一种定向移动行为,是由于环境变化而引起的一种响应能力[8]。多数情况下,正趋化物(Positive chemotant)因其可为细菌提供碳源、氮源以及能源而促进自身的降解代谢,负趋化物(Negative chemotant)则由于对菌体的生长生活有毒害作用而使其发生趋离作用[9]。研究表明,具有运动能力的细菌对其可降解的化合物绝大多数都表现出明显的趋化性,意味着微生物的趋化性可能是其对环境污染物降解的一个重要依据[10-12]。因此,对趋化性的研究能为微生物在环境修复中的实际应用提供有效的理论基础。细菌趋化性的研究方法主要有密度趋化性[13]、游动平板趋化性[14-16]、土壤趋化性[16]以及毛细管趋化性[5, 17]等。
本研究以可彻底降解对硝基苯酚的节杆菌(Arthrobacter sp.)CN2为材料,对以对硝基苯酚为底物时菌株的趋化性进行定性与定量分析,测定菌株在模拟土壤原位修复过程中对对硝基苯酚的降解能力,并分析修复过程中生物与非生物因素对降解的影响,以期为细菌趋化性研究及其在环境修复中的应用提供理论参考。
1 材料与方法 1.1 菌株来源供试菌株为本课题组分离并保藏的对硝基苯酚降解菌节杆菌CN2,菌株分离自常年生产有机磷农药的山东华阳农药厂(山东,泰安)废水处理池中的活性淤泥。菌株的16S rRNA基因序列已递交GenBank,登录号为EU266494[18]。
1.2 药品与仪器研究所用的对硝基苯酚(分析纯,天津市凯通化学试剂有限公司)用无菌水溶解配制成浓度为2×104 mg·L-1母液,避光储存备用。甲醇和乙腈为色谱纯级(美国,Fisher公司),其余药品为分析纯级(国药集团)。
所用仪器主要有Agilent 1200高效液相色谱仪(美国,Agilent公司),S-3000N扫描电镜(日本Hitachi公司),Supere G6R全自动菌落分析仪(杭州迅数科技有限公司)。点样毛细管(上海欣鹏玻璃仪器有限公司)规格:内径0.2 mm,长度100 mm。
1.3 培养基及细菌悬浮液的制备LB培养基:蛋白胨10 g·L-1,酵母粉5 g·L-1,氯化钠10 g·L-1,琼脂15 g·L-1(用于固体培养基),121 ℃灭菌30 min。
BM培养基:(NH4)2SO4 2.0 g·L-1,MgSO4 0.2 g·L-1,CaCl2·2H2O 0.01 g·L-1,FeSO4·7H2O 0.001 g·L-1,Na2HPO4·12H2O 1.5 g·L-1,KH2PO4 1.5 g·L-1,琼脂15 g·L-1(用于固体培养基),pH 7.2,121 ℃灭菌30 min。
细菌悬浮液制备:CN2菌株在LB培养基30 ℃下置于摇床中180 r·min-1培养至对数期,取1 mL菌液5000 r·min-1离心10 min,菌体用磷酸盐缓冲液(pH 7.0)冲洗3次后用去离子水重悬浮使其终浓度为109 cfu·mL-1,菌悬液在4 ℃下储存备用不超过24 h。
1.4 高效液相色谱法(HPLC)验证底物降解取100 μL上述菌液接入10 mL BM培养基中(含100 mg·L-1的对硝基苯酚)作为处理组,以含有相同浓度对硝基苯酚的BM培养基但不接菌作为对照,在180 r·min-1、30 ℃条件下培养72 h后取样检测对硝基苯酚的浓度。样品经0.2 μm孔径的滤膜过滤后,利用高效液相色谱仪在320 nm紫外光下基于外标法测定对硝基苯酚残留浓度。高效液相色谱仪为安捷伦1200,色谱柱为Zorbax Eclipse Plus C18(4.6 mm×150 mm×5 μm),流动相为甲醇、乙腈和水的混合物(体积比42:48:10),进样量2 μL,流速1 mL·min-1,柱温30 ℃,利用二极管阵列复合波长检测器进行检测。
1.5 趋化性试验方法趋化性试验方法包括游动平板趋化性、土壤趋化性和毛细管趋化性,全程均在无菌超净工作台内操作,所有实验至少重复3次。
1.5.1 游动平板趋化性[14-16]向已灭菌的BM液体培养基中添加0.4%琼脂糖,加热融化待冷却至室温后加入对硝基苯酚至终浓度100 mg·L-1,制备BM半固体平板培养基,用已灭菌的滤纸片(r=0.8 cm)蘸取少许菌液,适当晾干后放入平板中央,30 ℃下避光培养并定时观察拍照。
1.5.2 土壤趋化性[16]土壤趋化性实验模拟装置如图 1(a)所示。实验步骤如下:①取已灭菌土壤20 g,分4次加入对硝基苯酚母液至终浓度为100 mg·kg-1,每次剧烈摇晃使其混匀;②制备约50 mL不含对硝基苯酚的BM半固体培养基(含0.4%琼脂糖),取3~5 mL滴至平板中央小环内待其凝固;③在半固体BM培养基中加入250 μL对硝基苯酚使其终浓度为100 mg·L-1,平板中放入半环后加入该培养基,待其凝固后取出半环并在中间部分均匀加入土样,使土样边缘与固体培养基充分接触;④在平板中央加一滴菌样,30 ℃下避光培养并定时观察拍照。
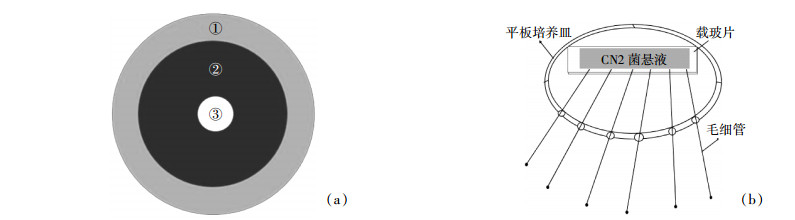
|
| 图 1 趋化性实验装置模拟图 Figure 1 Simulation devices for chemotaxis assays (a)土壤趋化性实验装置模拟图, 其中①、②、③分别为含100 mg·L-1对硝基苯酚的BM半固体培养基、含100 mg·kg-1对硝基苯酚灭菌土壤和不含对硝基苯酚的BM半固体培养基; (b)毛细管趋化性实验装置模拟图 |
毛细管趋化性实验模拟装置如图 1(b)所示。利用干净的培养皿做简化的反应容器,可同时在毛细管中注入不同浓度的对硝基苯酚或缓冲液作为趋化物,选择不同时长进行菌落培养即可统计进入毛细管中的菌落数。实验步骤如下:①取干净的平皿,用细针在其外沿烧开口径相同的若干孔以使毛细管正常插入;②将干净的载玻片紧贴平皿内沿置于平皿中,用毛细管制成一个U型空腔置于载玻片中央并滴入悬浮菌液,盖上盖玻片;③毛细管在酒精灯火焰上通过几次,稍加冷却后放入对硝基苯酚溶液中,液体即被吸入约4 cm;④待毛细管冷却后将其末端用酒精灯烧熔后封闭,即可在管内形成约5 cm的空腔以使菌液进入;⑤装有对硝基苯酚的毛细管开口一端水平插入盖玻片下的菌悬液中,轻轻盖上平板盖,置于30 ℃恒温恒湿环境中,温育不同时间后取出毛细管,用无菌蒸馏水冲洗外壁并用滤纸擦干,准备细菌计数;⑥细菌计数采用平板菌落计数法,即温育结束后,将毛细管中的内容物用适量缓冲液冲出并涂至LB平板上(每个毛细管中的菌悬液梯度稀释后涂在平板上),30 ℃下孵育24 h,利用迅数菌落计数仪统计平板上出现的菌落数目。
1.6 土壤原位修复模拟供试土壤采自无农药使用记录的中国农业科学院西门花园内。土样过20目筛后,部分直接用于实验,部分则连续两次经121 ℃高温高压灭菌1 h后备用。土壤中加入对硝基苯酚溶液至终浓度为100 mg·kg-1并轻微振荡混匀,分别取100 g不同处理后的土壤装入250 mL干净的三角瓶中,将CN2菌悬液分别加入灭菌与未灭菌土壤中至各自菌群浓度约为105 cfu·g-1。以不接菌时含相同浓度对硝基苯酚的未灭菌土壤作为对照组。所有实验组均在温度为30 ℃,相对湿度为10%左右的恒温箱中进行培养。每个处理组中每24 h取10 g土样并溶于20 mL无菌水,置于摇床中剧烈振荡1 h,4 ℃静置过夜,用0.22 μm的滤膜过滤后对所得样品利用高效液相色谱仪检测对硝基苯酚的浓度。
2 结果与分析 2.1 对硝基苯酚降解能力验证HPLC检测,对硝基苯酚的保留时间为1.73 min,选择320 nm作为检测波长。利用对硝基苯酚标准品绘制其浓度与320 nm处吸收值关系的标准曲线(y=5.384 3x+0.954 3;R2=0.999 8)。图 2为培养72 h后HPLC的检出结果,其中(a)、(b)分别为以对硝基苯酚(100 mg·L-1)为对照组与CN2菌液在含对硝基苯酚的BM无机盐培养基培养72 h后的检测结果。可见,菌株CN2在对硝基苯酚中培养72 h后降解率大于99%。

|
| 图 2 对硝基苯酚在320 nm处的HPLC检测结果 Figure 2 Detecting results for p-nitrophenol under 320 nm by HPLC (a)以对硝基苯酚(100 mg·L-1)作对照时的吸收值; (b)菌株CN2在对硝基苯酚(100 mg·L-1)中培养72 h后的吸收值 |
菌株在以对硝基苯酚(100 mg·L-1)为唯一碳源的培养基中表现出明显的趋化性。平板培养基中接入CN2于30 ℃恒温培养,可观察到菌株将培养基中的部分对硝基苯酚降解,使菌落周围培养基由黄绿色变为无色,出现透明的水解圈(图 3),且随着时间的延长,细菌不断向外运动,使得菌落边缘逐渐增大。图 3(a)所示为初始时刻将CN2菌液接入平板中形成的菌落,其直径约为2.5 mm;培养24 h后菌落直径扩大至8 mm,待96 h后菌落直径约增至12 mm,分别如图 3(b)、图 3(c)所示。这说明菌株CN2在利用平板中的对硝基苯酚时首先将细胞周围的对硝基苯酚降解,随着底物的减少,菌体逐渐向底物浓度较高的位置移动,这正是细菌对底物趋化性作用的表现。同时通过扫描电镜观察发现菌株CN2具有较长鞭毛,如图 3(d),这是其具有较强运动能力的结构基础。
|
| 图 3 菌株CN2在平板培养基中的趋化性效果及其扫描电镜观察 Figure 3 Chemotaxis response of CN2 in swarm plate assay (a)初始时刻接入CN2菌液的平板; (b)CN2在含对硝基苯酚(100 mg·L-1)的平板中培养24 h后生成的水解圈; (c)CN2在含对硝基苯酚(100 mg·L-1)的平板中培养96 h后生成的水解圈; (d)CN2菌株的扫描电镜图 |
由于微生物在环境修复过程中具有易实施、无二次污染且成本小等特点,目前微生物降解已被证明为实现环境污染物降解的有效措施[19]。为了解菌株在真实环境中的降解性能,本文利用土壤趋化性实验对其进行了模拟。图 4所示为CN2接种于土壤平板中培养一周后外圈培养基中对硝基苯酚的降解情况。可见,接种后30 ℃下避光培养一周,在半固体培养基中的底物对硝基苯酚即被显著降解,原来的黄绿色培养基变为无色透明。

|
| 图 4 菌株CN2的土壤趋化性实验 Figure 4 Soil chemotaxis response of CN2 (a)未接种CN2时的土壤平板; (b)接种CN2 7 d后半固体培养基由黄绿色变为无色透明 |
为定量分析菌株CN2对底物对硝基苯酚的趋化性,通过改进后的毛细管趋化性实验进行了验证。将进入毛细管中的菌落梯度稀释后涂至LB平板上,根据其生长情况可以确定,当稀释104后平板中的菌落易于准确计数,稀释浓度过高或过低均不利于统计与分析。
图 5为用趋化物诱导20 min后将毛细管中菌液稀释104后涂布至LB平板24 h后的生长情况,其中图 5a为以BM缓冲液为对照时进入毛细管的菌落数,图 5b~图 5i分别为以不同浓度对硝基苯酚为底物时进入毛细管中菌落细胞的生长情况,分别利用迅数菌落计数仪统计不同平板中菌落数目。可见,该菌株在一定浓度范围的底物诱导下表现出明显的趋化性,进入毛细管中的细菌细胞数目与底物浓度呈正相关;当底物浓度超过800 mg·L-1时则表现出趋化性的减弱,且随着底物浓度的增加,进入毛细管中细菌的数目逐渐减少。这也是该菌株在高浓度时对底物趋离作用的表现,即当细菌细胞周围的化学物质浓度达到一定阈值时会对其产生毒害作用,细菌因远离该类物质而避免了危害的发生。

|
| 图 5 菌株CN2在LB平板中24 h后的生长情况 Figure 5 Growth of CN2 in LB plates for 24 h (a)为以BM缓冲液为对照时菌落生长情况; (b)~(i)分别为CN2在不同浓度对硝基苯酚诱导后的生长情况; c、n分别代表对硝基苯酚浓度(mg·L-1)与LB平板中CN2的菌落数(cfu) |
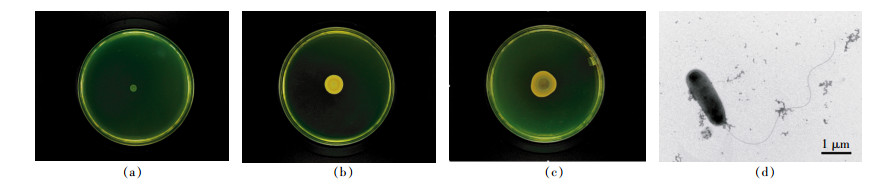
为进一步验证菌株CN2的趋化性,我们以不同浓度的对硝基苯酚为趋化物,对培养不同时长后进入毛细管中的细菌细胞数进行了统计分析。结果显示(图 6a),当底物浓度在0~2×104 mg·L-1时,随着培养时间的递增,进入毛细管中的细菌细胞数逐渐增大,在30 min时达到最大值,此后培养时间分别为40 min和50 min时进入毛细管中的菌落数虽高于20 min时但均略小于30 min时的菌落数目。可见,培养30 min以后细菌进入毛细管中的速率逐渐降低。
|
| 图 6 菌株CN2在不同浓度底物的诱导下培养不同时间后的生长情况及其进入毛细管中菌落数的速率变化 Figure 6 Growth of CN2 in p-nitrophenol of various concentrations after different period of culturing and the varying rates of colonies in capillary |
以50 mm为细菌进入毛细管中所经过的路程,以不同时长下进入毛细管中CN2菌落数的平均值为细菌数量,则CN2在单位时间内移动一定距离时进入毛细管中菌落数(N)变化的速率方程式可表示为:
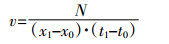
式中:N表示菌落数目,cfu;x1、x0分别为t1、t0时间所对应的CN2菌株在毛细管中移动的距离。
本文中,(x1-x0)为一定值50 mm,t0为CN2菌株进入毛细管中的初始时刻,(t1-t0)即为相应的统计时间(10~50 min)。由图 6(b)可知,培养30 min时,细菌进入毛细管的平均速率达到最大,约为8.56×103 cfu·mm-1·min-1。10~20 min内平均速率基本一致,经30 min以后则随时间的递增细菌进入毛细管中的速率呈逐渐下滑趋势。这一结论与图 6(a)中结果一致。
2.5 土壤原位修复模拟由图 7可见,随着培养时长的增加,土壤中对硝基苯酚浓度呈逐渐下降趋势。至培养14 d时,灭菌土壤中对硝基苯酚仍有残留且浓度基本稳定在高于20 mg·L-1。未灭菌土壤中对硝基苯酚则残留较少,其降解速率也明显快于灭菌后土壤中的降解速率,至培养14 d时,对硝基苯酚降解率达到95%。灭菌后土壤中残留的对硝基苯酚浓度始终高于未灭菌土壤中的浓度,推测可能是由于未灭菌土壤中存在其他可同时降解对硝基苯酚或可与菌株CN2共降解对硝基苯酚的微生物群落[2],同时由于高温高压灭菌过程会改变原有土壤的结构层次以及化合物组成,从而对外源性菌株的降解作用产生了抑制效果。

|
| 图 7 不同土壤中CN2对对硝基苯酚的降解曲线 Figure 7 Degradation of p-nitrophenol in different soil by CN2 |
微生物在环境修复中的作用,尤其是细菌对污染物的降解中,扮演了重要的角色。事实上,环境中污染物大量富集的过程也是对微生物自然驯化的过程,一些微生物通过改变或增强自身性能从而可在以这些化合物为碳源、氮源及能源的条件下实现对环境污染物的降解。而实现生物修复首先要保证微生物与底物的良好接触,细菌所具有的趋化性系统则有效克服了这一难题,使其可以感应并游向目标物质,从而增加污染物周围菌体浓度,促进细菌细胞生长或通过生物薄膜的形成而提高化合物的生物可利用性及降解性[20]。其次在相对有限的资源环境中有效摄取营养为自身提供碳源、氮源以及代谢所需能源,从而将环境中的污染物完全降解为小分子物质[21-23]。微生物的这一特性对于环境污染的修复有至关重要的作用,其固有的优势是常规的物理化学方法所不能比拟的[23]。
本实验以对硝基苯酚这一重要的环境污染物为底物,不仅是因为菌株CN2对此具有趋化性,也是因为在该菌株将其完全降解的过程中可明显观察到对硝基苯酚本身具有的黄绿色逐渐消失的现象。通过游动平板趋化性、土壤趋化性以及毛细管趋化性等方法对该菌株的趋化性进行了定性与定量研究。结果表明,该菌株对对硝基苯酚具有明显的趋化性且可在较短时间内将其高效降解。游动平板趋化性与土壤趋化性实验中均可观察到培养基中对硝基苯酚的降解效果,且通过模拟细菌在真实生态环境中的作用,进一步证实了菌株CN2的趋化性在促进其对环境污染物的降解过程中发挥了重要作用。这正是细菌利用复杂有效的趋化性系统而趋向有利于自身生存条件,从而增加对环境适应性的表现。
毛细管趋化性实验可定量反映细菌在趋化过程中的重要特征。由于菌株CN2具有鞭毛,游动能力较强,其进入毛细管中的最大速率可达8.56×103 cfu·mm-1·min-1,在模拟真实环境中的作用时该菌株的降解速率也较快。这与上文所述的结论是一致的。
此外,通过模拟土壤原位修复作用发现,灭菌后土壤中对硝基苯酚的残留浓度远大于未灭菌土壤中残留底物的浓度,且降解速率相对降低。对其可能的原因有两个方面的推测:一方面是由于原土样中存在其他可利用对硝基苯酚进行代谢的微生物或可与外源性菌株CN2共降解的土著微生物;另一方面可能是由于原土在高温高压灭菌后其土层结构遭到破坏或原土中化合物的组成有所改变,从而抑制了菌株的降解特性。已有研究证实,长期受污染的土壤中外源性真菌的添加会同时改变环境修复效率以及土壤中土著微生物群落的多样性[24]。进一步的研究也表明,通过改变土壤中的土著微生物群落结构以及一些非生物因素如土壤中沙土、泥土以及粘土的组成比例等,发现外源性降解菌的降解效率均受显著影响[25]。这些都可能会成为抑制外源性菌株发挥生物修复作用的因素,即土壤中存在的微生物群落以及土壤组成成分等都会改变菌株在环境修复过程中的效率[26-27]。据此推测,土壤的灭菌过程实质上也是对土壤微生物群落的破坏过程。因此,减少了可与外源菌实现对底物共同降解的细菌数目,造成外源性菌株在土壤中对底物的局部降解,从而导致土壤中的污染物长时间存在残留并富集,破坏了土壤生态环境。
目前,由于对硝基苯酚在环境中的广泛分布,细菌对这一环境污染物的趋化性也引起了人们浓厚的兴趣[28],细菌正逐渐被用作环境修复主要的生物资源。然而,自Adler[29]发现趋化性以来,尽管已有一些报道对细菌鞭毛的运动方式及其化学信号的转导等有所报道[30-32],但对趋化性的分子机理研究尚不透彻,仍需进一步做深入的研究。
4 总结本研究利用课题组已获得的节杆菌株CN2,通过游动平板趋化性、土壤趋化性以及毛细管趋化性等方法,主要研究了其在对硝基苯酚的生物降解过程中所发生的趋化性现象,证实了该菌株可高效降解对硝基苯酚。进一步通过模拟分析其在自然环境中实现土壤原位修复的过程,揭示了趋化性在微生物降解过程中的重要作用,表明利用微生物降解环境污染物的策略具有良好的应用潜力与价值。
微生物对污染物的降解是环境修复的重要组成部分,然而对于部分污染物的降解机理与趋化性机制尚未研究清楚,仍需进一步从分子水平上深入探究。
| [1] | Zhang S, Sun W, Xu L, et al. Identification of the para-nitrophenol catabolic pathway, and characterization of three enzymes involved in the hydroquinone pathway, in Peudomonas sp. 1-7[J]. BMC Microbiology , 2012, 12 : 27. DOI:10.1186/1471-2180-12-27 |
| [2] | 史延华, 任磊, 贾阳, 等. 节杆菌与施氏假单胞菌对甲基对硫磷的共降解研究[J]. 湖南农业科学 , 2015 (4) : 97–101. SHI Yan-hua, REN Lei, JIA Yang, et al. Codegradation of methyl parathion by Pseudomonas stutzeri and Arthrobacter sp.[J]. Hunan Agricultural Sciences , 2015 (4) : 97–101. |
| [3] | EPA(US Environmental Protection Agency). Ambient water quality for nitrophenols[R]. Washington, DC, USA, 1980, EPA-440/580-063. |
| [4] | Camilli R, Christopher M, Dana R, et al. Tracking hydrocarbon plume transport and biodegradation at deepwater horizon[J]. Science , 2010, 33 (6001) : 201–204. |
| [5] | Wang W P, Shao Z Z. The long-chain alkane metabolism network of Alcanivorax dieselolei[J/OL]. Nature Communications, 2014, 5:5755 doi:10.1038/ncomms6755. 10.1038/ncomms6755 |
| [6] | 任磊, 史延华, 贾阳, 等. 菌株Arthrobacter sp.CN2降解对硝基苯酚的特性与动力学[J]. 环境科学 , 2015, 36 (5) : 1757–1762. REN Lei, SHI Yan-hua, JIA Yang, et al. Biodegradation characteristics and kinetics of p-nitrophenol by strain Arthrobacter sp. CN2[J]. Enviromental Science , 2015, 36 (5) : 1757–1762. |
| [7] | Sivasubramanian S, Karthick S. Phenol degradation studies using microbial consortium isolated from environmental sources[J]. Journal of Environmental Chemical Engineering , 2015, 3 (1) : 243–252. DOI:10.1016/j.jece.2014.12.014 |
| [8] | Adler J. A method for measuring chemotaxis and use the method to determine optimum conditions for chemotaxis by Escherichia coli[J]. Journal of General Microbiol , 1973, 74 (1) : 77–91. DOI:10.1099/00221287-74-1-77 |
| [9] | Stock A, Mowbray S. Bacterial chemotaxis:A field in motion[J]. Current Opinion in Structural Biology , 1995, 5 (6) : 744–751. DOI:10.1016/0959-440X(95)80006-9 |
| [10] | Pandey G, Jain R. Bacterial chemotaxis toward environmental pollutants:Role in bioremediation[J]. Applied Environmental Microbiology , 2002, 68 (12) : 5789–5795. DOI:10.1128/AEM.68.12.5789-5795.2002 |
| [11] | Fenchel T. Microbial behavior in a heterogeneous world[J]. Science , 2002, 296 (5570) : 1068–1071. DOI:10.1126/science.1070118 |
| [12] | Glaeser J, Overmann J. The significance of organic carbon compounds for in situ metabolism and chemotaxis of phototrophic consortia[J]. Environmetal Microbiology , 2003, 5 (11) : 1053–1063. DOI:10.1046/j.1462-2920.2003.00516.x |
| [13] | Calvo O, Marchenko A, Vorobyov A, et al. Chemotaxis in polycyclic aromatic hydrocarbon degrading bacteria isolated from coal-tar and oil-polluted rhizospheres[J]. FEMS Microbiology Ecology , 2003, 44 (3) : 373–381. DOI:10.1016/S0168-6496(03)00092-8 |
| [14] | Gunjan P, Ashvini C, Sudip K. Chemotaxis of a Ralstonia sp. SJ98 toward co-metabolizable nitroaromatic compounds[J]. Biochemical and Biophysical Research Communications , 2002, 299 (3) : 404–409. DOI:10.1016/S0006-291X(02)02601-3 |
| [15] | Samanta S K, Bhushan B, Chauhan A, et al. Chemotaxis of a Ralstonia sp. SJ98 toward different nitroaromatic compounds and their degradation[J]. Biochemical and Biophysical Research Communications , 200, 269 (1) : 117–123. |
| [16] | Paul D, Singh R, Rakesh K. Chemotaxis of Ralstonia sp. SJ98 towards p-nitrophenol in soil[J]. Environmental Microbiology , 2006, 8 (10) : 1797–1804. DOI:10.1111/emi.2006.8.issue-10 |
| [17] | Marx R, Aitken M. A material-balance approach for modeling bacterial chemotaxis to a consumable substrate in the capillary assay[J]. Biotechnology and Bioengineering , 2000, 68 (3) : 308–315. DOI:10.1002/(ISSN)1097-0290 |
| [18] | Ren L, Shi Y H, Jia Y, et al. Genome sequence of Arthrobacter sp. YC-RL1, an aromatic compound-degrading bacterium[J/OL]. Genome Announcement, 2015, 3(4):e00749-15. doi:10. 1128/genomeA. 00749-15. 10. 1128/genomeA. 00749-15 |
| [19] | Paul D, Singh R, Jain R. Chemotaxis of Ralstonia sp. SJ98 towards p-nitrophenol in soil[J]. Environmental Microbiology , 2006, 8 (10) : 1797–1804. DOI:10.1111/emi.2006.8.issue-10 |
| [20] | 蒋建东, 张瑞福, 何健, 等. 细菌对环境污染物的趋化性及其在生物修复中的作用[J]. 生态学报 , 2005, 25 (7) : 1764–1771. JIANG Jian-dong, ZHANG Rui-fu, HE Jian, et al. Bacterial chemotaxis to environmental pollutants and its significance in bioremediation[J]. Acta Ecologica Sinica , 2005, 25 (7) : 1764–1771. |
| [21] | Terracciano J, Canale E. Enhancement of chemotaxis in Spirochaeta aurantia grown under conditions of nutrient limitation[J]. Journal of Bacteriology , 1984, 159 (1) : 173–178. |
| [22] | Armitage J. Taxing questions in development[J]. Trends in Microbiology , 2003, 11 (6) : 239–242. DOI:10.1016/S0966-842X(03)00128-8 |
| [23] | Sudip K S, Singh O V, Rakesh K J. Polycyclic aromatic hydrocarbons:Environmental pollution and bioremediation[J]. Trends in Microbiology , 2002, 20 (6) : 243–248. |
| [24] | Federici E, Maria A, Spaccapelo R, et al. Addition of allochthonous fungi to a historically contaminated soil affects both remediation efficiency and bacterial diversity[J]. Applied Microbiol Biotechology , 2007, 77 (1) : 203–211. DOI:10.1007/s00253-007-1143-1 |
| [25] | Canet R, Birnstingl J, Malcom D, et al. Biodegradation of polycyclic aromatic hydrocarbons(PAHs) by native microflora and combination of white-rot fungi in a coal-tar contaminated soil[J]. Bioresource Technology , 2001, 76 (2) : 113–117. DOI:10.1016/S0960-8524(00)00093-6 |
| [26] | Elias G, Neufield R. Degradation of fluorene in soil by fungus Phanerochaete chrysosporium[J]. Biotechnology and Bioengineering , 1989, 33 (10) : 1306–1310. DOI:10.1002/(ISSN)1097-0290 |
| [27] | Tucker B, Radtke C, Anderson A, et al. Suppression of bioremedation by Phanerochaete chrysosporium by soil factors[J]. Journal of Hazardas material , 1995, 41 (2/3) : 251–265. |
| [28] | Carmona M, Zamarro M, Blazquez B, et al. Anaerobic catabolism of aromatic compounds:A genetic and genomic view[J]. Microbiology and Molecular Biology Reviews , 2009, 73 (1) : 71–133. DOI:10.1128/MMBR.00021-08 |
| [29] | Adler J. Chemotaxis in Escherichia coli[J]. Cold Spring Harbor Symposia on Quantitative Biology , 1965, 30 : 289–292. DOI:10.1101/SQB.1965.030.01.030 |
| [30] | 李茹, 陈鹏. 细菌趋化性的信号传导及调节机制研究进展[J]. 生物技术通报 , 2011 (11) : 54–57. LI Ru, CHEN Peng. Progress on the signal transduction and regulation mechanism of bacterial chemotaxis research[J]. Biotechnology Bulletin , 2011 (11) : 54–57. |
| [31] | West A, Stock A. Histidine kinases and response regulator proteins in two-component signaling system[J]. Trends in Biochemical Sciences , 2001, 26 (6) : 369–376. DOI:10.1016/S0968-0004(01)01852-7 |
| [32] | Boukhvalova M, Dahlquist F, Stewart R. CheW binding interactions with CheA and Tar. Importance for chemotaxis signaling in Escherichia coli[J]. Journal of Biological Chemistry , 2002, 227 (25) : 22251–22259. |
 2016, Vol. 35
2016, Vol. 35