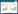文章信息
- 傅瑞琪, 刘榆, 楼子墨, 孙悦, 周晓馨, 王卓行, 徐新华
- FU Rui-qi, LIU Yu, LOU Zi-mo, SUN Yue, ZHOU Xiao-xin, WANG Zhuo-xing, XU Xin-hua
- 氨基改性猪热解炭化物及对水中微量Cu(Ⅱ)和Cu(Ⅱ)-Cit的去除研究
- Aminized pig biochar and its removals of trace Cu(Ⅱ) and Cu(Ⅱ)-Cit from aqueous solution
- 农业环境科学学报, 2016, 35(10): 1998-2004
- Journal of Agro-Environment Science, 2016, 35(10): 1998-2004
- http://dx.doi.org/10.11654/jaes.2016-0428
文章历史
- 收稿日期: 2016-03-30
铜是人类最早使用的金属之一,也是生命所必需的微量元素之一,但过量的铜对人体和动植物都有害。水中含铜量达到0.01 mg·L-1时,会对水体自净有抑制作用,超过5 mg·L-1会产生异味,超过15 mg·L-1就无法饮用[1]。近年来,随着电子、电镀、石化等产业的迅猛发展和大量络合剂的使用,络合铜废水排放量增大,废水成分也越来越复杂,它的处理已成为环保领域的难点。与游离态铜离子相比,络合态铜不再以单一的重金属离子形式存在,而是与柠檬酸、EDTA、NH3等物质配位形成稳定的可溶性络合物,去除难度增大,传统的化学沉淀法难以获得满意的处理效果。因此,探索络合铜废水有效的治理技术成为环保科技工作者广泛关心的热点问题。
目前国内外处理络合铜废水的研究主要集中在化学沉淀法、氧化还原法、吸附法、离子交换法、硫酸亚铁法等[2]。吸附法操作简便、稳定性好,所使用的吸附剂来源广泛、制造工艺简单、成本低,被广泛研究。其中,生物质炭作为一类新型环境功能材料,具有大量的孔隙结构和大的比表面积,表面负电荷量丰富,在土壤改良、受污染环境修复等方面都展现出了应用潜力[3-4]。当前以农作物秸秆和动物性废弃物为原材料的生物质炭的制备和应用研究较多,但以病死动物热解炭化物为原材料的生物质炭的研究较少。病死动物热解之后的炭化物可以进一步资源化利用,通过表面改性,引入相应功能基团(-NH2、-SH、-COOH等)来增强其对微量重金属的吸附性能,实现环境保护和经济价值的高度统一。
本文以病死猪热解炭化物(简称炭化物)为原料,对其进行表面修饰,引入螯合性能较好的官能团-NH2,增强其对重金属的吸附效果,考察氨基改性炭化物对水体中微量Cu2+和Cu(Ⅱ)-Cit的吸附效果,研究其去除机制,为炭化物进一步资源化利用提供理论基础。
1 材料与方法 1.1 材料与试剂实验所用药品均为分析纯,购买于国药集团化学试剂有限公司和阿拉丁(Aladdin)公司。病死猪热解炭化物取自某废物处理中心(将动物尸体在500~700 ℃温度下进行无氧热解炭化处理)。称取一定量的炭化物60 ℃真空干燥24 h,碾磨过80目筛,储存备用。游离态Cu2+储备液由三水硝酸铜晶体配制,Cu(Ⅱ)-Cit储备液由柠檬酸三钠和三水硝酸铜混合配成(两者摩尔比为1:1),两重金属储备液C铜均为500 mg·L-1,使用前用去离子水稀释。
1.2 氨基功能化改性炭化物复合材料制备本实验采用一步合成法制备氨基功能化炭化物(PCM@SiO2-NH2),具体步骤如下:称取一定量的炭化物于150 mL乙醇和水的混合溶液中,超声分散后缓慢加入3 mL氨水,在30 ℃环境中搅拌均匀,之后依次加入正硅酸乙酯(TEOs)和3-氨丙基三甲氧基硅烷(APTMS),持续反应4 h后产物过滤分离,用去离子水洗涤至中性,真空干燥。同样在不加APTMS的条件下按照上述步骤制备PCM@SiO2。
1.3 实验方法用重金属储备液配制一定浓度的含Cu(Ⅱ)/Cu(Ⅱ)-Cit模拟废水(基准浓度为5.0 mg·L-1),调节pH后取25 mL于100 mL锥形瓶中,并加入一定质量的PCM@SiO2-NH2。将锥形瓶密封,放入恒温摇床中在30 ℃、180 r·min-1条件下反应、吸附一定时间后,取上清液用0.45 μm滤膜过滤,所得滤液留待分析。
实验主要考查材料投加量(0~3 g·L-1)、溶液pH(Cu(Ⅱ):2~9,Cu(Ⅱ)-Cit:2~11)、初始浓度(2~100 mg·L-1)对Cu(Ⅱ)和Cu(Ⅱ)-Cit吸附效率的影响。每组条件实验均设置平行样以及空白样以确保实验结果的可靠性。
1.4 分析测试方法采用扫描电镜(SEM)以及X射线能谱(EDX,日本日立公司S-3000N型)分析所制备PCM@SiO2-NH2的形态结构和元素组成。对反应前后的材料进行傅里叶变换红外光谱(FTIR,美国NICOLET公司AVA TAR370型)与X射线光电子能谱(XPS,美国赛默飞世尔公司Escalab 250Xi型)分析,测定其表面官能团、原子价态等。
实验所得滤液中总铜浓度采用日本岛津公司AA-6300型原子吸收分光光度计测定。溶液pH值使用梅特勒-托利多仪器(上海)有限公司生产的pH计(SG2)测定。材料的吸附容量和吸附效率由如下公式计算:
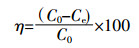 (1)
(1) 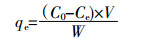 (2)
(2) 式中:qe为材料平衡吸附量,mg·g-1;C0和Ce分别为溶液中Cu2+初始和反应平衡时浓度,mg·L-1;V是反应溶液总体积,mL;W是吸附剂投加量,mg;η是吸附效率,%。
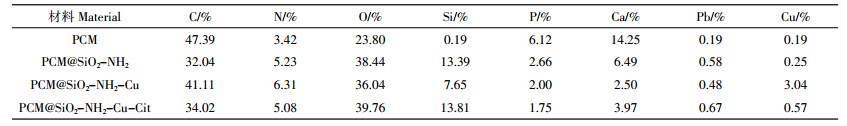
2 结果与讨论 2.1 氨基功能化改性炭化物扫描电镜(SEM)及元素分析(EDX)对炭化物、氨基功能化炭化物及其吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit之后的形态和表面元素组成进行了SEM和EDX测试,结果见图 1。对比图 1a和图 1b的SEM图可发现,氨基功能化后的炭化物有着更为粗糙的表面,说明氨基基团可能已成功修饰到炭化物表面。PCM@SiO2-NH2与Cu(Ⅱ)和Cu(Ⅱ)-Cit废水反应后,大多数Cu被复合材料吸附,如图 1c和图 1d所示,吸附后的EDX图中明显有Cu元素的存在,而且Cu(Ⅱ)的吸附量明显高于Cu(Ⅱ)-Cit。炭化物及氨基功能化炭化物吸附前后主要元素组成见表 1。

|
| 图 1 吸附材料扫描电镜(SEM)及X射线能谱(EDX)分析 Figure 1 SEM and EDX images of PCM(a), PCM@SiO2-NH2 (b) and PCM@SiO2-NH2 after Cu(Ⅱ)/ Cu(Ⅱ)-Cit adsorption(c, d) (a)PCM; (b)PCM@SiO2-NH2; (c)PCM@SiO2-NH2-Cu(Ⅱ); (d)PCM@SiO2-NH2-Cu(Ⅱ)-Cit |
 |
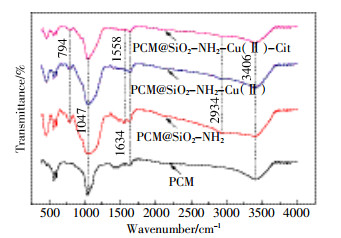
本实验采用FTIR定性分析了氨基功能化炭化物的官能团变化,结果如图 2所示。在1047 cm-1处的特征吸收峰为Si-O-Si的伸缩振动峰[5];3406 cm-1处广而强的峰即为水分子中O-H的伸缩振动峰[6]。在1634 cm-1和2934 cm-1处的特征吸收峰分别为C-H和N-H伸缩振动峰,表明-NH2已成功修饰在炭化物表面;794 cm-1处的C-N摇摆振动峰以及1558 cm-1处的-NH2弯曲振动峰也进一步证明了材料中-NH2基团的存在[7-8]。此外,吸附反应之后C-N峰逐渐变弱,而-NH2峰几乎消失,表明-NH2基团在吸附去除Cu(Ⅱ)以及络合态铜过程中起着重要作用。
|
| 图 2 炭化物及氨基功能化炭化物吸附前后红外光谱图 Figure 2 FTIR spectrums of PCM, PCM@SiO2-NH2 and PCM@SiO2-NH2 after Cu(Ⅱ)/ Cu(Ⅱ)-Cit adsorption |
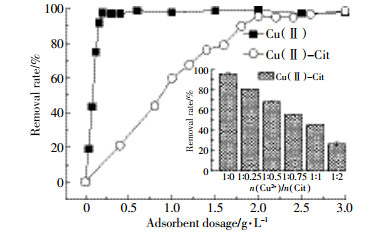
单独考察PCM@SiO2-NH2投加量对吸附的影响。由于Cu(Ⅱ)和Cu(Ⅱ)-Cit溶液在C(Cu2+)=5 mg·L-1时有不同的初始pH值,本实验将上述两溶液pH均调节为5.0±0.1。从图 3看出,随着吸附剂投加量的增多,两种重金属溶液去除效率逐渐提高,且Cu(Ⅱ)比Cu(Ⅱ)-Cit更容易去除。Cu(Ⅱ)溶液中0.16 g·L-1的投加量能达到90%以上的去除率,而在Cu(Ⅱ)-Cit溶液中,要达到相同去除率需要1.8 g·L-1吸附剂。考虑到经济适用性,在接下来的研究中Cu(Ⅱ)溶液投加量取0.16 g·L-1,Cu(Ⅱ)-Cit溶液投加量取1.8 g·L-1。
|
| 图 3 吸附剂投加量对Cu(Ⅱ)/Cu(Ⅱ)-Cit去除的影响及n(Cu2+)/n(Cit)不同摩尔比的影响 Figure 3 Effect of adsorbent rates on Cu(Ⅱ)/Cu(Ⅱ)-Cit removal at different mole ratios of copper to cit |
不同柠檬酸含量对络合态铜的去除结果见图 3(内插图)。溶液不含柠檬酸时,Cu(Ⅱ)全为游离状态,较容易被吸附剂去除;随着柠檬酸含量的增加,Cu(Ⅱ)-Cit的去除率逐渐减小;而当Cit浓度大于Cu(Ⅱ)浓度时,Cu2+全部为络合态,去除率降至27%,表明柠檬酸的加入阻碍了Cu(Ⅱ)的去除。在处理络合态铜废水实际应用中,可降低柠檬酸含量来提高重金属去除率。本文将摩尔比为1:1的柠檬酸铜作为实验对象展开研究。
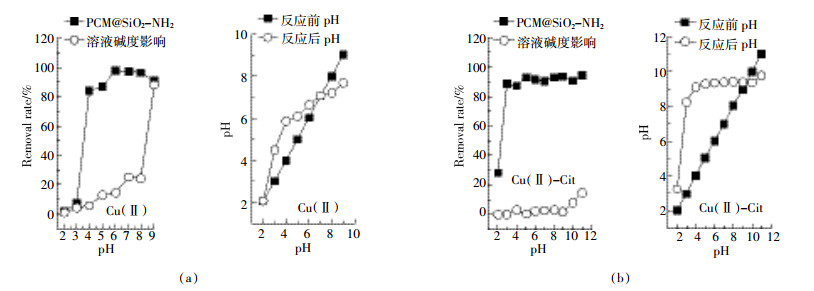
2.3.2 pH对Cu(Ⅱ)和Cu(Ⅱ)-Cit吸附的影响图 4a为溶液pH值在2~9范围内PCM@SiO2-NH2对Cu(Ⅱ)去除效率的影响及反应前后溶液pH的变化值,图 4b中Cu(Ⅱ)-Cit溶液pH范围设置为2~11(强碱条件会抑制PCM@SiO2-NH2络合性能)。随着初始pH的上升,两种废水溶液的去除率增大,当pH过高时,去除效率有所减小。溶液pH的变化会影响溶液中重金属的离子分布、形态以及吸附剂的结构、性能等[9]。Cu(Ⅱ)溶液的pH范围设置在9.0以内,因为pH过高含铜废水本身可能会形成Cu(OH)2沉淀,不能代表其去除是通过功能化炭化物的吸附作用[10]。PCM@SiO2-NH2表面富含的-NH2基团在酸性条件下易发生质子化,随着pH的升高,溶液中H+下降,-NH2质子化作用变弱,H+和Cu(Ⅱ)之间的竞争吸附下降,PCM@SiO2-NH2对Cu(Ⅱ)的吸附能力增大,在pH 6时最大去除率为97%[11]。在Cu(Ⅱ)-Cit溶液中,pH为2~9时,吸附剂对Cu(Ⅱ)-Cit的去除率从28%上升到92%,随后逐渐稳定。在该pH范围内,由溶液碱度引起的去除率小于5%,而吸附剂使溶液去除率提高到90%以上。图 4a和图 4b也分别显现出吸附前后溶液pH变化值。当溶液pH约为6时,两金属溶液均可达到去除最高值,且不会造成-NH2基团质子化,不会促使Cu(OH)2沉淀,故后续都采用pH 6.0±0.1的Cu(Ⅱ)和Cu(Ⅱ)-Cit溶液来进行吸附实验。
|
| 图 4 初始pH对Cu(Ⅱ)(a)、Cu(Ⅱ)-Cit(b)去除的影响以及吸附反应前后溶液pH的变化 Figure 4 Effect of initial pH on Cu(Ⅱ) (a) and pH variation in solution during adsorption and Cu(Ⅱ)-Cit removal(b) |
为了进一步研究PCM@SiO2-NH2对Cu(Ⅱ)和Cu(Ⅱ)-Cit的吸附机制,采用Langmuir和Freundlich等温模型分别对吸附平衡数据进行拟合。
Langmuir模型和Freundlich模型分别表示为[12]:
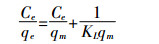 (3)
(3) 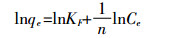 (4)
(4) 式中:Ce为平衡时溶质的浓度,mg·L-1;qe为平衡时单位吸附量,mg·g-1;qm为吸附等温线的饱和吸附容量,mg·g-1;KL是Langmuir常数,L·mg-1;KF为Freundlich吸附系数,(mg·g-1)·(1·mg-1)1/n;1/n为Freundlich常数[13]。
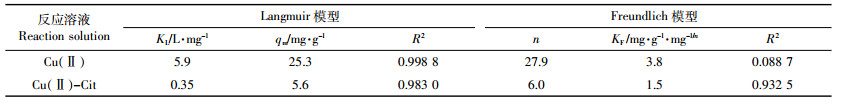
图 5是PCM@SiO2-NH2对Cu(Ⅱ)和Cu(Ⅱ)-Cit的吸附等温线。由图可知,Cu(Ⅱ)和Cu(Ⅱ)-Cit的吸附容量随着平衡浓度Ce的增加而增大,然后趋于稳定。对PCM@SiO2-NH2等温吸附数据采用Langmuir和Freundlich方程进行拟合,拟合结果见表 2。通过比较拟合相关系数R2,可知Langmuir模型能更好地描述Cu(Ⅱ)和Cu(Ⅱ)-Cit在PCM@SiO2-NH2上的吸附行为,表明PCM@SiO2-NH2表面具有均一性,且是单层吸附[14-15],复合材料对Cu(Ⅱ)和Cu(Ⅱ)-Cit的吸附机理主要为化学吸附。
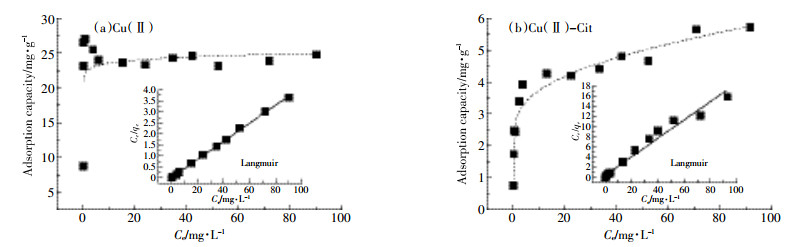
|
| 图 5 PCM@SiO2-NH2对Cu(Ⅱ)和Cu(Ⅱ)-Cit的吸附等温拟合 Figure 5 Isotherms of Cu(Ⅱ) and Cu(Ⅱ)-Cit adsorption on PCM@SiO2-NH2 |
 |
根据实验研究,氨基功能化炭化物能有效地去除微量Cu(Ⅱ)和Cu(Ⅱ)-Cit,吸附机理可能包含络合反应、静电吸附以及离子交换。
为进一步研究吸附机理,实验测量了PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit前后溶液pH值的变化(图 4)。在低pH环境下,吸附反应后溶液的pH值上升,说明PCM@SiO2-NH2上的氨基基团在酸性环境下会发生质子化,使材料表面带正电。但质子化的-NH2功能团仍有可能与Cu(Ⅱ)阳离子发生离子交换而使H+释放到溶液中,然而材料表面可利用的H+数量是有限的,故离子交换不是最主要的吸附机制。随着pH的增大,溶液中OH-含量增多,-NH2基团会发生去质子化,形成带负电的表面,与溶液中Cu2+发生静电吸附。PCM@SiO2-NH2吸附前后的红外谱图(图 2)显示,吸附反应之后变弱的C-N峰(794 cm-1)以及几乎消失的-NH2峰(1558 cm-1)均说明-NH2基团可通过与Cu(Ⅱ)形成稳定的络合物而使Cu(Ⅱ)被吸附,故络合吸附是主要的吸附机制。
图 6a为PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit前后的XPS全扫描谱图,由图可知,吸附后的PCM@SiO2-NH2 XPS全扫描谱图在结合能为940 eV左右处出现了Cu2p的新峰,表明Cu(Ⅱ)和Cu(Ⅱ)-Cit均已经被成功吸附在PCM@SiO2-NH2表面[16]。图 6c图 6d分别为PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit后的单扫描Cu2p谱图,前者显示Cu2p 3/2和Cu2p 1/2吸收峰分别出现在结合能为935.5、943.7、955.5 eV的位置,后者显示Cu2p 3/2和Cu2p 1/2吸收峰的结合能分别为933.6、945.0、954.0 eV,表明Cu2+被吸附在复合材料表面且吸附反应并没有改变重金属Cu的价态[17]。PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit前后的单扫描N谱图如图 6b所示,图中N1s吸收峰的结合能在400 eV左右,进一步证明了氨基基团成功修饰在炭化物表面。溶液吸附反应之后,N1s的结合能均有所增大,可能因为RNH2Mnn+(Mnn+代表Cu2+)复合物的形成。N原子周围很大一部分孤对电子用于N与Mnn+之间的结合,使得N原子的电子云密度降低,导致更高的结合能吸收峰[18]。因此,N谱图进一步证明了主要的吸附机理是-NH2和Mnn+之间的络合作用。
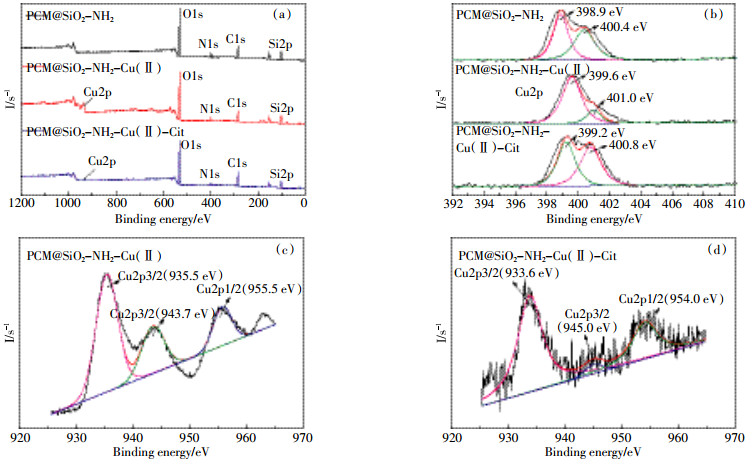
|
| 图 6 (a)PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit前后的XPS全扫描谱图;(b)PCM@SiO2-NH2吸附Cu(Ⅱ)和Cu(Ⅱ)-Cit前后的单扫描N谱图;(c)PCM@SiO2-NH2吸附Cu(Ⅱ)后的单扫描Cu谱图;(d)PCM@SiO2-NH2吸附Cu(Ⅱ)-Cit后的单扫描Cu谱图 Figure 6 XPS spectra of PCM@SiO2-NH2(a) and N1s core level spectra(b) before and after Cu(Ⅱ)/Cu(Ⅱ)-Cit adsorption; Copper spectrum(c, d) after Cu(Ⅱ) and Cu(Ⅱ)-Cit adsorption |
(1)病死猪热解炭化物能去除水体中微量Cu(Ⅱ)和Cu(Ⅱ)-Cit,但去除效率有限;通过一步法合成的氨基功能化改性炭化物,能够更有效地去除水体中微量重金属。
(2)Cu(Ⅱ)和Cu(Ⅱ)-Cit的去除效率随着PCM@SiO2-NH2投加量的增大而增大,且单位质量吸附剂对Cu(Ⅱ)的去除效果高于Cu(Ⅱ)-Cit;吸附剂对Cu(Ⅱ)和Cu(Ⅱ)-Cit最佳初始pH值为6.0。
(3)PCM@SiO2-NH2去除Cu(Ⅱ)的最大吸附容量为25.3 mg·g-1,去除Cu(Ⅱ)-Cit的最大吸附容量为5.6 mg·g-1;Langmuir模型能较好地描述重金属在氨基功能化炭化物上的吸附行为。
(4)对吸附反应前后的PCM@SiO2-NH2进行FTIR和XPS分析,结果表明材料能有效地去除微量Cu(Ⅱ)和Cu(Ⅱ)-Cit,氨基基团与重金属直接的络合吸附为主要的吸附机理。
| [1] | 刘新梅, 毛文洁, 陈夏. 重金属捕集剂DTC(BETA)处理含铜废水效果研究[J]. 广西工学院学报 , 2008, 19 (4) : 90–92. LIU Xin-mei, MAO Wen-jie, CHEN Xia. Studies on the treatment effect of wastewater containing Cu2+ with heavy metal chelating agent DTC(BETA)[J]. Journal of Guangxi University of Technology , 2008, 19 (4) : 90–92. |
| [2] | 陈文松, 宁寻安. 络合铜废水处理技术[J]. 水处理技术 , 2008, 34 (6) : 1–3. CHEN Wen-song, NING Xun-an. Treatment technology of wastewaterwith copper in complex state[J]. Technology of Water Treatment , 2008, 34 (6) : 1–3. |
| [3] | Roberts K G, Gloy B A, Joseph S, et al. Life cycle assessment of biochar systems:Estimating the energetic, economic, and climate change potential[J]. Environmental Science and Technology , 2010, 44 (2) : 827–833. DOI:10.1021/es902266r |
| [4] | Smemik R, Kookana R, Skjemstad J. NMR characterization of 13C-benzene sorbed to natural and prepared charcoals[J]. Environmental Science and Technology , 2006, 40 (6) : 1764–1769. DOI:10.1021/es051895o |
| [5] | Sharma R K, Puri A, Monga Y, et al. Acetoacetanilide-functionalized Fe3O4 nanoparticles for selective and cyclic removal of Pb2+ ions from different charged wastewaters[J]. Journal of Materials Chemistry A , 2014, 2 (32) : 12888–12898. DOI:10.1039/C4TA01815J |
| [6] | Tan L S, Xu J, Xue X Q, et al. Multi-functional nanocomposites Fe3O4@SiO2-mPD/SP for selective removal of Pb(Ⅱ) and Cr(Ⅵ) from aqueous solutions[J]. RSC Advance , 2014, 4 : 45920–45929. DOI:10.1039/C4RA08040H |
| [7] | Wei P, Xie Z, Ge C, et al. Amino-functionalized adsorbent prepared by means of Cu(Ⅱ) imprinted method and its selective removal of copper from aqueous solutions[J]. Journal of Hazardous Materials , 2015, 294 : 9–16. DOI:10.1016/j.jhazmat.2015.03.046 |
| [8] | Fu R Q, Liu Y, Lou Z M, et al. Adsorptive removal of Pb(Ⅱ) by magnetic activated carbon incorporated with amino groups from aqueous solutions[J]. Journal of the Taiwan Institute of Chemical Engineers , 2016, 62 : 247–258. DOI:10.1016/j.jtice.2016.02.012 |
| [9] | Ge Y Y, Cui X M, Kong Y, et al. Porous geopolymeric spheres for removal of Cu(Ⅱ) from aqueous solution:Synthesis and evaluation[J]. Journal of Hazardous Materials , 2015, 283 (11) : 244–251. |
| [10] | Fu H, Lv X S, Yang Y P, et al. Removal of micro complex copper in aqueous solution with a dithiocarbamate compound[J]. Desalination and Water Treatment , 2012, 39 : 103–111. DOI:10.1080/19443994.2012.669165 |
| [11] | Tan Y Q, Chen M, Hao Y M. High efficient removal of Pb(Ⅱ) by amino-functionalized Fe3O4 magneticnano-particles[J]. Chemical Engineering Journal , 2012, 191 : 104–111. DOI:10.1016/j.cej.2012.02.075 |
| [12] | Kim E J, Lee C S, Chang Y S, et al. Hierarchically structured manganese oxide-coated magnetic nano-composites for the efficient removal of heavy metal ions from aqueous systems[J]. ACS Applied Materials & Interfaces , 2013, 5 (19) : 9628–9634. |
| [13] | Wu Y, Luo H, Wang H, et al. Adsorption of hexavalent chromium from aqueous solutions by graphene modified with cetyl-trimethylammonium bromide[J]. Journal of Colloid and Interface Science , 2013, 394 (1) : 183–191. |
| [14] | Wu Z, Cheng Z, Ma W. Adsorption of Pb(Ⅱ) from glucose solution on thiol-functionalized cellulosic biomass[J]. Bioresource Technology , 2012, 104 : 807–809. DOI:10.1016/j.biortech.2011.10.100 |
| [15] | Bohli T, Ouederni A, Fiol N, et al. Evaluation of an activated carbon from olive stones used as an adsorbent for heavy metal removal from aqueous phases[J]. Comptes Rendus Chimie , 2015, 18 (1) : 88–99. DOI:10.1016/j.crci.2014.05.009 |
| [16] | Liu Y, Fu R Q, Sun Y, et al. Multifunctional nanocomposites Fe3O4@SiO2-EDTA for Pb(Ⅱ) and Cu(Ⅱ) removal from aqueous solutions[J]. Applied Surface Science , 2016, 369 : 267–276. DOI:10.1016/j.apsusc.2016.02.043 |
| [17] | Chen D, Zhang H, Yang K, et al. Functionalization of 4-aminothiophenol and 3-aminopropyltriethoxysilane with graphene oxide for potential dye and copper removal[J]. Journal of Hazardous Materials , 2016, 310 : 179–187. DOI:10.1016/j.jhazmat.2016.02.040 |
| [18] | Wu N M, Li Z K. Synthesis and characterization of poly(HEA/MALA) hydrogel and its application in removal of heavy metal ions from water[J]. Chemical Engineering Journal , 2013, 15 (215/216) : 894–902. |
 2016, Vol. 35
2016, Vol. 35