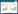文章信息
- 何清明, 李廷友, 韦平和
- HE Qing-ming, LI Ting-you, WEI Ping-he
- 低碳氮比畜禽粪水厌氧消化液短程硝化脱氮试验研究
- Feasibility study on the treatment of low C/N digested animal manure with shortcut nitrification-denitrification process
- 农业环境科学学报, 2016, 35(10): 2005-2010
- Journal of Agro-Environment Science, 2016, 35(10): 2005-2010
- http://dx.doi.org/10.11654/jaes.2016-0355
文章历史
- 收稿日期: 2016-03-18
2. 重庆大学三峡库区生态环境教育部重点实验室, 重庆 400045
2. Key Laboratory of the Three Gorges Reservoir Region's Eco-Environment, Ministry of Education, Chongqing University, Chongqing 400045, China
三峡库区周边众多的畜禽养殖场建在次级支流沿岸,畜禽废弃物大多未经处理直接排入水体,对三峡库区水环境安全造成严重威胁,且畜禽废水成分复杂,是一种高有机物、高氨氮、高SS废水,畜禽粪液已成为三峡水库的主要污染源之一,且畜禽废水经厌氧处理后为低C/N废水,存在可生化性差、碳源不足等问题,造成后续好氧脱氮效果差、不能达到出水排放要求。因此,如何更好地克服畜禽粪水厌氧消化液脱氮过程中存在的弊端,是迫切需要解决的问题。
短程硝化脱氮工艺是近年来开发的一种新型生物脱氮工艺[1],自Voets等[2]提出短程硝化反硝化去除有机质和氮源后,短程硝化反硝化以其可节省40%的有机碳源、减少1/4的能耗及缩短4.3倍反应历程等优势而备受国内外学者关注[3-6]。Lopez-Palau等[7]采用较高曝气量,在DO一直饱和的条件下成功培养出亚硝化率在95%以上的亚硝化颗粒污泥;Peng等[8]在处理氨氮浓度为58~108 mg·L-1生活污水时,将供气量作为控制参数,运行3周后亚硝态氮积累率达到了92.4%。Ge等[9]和Frison等[10]研究了短程硝化在不同碳源条件下的亚硝态氮积累率变化规律,发现底物不同则亚硝态氮还原酶和硝态氮还原酶对电子竞争速率不同,从而引起亚硝态氮积累率的差异。Vilar等[11]采用短程硝化技术通过恒温器将反应器的温度控制为35 ℃,获得了100%的氨氮去除率。Gabarro等[12]研究表明,即使存在其他限制因素(如高游离氨浓度、低DO浓度),短程硝化反硝化的最低温度也应控制在20 ℃以上。然而,目前对高氨氮废水,特别是对氨氮浓度在600 mg·L-1以上的有机废水,实现亚硝化脱氮的最佳pH和游离氨(FA)值尚无定论[13],且国内对短程硝化的研究大多都采用模拟废水,用实际废水研究的很少。
本文应用短程硝化反硝化技术处理高氨氮、低C/N畜禽废水厌氧消化液,研究其快速启动及运行规律,并通过对比不同pH、FA对氨氮去除及亚硝氮积累的影响,提出利用pH协同FA作用长期稳定实现高氨氮废水的短程硝化反硝化,完成对消化液中有机质和氮源的去除。这对今后高氨氮、低C/N畜禽粪液厌氧消化液亚硝化脱氮研究,无疑具有重要的理论和实际意义。
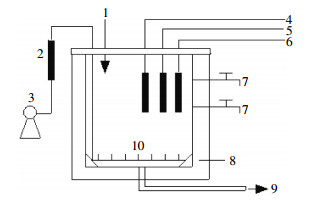
1 材料及方法 1.1 试验装置图 1所示SBR(Sequencing batch reactor)反应器由有机玻璃制成,反应器总容积为5.0 L,有效容积为3.0 L。反应器底部设有排泥装置,以微孔曝气器进行曝气,曝气筒内液流与反应器内液流形成内循环,通过传质交换为反应器内处理水提供溶解氧,配置溶解氧测定仪和温度计,使用水浴装置控制温度。实时对反应器内处理液的NH4+-N、COD、MLSS、NO2--N、NO3--N等参数进行检测,在线监测DO、ORP和pH等参数。
|
| 图 1 厌氧消化试验装置图 Figure 1 Schematic diagram of anaerobic digestion experiment system 1.进水管;2.流量计;3.曝气装置;4.溶解氧测定仪;5.pH测定装置;6.温度计;7.出水管;8.温控水箱;9.排泥装置;10.曝气头。 |
实验所用畜禽粪水水样取自重庆歌乐山某养猪场,经厌氧消化处理后猪粪尿废水主要指标:NH4+-N 660~900 mg·L-1,NO2--N<0.5 mg·L-1,NO3--N<1 mg·L-1,pH 7.35~7.65,COD 2000~3500 mg·L-1。接种污泥取自重庆大学UASB中已驯化颗粒污泥,该污泥已对畜禽废水有良好的适应性[14],其VSS/SS为0.68,接种污泥SVI为20~30 mL·g-1,接种污泥体积为0.75 L。实验期间维持MLSS在3500~4000 mg·L-1范围内,反应温度(30±1)℃。
1.3 监测参数与分析方法COD:重铬酸钾法;NH4+-N:纳氏试剂分光光度法;NO2--N:N-1-萘基-乙二胺分光光度法;NO3--N:紫外分光光度法;MLSS和MLVSS:标准重量法;DO:溶氧仪法;pH值:玻璃电极法。AOB和NOB采用梯度稀释培养计数法测定[15-16]。
2 试验结果 2.1 厌氧消化系统的产气状况分析于SBR中接种厌氧氨氧化颗粒污泥,进行反应器的启动,反应初期为保证反应器内混合液有充足的碱度,通过投加碳酸钠使反应器内初始pH维持在7.8~8.4。试验温度(30±1)℃,实时控制DO值为0.6~0.9 mg·L-1。启动期采用模拟畜禽粪水厌氧消化液,按照粪水和自来水1:1比例并添加一定的氯化铵保持进水氨氮浓度,将该浓度控制在750~900 mg·L-1。由于接种颗粒污泥已对畜禽废水有很好的适应性[14],短程硝化反硝化反应器的启动周期较短。为了尽快使反应器内AOB成为优势菌群,采用较高游离氨(FA)进水,维持初始SBR反应器内游离氨浓度在8~13 mg·L-1之间,利用高浓度游离氨几乎可以全部抑制硝酸菌活性的特性,使NO2--N的氧化被阻碍,快速实现NO2--N积累[17]。
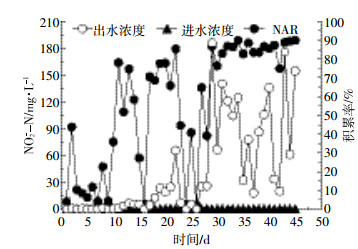
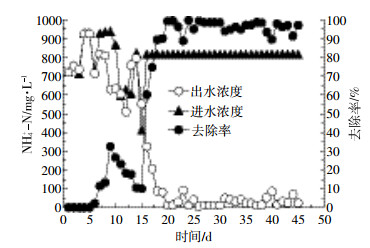
图 2显示驯化期反应器内进出水亚硝氮及积累率变化规律。随着反应的进行,SBR出水亚硝酸盐氮的浓度逐渐增高,亚硝氮积累率(NAR)相应增加,反应器内NAR由运行起始阶段的4.1%增长到91%以上,但NAR不够稳定。结合图 3可知,初始驯化期氨氮去除率也较低。为保持AOB在SBR反应器中优势地位,在试验进行5 d后安排了一次排泥,排泥量大约占总污泥量的43%,并实时控制污泥浓度为3500~4000 mg·L-1,利用高pH、高FA对NOB的抑制要大于AOB,不断淘洗NOB实现反应器内亚硝氮积累[14]。第15~20 d时,由于AOB成为优势菌种并弥补了因低溶解氧所造成的氨氧化菌代谢活性降低,氨氮氧化为亚硝酸盐的过程并未受到明显的影响[18],氨氮去除率快速增长,出水硝氮几乎为零,亚硝氮积累率也达到并稳定在91%以上。当反应进行到第25~30 d,氨氮平均去除率达到94.25%,亚硝酸盐积累率稳定在90.25%左右,成功实现畜禽废水的亚硝化途径脱氮。这表明,通过适当提高反应器内混合液初始pH,保持高FA浓度条件下,结合排泥能够快速并有效地获得短程硝化反硝化脱氮过程。
|
| 图 2 SBR进出水NO2--N含量及积累率 Figure 2 NO2--N concentration and its NAR in SBR |
|
| 图 3 SBR进出水NH4+-N浓度及去除率 Figure 3 NH4+-N concentration and its removal efficiency in SBR |
Kim等[19]研究发现,在一定的温度及恒定曝气量下,pH值的微小变化将对游离氨浓度产生重大影响,而FA是短程硝化反硝化途径脱氮的重要控制因子。对于FA与pH值关系分析通常采用Anthonisen等[20]给出的平衡方程:
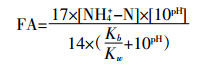
式中:Kb为NH3-N在水溶液中的平衡常数;Kw为水的平衡常数;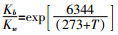
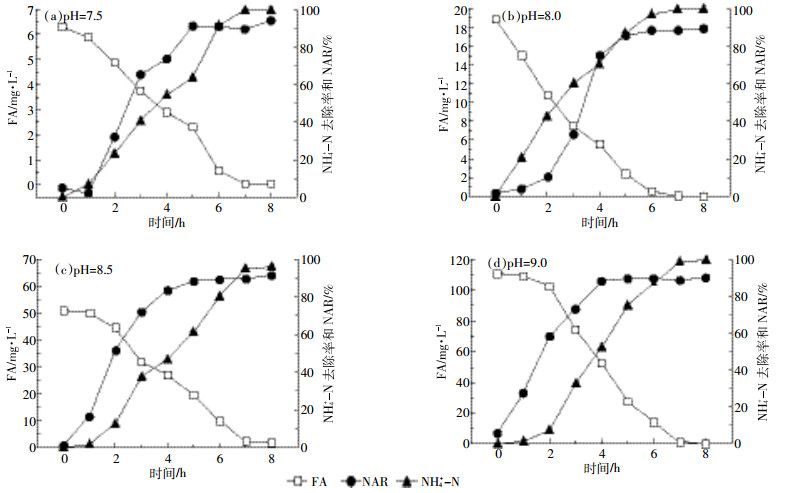
本试验通过进行不同pH值下短程硝化反硝化处理畜禽粪水的试验研究,考察不同浓度的游离氨对NH4+-N的去除和NAR的影响。图 4反映了pH值分别为7.5、8.0、8.5、9.0(相应FA分别为6、18、51、111 mg·L-1)时,短程硝化反硝化反应器内氨氮及NAR的变化规律。
|
| 图 4 不同pH、FA对氨氮去除率和亚硝氮积累率的影响 Figure 4 NH4+-N removal efficiency and NO2--N accumulation rate in different pH and FA |
由图 4可以看出,不同FA对亚硝氮积累速率和氨氮去除速率有一定程度的影响。FA越大亚硝酸盐氧化菌越易被抑制,亚硝氮积累速率越高。在反应进行到2 h时,四者的NAR分别为32.03%、10.15%、51.71%、58.44%;反应继续进行至4 h,积累率分别达到73.50%、75.10%、83.75%、88.52%。可见,FA为111 mg·L-1时,亚硝氮积累率增长迅速,亚硝氮积累速率最快。
研究发现,当FA大于10 mg·L-1时,AOB也会受到一定程度的抑制[19],导致氨氮去除率下降,如图 4所示,当反应进行到4 h,图 4c、图 4d氨氮去除速率(分别为46.92%和52.43%)小于图 4a、图 4b(分别为54.40%和70.58%),但图 4b的氨氮去除速率高于图 4a。分析认为一方面由于FA为18 mg·L-1时对NOB活性的抑制在一定程度上要大于AOB,经过一段时间后AOB成为优势菌种,会弥补因高FA所造成的微生物代谢活性下降,使氨氮氧化为亚硝酸盐的过程并未受到明显影响[9];另一方面是亚硝氮积累和氨氮去除不仅受到FA影响,还与pH有关,当pH为8时,亚硝酸盐积累率达到最高,NO2--N生成速度最大[21]。通过四组对比可以得出,当pH=8、FA=18 mg·L-1左右更利于亚硝化菌的优势竞争和氨氮的去除。
2.3 短程硝化反硝化的稳定运行在完成短程硝化反硝化反应器启动后进入稳定运行期,稳定运行期不断排泥,实时控制污泥浓度在3500~4000 mg·L-1,反应器内温度(29±1)℃,恒定曝气量使反应器内DO在0.1~2.28 mg·L-1之间,控制pH始终保持在8.0左右。反应器内初始FA为18 mg·L-1左右,进水为畜禽粪水厌氧消化液,稳定运行阶段运行情况见图 5和图 6。
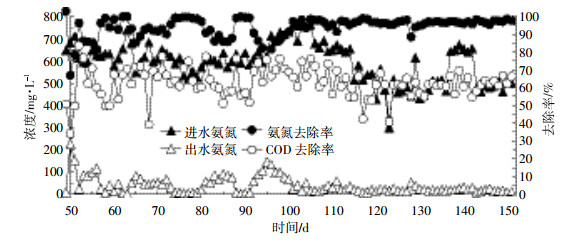
|
| 图 5 稳定运行期有机质及氨氮的去除变化曲线 Figure 5 Organic and ammonia nitrogen removal in stable operation |

|
| 图 6 稳定运行期进出水NOx--N浓度及NAR Figure 6 NOx--N influent and effluent concentration and NAR in stable operation |
从图 5可以看出,进水氨氮浓度在510~800 mg·L-1之间,稳定运行初期由于高pH、FA对硝化菌产生的抑制作用,出水氨氮浓度较高,为20~100 mg·L-1。经过一段时间后AOB成为优势菌种,弥补了因高FA所造成的微生物代谢活性下降,出水氨氮去除率增长并稳定在95%以上,出水氨氮浓度主要在30 mg·L-1以下,反应器内氨氮的去除效果较好,平均氨氮去除率达到97.7%。上述试验表明,通过控制适宜的pH及FA对AOB、NOB选择性抑制可长期稳定实现短程硝化反硝化;但SBR反应器进水COD在2399~4410 mg·L-1,出水COD在920~1315 mg·L-1,COD去除率为57.9%~76.12%,出水仍含有一定的COD。这是由于畜禽粪水含有油分、盐分等多种生物抑制性因子,且畜禽废水经厌氧处理后可生化性差,难降解有机质较多等原因造成的[16]。
图 6为反应稳定运行期进出水NOx--N浓度及NAR,不难发现,反应器出水亚硝氮波动较大,但出水硝氮浓度基本在30 mg·L-1以下。随着反应的进行,硝化菌建立起适应FA毒性影响的酶系统,硝化活性逐渐回升,但亚硝氮积累率仍维持在90%以上,平均亚硝氮积累率达到94.55%,说明SBR主要进行短程硝化反应,反应器内氨氧化菌活性较高;同时应用MPN法对稳定运行过程水样中AOB和NOB数量进行测定分析[15],测定结果如表 1所示,可以发现,AOB与NOB的比值为600:1,表明SBR反应器内AOB含量丰富且活性较高,而NOB数量较少或其活性受到严重抑制。
3 结论(1)本试验通过调节适宜的DO、温度和泥龄,在较高pH、FA条件下,接种厌氧氨氧化颗粒可实现亚硝酸型硝化反硝化的快速启动和稳定运行,NO2--N累积率长期稳定在90%以上。
(2)短程硝化处理高氨氮畜禽厌氧消化液,通过对比不同pH调控FA发现,当pH=8、FA=18 mg·L-1左右时,可得到最佳氨氮去除率和较高的亚硝氮积累率,NAR在94.25%以上。
(3)通过MPN法测定短程硝化反硝化稳定运行期AOB与NOB的比值为600:1。
(4)利用SBR反应器处理厌氧消化液,出水总氮以NO2--N形式为主,氨氮去除率达到91.26%,亚硝氮积累率达到94.55%。
| [1] | Vadivelu V M, Keller J, Yuan Z. Effect of free ammonia on the respiration and growth processes of an enriched Nitrobacter culture[J]. Water Resources , 2007, 41 (4) : 826–834. |
| [2] | Voets J P, Vanstanen H, Verstraete W. Removal of nitrogen from highly nitrogenous wastewater[J]. Journal of Water Pollution Control Federation , 1975, 47 (2) : 394–398. |
| [3] | Wang Y, Pelkonen M, Kaila J. Cost-saving biological nitrogen removal from strong ammonia landfill leachate[J]. Waste Management & Research , 2011, 29 (8) : 797–806. |
| [4] | Ge S J, Wang S Y, Yang X, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment:A review[J]. Chemosphere , 2015, 140 : 85–98. DOI:10.1016/j.chemosphere.2015.02.004 |
| [5] | Guo J H, Peng Y Z, Yang X, et al. Combination process of limited filamentous bulking and nitrogen removal via nitrite for enhancing nitrogen removal and reducing aeration requirements[J]. Chemosphere , 2013, 91 (1) : 68–75. DOI:10.1016/j.chemosphere.2012.12.004 |
| [6] | Ganigué R, Volcke E I P, Puig S, et al. Impact of influent characteristics on a partial nitritation SBR treating high nitrogen loaded wastewater[J]. Bioresource Technology , 2012, 111 : 62–69. DOI:10.1016/j.biortech.2012.01.183 |
| [7] | Lopez-Palau S, Pericas A, Dosta J, et al. Partial nitrification of sludge reject water by means of aerobic granulation[J]. Water Science and Technology , 2011, 64 (9) : 1906–1912. DOI:10.2166/wst.2011.386 |
| [8] | Peng Y Z, Gao S Y, Wang S Y, et al. Partial nitrification from domestic wastewater by aeration control at ambient temperature[J]. Chin J Chem Eng , 2007, 15 (1) : 115–121. DOI:10.1016/S1004-9541(07)60043-3 |
| [9] | Ge S J, Peng Y A, Wang S Y, et al. Nitrite accumulation under constant temperature in anoxic denitrification process:The effects of carbon sources and COD/NO3-N[J]. Bioresource Technology , 2012, 114 : 137–143. DOI:10.1016/j.biortech.2012.03.016 |
| [10] | Frison N, Fabio S D, Cavinato C, et al. Best available carbon sources to enhance the via-nitrite biological nutrients removal from supernatants of anaerobic co-digestion[J]. Chemical Engineering Journal , 2012, 215 : 15–22. |
| [11] | Vilar A, Eiroa M, Kennes C, et al. The SHARON process in the treatment of landfill leachate[J]. Water Science and Technology , 2010, 61 (1) : 47–52. DOI:10.2166/wst.2010.786 |
| [12] | Gabarro J, Ganigue R, Gich F, et al. Effect of temperature on AOB activity of a partial nitritation SBR treating landfill leachate with extremely high nitrogen concentration[J]. Bioresource Technology , 2012, 126 : 283–289. DOI:10.1016/j.biortech.2012.09.011 |
| [13] | Cui F H, Lee S, Kim M. Removal of organics and nutrients from food wastewater using combined thermophilic two-phase anaerobic digestion and shortcut biological nitrogen removal[J]. Water Research , 2011, 45 (16) : 5279–5286. DOI:10.1016/j.watres.2011.07.030 |
| [14] | 彭绪亚, 李治阳, 王璐, 等. UASB反应器培养厌氧氨氧化菌的试验研究[J]. 中国给水排水 , 2011, 27 (11) : 20–24. PENG Xu-ya, LI Zhi-yang, WANG Lu, et al. Study on cultication of anammox bacteria in UASB reactor[J]. China Water & Wastewater , 2011, 27 (11) : 20–24. |
| [15] | 王家玲. 环境微生物学实验[M]. 北京: 高等教育出版社, 1986 : 48 -51. WANG Jia-ling. Environmental microbiology experiment[M]. Beijing: Higher Education Press, 1986 : 48 -51. |
| [16] | 李治阳.畜禽废水生物除碳脱氮耦合新工艺及机理研究[D].重庆:重庆大学, 2013:102-103. LI Zhi-yang. Study on new coupling technology in biological removal of nitrogen and carbon from livestock wastewater and its mechanism[D]. Chongqing:Chongqing University, 2013:102-103. http://cdmd.cnki.com.cn/article/cdmd-10611-1012047252.htm |
| [17] | Abeling U, Seyfrid C F. Anaerobic-aerobic treatment of high strength ammonium wastewater-nitrogen removal via nitrite[J]. Water Science & Technology , 1992, 26 (5) : 1007–1015. |
| [18] | Keisuke H. Nitrification at low levels of dissolved oxygen with and without organic loading in a suspended-growth reactor[J]. Water Resources , 1990, 24 (3) : 297–302. |
| [19] | Kim D J, Lee D L, Keller J. Effect of temperature and free ammonia on nitrification and nitrite accumulation in landfill leachate and analysis of its nitrifying bacterial community by fish[J]. Bioresource Technology , 2005, 97 (3) : 459–468. |
| [20] | Anthonisen A C, Loehr R C, Prakasam T B S, et al. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal of Water Pollution Control Federation , 1976, 48 (5) : 835–852. |
| [21] | Balmelle B, Nguyen M, Capdeville B, et al. Study of factors controlling nitrite build-up in biological processes for water nitrification[J]. Water Science & Technology , 1992, 26 (5) : 1017–1025. |
 2016, Vol. 35
2016, Vol. 35