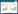文章信息
- 温慧洋, 焦燕, 杨铭德, 白曙光, 谷鹏
- WEN Hui-yang, JIAO Yan, YANG Ming-de, BAI Shu-guang, GU Peng
- 不同盐碱程度土壤氧化亚氮(N2O)排放途径的研究
- Studies on emission pathways of nitrous oxide from different salinization soils
- 农业环境科学学报, 2016, 35(10): 2026-2033
- Journal of Agro-Environment Science, 2016, 35(10): 2026-2033
- http://dx.doi.org/10.11654/jaes.2016-0566
文章历史
- 收稿日期: 2016-04-22
全球变暖是目前国际关注的重要环境问题,氧化亚氮(N2O)是重要的温室气体,在大气中存留的时间长达120年,百年尺度的增温潜势是CO2的296倍,而且正以每年0.25%的速率增加[1]。政府间气候变化专业委员会(IPCC)第五次评估指出,2011年全球大气N2O浓度约为324.2 nL·L-1,比工业革命(1750年)前增加20%,过去30年间平均增量为(0.73±0.03)nL·L-1·a-1,故N2O对全球变暖的贡献已超过CFC-12(一种氟立昂),成为继CO2和CH4之后的又一重要的温室气体[2]。农田土壤是大气中N2O的最重要排放源,反硝化作用(Denitrification)、硝化作用(Nitrification)、硝化微生物的反硝化作用(Nitrifierdenitrification)等微生物过程均能生成N2O,其中反硝化作用和硝化作用被认为是农田土壤释放N2O的最重要途径[3-4]。
目前,国内外关于土壤中N2O排放的研究主要集中在影响排放的因素及排放机制,包括土壤水分、土壤质地、pH、含盐量、土壤温度、土壤有机质、土壤氮素类型及农田的耕作措施等[5-7],关于盐分对土壤N2O排放的影响研究较少。盐分主要是通过土壤中的硝化作用和反硝化作用来影响N2O的排放。农田土壤N2O排放主要产生于由微生物引起的硝化和反硝化过程,土壤盐渍化通过影响微生物活性进而影响N2O排放[8-9]。关于土壤盐分含量对硝化和反硝化作用及N2O排放的影响,Inubushi等[10]研究得出,氮素矿化作用、硝化作用及N2O释放都受到土壤盐含量的影响,土壤盐含量高时,硝化作用受抑制;盐含量低时,硝化作用不受影响。Ruiz-Romero等[11]研究发现,N2O累积排放量随着盐分含量的增加而增加,N2累积排放量则反之;而且,电导率(EC)为56 dS·m-1的土壤N2O累积排放量大于电导率为12 dS·m-1。Marton等[12]研究也发现,反硝化过程中的N2O还原酶在高盐土壤中被抑制,导致在厌氧条件下N2O累积排放量增加。为探究盐分含量对硝化和反硝化作用N2O排放的影响,需明确不同盐碱程度土壤不同排放途径的N2O排放贡献率。
关于农田土壤不同排放途径的N2O排放贡献率的研究主要集中于水分条件对不同排放途径的N2O排放贡献率的影响。Mathieu等[13]研究发现,75%WHC培养条件下,硝化作用对耕作土壤中N2O排放的贡献为60%,而150%WHC条件下反硝化作用的贡献达到85%~90%。Zhu等[14]通过15N同位素示踪技术研究蔬菜地土壤中N2O的排放途径时发现,50%WHC条件下硝化作用N2O的排放贡献为42.3%~77.5%。但李平等[15]通过室内好气培养试验(60%WHC)测定林地和草地土壤硝化和反硝化过程对N2O排放的贡献率则发现,培养期间林地土壤中反硝化过程对N2O排放的平均贡献率为44.9%,硝化过程对N2O排放的平均贡献率为55.1%,草地土壤反硝化过程对N2O排放的平均贡献率为28.9%,硝化过程对N2O排放的平均贡献率为71.1%。上述结果表明,好气条件下硝化作用是土壤中N2O排放的主要途径,但反硝化作用仍占有很大比例。
目前,农田土壤N2O排放途径的研究主要集中于南方酸性土壤,而对于北方不同盐碱程度土壤N2O不同排放途径的研究甚少。全球盐碱土壤面积达9.5×108 hm2,约占陆地总面积的25%,中国盐碱土壤面积约为0.6×108 hm2 [16],内蒙古河套灌区的盐碱土壤面积约占内蒙古盐碱土壤面积的70%,高的盐含量以及pH改变了土壤的质地结构、土壤有机碳以及土壤肥力等[17]。
本研究选取内蒙古河套灌区4种不同盐碱程度土壤,通过低浓度C2H2抑制技术和纯O2抑制技术进行室内培养试验,研究不同盐碱程度土壤N2O排放途径,明确硝化过程和反硝化过程对N2O排放的贡献,为估算不同盐碱程度农田土壤N2O排放提供数据支撑,以便进一步深入探讨大气-土壤的氮循环过程,为减缓温室气体排放提供重要依据。
1 材料与方法 1.1 研究区概况试验土壤采于内蒙古河套灌区乌拉特前旗,该地处于我国西北黄河上中游地区,40°28′~41°16′N,108°11′~109°54′E,夏季高温干旱、冬季严寒少雪,年降雨量100~250 mm,蒸发量高达2400 mm左右,属典型的温带大陆性气候;昼夜温差大,季风强劲,极端最高气温为39.7 ℃,最低气温-30.7 ℃,年平均气温7.7 ℃;年平均日照3 212.5 h,无霜期167 d。降水集中于7-9月,年平均降水量213.5 mm,最大降水量在8月,极端日降水量达109.6 mm。主要种植小麦、玉米和向日葵。
1.2 样品采集土壤样品采集于2014年6月(未种植作物),依据不同盐碱程度土壤电导率(EC)值,选取4种不同盐碱程度农田土壤。样地SA(轻度盐土)、SB(重度盐土)、SC(盐土)、SD(极度盐土)面积均为10 m×10 m,按照邻近原则布置样点,用土钻采集0~20 cm土壤。各采样点重复取样3次,并将3次土样充分混匀,将可见植物残体(根、茎和叶)和土壤动物去除,装于无菌聚乙烯自封袋。风干磨碎过2 mm筛,用于土壤理化特性测定和室内培养实验。
1.3 测定方法 1.3.1 土壤基本理化性状土壤基本理化性质测定方法如下:pH以1:2.5土水比,土壤pH计法测定;土壤EC以1:1土水比,土壤便携式电导仪法测定;土壤NH4+-N选用靛酚蓝比色法测定;土壤NO3--N选用紫外分光光度计法测定。土壤基本理化性质见表 1。
培养实验共设置3个处理。对照组(CK):无C2H2或者纯O2抑制处理的土壤样品;实验组(A):0.06%C2H2(V/V)气体分别处理4种样地土壤;实验组(AO):0.06%C2H2(V/V)和纯O2联合处理4种样地土壤。
每种土壤称取风干土样100 g于310 mL规格培养瓶(Glasgeratebau OCHS GmbH),加入灭菌去离子水5 mL,预培养7 d,激活土壤微生物,7 d后取出培养瓶,用去离子水调节土壤质量含水率保持在25%(田间持水量的60%),T型硅胶塞封口;将装有土样的培养瓶抽真空,然后充入相应体积的100%氧气,再抽真空、再充入氧气,如此反复3次;抽出0.06%的C2H2气体并充入纯化的C2H2气体。每种处理设置3个重复,于(25±1)℃恒温培养箱避光培养21 d,每次取样后打开瓶盖通气2 h,然后将原培养瓶重新抽真空,并对培养瓶内气体进行添加或置换后加盖培养。培养期间每次取样时(间隔2~3 d)用称重法检查并补充培养瓶中水分,以使实验期间土壤水分保持一致。
将培养次日记作第1 d,分别于第1、2、3、4、7、10、13、16、21 d用连接三通的注射器取气样,通过改进的Agilent6820型气相色谱仪测定其N2O浓度。
1.4 数据分析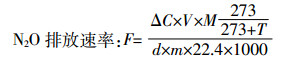 (1)
(1) 式中:F为N2O排放速率,μg·kg-1·d-1;V为培养瓶中培养土上方的气体体积,mL;ΔC为单位培养时间内气体浓度变化值,nL·L-1·d-1;M为每摩尔N2O的质量,44;T为培养箱温度,25 ℃;d为培养时间,d;m为培养瓶内的干土重,100 g;22.4为温度为273 K(绝对零度)时N2O的摩尔体积,L·mol-1。
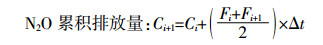 (2)
(2) 式中:Ci+1为第i次和第i+1次采样期间的N2O累积排放量,μg·kg-1;Fi和Fi+1分别为第i次和第i+1次采样时的N2O排放速率,μg·kg-1·d-1;Δt为两次测定时间间隔。
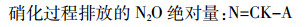 (3)
(3) 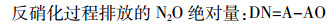 (4)
(4) 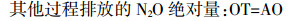 (5)
(5) 用OriginPro 9.0和Excel 2010软件进行数据处理和制图,SPSS 22.0进行单因素方差分析(AVNOA)。
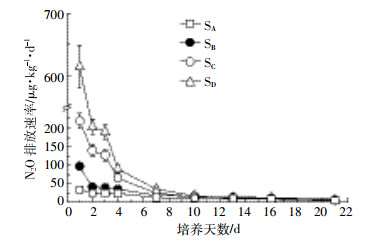
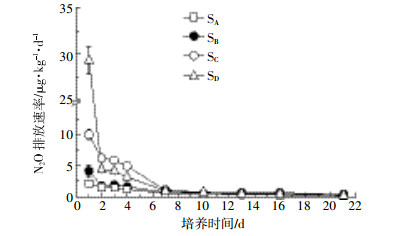
2 结果与分析 2.1 无抑制剂处理的不同盐碱程度土壤N2O排放由图 1可见,无抑制剂处理的不同盐碱程度土壤N2O排放速率随着培养时间变化明显,培养1 d后N2O排放速率达到最大,然后逐渐降低,最后趋于稳定。培养1 d后,极度盐土(SD)土壤N2O排放速率最高达到613.72 μg·kg-1·d-1,明显高于其他盐碱土壤;培养2 d后,极度盐土(SD)和盐土(SC)土壤N2O排放速率分别下降66.9%和36.4%;培养21 d后,4种土壤N2O排放速率稳定在5.66~7.68 μg·kg-1·d-1。
|
| 图 1 无抑制剂处理的不同盐碱程度土壤N2O排放速率 Figure 1 N2O emission rates from different salinization soils to no inhibitors treatment |
不同盐碱程度土壤N2O累积排放量存在显著差异(F=887.41,P < 0.001)。轻度盐土(SA)的累积排放量为289.71 μg·kg-1,重度盐土(SB)的累积排放量为500.08 μg·kg-1,盐土(SC)的累积排放量为951.66 μg·kg-1,极度盐土(SD)的累积排放量最高为1 750.39 μg·kg-1(图 2)。4种不同盐碱程度土壤N2O累积排放量表现为:极度盐土(SD)>盐土(SC)>重度盐土(SB)>轻度盐土(SA)。
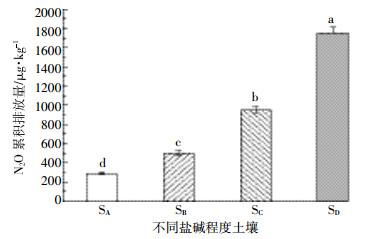
|
| 图 2 无抑制剂处理的不同盐碱程度土壤N2O累积排放量 Figure 2 Cumulative N2O emissions from different salinization soils to no inhibitors treatment 不同小写字母表示不同盐碱土壤间差异显著(P < 0.001) |
在0.06%低浓度C2H2和与对照组相同的温度和水分条件下,4种不同盐碱程度土壤N2O排放速率随着培养时间变化明显。由图 3可以看出,极度盐土(SD)在第2 d培养结束后N2O排放速率由最高428.97 μg·kg-1·d-1下降至104.45 μg·kg-1·d-1,下降约75.6%。在第2 d培养结束后,土壤N2O排放速率随着培养时间的变化趋势盐土(SC)与极度盐土(SD)相近,轻度盐土(SA)与重度盐土(SB)相近。培养到最后,4种不同盐碱程度土壤N2O排放速率均下降至3.07~5.56 μg·kg-1·d-1。

|
| 图 3 低浓度C2H2处理不同盐碱程度土壤N2O排放速率 Figure 3 N2O emission rates from different salinization soils to the treatment of acetylene |
4种不同盐碱程度土壤N2O的累积排放量存在显著差异(F=450.84,P < 0.001,图 4)。轻度盐土(SA)的累积排放量为224.49 μg·kg-1,重度盐土(SB)的累积排放量为384.89 μg·kg-1,盐土(SC)的累积排放量为719.22 μg·kg-1,极度盐土(SD)的累积排放量最高为1 124.57 μg·kg-1。4种不同盐碱程度土壤N2O累积排放量表现为SD>SC>SB>SA。
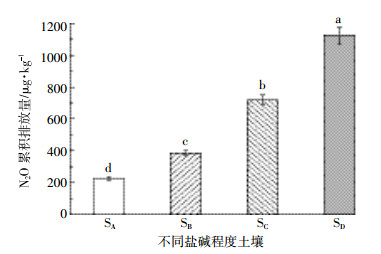
|
| 图 4 低浓度C2H2处理的不同盐碱程度土壤N2O累积排放量 Figure 4 Cumulative N2O emissions of different salinization soils to the treatment of acetylene 不同小写字母表示不同盐碱土壤间差异显著(P < 0.001) |
在0.06%低浓度C2H2和纯O2联合处理下,4种不同盐碱程度土壤在与对照组(CK)相同的温度和水分条件下,N2O排放速率随着培养时间变化明显。由图 5可知,极度盐土(SD)在第2 d培养后,N2O排放速率由最高29.34 μg·kg-1·d-1下降至4.43 μg·kg-1·d-1,下降约84.9%;在第2 d培养后,盐土(SC)N2O排放速率略高于极度盐土(SD),而轻度盐土(SA)与重度盐土(SB)两种土壤N2O排放速率在整个培养期均相近;在21 d培养结束后,4种不同盐碱程度土壤N2O排放速率均低于0.5 μg·kg-1·d-1。
|
| 图 5 低浓度C2H2和纯O2联合处理的不同盐碱程度土壤N2O排放速率 Figure 5 N2O emission rates from different salinization soils to the treatment of acetylene and pure oxygen |
4种不同盐碱程度土壤N2O累积排放量存在显著差异(F=55.10,P < 0.001)。轻度盐土(SA)的累积排放量为14.58 μg·kg-1,重度盐土(SB)的累积排放量为29.07 μg·kg-1,盐土(SC)的累积排放量为45.90 μg·kg-1,极度盐土(SD)的累积排放量为68.20 μg·kg-1。4种不同盐碱程度土壤N2O累积排放量表现为:SD最高,SC次之,SB较低,SA最低(图 6)。

|
| 图 6 图 6低浓度C2H2和纯O2联合处理的不同盐碱程度土壤N2O累积排放量 Figure 6 Cumulative N2O emissions from different salinization soils to the treatment of acetylene and pure oxygen 不同小写字母表示不同盐碱土壤间差异显著(P < 0.001) |
由图 7可知,整个培养期间,4种不同盐碱程度土壤不同排放途径对N2O排放贡献率随着培养时间变化趋势不同。对于轻度盐土(SA)和重度盐土(SB)来说,硝化过程N2O排放贡献率在培养后的第4 d和第21 d达到最大,分别为34.49%和32.13%,反硝化过程N2O排放贡献率分别在培养后的第13 d和第2 d达到最大,分别为80.90%和81.40%,其他过程N2O排放贡献率保持在4.31%~7.09%;对于盐土(SC)和极度盐土(SD)来说,硝化过程N2O排放贡献率均在培养后的第7 d达到最大,分别为39.37%和56.26%,反硝化过程N2O排放贡献率分别在培养后的第13 d和第16 d达到最大,分别为80.90%和91.14%,其他过程N2O排放贡献率保持在2.77%~6.52%。

|
| 图 7 不同盐碱程度土壤不同排放途径N2O排放贡献率随时间变化趋势 Figure 7 Changes versus time of N2O emission contribution rates from different processes in different salinization soils |
轻度盐土(SA)的硝化过程、反硝化过程和其他过程N2O平均排放贡献率分别为21.79%、71.31%和4.90%;重度盐土(SB)的3个过程分别为22.72%、71.16%和6.12%;盐土(SC)的3个过程分别为26.49%、68.90%和4.62%;极度盐土(SD)的3个过程分别为33.05%、63.42%和3.53%。
2.4 不同盐碱程度土壤不同排放途径N2O排放贡献率表 2所示,对于4种不同盐碱程度土壤N2O总累积排放量表现为:反硝化过程>硝化过程>其他过程,表明反硝化过程是盐碱土壤中N2O的主要排放途径,不同排放途径N2O总累积排放量随着土壤电导率(EC)的升高而升高。4种不同盐碱程度土壤不同排放途径(硝化过程、反硝化过程、其他过程)N2O排放贡献率表现为:轻度盐土(SA)分别为22.51%、72.46%和5.03%;重度盐土(SB)分别为23.03%、71.15%和5.81%;盐土(SC)分别为24.42%、70.75%和4.82%;极度盐土(SD)分别为35.75%、60.35%和3.90%。总体来看,随着土壤电导率的升高,硝化过程N2O排放贡献率逐渐升高,反硝化过程N2O排放贡献率逐渐降低。
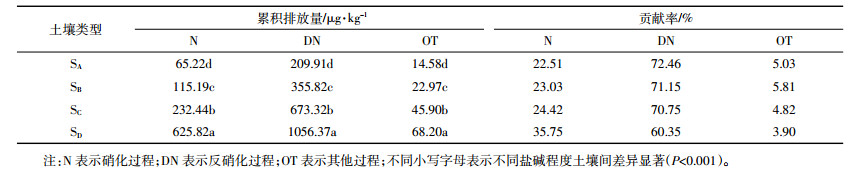 |
在60%WHC水分条件和(25±1)℃温度条件下,不同盐碱程度土壤N2O排放速率随着培养时间逐渐降低,最后趋于稳定(图 1),表现为:SD(EC=5.4 mS·cm-1)>SC(EC=2.92 mS·cm-1)>SB(EC=0.9 mS·cm-1)>SA(EC=0.46 mS·cm-1);4种不同盐碱程度土壤N2O排放速率均随着培养时间显著下降,原因可能在于土壤中氮素的激发效应[18-19],即土壤中无机氮含量越高,土壤中的有机氮分解越快。本研究选取的4种不同盐碱程度土壤无机氮含量表现为SA < SB < SC < SD,而土壤肥力则恰好相反。潘晓丽等[20]研究发现,有机质含量较低的中、低肥力土壤,其氮素的激发效应要高于有机质含量高的高肥力土壤。吕殿青等[21]也研究发现,激发效应的总趋势是肥力低的土壤高于肥力高的土壤。不同盐碱程度土壤N2O总累积排放量随着土壤盐碱程度即土壤电导率的升高而升高(图 2),表明在一定土壤盐分条件下,盐分促进N2O产生或抑制N2O向其他过程转化。这与Namratha Reddy等[22]研究发现的土壤N2O累积排放量随着土壤电导率的增大而增大的研究结果一致,原因可能是在含盐土壤中,由于N2O还原酶受土壤盐度影响,N2O易累积,随着土壤盐度的增加,N2O排放量增加[9, 23]。
对于轻度盐土(SA)、重度盐土(SB)和盐土(SC)来说,硝化过程N2O排放贡献率随时间变化表现为先升高后降低再升高,反硝化过程N2O排放贡献率随时间变化表现为先降低后升高再降低;对于极度盐土(SD)来说,硝化过程N2O排放贡献率随时间变化表现为先升高后降低,反硝化过程N2O排放贡献率随时间变化趋势正好相反。研究结果表明,硝化作用和反硝化作用是盐碱土壤中N2O排放的两个主要途径。目前,关于培养实验中硝化和反硝化过程N2O排放贡献随着培养时间的变化趋势报道不一。Wolf等[24]研究表明,无论是在饱和还是不饱和水分条件下培养,反硝化过程对N2O的排放贡献均随着培养时间逐渐增加,Khalil等[25]研究发现,在不同的O2分压下,硝化和反硝化过程对N2O的排放贡献随时间变化而波动,Mathieu等[13]则指出,无论在什么水分条件下培养,反硝化作用对N2O的排放贡献都随时间进行而降低。
在65%的WFPS条件下,硝化作用和反硝化作用是土壤中N2O排放的主要来源[26]。在整个培养实验期间,通过称重法补充培养瓶中土壤水分,以保证土壤水分保持在60%WHC。4种不同盐碱程度土壤的硝化过程和反硝化过程的N2O排放总贡献率分别为22.51%~35.75%和60.35%~72.46%,其他过程的N2O排放贡献率为3.90%~5.81%,表明反硝化过程是盐碱土壤中N2O排放的主要途径。这与Azam等[27]研究发现的在实验室培养条件下反硝化作用是农田土壤N2O产生的主要排放途径研究结果相一致。Prieme等[28]在低浓度C2H2抑制条件下,对冻融作用下德国和瑞典的草地和农田土壤反硝化作用研究发现,反硝化过程产生的N2O对整个冻融期N2O排放量的贡献率在德国草地土壤上仅为38%,而其他三种土壤中绝大多数的N2O来源于反硝化过程(90%~121%)。
土壤中的可溶性盐分含量通常用电导率表示,而盐分含量显著影响土壤中的微生物过程,进而影响土壤中不同排放途径N2O排放贡献率。本研究表明:4种不同盐碱程度土壤,随着电导率的升高,硝化过程N2O排放贡献率逐渐升高,反硝化过程N2O排放贡献率逐渐降低。在一定的盐分条件下,随着电导率的升高,土壤中的硝化作用逐渐升高。Low等[29]研究也发现,随着土壤盐度的增加,硝化反应产生N2O增加。Chandra等[30]研究得出,土壤氮的硝化和矿化作用会受到土壤中低盐分含量的刺激而增强。杨文柱等[31]研究发现,对于轻度盐碱土壤来说,土壤的硝化作用强度随外源盐分含量的升高而增强,进而引起轻度盐碱土壤的N2O排放的升高。
好气条件下,区分N2O不同排放途径及排放贡献率具有一定难度,国内外较有前景的方法包括稳定性同位素自然丰度法和15N同位素双标记法[3, 32-33]。但也有利用低浓度C2H2和纯O2区分土壤中N2O的不同排放途径,如:Ronald等[34]利用低浓度C2H2短时暴露和纯O2联合处理的方法区分土壤和沉积物中硝化和反硝化过程的N2O排放量;Wrage等[35]研究也发现,在低浓度C2H2和不同的O2分压条件下,当O2分压达到100 kPa时,硝化细菌的反硝化过程产生的N2O被抑制。本研究所选土壤样品中铵态氮含量和pH均较高,水分含量保持在60%WHC,且在好气条件下培养,因此硝化细菌的反硝化作用不易发生[36]。选取低浓度C2H2(0.06%)抑制土壤的硝化作用,纯O2抑制土壤的反硝化作用[37-39],是由土壤自身条件的特殊性所决定的。本研究是在实验室条件下,通过控制温度水分等条件探究不同盐碱程度土壤N2O不同排放途径及排放贡献率,但在野外条件下,土壤环境受盐分、施氮量、温度等多种环境因素的综合影响,为进一步探究不同盐碱程度土壤N2O不同排放途径及排放贡献率,还需关注不同盐碱程度土壤中的无机氮含量及从土壤微生物学等角度进行后续试验深入研究。
4 结论(1)在无抑制剂处理的条件下,N2O总累积排放量随土壤盐碱程度的升高而升高,不同盐碱程度土壤N2O排放速率表现为:极度盐土>盐土>重度盐土>轻度盐土。
(2)不同盐碱程度土壤不同排放途径N2O累积排放量和贡献率均表现为:反硝化过程>硝化过程>其他过程。表明反硝化过程是盐碱土壤中N2O排放的主要途径。
(3)不同盐碱程度土壤,随着土壤电导率的升高,硝化过程N2O排放贡献率逐渐升高,反硝化过程N2O排放贡献率逐渐降低。
| [1] | Kim K R, Craig H. Nitrogen-15 and oxygen-18 characteristics of nitrous oxide:A global perspective[J]. Science , 1993, 262 (5141) : 1855–1857. DOI:10.1126/science.262.5141.1855 |
| [2] | Stocker T F, Qin D H, Plattner G K, et al. Climate change 2013:The Physical Science Basis Intergovernmental Panel on Climate Change, Working Group I Contribution to the IPCC Fifth Assessment Report[R]. Cambridge:Cambridge University Press, 2013. http://www.oalib.com/references/16728819 |
| [3] | Baggs E M. A review of stable isotope techniques for N2O source partitioning in soils:Recent progress, remaining challenges and future consideration[J]. Rapid Communications in Mass Spectrometry , 2008, 22 (11) : 1664–1672. DOI:10.1002/(ISSN)1097-0231 |
| [4] | Wrage N, Velthof G L, Van Beusichem M L, et al. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology & Biochemistry , 2001, 33 (12/13) : 1723–1732. |
| [5] | 王连峰, 蔡祖聪. 淹水与湿润水分前处理对旱地酸性土壤氧化亚氮和二氧化碳排放的影响[J]. 环境科学学报 , 2011, 31 (8) : 1736–1744. WANG Lian-feng, CAI Zu-cong. Effects of waterflooding and pretreatment of wet water on nitrous oxide and carbon dioxide emission in upland acid soils[J]. Acta Scientiae Circumstantiae , 2011, 31 (8) : 1736–1744. |
| [6] | 叶欣, 李俊, 王迎红, 等. 华北平原典型农田土壤氧化亚氮的排放特征[J]. 农业环境科学学报 , 2005, 24 (6) : 1186–1191. YE Xin, LI Jun, WANG Ying-hong, et al. Emission characteristics of nitrous oxide in typical farmland soils of North China[J]. Journal of Agro-Environment Science , 2005, 24 (6) : 1186–1191. |
| [7] | Dobbie K E, Smith K A. The effects of temperature, water-filled pore space and land use on N2O emissions from an imperfectly drained gleysol[J]. European Journal of Soil Science , 2001, 52 (4) : 667–673. DOI:10.1046/j.1365-2389.2001.00395.x |
| [8] | Elgharably A, Marschner P. Microbial activity and biomass and N and P availability in a saline sandy loam amended with inorganic N and lupin residues[J]. European Journal of Soil Biology , 2011, 47 (5) : 310–315. DOI:10.1016/j.ejsobi.2011.07.005 |
| [9] | 李玲, 仇少君, 檀菲菲, 等. 盐分和底物对黄河三角洲区土壤有机碳分解与转化的影响[J]. 生态学报 , 2013, 33 (21) : 6844–6852. LI Ling, QIU Shao-jun, TAN Fei-fei, et al. Effects of salinity and substrate on organic carbon decomposition and conversion in the Yellow River delta area soils[J]. Acta Ecologica Sinica , 2013, 33 (21) : 6844–6852. DOI:10.5846/stxb |
| [10] | Inubushi K, Barahona M A, Yamakawa K. Effects of salts and moisture content on N2O emission and nitrogen dynamics in yellow soil and andosol in model experiments[J]. Biology and Fertility of Soils , 1999, 29 (4) : 401–407. DOI:10.1007/s003740050571 |
| [11] | Ruiz-Romero E, Alcantara-Hernandez R, Cruz-Mondragon C, et al. Denitrification in extreme alkaline saline soils of the former lake Texcoco[J]. Plant and Soil , 2009, 319 (1-2) : 247–257. DOI:10.1007/s11104-008-9867-y |
| [12] | Marton J M, Herbert E R, Craft C B. Effects of salinity on denitrification and greenhouse gas production from laboratory-incubated tidal forest soils[J]. Wetlands , 2012, 32 (2) : 347–357. DOI:10.1007/s13157-012-0270-3 |
| [13] | Mathieu O, Henault C, Leveque J, et al. Quantifying the contribution of nitrification and denitrification to the nitrous oxide flux using 15N tracers[J]. Environmental Pollution , 2006, 144 (3) : 933–940. DOI:10.1016/j.envpol.2006.02.005 |
| [14] | Zhu T B, Zhang J B, Cai Z C. The contribution of nitrogen transformation processes to total N2O emissions from soils used for intensive vegetable cultivation[J]. Plant and Soil , 2011, 343 (1/2) : 313–327. |
| [15] | 李平, 郎漫. 硝化和反硝化过程对林地和草地土壤N2O排放的贡献[J]. 中国农业科学 , 2013, 46 (22) : 4726–4732. LI Ping, LANG Man. The contribution of nitrous oxide emission of nitrification and denitrification process in forest land and grassland soils[J]. Scientia Agricultura Sinica , 2013, 46 (22) : 4726–4732. |
| [16] | Liu J H. Research progress of development and control of saline land[J]. Journal of Shanxi Agricultural Science , 2008, 36 (12) : 51–53. |
| [17] | Wang Q J, Lu C Y, Lia H W, et al. The effects of no-tillage with subsoiling on soil properties and maize yield:12-Year experiment on alkaline soils of Northeast China[J]. Soil and Tillage Research , 2014, 137 : 43–49. DOI:10.1016/j.still.2013.11.006 |
| [18] | Hauck R D, Brenner J M. Use of tracers for soil and fertilizer nitrogen research[J]. Adv Agron , 1976, 28 : 219–266. DOI:10.1016/S0065-2113(08)60556-8 |
| [19] | Jenkinson D S, Fox R H, Rayner J H. Interactions between fertilizer nitrogen and soil nitrogen:The so-called priming effect[J]. Soil Sci , 1985, 36 : 425–444. DOI:10.1111/ejs.1985.36.issue-3 |
| [20] | 潘晓丽, 林治安, 袁亮, 等. 不同土壤肥力水平下玉米氮素吸收和利用的研究[J]. 中国土壤与肥料 , 2013 (1) : 8–12. PAN Xiao-li, LIN Zhi-an, YUAN Liang, et al. Nitrogen uptake and use of summer maize under different soil fertility levels[J]. Soil and Fertilizer Sciences in China , 2013 (1) : 8–12. |
| [21] | 吕殿青, 张树兰, 杨学云. 外加碳、氮对土壤氮矿化、固定与激发效应的影响[J]. 植物营养与肥料学报 , 2007, 13 (2) : 223–229. LÜDian-qing, ZHANG Shu-lan, YANG Xue-yun. Effect of supplying C and N on the mineralization, immobilization and priming effect of soil nitrogen[J]. Plant Nutrition and Fertilizer Science , 2007, 13 (2) : 223–229. |
| [22] | Reddy N, Crohn D M. Effects of soil salinity and carbon availability from organic amendments on nitrous oxide emissions[J]. Geoderma , 2014, 235/236 : 363–371. DOI:10.1016/j.geoderma.2014.07.022 |
| [23] | Xu X K, Inubushi K. Effects of nitrogen sources and glucose on the consumption of ethylene and methane by temperate volcanic forest surface soils[J]. Chinese Science Bulletin , 2007, 52 (23) : 3281–3291. DOI:10.1007/s11434-007-0499-z |
| [24] | Wolf I, Russow R. Different pathways of formation of N2O and NO in black earth soil[J]. Soil Biology and Biochemistry , 2000, 32 (2) : 229–239. DOI:10.1016/S0038-0717(99)00151-0 |
| [25] | Khalil K, Mary B, Renault P. Nitrous oxide production by nitrification and denitrification in soil aggregates as affected by O2 concentration[J]. Soil Biology & Biochemistry , 2004, 36 (4) : 687–699. |
| [26] | Maag M, Vinther F. Nitrous oxide emission by nitrification and denitrification in different soil types and at different soil moisture contents and temperatures[J]. Applied Soil Ecology , 1996, 4 (1) : 5–14. DOI:10.1016/0929-1393(96)00106-0 |
| [27] | Azam F, Mmler C, Weiske A, et al. Nitrification and denitrification as sources atmospheric nitrous oxide-role of oxidizable carbon and applied nitrogen[J]. Biol and Fertility of Soils , 2002, 35 (1) : 54–61. DOI:10.1007/s00374-001-0441-5 |
| [28] | Prieme A, Christensen S. Natural perturbations, drying-wetting and freezing-thawing cycles, and the emission of nitrous oxide, carbon dioxide and methane from farmed organic soils[J]. Soil Biology and Biochemistry , 2001, 33 (15) : 2083–2091. DOI:10.1016/S0038-0717(01)00140-7 |
| [29] | Low A P, Stark J M, Dudley L M. Effects of soil osmotic potential on nitrification, ammonification, N-assimilation, and nitrous oxide production[J]. Soil Science , 1997, 162 (1) : 16–27. DOI:10.1097/00010694-199701000-00004 |
| [30] | Chandra S, Joshi H C, Pathak H. Effect of potassium salts and distillery effluent on carbon mineralization in soil[J]. Bioresource Technology , 2002, 83 (3) : 255–257. DOI:10.1016/S0960-8524(01)00230-9 |
| [31] | 杨文柱, 孙星, 焦燕. 盐度水平对不同盐碱程度土壤氧化亚氮排放的影响[J]. 环境科学学报 , 2016, 36 (10) : 3826–3832. YANG Wen-zhu, SUN Xing, JIAO Yan. Effect of salinity gradient on nitrous oxide emissions from different salinization soil[J]. Acta Scientiae Circumstantiae , 2016, 36 (10) : 3826–3832. |
| [32] | Park S, Pérez T, Boering K A, et al. Can N2O stable isotopes and isotopomers be useful tools to characterize sources and microbial pathways of N2O production and consumption in tropical soils?[J]. Global Biogeochemical Cycles , 2011, 25 (1) . |
| [33] | Decock C, Six J. How reliable is the intramolecular distribution of 15N in N2O to source partition N2O emitted from soil?[J]. Soil Biology and Biochemistry , 2013, 65 : 114–127. DOI:10.1016/j.soilbio.2013.05.012 |
| [34] | Kester R A, de Boer W, Laanbroek H J. Short exposure to acetylene to distinguish between nitrifier and denitrifier nitrous oxide production in soil and sediment samples[J]. FEMS Microbiology Ecology , 1996, 20 (2) : 111–120. |
| [35] | Wrage N, Velthof G L, Oenema O, et al. Acetylene and oxygen as inhibitors of nitrous oxide production in Nitrosomonas europaea and Nitrosospira briensis:A cautionary tale[J]. FEMS Microbiology Ecology , 2004, 47 (1) : 13–18. DOI:10.1016/S0168-6496(03)00220-4 |
| [36] | Wrage N, Velthof G L, Van Beusichem M L, et al. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology and Biochemistry , 2001, 33 (12) : 1723–1732. |
| [37] | Batjes N H, Bridges E M. World inventory of soil emission[J]. Working Paper PrePrint , 1992, 4 : 204. |
| [38] | Mosier A R, Mohanty S K, Bhadrachalam A, et al. Evolution of dinitrogen and nitrous oxide from the soil to the atmosphere though rice plants[J]. Biol Fertil Soil , 1990, 9 (1) : 61–67. DOI:10.1007/BF00335863 |
| [39] | 白璐. 氮肥及作物根系对农田N2O、CH4排放的影响[J]. 应用生态学报 , 2000, 11 : 59–62. BAI Lu. Effect of nitrogen fertilizer and crop roots on nitrous oxide and methane emissions from farmland[J]. Chinese Journal Applied Ecology , 2000, 11 : 59–62. |
 2016, Vol. 35
2016, Vol. 35