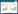文章信息
- 贺南南, 管永祥, 梁永红, 吴昊, 罗朝晖, 赵海燕, 顾祖丽
- HE Nan-nan, GUAN Yong-xiang, LIANG Yong-hong, WU Hao, LUO Zhao-hui, ZHAO Hai-yan, GU Zu-li
- 高效液相色谱-荧光检测法同时分析沼液中4种喹诺酮类抗生素
- Simultaneous determination of four fluoroquinolones in biogas slurry by high performance liquid chromatography with fluorescence detection
- 农业环境科学学报, 2016, 35(10): 2034-2040
- Journal of Agro-Environment Science, 2016, 35(10): 2034-2040
- http://dx.doi.org/10.11654/jaes.2016-0442
文章历史
- 收稿日期: 2016-04-01
2. 江苏省耕地质量与农业环境保护站, 南京 210036 ;
3. 江苏省农业环境监测与保护站, 南京 210036
2. Jiangsu Station of Cultivate-land Qualitative and Agro-Environmental Protection, Nanjing 210036, China ;
3. Jiangsu Station of Agro-Environmental Monitoring and Protection, Nanjing 210036, China
近年来,在集约化、规模化的畜禽养殖过程中,喹诺酮类抗生素(FQs)是迅速发展起来的一类人工合成的药物[1],因其具有抗菌谱广、抗菌力强、低毒、组织穿透力强、结构简单、给药方便等优点而被广泛用来促进畜禽生长和减少畜禽疾病[2-3]。目前,中国是世界上最大的抗生素生产国和消费国[4],每年约生产210 000 t抗生素,其中48%用于农业和畜牧产业[5]。由于许多种类抗生素药物在动物体内不能被吸收利用,造成30%~90%的抗生素会以原形和活性代谢产物的方式排泄到环境中[6]。据研究报道,环境中残留的抗生素会影响陆地生物、改变土壤中微生物活动和种群组成[7],促进细菌耐药性抗性基因发展,并逐步演变成新型环境有机污染物,进而给人类健康带来严重的威胁[8]。
目前,国内外研究者对FQs的检测分析主要集中于畜禽粪便,关于沼液中FQs的检测鲜见报道。沼液是以畜禽粪便为主要发酵原料,并经过甲烷菌厌氧消化后生成[9],因为其基质复杂且残留药物浓度较低(痕量或超微量)[10],对沼液中的FQs的分析造成了较大干扰。
针对环境中FQs的检测分析技术主要采用液相色谱-质谱联用(HPLC-MS),但该分析方法仪器设备昂贵,分析成本高,难以普及应用[11]。因为FQs在灵敏度较高而成本相对较低的荧光检测器(FLD)下响应良好,所以高效液相色谱-荧光分析法(HPLC-FLD)检测技术受到众多研究者欢迎。He等[12]使用HPLC-FLD对废水中的11种FQs进行残留检测,该方法检测限在5~30 ng·L-1;Gao等[13]建立了HPLC-FLD对牛奶、鸡蛋、蜂蜜的6种FQs同时检测分析方法,方法检测限在70~530 ng·L-1;Sun等[14]利用HPLC-FLD对鱼中的8种FQs进行检测分析时发现,该方法的检出限在60~220 ng·L-1;Rodriguez等[15]建立了HPLC-FID对婴儿产品中5种FQ检测分析方法,其最低检测限为10 ng·L-1;刘博等[16]利用HPLC-FLD对鸡粪中6种FQ进行检测分析时发现,该方法检出限为0.002~0.022 mg·kg-1;丑亚琴等[17]建立了HPLC-FLD对水产品中4种FQs药物残留检测分析发现,其定量限为0.004 mg·kg-1。
本研究借鉴了Vázquez等[18]的SPE-HPLC-FID检测地下水8种FQs的研究技术,考虑到沼液基质的复杂性,在此基础上对样品的前处理过程进行优化,建立了一种简单、快速、低成本、可靠、同时检测沼液中4种喹诺酮类抗生素残留量的方法。本实验开发的研究方法,提取抗生素的过程简单;不需要增加复杂的超声、离心等过程;不需要添加复杂的提取剂;固相萃取后的洗脱液不经过氮气吹干而是利用旋转蒸发蒸干,显著节约时间和实验成本。另外,基于本实验采用的液相条件得到的部分FQs的检出限显著高于Ni等[19]和Urraca等[20]的文献报告,适合对沼液中4种FQs的分析,为研究和治理复杂介质环境中FQs污染提供支撑,以期为沼液的农业安全利用把关。
1 材料和方法 1.1 仪器与试剂Agilent 1260高效液相色谱仪(附FLD检测器、标准型自动进样器、四元泵、柱温箱),美国安捷伦公司;Shim-Pack,VP-ODS色谱柱(250 mm×4.6mm,5 μm),日本岛津公司;真空泵、十二孔固相萃取装置,东康科技有限公司;超声波清洗仪,昆山禾超声仪器有限公司;Oasia HLB固相萃取柱(3 mL/60 mg),月旭科技股份有限公司;抽滤装置,南京寿德有限公司;0.7 μm玻璃纤维微膜,昀冠生物科技有限公司;0.45 μm聚四氟乙烯微孔滤膜,上海鼎杰生物科技有限公司;pH计,德国Sartorius公司;超纯水器,南京易普易达发展有限公司;万分之一天平,SHIMADAU公司;旋转蒸发器,德国BUCHI公司。
氧氟沙星(FOL)、环丙沙星(CIP)、恩诺沙星(ENR)、诺氟沙星(NOR)均购于上海瑞永生物科技有限公司,纯度均为98%;四丁基溴化铵购于Aladdin公司,纯度99%;甲醇、乙腈均为色谱纯;氢氧化钠、柠檬酸、磷酸氢二钠、乙二胺四乙酸二钠、磷酸、盐酸等为分析纯,均购于国药集团化学试剂有限公司;试验用水为超纯水。
1.2 溶液配制Na2EDTA-McIIvaine缓冲溶液:称取一定量的Na2EDTA、Na2HPO4和柠檬酸,分别配制成0.1、0.2、0.4 mol·L-1的溶液。按照3:2的比例混合Na2HPO4和柠檬酸,配制成McIIvaine溶液。将0.1 mol·L-1Na2EDTA溶液与McIIvaine缓冲溶液按照1:1的比例混合,配制成Na2EDTA-McIIvaine缓冲溶液(混合后pH值约为4)。
标准储备液:准确称取OFL、CIP、ENR、NOR标准品各0.010 0 g溶于0.03 mol·L-1的氢氧化钠溶液,用高纯水稀释定容至100 mL,配成100 mg·L-1的工作母液,在4 ℃避光保存备用,保质期为2个月。
1.3 样品采集与前处理沼液样品采自南京市郊区3个大中型沼气工程。以牛粪为发酵原料的沼液采自南京市浦口区永宁镇友联村(118°32′16″E,32°10′47″N);以猪粪为发酵原料的沼液采自南京市浦口区大林养殖场(118°34′32″E,32°1′16″N);以鸡粪为发酵原料的沼液采自南京市江宁区新洲蛋鸡养殖场(118°35′8″E,31°53′34″N)。多点收集新鲜沼液并混合均匀成为一个沼液样品,避光密封,带回实验室在室温条件下保存。
采集的沼液先通过滤纸过滤除去悬浮物,再通过0.7 μm的玻璃纤维过滤后,准确量取滤液50 mL到烧杯中,加入0.25 g乙二胺四乙酸二钠抑制重金属的螯合,然后用盐酸调节样品pH=4左右。滤液经过漩涡均质后保持以1 mL· ·min-1的速率通过Oasis HLB固相萃取柱进行富集[Oasis HLB固相萃取柱使用前,依次用3×2 mL甲醇、3×2 mL超纯水、3×2 mL盐酸(pH=4)进行预处理],萃取富集后,用6 mL超纯水清洗固相萃取柱,并真空干燥30 min。最后用6 mL甲醇缓慢洗脱到10 mL离心管中,将收集的洗脱液在40 ℃水浴条件下旋转蒸发至近干,用2 mL超纯水复溶,超声5 min促溶。以上溶液均过0.22 μm水系滤膜后放入2 mL的棕色玻璃瓶待测。
1.4 色谱条件色谱柱Shim-Pack,VP-ODS(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相为0.01 mol·L-1四丁基溴化铵/乙腈混合液(95:5,V:V),(用磷酸调节pH=3,用前过0.45 μm的聚四氟乙烯微孔滤膜、乙腈使用前超声脱气30 min),流速1.0 mL·min-1;进样量20 μL;荧光检测器(FLD)检测:激发波长280 nm,发射波长450 nm。
1.5 标准溶液的配置将标准储备液用超纯水稀释,配制成浓度为0.002、0.005、0.02、0.05、0.1、0.2、0.1、1、2、5 mg·L-1的FQs混合标准系列溶液。
1.6 回收率的计算过程根据文献[21]的规定,对添加抗生素的样品与未添加抗生素的空白样品同时执行SPE-HPLC测试抗生素浓度,按以下公式计算回收率:

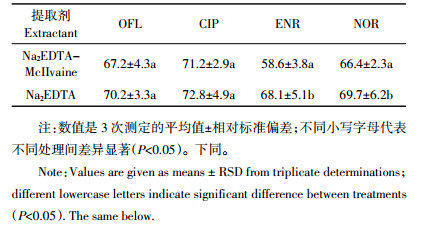
从环境样品中提取FQs物质,提取剂的选择非常重要,目前常用的提取剂为Na2EDTA-McIIvaine缓冲液。本研究比较了Na2EDTA-McIIvaine缓冲液(pH=4)和单独使用Na2EDTA溶液提取沼液各目标物的回收率, 结果见表 1。分别使用Na2EDTA溶液、Na2EDTA-Mcllvaine缓冲液提取液时,均可以从沼液中提取出目标物,但单独使用Na2EDTA溶液时ENR和NOR的提取效果与使用Na2EDTA-Mcllvaine缓冲液相比存在显著性差异。同时Na2EDTA-McIIvaine实验使用量较大,配制过程繁琐、易堵塞SPE装置、前处理后的样品上机检测时检出的杂质也较多。综合考虑本实验使用Na2EDTA溶液作为沼液中FQs的提取剂。
 |
FQs在水溶液酸性条件下(通常pH < 5)是阳离子形式,在对FQs样品预处理中大多将样品pH调节为酸性,将其转化为阳离子形式有利于提取[22-23]。选择Na2EDTA溶液作为提取剂,用HCl或NaOH调节样品pH为2~7,对样品进行提取过SPE柱后上机测定,每个样品重复3次,比较样品在不同pH条件下的提取效果。由表 2可知,各目标物回收率受样品pH变化影响非常显著,在一定范围内,抗生素回收率随着pH的降低而提高。pH=5时,目标物回收率较低均小于68.3%,而当pH=4时,4种FQs回收率最佳,达87.5%~101.9%。因此,选择Na2EDTA溶液作为提取剂,样品pH调至4时,提取效率最佳。
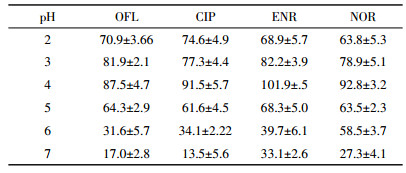 |
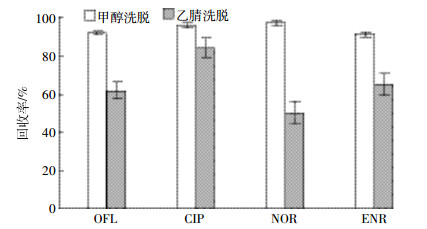
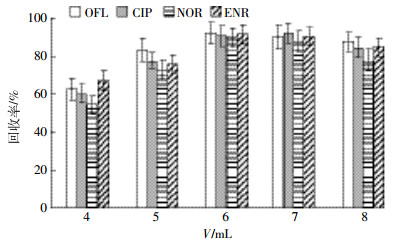
由于沼液基质的复杂性,洗脱溶剂类型会影响喹诺酮类抗生素的提取效果,需选择适当的有机溶剂尽可能洗脱目标物,同时避免将干扰杂质洗脱下来影响目标物的检测。目前常用洗脱液中抗生素的溶剂主要是甲醇、乙腈[24-25]。将1 mL各目标物浓度均为2 mg·L-1的混合标准溶液用50 mL超纯水稀释后过HLB柱,分别以甲醇、乙腈为洗脱剂,进行洗脱实验,结果见图 1。甲醇的洗脱效果最理想为91.9%~101.8%,乙腈的洗脱能力比甲醇低,而且甲醇洗脱实际样品后产生的杂质峰并不会对目标峰产生干扰,所以对沼液实际样品洗脱选用甲醇。分别用4、5、6、7、8 mL甲醇洗脱吸附在固相萃取柱上的目标物,实验结果见图 2,发现6 mL时目标物洗脱效率已达最高值,最终确定最佳洗脱体积为6 mL。
|
| 图 1 不同洗脱剂对回收率的影响 Figure 1 Effects of different elution solutions on recoveries of FQs |
|
| 图 2 不同洗脱量对回收率的影响 Figure 2 Effects of different volume of elution solutions on recoveries of FQs |
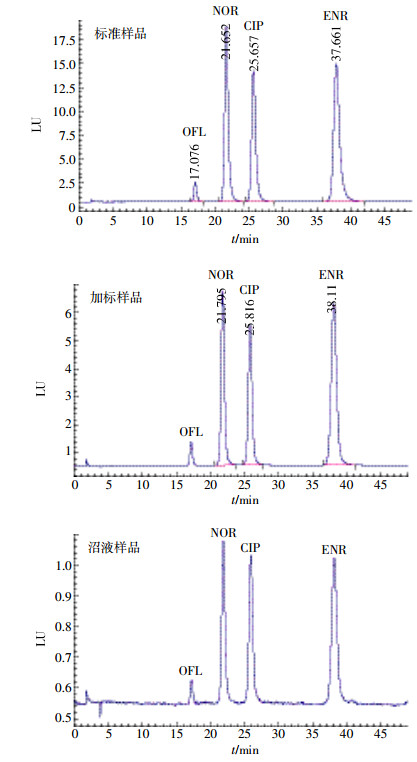
喹诺酮抗生素化合物具有两性基团,在水溶液中呈离子状态,会因色谱柱的吸附形成拖尾,从而导致诺氟沙星与环丙沙星很难在较短时间内基线分离。结合其最大吸收波长,实验确定了激发波长为280 nm,发射波长为450 nm,加入磷酸作为改性剂对拖尾现象有较大改善。使用磷酸调节流动相pH值,考察pH在2.0~4.0范围内的色谱分离效果,发现pH在2.5~3.0时,4种FQs可以在合适时间得到基线分离。流动相中乙腈的含量对保留时间影响4种FQs药物的出峰时间在17~38 min,而样品中的杂峰集中在14 min之前,不会形成干扰。标准样品(1.0 mg·L-1)、加标样品(以猪粪为发酵原料的沼液样品添加浓度为0.5 mg·L-1)、沼液样品中4种FQs的色谱分离图见图 3。
|
| 图 3 标准样品、加标样品、沼液样品中FQs的色谱图 Figure 3 Chromatograms of FQs in a standard sample, a spiked sample and biogas slurry samples |
不同型号的色谱柱因其键合工艺和填料方法的不同,同样条件下分析同样物质时会有不同的色谱行为。本实验考查了安捷伦公司的AgilentXDB-C18色谱柱(250 mm×4.6 mm,5 μm)和日本岛津公司的Shim-Pack,VP-ODS色谱柱(250 mm×4.6 mm,5 μm),流动相0.01 mol·L-1四丁基溴化铵(用磷酸调pH至2.5~3)/乙腈调制为95:5,其余色谱条件不变。图 4为使用AgilentXDB-C18色谱柱时的色谱图,图 5为Shim-Pack,VP-ODS色谱柱的色谱图。比较可知,图 5明显优于图 4,所以本研究采用Shim-Pack,VP-ODS进行分析。
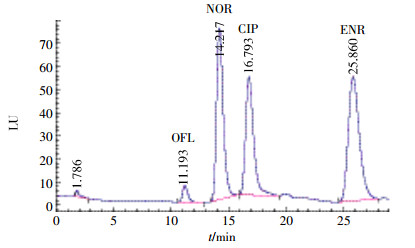
|
| 图 4 Agilent XDB-C18色谱柱 Figure 4 Agilent XDB-C18 chromatographic column |
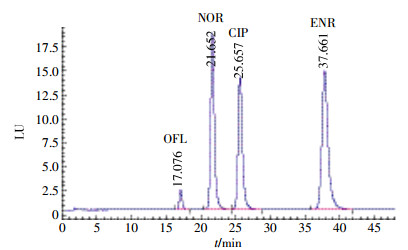
|
| 图 5 Shim-Pack,VP-ODS色谱柱 Figure 5 Shim-Pack, VP-ODS chromatographic column |
流速和柱温对样品保留时间和峰型都有影响。流速增加、柱温升高都会使保留时间减少,峰宽变窄,峰型更加尖锐,但是如果流速太大、柱温太高,会造成峰重叠。本研究考察了0.6、0.8、1.0 mL·min-1 3个流速,20、25、30、35 ℃ 4个柱温,结果表明流速1.0 mL·min-1、柱温30 ℃时效果最佳。
2.3 线性范围和检出限配制0.002、0.005、0.02、0.05、0.1、0.2、0.5、1.0、2.0、5.0 mg·L-1的系列混合工作曲线,按照前述的色谱条件进行检测,以色谱峰面积对抗生素质量浓度作校正曲线后得到线性回归方程和相关系数,采用3倍信噪比计算检出限,结果见表 3。4种FQs浓度(C)与峰面积(S)呈现良好的线性关系(R2>0.990)。
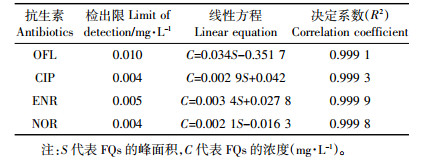
分别在50 mL沼液样品中添加0.1、0.2、0.5、1.0、2.0、5.0 mg·L-1的混合标准溶液,每个添加水平取3个平行样,按上述方法进行实验,并计算各目标物平均回收率及相对标准偏差(RSD),结果见表 4。4种FQs的平均回收率为81.3%~105.7%,相对标准偏差 < 10%,表明本方法的准确度和精密度均符合样品分析要求。
利用上述所建立的分析方法,对南京市以猪粪、牛粪、鸡粪为发酵原料的沼液样品中4种FQs进行了检测,分析结果见表 5。检测结果表明,以猪粪、牛粪、鸡粪为发酵原料的沼液样品中均检测到4种FQs。沼液样品中以猪粪为发酵原料的沼液中4种抗生素总含量为475 μg·L-1;以牛粪为发酵原料的沼液中4种抗生素总含量为188.8 μg·L-1;以鸡粪为发酵原料的沼液中4种抗生素总含量为204 μg·L-1。这可能与兽药使用量最大和猪的消化系统有关。沼液样品中氧氟沙星浓度范围为16.8~103 μg·L-1,环丙沙星为浓度范围为5~17 μg·L-1、恩诺沙星浓度范围为67~151 μg·L-1,诺氟沙星浓度范围为56~204 μg·L-1,沼液样品中4种FQs的相对标准偏差(RSD)均 < 10%,诺氟沙星的含量较高,环丙沙星的含量较低。这可能是因为除了诺氟沙星使用比较广泛以外,还由于诺氟沙星水溶性比较好,易于以粪尿的形式排出。沼液样品中诺氟沙星和恩诺沙星的含量比较高,应该加强监管。
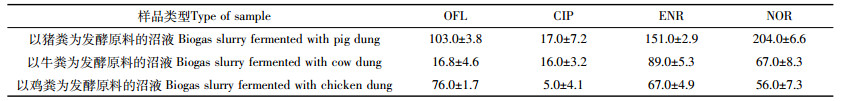 |
建立了基于固相萃取-高效液相色谱-荧光检测法(SPE-HPLC-FLD)分析沼液中4种喹诺酮类药物的方法。4种FQs的检测限范围为0.004~0.01 μg·mL-1,外标法定量准确性较好。应用该方法对南京郊区沼液样品中4种FQs进行检测,发现诺氟沙星在以猪粪为发酵原料的沼液中含量最高,恩诺沙星在以牛粪为发酵原料的沼液中含量最高,氧氟沙星在以鸡粪为发酵原料的沼液中含量最高。沼液样品中恩诺沙星、诺氟沙星、氧氟沙星的含量较高,环丙沙星含量最低。
| [1] | Meng Z, Shi Z, Liang S, et al. Residues investigation of fluoroquinolones and sulphonamides and their metabolites in bovine milk by quantification and confirmation using ultra-performance chromatography-tandem mass spectrometry[J]. Food Chemistry , 2015, 174 : 597–605. DOI:10.1016/j.foodchem.2014.11.067 |
| [2] | Herranz S, Moreno-Bondi M C, Marazuela M D. Development of a new sample pretreatment procedure based on pressurized liquid extraction for the determination of fluoroquinolone residues in table eggs[J]. Journal of Chromatography A , 2007, 1140 (1/2) : 63–70. |
| [3] | 孟磊, 杨兵, 薛南冬, 等. 高温堆肥对鸡粪中氟喹诺酮类抗生素的去除[J]. 农业环境科学学报 , 2015, 34 (2) : 377–383. MENG Lei, YANG Bing, XUE Nan-dong, et al. Effect of high temperature composing on removal of fluoroquinolones in chicken manures[J]. Journal of Agro-Environment Science , 2015, 34 (2) : 377–383. |
| [4] | Cepurnieks G, Rjabova J, Zacs D, et al. The development and validation of a rapid method for the determination of antimicrobial agent residues in milk and meat using ultra performance liquid chromatography coupled to quadrupole-Orbitrap mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis , 2015, 102 : 184–192. DOI:10.1016/j.jpba.2014.09.005 |
| [5] | Dorival-García N, Junza A, Zafra-Gómez A, et al. Simultaneous determination of quinolone and β-lactam residues in raw cow milk samples using ultrasound-assisted extraction and dispersive-SPE prior to UHPLC-MS/MS analysis[J]. Food Control , 2016, 60 : 382–393. DOI:10.1016/j.foodcont.2015.08.008 |
| [6] | Tang J, Shi T, Wu X, et al. The occurrence and distribution of antibiotics in Lake Chaohu, China:Seasonal variation, potential source and risk assessment[J]. Chemosphere , 2015, 122 : 154–161. DOI:10.1016/j.chemosphere.2014.11.032 |
| [7] | Chen H, Liu S, Xu X, et al. Antibiotics in the coastal environment of the Hailing Bay region, South China Sea:Spatial distribution, source analysis and ecological risks[J]. Marine Pollution Bulletin , 2015, 95 (1) : 365–373. DOI:10.1016/j.marpolbul.2015.04.025 |
| [8] | Yao L, Wang Y, Tong L, et al. Seasonal variation of antibiotics concentration in the aquatic environment:A case study at Jianghan Plain, Central China[J]. Science of the Total Environment , 2015, 527-528 : 56–64. DOI:10.1016/j.scitotenv.2015.04.091 |
| [9] | 李祎雯, 曲英华, 徐奕琳, 等. 不同发酵原料沼液的养分含量及变化[J]. 中国沼气 , 2012, 30 (3) : 17–20. LI Yi-wen, QU Ying-hua, XU Yi-lin, et al. Change of nutrition contents of biogas slurry with different fermentation raw materials[J]. China Biogas , 2012, 30 (3) : 17–20. |
| [10] | 赵扬, 郑志明, 金社胜, 等. 液质联用法同时测定猪粪便中16种(氟)喹诺酮类药物残留[J]. 农业环境科学学报 , 2011, 30 (6) : 1248–1253. ZHAO Yang, ZHENG Zhi-ming, JIN She-sheng, et al. Simultaneous determination of sixteen fluoroquinol ones residues in pig faces by liquid chromatography-mass spectrometry[J]. Journal of Agro-Environment Science , 2011, 30 (6) : 1248–1253. |
| [11] | Cheng W, Li J, Wu Y, et al. Behavior of antibiotics and antibiotic resistance genes in eco-agricultural system:A case study[J]. Journal of Hazardous Materials , 2016, 304 : 18–25. DOI:10.1016/j.jhazmat.2015.10.037 |
| [12] | He K, Blaney L. Systematic optimization of an SPE with HPLC-FLD method for fluoroquinolone detection in wastewater[J]. Journal of Hazardous Materials , 2015, 282 : 96–105. DOI:10.1016/j.jhazmat.2014.08.027 |
| [13] | Gao M, Wang H, Ma M, et al. Optimization of a phase separation based magnetic-stirring salt-induced liquid-liquid microextraction method for determination of fluoroquinolones in food[J]. Food Chemistry , 2015, 175 : 181–188. DOI:10.1016/j.foodchem.2014.11.132 |
| [14] | Sun X, Wang J, Li Y, et al. Novel dummy molecularly imprinted polymers for matrix solid-phase dispersion extraction of eight fluoroquinolones from fish samples[J]. Journal of Chromatography A , 2014, 1359 : 1–7. DOI:10.1016/j.chroma.2014.07.007 |
| [15] | Rodriguez E, Villoslada F N, Moreno-Bondi M C, et al. Optimization of a pressurized liquid extraction method by experimental design methodologies for the determination of fluoroquinolone residues in infant foods by liquid chromatography[J]. Journal of Chromatography A , 2010, 1217 (5) : 605–613. DOI:10.1016/j.chroma.2009.11.089 |
| [16] | 刘博, 薛南冬, 杨兵, 等. 高效液相色谱-荧光检测法同时分析鸡粪中六种氟喹诺酮类抗生素[J]. 农业环境科学学报 , 2014, 33 (5) : 1050–1056. LIU Bo, XUE Nan-dong, YANG Bing, et al. Simultaneous determination of six fluoroquinolons in chicken manures by high performance liquid chromatography with fluorescence detection[J]. Journal of Agro-Environment Science , 2014, 33 (5) : 1050–1056. |
| [17] | 丑亚琴, 唐巍, 卢艳芬, 等. 高效液相色谱法同时测定水产品中四种氟喹诺酮类药物残留前处理条件的优化[J]. 水产养殖 , 2013, 34 (1) : 21–27. CHOU Ya-qin, TANG Wei, LU Yan-fen, et al. Optimization of pretreatmet for determination of four fluoroquinolones in aquatic product by high performance liquid chromatography[J]. Journal of Aquaculture , 2013, 34 (1) : 21–27. |
| [18] | Vázquez M M P, Vázquez P P, Galera M M, et al. Determination of eight fluoroquinolones in groundwater samples with ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction prior to high-performance liquid chromatography and fluorescence detection[J]. Analytica Chimica Acta , 2012, 748 : 20–27. DOI:10.1016/j.aca.2012.08.042 |
| [19] | Ni Y, Wang Y, Kokot S. Simultaneous determination of three fluoroquinolones by linear sweep stripping voltammetry with the aid of chemometrics[J]. Talanta , 2006, 69 (1) : 216–225. DOI:10.1016/j.talanta.2005.09.032 |
| [20] | Urraca J L, Castellari M, Barrios C A, et al. Multiresidue analysis of fluoroquinolone antimicrobials in chicken meat by molecularly imprinted solid-phase extraction and high performance liquid chromatography[J]. Journal of Chromatography A , 2014, 1343 : 1–9. DOI:10.1016/j.chroma.2014.03.045 |
| [21] | 闾幸.生猪养殖废水及地表水中兽用抗生素污染现状与处理技术研究[D].上海:上海师范大学, 2013. LÜXing. Veterinary antibiotics in swine wastewater and groundwater and processing technology[D]. Shanghai:Shanghai Normal University, 2013. http://cdmd.cnki.com.cn/article/cdmd-10270-1013295732.htm |
| [22] | Zhang H, Zhou Y, Huang Y, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere , 2016, 152 : 229–237. DOI:10.1016/j.chemosphere.2016.02.111 |
| [23] | Seifrtová M, Nováková L, Lino C, et al. An overview of analytical methodologies for the determination of antibiotics in environmental waters[J]. Analytica Chimica Acta , 2009, 649 (2) : 158–179. DOI:10.1016/j.aca.2009.07.031 |
| [24] | Panasiuk O, Hedström A, Marsalek J, et al. Contamination of stormwater by wastewater:A review of detection methods[J]. Journal of Environmental Management , 2015, 152 : 241–250. DOI:10.1016/j.jenvman.2015.01.050 |
| [25] | Pan X, Qiang Z, Ben W, et al. Simultaneous determination of three classes of antibiotics in the suspended solids of swine wastewater by ultrasonic extraction, solid-phase extraction and liquid chromatography-mass spectrometry[J]. Journal of Environmental Sciences , 2011, 23 (10) : 1729–1737. DOI:10.1016/S1001-0742(10)60590-6 |
 2016, Vol. 35
2016, Vol. 35