文章信息
- 苏明洁, 廖源林, 叶充, 蔡仕珍, 龙聪颖, 邓辉茗
- SU Ming-jie, LIAO Yuan-lin, YE Chong, CAI Shi-zhen, LONG Cong-ying, DENG Hui-ming
- 镉胁迫下苦楝(Melia azedarach L.)幼苗的生长及生理响应
- The growth and physiological responses of Melia azedarach L. seedlings to cadmium stress
- 农业环境科学学报, 2016, 35(11): 2086-2093
- Journal of Agro-Environment Science, 2016, 35(11): 2086-2093
- http://dx.doi.org/10.11654/jaes.2016-0929
文章历史
- 收稿日期: 2016-07-18
苦楝(Melia azedarach L.)又名苦苓、楝树、森树等,为楝科(Meliaceae)楝属(Melia)的落叶乔木,其材质坚韧,纹理美丽[1],且根、皮、花、果均可入药[2],抗病虫害能力强,可作为植物源农药[3],是一种综合利用价值较高的乡土树种,广泛分布于我国南方地区[4]。苦楝生长迅速,树形优美,具有耐烟尘,耐瘠薄,可吸收二氧化硫等特点,是城市及矿区优良的绿化和造林树种[5],宜配植于池边、园路两侧,可孤植、列植和丛植。前人对苦楝的抗盐性[6]、抗旱性[7]和抗寒性[8]进行了探究,近年来对苦楝的研究主要集中在遗传多样性分析方面[9-11],而对其重金属胁迫下的响应机制则鲜有报道。廖源林等[12]探讨了苦楝叶片抗氧化系统对镉(Cd)胁迫的响应,但Cd 胁迫下苦楝的Cd 积累特征、光合特性以及渗透调节相关物质含量变化情况尚未明确。
随着城市化和工业化的不断推进,城市土壤Cd污染问题日益加剧。四川内江城市表层和下层土壤中Cd含量超标样点比例为94.6%和88.2%,且城市土壤Cd含量具有显著积累趋势[13];付娟林等[14]对杭州市区50 个居民区Cd 污染状况进行评价,结果显示96%的土壤处于中度或重度污染。因此,耐Cd 性应作为筛选园林绿化植物的重要参考指标。选择对Cd具有耐性的植物进行城市绿化,在增加绿量、美化环境的同时,还能缓解土壤Cd 污染,甚至还能在一定程度上起到重金属污染修复的作用[15]。苦楝作为一种生长迅速、生物量大、观赏性强的多功能园林树种,具有极高的实际应用价值和重金属污染修复潜力,而其对Cd是否具有一定的抗性,尚待进一步明确。探究Cd 胁迫下苦楝的生理响应机制,对城市及矿区Cd 污染区域绿化和造林树种的选择具有重要意义。本研究通过盆栽试验,探究Cd 胁迫下苦楝的生物量、Cd 积累、光合特性、质膜透性以及渗透调节物质含量变化,以期为揭示苦楝的耐Cd 性及其在城市土壤Cd 污染区域的综合应用提供参考依据。
1 材料与方法 1.1 材料和处理2014 年年底于四川温江7~8 年生苦楝母株上采集树种,净种后筛选出饱满籽粒,2015 年3 月上旬播种至上口径15 cm、高15 cm的塑料盆中,播种基质由园土、草炭和河沙混合而成(体积比为5:3:2),于四川农业大学科研基地内培养。
种植土配比为园土:草炭土:河沙=5:1:1,将园土风干、碾碎、剔除杂物,研磨,与草炭土和河沙按比例混合均匀后过5 mm 钢筛,再用800 倍多菌灵消毒,堆积静置45 d后,按照每盆7 kg 的标准装入带托盘的花盆(口径25 cm,高20 cm)中,用不含Cd 等干扰物质的清水控制其土壤含水量为田间持水量的60%。种植土中有机质、全氮、全磷、全钾含量分别为43.05、0.47、0.69、3.72 g·kg-1,Cd 含量为1.8 mg·kg-1。参照国家土壤环境质量标准和四川盆地重金属污染概况[16],试验以不添加Cd 为对照(0 mg·kg-1;CK),设置Cd 处理(不包括种植土中Cd 背景值)浓度梯度为30、60、90、120、150、180 mg·kg-1,用分析纯CdCl2·2.5H2O 配制而成的约500 mL溶液均匀浇灌盆土,渗出液需反复回浇,直到Cd2+与盆土混合均匀,在室内稳定15 d后用于试验。
8月初选取生长旺盛、长势相近的苦楝幼苗,移栽至含Cd 处理土壤的塑料盆中,每盆3 株,每个处理10 盆,共计210 株。移栽后第1 周保证叶片不失水,1 周后正常管理,试验期间每隔3 d浇400 mL 清水至田间持水量,胁迫处理60 d。该试验大棚中透光率为80%,棚内温度为(25±3)益,室内外温度接近,相对湿度为70%。分别于移栽后20、40、60 d上午9:00取植物第3~5 片叶鲜样进行各项生理指标测定,60 d时观察记录叶片颜色及形态特征,测定生物量、Cd 含量和光合作用相关指标。
1.2 测定指标与方法 1.2.1 株高与生物量的测定处理60 d后,拍照记录苦楝幼苗叶形和叶色;每个处理选取3株长势一致的植株,用卷尺从植株基部测量,其平均值作为该处理的株高;收获所有的根、茎、叶,用自来水洗净后,再用蒸馏水冲洗3 遍,105益杀青30 min,80℃恒温烘干至恒重,电子天平称重。
1.2.2 Cd 含量处理60 d后,将苦楝根、茎、叶样品烘干、粉碎,称取0.5 g,采用混合酸(硝酸:高氯酸=4:1)于电炉上消解,过滤,定容至50 mL,用原子吸收分光光度计(上海精密科学仪器有限公司,AA320N 型)测定根、茎、叶中Cd 含量。
1.2.3 质膜透性和渗透调节物质含量各项生理指标于处理20、40、60 d测定,质膜透性采用相对电导率法(REC)测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;可溶性糖含量测定采用蒽酮比色法;可溶性蛋白含量测定采用考马斯亮蓝法;游离脯氨酸含量测定采用酸性茚三酮法。以上指标均参照熊庆娥[17]的方法测定。
1.2.4 光合作用相关指标处理60 d后,利用丙酮-乙醇浸提法测定叶绿素含量[17];由便携式光合仪(Li-6400XT,美国)测定气体交换参数,测定过程中保证光合有效辐射为1000μmol·m-2·s-1,大气CO2 浓度为400 μmol·mol-1,叶室温度为25℃。
1.3 数据处理采用Microsoft Office Excel 2007 进行数据处理和图表分析,并用SPSS 20.0 统计软件进行单因素方差分析(One-way ANOVA)、新复极差法(Duncan's)多重比较。显著性水平设定α=0.05。
2 结果与分析 2.1 Cd2+对苦楝幼苗生长的影响形态特征观测发现,Cd 处理对叶片形态无显著影响,随Cd 浓度的增加,叶片颜色逐渐变浅(图 1)。Cd2+浓度≤60 mg·kg-1 时,叶片呈墨绿色;浓度为90~120 mg·kg-1时,叶片呈绿色;浓度为150~180 mg·kg-1时,叶片开始泛黄,失绿症状由叶基沿叶脉逐渐向上蔓延。

|
| 图 1 不同浓度Cd 对苦楝幼苗叶片形态的影响(60 d后) Figure 1 Effects of cadmium stress on the leaf morphology of Melia azedarach L. seedlings(after 60 d) |
由表 1 可见,Cd 胁迫后幼苗的生长受到一定影响。浓度低于60 mg·kg-1的Cd 处理,对根、茎干重有一定促进效果,与CK 相比分别提高了2.58%~16.01%和4.78%~11.85%;株高在Cd2+浓度≤120 mg·kg-1处理下与CK 差异不显著(P>0.05)。株高、根部干重和茎部干重在Cd2+浓度为180 mg·kg-1时,依次较CK 降低了19.83%、17.04%和18.50%。
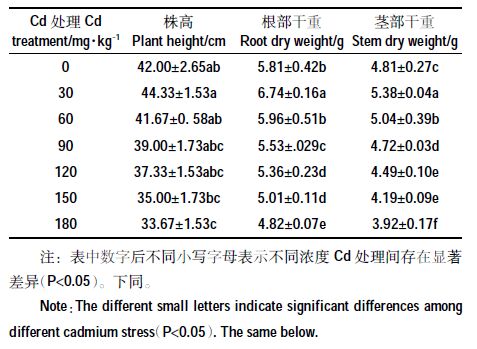
|
表 2 显示,根、茎、叶中的Cd 含量均随Cd 处理浓度的增加而增加,Cd2+分布特征为根>茎>叶。Cd2+浓度≤30 mg·kg-1 时,根、茎间Cd 含量差异较小,根、茎、叶Cd 含量均显著高于CK(P<0.05);Cd2+浓度为60~180 mg·kg-1时,根Cd 含量上升幅度明显大于茎和叶,为茎的1.80~3.45 倍、叶的2.26~4.51 倍。根、茎、叶Cd 含量的最大值出现在180 mg·kg-1 Cd 处理,分别为181.94 μg·g-1、52.65 μg·g-1和40.36 μg·g-1。
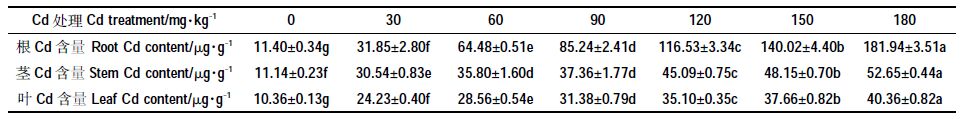
|
随着Cd 胁迫浓度增大,叶片叶绿素a(Chla)、叶绿素b(Chlb)和总叶绿素(Chla+b)含量略有下降,叶绿素a/b(Chla/b)无明显变化(表 3)。当Cd2+浓度≤120 mg·kg-1 时,Chla 和Chlb 与CK 差异不显著(P>0.05)。Chla+b 在Cd2+浓度≤150 mg·kg-1时,各浓度之间差异不显著(P>0.05),但在Cd2+浓度≥90 mg·kg-1时,显著低于CK(P>0.05);各浓度处理下Chla/b 之间差异不显著(P>0.05),但均略高于CK。180 mg·kg-1 Cd处理的Chla、Chlb 和Chla+b 含量最低,较CK 分别下降了37.00%、47.62%和39.16%。

|
由表 4 可知,各项光合参数均随Cd 处理浓度的增加而下降。Cd2+浓度≤60 mg·kg-1 时,净光合速率(Pn)、胞间CO2 浓度(Ci)和蒸腾速率(Tr)与CK 差异不显著(P>0.05),而各处理下气孔导度(Gs)均显著低于CK(P<0.05)。180 mg·kg-1 Cd 处理下,Pn、Gs、Ci和Tr 较CK 依次下降了34.59%、37.50%、20.39%和40.00%。

|
表 5 显示,Cd 处理后,幼苗叶片的细胞膜透性逐渐增大。胁迫20 d,各浓度的相对电导率均显著高于CK(P<0.05),说明叶片细胞膜受到Cd2+伤害。胁迫40d 和60 d,Cd2+浓度≤60 mg·kg-1时,相对电导率与CK相比差异不显著(P>0.05),说明胁迫处理一段时间后,苦楝幼苗产生了一定的适应性;150 mg·kg-1 和180 mg·kg-1 Cd 处理下差异不显著,说明Cd2+浓度达到一定高度后,对苦楝细胞膜透性的影响逐渐减弱。MDA 含量随Cd 浓度增加呈缓慢上升趋势,Cd 胁迫20 d、Cd2+浓度≥60 mg·kg-1 以及胁迫处理40 d和60d、Cd2+浓度≥90 mg·kg-1 时,MDA 含量显著高于对照(P<0.05);三个处理时间节点下,Cd2+浓度为180 mg·kg-1 时,MDA 含量分别是CK 的6.38、2.19 倍和1.90倍,而且胁迫20 d,与150 mg·kg-1 Cd 处理相比,180mg·kg-1处理的MDA 含量上升幅度较大。
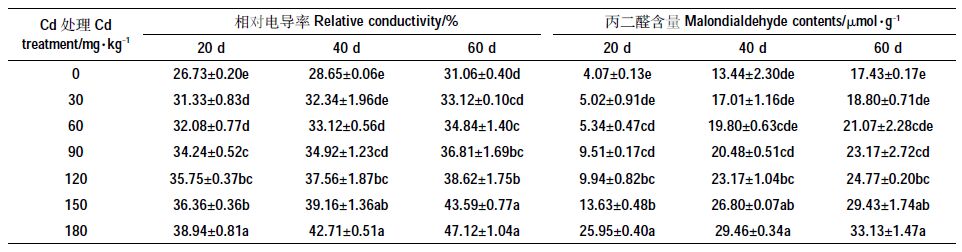
|
如表 6 所示,可溶性糖含量随Cd 胁迫浓度增加而降低,180 mg·kg-1 Cd 处理下有最小值,20、40、60 d时,较CK 分别下降27.21%,20.36%和24.23%,而30mg·kg-1 Cd 处理与CK 差异不显著(P>0.05)。
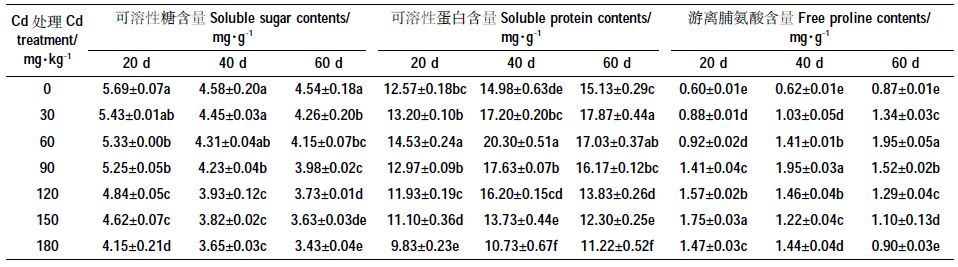
|
可溶性蛋白含量随Cd 处理浓度的增加先升后降,20 d和40 d的峰值出现在Cd2+浓度60 mg·kg-1时,分别较CK 上升15.65%和35.48%;处理60 d,峰值出现在Cd2 +浓度30 mg·kg-1 时,较CK 上升18.06%;且Cd2+浓度≤120 mg·kg-1 时,可溶性蛋白含量均不低于CK。
游离性脯氨酸含量也随Cd2+浓度的增加先升后降,20、40、60 d其峰值分别出现在Cd2+浓度为150、90、60 mg·kg-1时,分别较CK 上升193.38%、214.32%和123.03%,且各处理下游离脯氨酸含量均显著高于对照(P<0.05)。
3 讨论Cd 是植物生长发育的非必需元素,但其在土壤中有高度移动性,易被植物吸收,从而影响植物蒸腾作用、光合作用和呼吸作用等正常生理代谢过程[18]。Cd 对植物的毒害首先反映在生物量的变化上[15],实验结果显示,随着Cd2+浓度的增大,苦楝幼苗根、茎干重呈“低促高抑”效应。这与具有耐Cd性的园林植物海桐[19]的研究结果一致,且苦楝比海桐的耐性更强。随着Cd 处理浓度的升高,苦楝幼苗根、茎、叶中的Cd含量上升,Cd在苦楝体内的分布特征为根>茎>叶,且根中Cd 含量远高于茎和叶,说明根是苦楝积累Cd的主要部位。这与超富集植物龙葵[20]的研究结果不同,但与同为楝科的香椿和红椿[21]的研究结果一致,可能与不同植物独特的解毒机制有关。苦楝通过根系固定的方式限制Cd2+转移,既能维持地上部的观赏特性,又能达到修复土壤污染的目的。
叶绿素是植物进行光合作用的重要色素,其含量变化与光合作用密切相关[16]。本研究中,低于90 mg·kg-1 Cd 处理,苦楝幼苗叶片Chla+b 与CK 无显著差异(P<0.05),而当Cd2+浓度超过120 mg·kg-1,Chla 和Chlb 含量下降,叶片颜色变浅发黄,品质变差。究其原因,可能是高浓度Cd2+与叶绿体中蛋白质的巯基(-SH-)结合,破坏叶绿体的结构和功能,最终导致叶绿素的降解[22]。此外,Cd2+还可以通过抑制卡尔文循环相关的酶活性和使气孔部分关闭等途径,直接或间接影响植物的光合作用[23]。低于60 mg·kg-1 Cd 处理的Pn 与CK差异不显著(P>0.05),表明苦楝对低浓度Cd2+具有较强的光合耐受性。随Cd 处理浓度增加,叶片的Pn、Gs和Ci均呈下降趋势,说明气孔的部分关闭是苦楝叶片光合速率降低的主要原因[24]。120 mg·kg-1Cd处理的Pn、Gs、Ci和Tr明显低于CK,此时苦楝幼苗的有机物合成能力显著下降,其原因与气孔限制引起的Ci 降低以及Chla+b含量下降有关。而Tr下降导致的叶片蒸腾拉力降低,是否与苦楝养分的吸收受阻相关,有待进一步研究。
细胞膜是保障植物细胞内外物质交换运输的重要结构,Cd 胁迫诱导产生活性氧自由基(ROS),引发膜脂过氧化,导致细胞膜结构和功能损伤[25]。MDA是膜脂过氧化的产物,其含量的高低和细胞质膜透性的变化可以反映细胞膜受伤害的程度[26]。本研究中,高浓度Cd胁迫下,苦楝幼苗叶片相对电导率增大,MDA含量上升。Cd2+诱导产生的ROS 积累到一定程度,可以促进Cd2+与含N、S 基团或蛋白质结合,形成二硫键(-S-S-),导致膜离子通道结构破坏[16]。而低浓度处理,REC 和MDA 含量变化不显著(P>0.05),说明此时膜系统能够正常运行,可能与其启动了抗氧化酶保护机制[12]和渗透调节机制有关。
植物在遭遇干旱、高盐、低温以及重金属胁迫等逆境时,会迅速积累脯氨酸、可溶性蛋白、可溶性糖、甜菜碱以及有机酸等一系列渗透调节物质,从而增强植物的防御能力[27]。可溶性糖可以有效地提高细胞渗透浓度,降低水势,同时也是构成生物大分子的碳架和重要的能量来源[28]。本研究发现,Cd2+浓度高于60mg·kg-1 时,苦楝幼苗可溶性糖含量显著低于CK(P<0.05)。这与刺槐幼苗[29]的研究结果不同,可能是因为Cd2+干扰了苦楝对营养物质的吸收和分配,使得氧化和光合过程受阻,从而导致可溶性糖含量下降[30]。此外,研究发现脯氨酸等有机渗透调节物质的合成,需要可溶性糖提供碳源和能量[31],也是可溶性糖含量下降的原因。Cd2+胁迫下可溶性蛋白含量先升后降,可能是因为低浓度Cd2+能诱导植物形成Cd 结合蛋白(Cd-Bp),如金属硫蛋白和类金属螯合蛋白等[32],从而降低Cd 毒害,提高苦楝的抗逆性;另一方面增加的可溶性蛋白有助于维持细胞渗透压,保障植物进行正常的生理代谢。当Cd2+浓度高于90 mg·kg-1,可溶性蛋白含量下降并低于对照,表明此时Cd2+浓度已经超过了可溶性蛋白调节的阈值,高浓度的Cd2+抑制了DNA 的合成,加速了蛋白质的分解,导致其含量下降。脯氨酸是植物蛋白的组成之一,是维持细胞渗透平衡的重要调节物质,因其具有偶极性,在稳定细胞膜结构方面也起着重要作用[31],其含量变化是植物受到逆境胁迫的一种信号。本研究中苦楝幼苗游离脯氨酸含量随Cd2+浓度的增加呈先升后降的趋势,但各处理下均显著高于CK(P<0.05),低浓度下游离脯氨酸迅速积累,最高可达对照组的2~3 倍。脯氨酸含量的增加在一定程度上维持了细胞渗透压,保持了细胞膜结构和功能的完整性,还有利于清除过量积累的ROS,调节细胞氧化还原电势[33],对提高植物对Cd 的耐受性具有重要意义。
4 结论(1)苦楝对Cd 有一定的积累能力,且Cd 的分布特征为根>茎>叶,根系是积累Cd的主要部位。
(2)低于60 mg·kg-1 Cd 处理,对苦楝幼苗的根、茎部干重有显著促进作用,对Chla+b 含量、Pn、相对电导率以及MDA 含量无显著影响,植株能较好地生长;120 mg·kg-1 Cd 处理下,株高、Chla 和Chlb 含量与CK 无显著差异(P>0.05),植株能正常生长且保持较大的生物量,说明苦楝对Cd有一定的耐受能力。
(3)苦楝幼苗可溶性蛋白和游离脯氨酸含量均随Cd2+浓度的增大呈先升后降的趋势,低Cd2+浓度处理下的渗透调节以可溶性蛋白为主,游离脯氨酸调节为辅,高Cd2+浓度下则以游离脯氨酸调节为主。综上所述,苦楝耐Cd 胁迫的阈值浓度大约是120 mg·kg-1,即苦楝可以作为绿化和造林树种应用于Cd污染低于此浓度的城市和矿区,且其在土壤Cd 污染的修复中具有较大的应用潜力。
| [1] | 廖柏勇, 陈晓阳, 陈丽君, 等. 苦楝种源间种子发芽变异的观测[J]. 广东农业科学 , 2014 (11) : 43–47. LIAO Bo-yong, CHEN Xiao-yang, CHEN Li-jun, et al. Observation of Melia azedarach seed germination variation among provenances[J]. Guangdong Agricultural , 2014 (11) : 43–47. |
| [2] | 王家源, 郭杰, 喻方圆. 不同种源苦楝种子生物学特性差异[J]. 南京林业大学学报(自然科学版) , 2013, 37 (1) : 49–54. WANG Jia-yuan, GUO Jie, YU Fang-yuan. The differences of seed biological characters in Melia azedarach L. from different provenances[J]. Journal of Nanjing Forestry University(Natural Science Edition) , 2013, 37 (1) : 49–54. |
| [3] | 刘佳敏, 徐华潮. 苦楝对星天牛的引诱研究[J]. 浙江农林大学学报 , 2014, 31 (3) : 437–441. LIU Jia-min, XU Hua-chao. Attractiveness of Melia azedarach to A noplophora chinensis[J]. Journal of Zhejiang A&F University , 2014, 31 (3) : 437–441. |
| [4] | 杨吉安, 马玉花, 苏印泉, 等. 苦楝研究现状及发展前景[J]. 西北林学院学报 , 2004, 19 (1) : 115–118. YANG Ji-an, MA Yu-hua, SU Yin-quan, et al. Review and prospect of research and development in chinaberry tree[J]. Journal of Northwest Forestry University , 2004, 19 (1) : 115–118. |
| [5] | 陈丽君, 邓小梅, 丁美美, 等. 苦楝种源果核及种子性状地理变异的研究[J]. 北京林业大学学报 , 2014, 36 (1) : 15–20. CHEN Li-jun, DENG Xiao-mei, DING Mei-mei, et al. Geographic variation in traits of fruit stones and seeds of Melia azedarach[J]. Journal of Beijing Forestry University , 2014, 36 (1) : 15–20. |
| [6] | 张子晗, 王家源, 喻方圆. 盐胁迫对两种源苦楝种子萌发特性的影响[J]. 南京林业大学学报(自然科学版) , 2014, 38 (5) : 107–112. ZHANG Zi-han, WANG Jia-yuan, YU Fang-yuan. Effects of NaCl stress on germination characteristics of Melia azedarach L. seeds from two provenances[J]. Journal of Nanjing Forestry University(Natural Sciences Edition) , 2014, 38 (5) : 107–112. |
| [7] | 陈平, 万福绪, 顾汤华, 等. 干旱胁迫下侧柏、苦楝等树种的生理生化响应及抗旱性评价[J]. 林业科技开发 , 2012, 26 (4) : 43–48. CHEN Ping, WAN Fu-xu, GU Tang-hua, et al. Physiological and biochemical response and drought tolerance evaluation on five tree species under drought stress[J]. Forestry Science and Technology , 2012, 26 (4) : 43–48. |
| [8] | 王家源, 郭杰, 喻方圆. 不同产地苦楝苗木抗寒性差异[J]. 林业科技开发 , 2011, 25 (3) : 67–69. WANG Jia-yuan, GUO Jie, YU Fang-yuan. The difference of cold resistance in Melia azedarach seedlings among different provenance[J]. Forestry Science and Technology , 2011, 25 (3) : 67–69. |
| [9] | 陈丽君, 刘明骞, 廖柏勇, 等. 苦楝SRAP分子标记及遗传多样性分析[J]. 华南农业大学学报 , 2016, 37 (1) : 70–74. CHEN Li-jun, LIU Ming-qian, LIAO Bo-yong, et al. Analysis of genetic diversity of Melia azedarach with SRAP markers[J]. Journal of South China Agricultural University , 2016, 37 (1) : 70–74. |
| [10] | 王芳, 廖柏勇, 李培, 等. 苦楝SSR-PCR反应体系优化及引物筛选[J]. 林业科学研究 , 2016, 29 (2) : 167–175. WANG Fang, LIAO Bo-yong, LI Pei, et al. Optimization of SSR-PCR reaction system and primer screening of Melia azedarach[J]. Forest Research , 2016, 29 (2) : 167–175. |
| [11] | 陈丽君, 刘明骞, 廖柏勇, 等. 苦楝SRAP-PCR反应体系的建立及优化[J]. 华南农业大学学报 , 2015, 36 (3) : 104–108. CHEN Li-jun, LIU Ming-qian, LIAO Bo-yong, et al. Establishment and optimization of SRAP-PCR system in Melia azedarach[J]. Journal of South China Agricultural University , 2015, 36 (3) : 104–108. |
| [12] | 廖源林, 蔡仕珍, 邓辉茗, 等. 苦楝叶片抗氧化系统对Cd2+胁迫的响应[J]. 东北林业大学学报 , 2015, 43 (11) : 22–27. LIAO Yuan-lin, CAI Shi-zhen, DENG Hui-ming, et al. Response of antioxidative system to cadmium stress in Melia azedarach leaf[J]. Journal of Northeast Forestry University , 2015, 43 (11) : 22–27. |
| [13] | 谢贤健. 基于GIS和地积累指数法的内江市城市土壤镉含量及污染评价[J]. 地球与环境 , 2016, 44 (1) : 82–88. XIE Xian-jian. Concentration and spatial distribution characteristics and pollution evaluation on Cd in soil from Neijiang City, China based on GIS and Index of Geoaccumulation[J]. Earth and Environment , 2016, 44 (1) : 82–88. |
| [14] | 符娟林, 章明奎, 厉仁安. 基于GIS的杭州市居民区土壤重金属污染现状及空间分异研究[J]. 土壤通报 , 2005, 36 (4) : 575–578. FU Juan-lin, ZHANG Ming-kui, LI Ren-an. GIS-Assisted assessment and spatial variation of heavy metal pollution in soils of residential areas of Hangzhou City[J]. Chinese Journal of Soil Science , 2005, 36 (4) : 575–578. |
| [15] | 顾翠花, 王懿祥, 白尚斌, 等. 四种园林植物对土壤镉污染的耐受性[J]. 生态学报 , 2015, 35 (8) : 2536–2544. GU Cui-hua, WANG Yi-xiang, BAI Shang-bin, et al. Tolerance and accumulation of four ornamental species seedlings to soil cadmium contamination[J]. Acta Ecologica Sinica , 2015, 35 (8) : 2536–2544. |
| [16] | 刘柿良, 杨容孑, 马明东, 等. 土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响[J]. 农业环境科学学报 , 2015, 34 (2) : 240–247. LIU Shi-liang, YANG Rong-jie, MA Ming-dong, et al. Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L. plants[J]. Journal of Agro-Environment Science , 2015, 34 (2) : 240–247. |
| [17] | 熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003 . XIONG Qing-e. Plant physiology experiment tutorial[M]. Chengdu: Sichuan Science and Technology Press, 2003 . |
| [18] | 王玉萍, 常宏, 李成, 等. Ca2+对镉胁迫下玉米幼苗生长、光合特征和PSⅡ功能的影响[J]. 草业学报 , 2016, 25 (5) : 40–48. WANG Yu-ping, CHANG Hong, LI Cheng, et al. Effects of exogenous Ca2+ on growth, photosynthetic characteristics and photosystemⅡ function of maize seedlings under cadmiun stress[J]. Acta Prataculture Sinica , 2016, 25 (5) : 40–48. |
| [19] | 曹霞, 郭朝晖, 肖细元, 等. 海桐(Pittosporum tobira)对污染土壤中镉的耐受和吸收特征[J]. 农业环境科学学报 , 2015, 34 (4) : 627–632. CAO Xia, GUO Zhao-hui, XIAO Xi-yuan, et al. Cadmium tolerance and uptake characteristics in Pittosporum tobira in contaminated soil[J]. Journal of Agro-Environment Science , 2015, 34 (4) : 627–632. |
| [20] | 郭智, 王涛, 奥岩松. 镉对龙葵幼苗生长和生理指标的影响[J]. 农业环境科学学报 , 2009, 28 (4) : 755–760. GUO Zhi, WANG Tao, AO Yan-song. Physiological responses of Solanum nigrum L. seedlings to cadmium stress[J]. Journal of Agro-Environment Science , 2009, 28 (4) : 755–760. |
| [21] | 徐睿. Cd污染对四川珍贵乡土树种的影响及螯合剂效应研究[D]. 成都:四川农业大学, 2015. XU Rui. The effect of Cd on valuable native woody species in Sichuan Province and the chelators' effect on the candidate species[D]. Chengdu:Sichuan Agricultural University, 2015. |
| [22] | 简敏菲, 杨叶萍, 余厚平, 等. 不同浓度Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J]. 植物生理学报 , 2015, 51 (8) : 1331–1338. JIAN Min-fei, YANG Ye-ping, YU Hou-ping, et al. Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of Ramie(Boehmeria nivea)[J]. Plant Physiology Journal , 2015, 51 (8) : 1331–1338. |
| [23] | 贾中民, 王力, 魏虹, 等. 垂柳和旱柳对镉的积累及生长光合响应比较分析[J]. 林业科学 , 2013, 49 (11) : 51–59. JIA Zhong-min, WANG Li, WEI Hong, et al. Comparative analysis of Salix babylonica and Salix matsudana for their cadmium accumulation, growth and photosynthesis in response to cadmium contamination[J]. Scientia Silvae Sinicae , 2013, 49 (11) : 51–59. |
| [24] | 许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯 , 1997, 33 (4) : 241–244. XU Da-quan. Some problems in stomatal limitation analysis of photosynthesis[J]. Plant Physiology Communications , 1997, 33 (4) : 241–244. |
| [25] | 张然然, 张鹏, 都韶婷. 镉毒害下植物氧化胁迫发生及其信号调控机制的研究进展[J]. 应用生态学报 , 2016, 27 (3) : 981–992. ZHANG Ran-ran, ZHANG Peng, DOU Shao-ting. Oxidative stress-related signals and their regulation under Cd stress[J]. Chinese Journal of Applied Ecology , 2016, 27 (3) : 981–992. |
| [26] | 田治国, 王飞. 不同品种万寿菊对镉胁迫的生长和生理响应[J]. 西北植物学报 , 2013, 33 (10) : 2057–2064. TIAN Zhi-guo, WANG Fei. Growth and physiological response of Tagetes cultivars to cadmiun stress[J]. Acta Bot Boreal-Occident Sin , 2013, 33 (10) : 2057–2064. |
| [27] | 张丽萍, 刘志强, 金竹萍, 等. H-2S对镉胁迫下白菜幼苗根系渗透胁迫的调节作用[J]. 农业环境科学学报 , 2016, 35 (2) : 247–252. ZHANG Li-ping, LIU Zhi-qiang, JIN Zhu-ping, et al. Regulation of H2S on Cd-induced osmotic stress in roots of Chinese cabbage seedling[J]. Journal of Agro-Environment Science , 2016, 35 (2) : 247–252. |
| [28] | 马玉心, 蔡体久, 宋丽萍, 等. 兴安鹿蹄草[Pyrola dahurica(H. Andr.)Kom.]雪盖前后丙二醛及渗透调节物质含量的变化[J]. 生态学报 , 2007, 27 (11) : 4596–4602. MA Yu-xin, CAI Ti-jiu, SONG Li-ping, et al. Changes in contents of MDA and osmoregulatory substances during snow cover for Pyrola dahurica[J]. Acta Ecologica Sinica , 2007, 27 (11) : 4596–4602. |
| [29] | 陆秀君, 关欣, 许有博, 等. 镉对刺槐幼苗生长和与透调节有关物质含量的影响[J]. 中国土壤与肥料 , 2008 (6) : 82–83. LU Xiu-jun, GUAN Xin, XU You-bo, et al. Study on ammonia-oxidizing activity and biological characteristics of a Corynebacterium spp. strain[J]. Soil and fertilizer of China , 2008 (6) : 82–83. |
| [30] | 夏建国, 兰海霞. 镉胁迫对蒙山茶树生长及叶片生理指标的影响[J]. 茶叶科学 , 2008, 28 (1) : 56–61. XIA Jian-guo, LAN Hai-xia. Effects of cadmium stress on growth of tea plant and physiological index in leaves of Mengshan Tea[J]. Journal of Tea Science , 2008, 28 (1) : 56–61. |
| [31] | 徐智敏, 何宝燕, 李取生, 等. 盐分胁迫下两个苋菜品种对镉及主要渗透调节物质累积的差异[J]. 生态学杂志 , 2015, 34 (2) : 483–490. XU Zhi-min, HE Bao-yan, LI Qu-sheng, et al. Differences between two amaranth cultivars in accumulations of Cd and main osmotic adjustment substances under salt stress[J]. Chinese Journal of Ecology , 2015, 34 (2) : 483–490. |
| [32] | 张静, 赵秀侠, 汪翔, 等. 重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J]. 植物生理学报 , 2015, 51 (11) : 1969–1974. ZHANG Jing, ZHAO Xiu-xia, WANG Xiang, et al. Effects of cadmium stress on the growth and physiological property of Oenanthe javanica[J]. Plant Physiology Journal , 2015, 51 (11) : 1969–1974. |
| [33] | 梁泰帅, 刘昌欣, 康靖全, 等. 硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J]. 农业环境科学学报 , 2015, 34 (8) : 1455–1463. LIANG Tai-shuai, LIU Chang-xin, KANG Jing-quan, et al. Effects of sulfur on cadmium accumulation, photosynthesis and some other physiological characteristics of Pakchoi(Brassica chinensis L.) under cadmium stresses[J]. Journal of Agro-Environment Science , 2015, 34 (8) : 1455–1463. |
 2016, Vol. 35
2016, Vol. 35




