文章信息
- 林燕, 张焕杰, 刘曦, 俞璐, 朱文颖, 孔海南
- LIN Yan, ZHANG Huan-jie, LIU Xi, YU Lu, ZHU Wen-ying, KONG Hai-nan
- 固定反硝化菌强化人工湿地处理低污染水研究
- Performance of immobilized denitrifying bacteria in constructed wetland for slightly-polluted water treatment
- 农业环境科学学报, 2016, 35(11): 2154-2162
- Journal of Agro-Environment Science, 2016, 35(11): 2154-2162
- http://dx.doi.org/10.11654/jaes.2016-0540
文章历史
- 收稿日期: 2016-04-19
近年来,人工湿地被广泛用于流域水体及污水厂尾水等的处理[1-2],但其脱氮效率受气温影响较大,低温时脱氮效果不佳[3-4],且脱氮过程中产生的NO2--N积累对微生物产生毒害作用而阻碍生物脱氮[5]等。固定化微生物技术具有环境适应能力强、耐毒害能力强等优点[6-7],可弥补湿地脱氮的不足,强化脱氮效果。张永栋等[8]进行的聚乙烯醇凝胶包埋方法固定化细菌联合植物的除氮研究,唐美珍等[9]进行的Pseudomonas flava WD-3固定化技术及其强化SBR污水处理的应用研究,张会萍等[10]进行的陶粒固定化脱氮菌群对景观水中NO3--N的去除研究,都证实了该强化技术的可行性。但对于固定化脱氮菌投加至人工湿地时投加方式的研究尚少,且大多研究是对强化结果的考查,而对强化原因的分析较少。
本研究考查了固定化反硝化菌投加至湿地系统时,不同投加位置(上层、下层、上下层)对系统低污染水脱氮效果的影响,采用高通量测序技术从微生物层面分析强化原因,并考察其在低温下的系统脱氮强化效果。
1 材料与方法 1.1 固定化反硝化菌菌种:Pseudomonas stutzeri A1501(序列号为NR_ 074829.1),实验室分离所得。
固定化材料:聚乙烯醇(PVA)、海藻酸钠(SA)。
固定化方法:硼酸包埋法。
固定化颗粒:密度为0.93 g·mL-1,平均1 g固定化颗粒中所含反硝化菌质量为0.02 g。
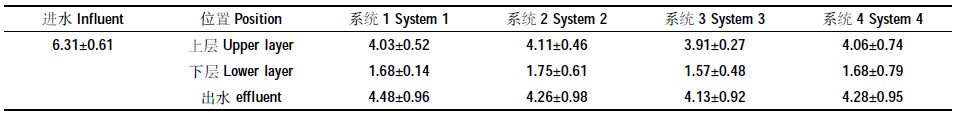
1.2 进水水质人工湿地系统进水为人工模拟低污染水,其主要污染物为NO3--N和COD,由自来水与KNO3、葡萄糖、K2HPO4、MgSO4·7H2O等试剂配制而成。相关水质参数见表 1。
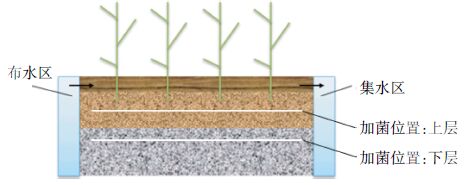
实验室模拟水平潜流人工湿地系统装置如图 1所示。材质为聚氯乙烯,尺寸为0.8 m(长)×0.25 m(宽)×0.7 m(高),总容积0.14 m3,内部填充8~12 mm粒径砾石,填充高度0.50 m,有效水深0.45 m。湿地植物为芦苇,种植密度为40株·m-2,种植前置于10%修正的Hoagland培养液中生长一周[10]。系统采用连续运行方式,流量为20 L·d-1,水力停留时间为2.0 d。
|
| 图 1 实验室模拟人工湿地装置 Figure 1 Constructed wetlands at pilot scale |
固定化反硝化菌的投加位置主要为湿地上下两层(均匀投加,三组湿地系统固定化反硝化菌的投加总量相同),分别设在填料表面下10 cm与35 cm处。各系统均在25 ℃条件下运行(人工气候室控制)。根据各系统中投加位置的不同,实验设置4组处理系统:第一组为空白(处理系统1);第二组为下层投加固定化反硝化菌(处理系统2);第三组为上层投加固定化反硝化菌(处理系统3);第四组为上下层均投加固定化反硝化菌(处理系统4)。
1.3.2 固定化反硝化菌对人工湿地脱氮的强化实验为探究固定化反硝化菌在低温下(15 ℃,人工气候室控制)对人工湿地脱氮的强化效果,根据1.3.1的实验结果,设置以下两组处理系统:第一组为空白(处理系统1);第二组为投加固定化反硝化菌强化人工湿地脱氮效果最佳的处理系统(由1.3.1实验确定)。比较分析不同处理系统中TN、NO3--N的去除效果。
1.4 测试方法水质监测:NO3--N、NO2--N、TN的测定采用QC-8500流动注射仪[12]。DO、pH测定分别采用HQ300D DO测定仪[13]和PHS-3CT pH计[14]。
微生物多样性分析:高通量测序平台(Illumina-Miseq 2×300 bp),微基生物科技有限公司。
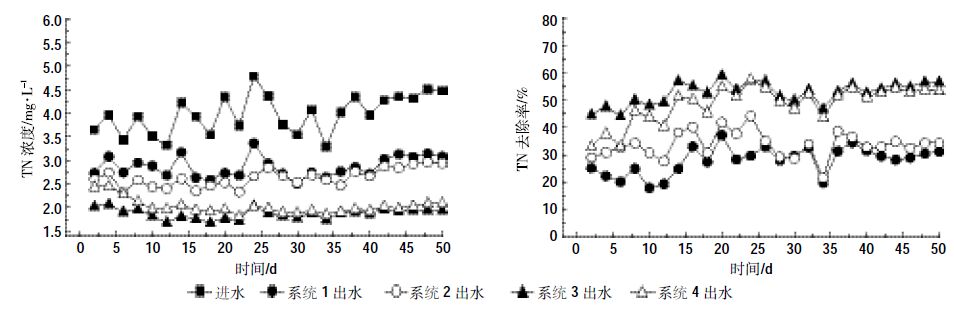
2 结果与分析 2.1 投加位置对人工湿地处理系统脱氮的影响 2.1.1 各人工湿地处理系统脱氮效果分析由图 2可知,在各人工湿地系统运行的前28 d,各处理系统出水TN浓度随进水TN浓度的变化而波动,但上下层均投加固定化反硝化菌的湿地系统出水TN浓度变化较小,投加固定化反硝化菌的三组强化湿地系统对TN的去除效果优于空白湿地系统。这主要是因为投加反硝化菌减少了湿地系统启动及脱氮微生物群落形成的时间。在运行的第28~50 d,各处理系统出水TN浓度均维持在相对稳定水平,空白湿地TN去除率较前阶段提高,出水TN浓度与下层投加反硝化菌湿地相差不大,说明随着系统的连续运行,空白湿地内植物逐渐适应系统环境并开始稳定生长,由此可见人工湿地内进行污染物去除的主要复合生态系统:基质-微生物-植物形成并稳定发挥作用。
|
| 图 2 各处理系统对TN去除效果 Figure 2 Total nitrogen removal efficiency in CWs |
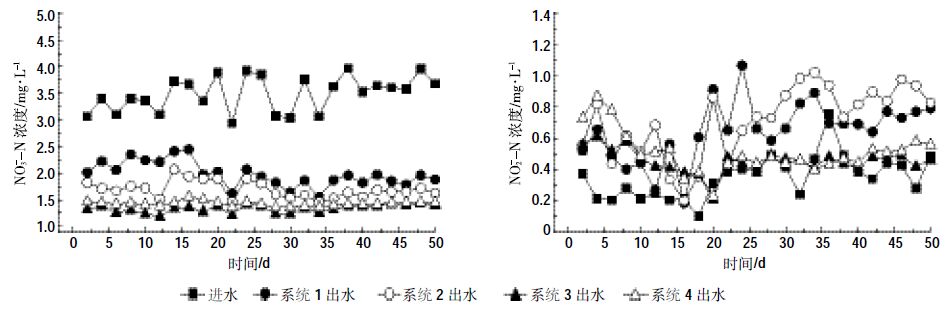
由图 2和图 3可以看出,各人工湿地处理系统在进水TN浓度为3~5 mg·L-1、NO3--N浓度为3~4 mg·L-1的条件下,处理系统3对TN的去除效果最好,即上层投加固定化反硝化菌对人工湿地脱氮的强化效果最佳,其TN去除率可达60.31%,优于处理系统1(空白对照人工湿地系统TN去除率为37.24%)、处理系统2(下层投加固定化反硝化菌TN去除率为44.35%)和处理系统4(上下层均投加固定化反硝化菌TN去除率为57.74%)。
|
| 图 3 各处理系统出水NO3--N与NO2--N浓度变化 Figure 3 Changes of nitrite and nitrate concentrations in effluent of CWs |
综合各处理系统出水TN浓度以及TN去除率来看,投加固定化反硝化菌的位置不同,对人工湿地脱氮的强化效果也不同,装置运行前期上层投加固定化反硝化菌系统的TN去除率最高,运行后期上层投加与上下层均投加固定化反硝化菌系统的TN去除率差别不大。分析其原因,主要有以下两点:
第一,潜流人工湿地内的水流分布特性显示,当进水口位于人工湿地基质表层,出水口位于与进水口平行高度处时,进入人工湿地的污水首先流经靠近湿地进水口上层部分,该处投加固定化反硝化菌对强化人工湿地脱氮效果最明显,孔德川等[15]用CFD Fluent多孔介模型对分层式潜流人工湿地内部的流场进行模拟的分析结果表明(图 4),进入人工湿地的污水水流分布主要在进水口区、出水口区以及人工湿地的底层区域。若据此来看,湿地下层投加固定化反硝化菌对脱氮的强化效果应为最佳,但湿地下层流速较快,水流流经下层时停留时间较短,且流经湿地上层的水体中NO3--N去除效果较差,从而使系统整体出水TN浓度偏高。因此,在投加位置的选择上,上层投加与上下层投加均为较好的方式。

|
| 图 4 人工湿地潜流流线图 Figure 4 The contour of stream function of the subsurface flow wetland |
第二,在本实验中湿地上层是植物根系生长的主要区域,发达的根系不仅为微生物生长提供了依附介质和环境,而且植物根系的分泌物和脱落物能够为微生物提供生长所需的营养物质和反硝化作用所需的碳源。Salvato等[16]及Henry等[17]研究表明植物根际分泌物对反硝化作用起到促进作用。这主要体现在三方面:NO3--N含量、根际溶解氧的量和根际可溶性有机碳量。植物的同化作用,使得植物根际附近的NO3--N含量降低;植物根系的呼吸作用使根际附近氧分压降低,以利于反硝化作用的进行;植物根系在代谢过程中会向外释放分泌物,其中的有机可溶性物质包括碳水化合物氨基酸、维生素和有机酸,可供植物吸收利用,并为根际微区中的微生物提供能源。因此,上层投加固定化反硝化菌具备反硝化作用所需的良好条件,反硝化作用较强,从而对强化人工湿地脱氮效果较明显。
在人工湿地系统的脱氮过程中,NO2--N虽为整个脱氮过程的中间产物,但其浓度变化对系统脱氮效果的影响也很重要,实验中考查NO2--N浓度变化是为了分析投加固定化反硝化菌对人工湿地系统NO2--N去除及是否积累的情况的影响。从图 3中可以看出,在各处理系统运行的前10 d,处理系统4出水中的NO2--N浓度稍高于其他3个处理系统,但相差仅在0.1~0.3 mg·L-1范围内,而在各处理系统运行的30~50 d,处理系统3与处理系统4的NO2--N浓度则明显低于处理系统1与处理系统2。这说明,投加固定化反硝化菌在一定程度上减少了系统脱氮过程中NO2--N的积累。
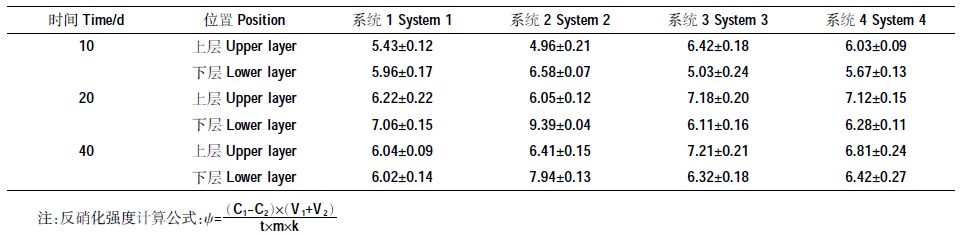
2.1.2 各人工湿地处理系统反硝化强度分析由表 2所示的反硝化强度结果可知,处理系统运行10 d时,在人工湿地系统上层,处理系统3与上下层均投加固定化反硝化菌的处理系统4反硝化强度明显强于处理系统1与处理系统2;在人工湿地系统下层,下层投加固定化反硝化菌的处理系统2与上下层均投加固定化反硝化菌的处理系统4反硝化强度明显强于处理系统1与处理系统3。显然,这主要是由于向人工湿地系统投加反硝化菌而产生的结果。但随着系统运行时间的增加,处理系统3与处理系统4内无论上层还是下层的反硝化强度的差异逐渐缩小,说明随着系统的运行,湿地植物的生长以及湿地微生物的繁殖,人工湿地处理系统3与4内的反硝化菌数量接近。这与2.1.1所得的处理系统3与处理系统4在运行的28~50 d,TN、NO3--N的去除效果相差不大这一结论一致。
综合表 3可见,不同位置处投固定化反硝化菌对各系统中不同位置处溶解氧浓度的变化虽有一定的影响,且投加固定化反硝化菌的各系统出水溶解氧浓度均低于空白对照组系统,但投加固定化反硝化菌的各系统溶解氧浓度的变化并未影响对系统的强化脱氮效果。
值得一提的是,处理系统2下层的反硝化强度在系统运行的整个过程中一直保持较高的水平,但其出水结果显示的TN及NO3--N去除率并不高。一方面这是由于湿地内水流分布的原因,另外,实际上反硝化强度的测定结果不仅与基质微生物数量有关,测定条件及测定过程中的碳源种类及数量也产生了重要的影响。
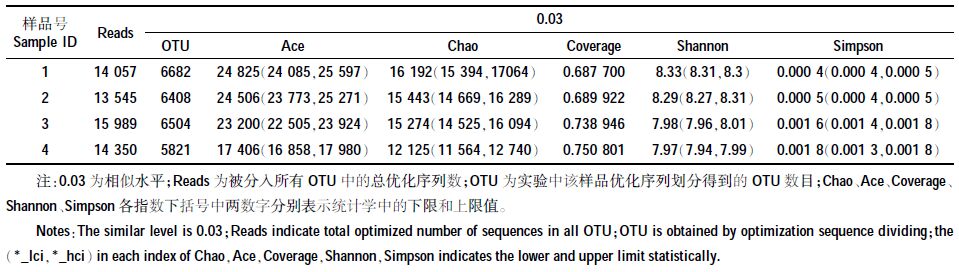
2.1.3 各人工湿地处理系统微生物多样性分析采用高通量测序技术,根据barcode序列区分各个样品数据。样品1、2、3、4(分别对应系统1~4)中所获得的优化有效序列条数分别为14 057、13 545、15 989、14 350条;在97%的相似水平下,对取自4个处理系统样品的测序结果进行多样性指数分析,具体结果如表 4所示。4个样品可分别划分为6682、6408、6504、5821个OTUs。对比分析Chao、Ace以及Shannon值可以得出,样品1中该3个指数值最大,可以说明空白对照组人工湿地系统中的微生物物种多样性最高,群落丰富度大;而样品4中该3个指数值最小,说明上下层均投加固定化反硝化菌的人工湿地系统中的微生物物种多样性最低,群落丰富度小。
对比分析4个样品的Simpson值可以得出如上相同结论。
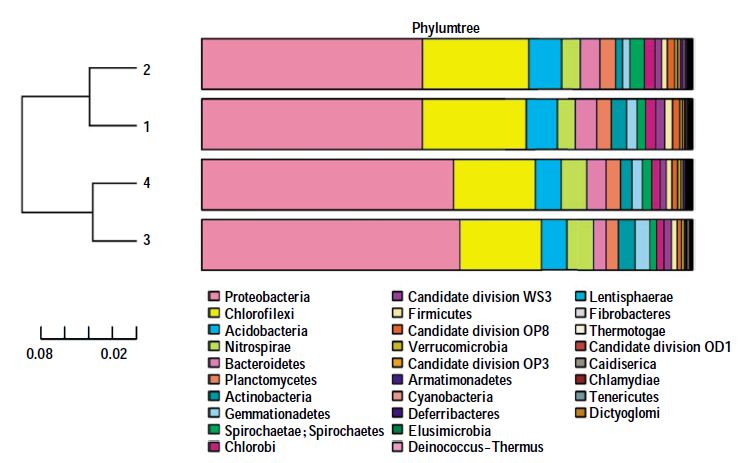
对4个处理系统样品以门水平进行微生物群落结构分析可知,4组样品所包含的微生物门类差异不大,均包含Proteobacteria(变形菌门)、Chloroflexi(绿弯菌门)、Nitrospira(硝化螺旋菌门)、Acidobacteria(酸杆菌门)等,且4组样品中所占的比例最大,即丰度最高的微生物均为Proteobacteria(变形菌门),其次为Chloroflexi(绿弯菌门),其他微生物门类在各自处理系统中所占的比例有所不同,如图 5所示。分析对比图 6可知,对于处理系统1与处理系统2来说,Acidobacteria(酸杆菌门)的丰度高于Bacteroidetes(拟杆菌门),也高于Nitrospira(硝化螺旋菌门),而处理系统3与处理系统4中所包含的Acidobacteria(酸杆菌门)与Nitrospira(硝化螺旋菌门)的比例相差不大,但均大于Bacteroidetes(拟杆菌门),另外各处理系统中的微生物群落所占门类还包括Gemmatimonadetes(芽单胞菌门)、Bacteroidetes(拟杆菌门)、Chlorobi(绿菌门)等。

|
| 图 5 环形发育树 Figure 5 Phylogenetic tree |
|
| 图 6 门水平物种分布柱状图 Figure 6 Microbial community barplot at phylum level |
Proteobacteria(变形菌门)是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等著名的种类。但其中所包含的自由生活的种类,如β-变形菌中无机化能种类,如可以氧化氨的Nitrosomonas(亚硝化单胞菌属),γ-变形菌中的Vibrionaceae(弧菌科)和Pseudomonadaceae(假单胞菌科)等,对生物的脱氮过程都起着重要的作用。本实验中,用于强化人工湿地脱氮效果而投加的固定化反硝化菌即为Pseudomonas(假单胞菌属)。从图 6可看出,处理系统3与处理系统4中微生物群落所含Proteobacteria(变形菌门)多于处理系统1与处理系统2,结合以上对于4个处理系统脱氮效果的分析,恰好说明投加固定化反硝化菌能够强化人工湿地脱氮效果的原因之一,即为投加的高效反硝化菌在人工湿地微生物反硝化作用中起到重要作用。
图 6中所示的Nitrospira(硝化螺旋菌门)在处理系统3与处理系统4中所占的比例大于其在处理系统1与处理系统2中所占比例。通过对该门类细菌的分析表明,Nitrospira(硝化螺旋菌门)是一类革兰氏阴性细菌,其中的Nitrospira(硝化螺旋菌属)作为硝化细菌(Nitrifier),可将亚硝酸盐氧化成硝酸盐,系统微生物群落中的该菌群增多,可减少NO2--N的积累,从而减轻NO2--N积累对系统脱氮微生物的毒害作用,以利于反硝化作用的进行,提高人工湿地系统整体的脱氮效果。
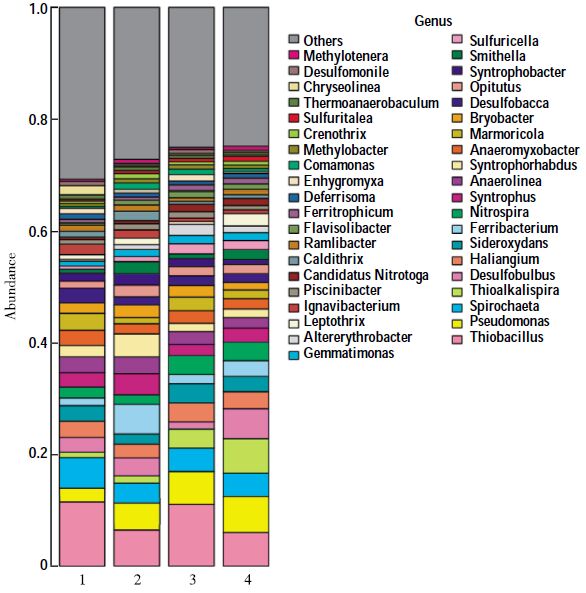
图 7所示为对4个处理系统样品以属水平进行的微生物群落多样性分析。由图可知,4个处理系统所包含的主要微生物种类差异不大,但各菌属所占比例各有不同,Pseudomonas(假单胞菌属)在处理系统2、处理系统3与处理系统4中所占比例均大于其在处理系统1中所占比例。这说明,投加至人工湿地系统的反硝化菌得以较好地生长繁殖,但从各处理系统出水的脱氮效果来看,处理系统2中,Psedomonas(假单胞菌属)的增多并未在很大程度上强化系统脱氮效果,而处理系统3与处理系统4脱氮效果却得以加强。从微生物方面分析其原因,可以发现,在处理系统3与处理系统4中,与Psedomonas(假单胞菌属)所占比例同样增加的菌属还包括Thioalkalispira(硫碱杆菌属)与Nitrospira(硝化螺旋菌属),而Nitrospira(硝化螺旋菌属)的存在可以与反硝化菌形成一个完整的硝化-反硝化的脱氮微生物体系。
|
| 图 7 属水平物种分布柱状图 Figure 7 Microbial community barplot at genus level |
根据2.1所得结果,将固定化反硝化菌强化人工湿地脱氮在低温(15 ℃)下进行,该实验分两组:第一组为空白(处理系统1);第二组为上层投加固定化反硝化菌(处理系统3)。比较分析不同处理系统中TN、NO3--N的去除效果。
由图 8和图 9可以看出,2.1中脱氮效果最好的处理系统3,在转为15 ℃的条件下,依然具有优于处理系统1的脱氮效果。在进水TN及NO3--N浓度范围不变的条件下,处理系统1与处理系统3的TN去除率分别可以达到24.81%和50.86%,NO3--N的去除率分别可以达到27.53%和55.06%。对比2.1中实验结果,当温度由25 ℃降至15 ℃时,处理系统1与处理系统3的TN去除率分别降低了12.43%和9.45%,NO3--N的去除率分别降低了23.15%和9.92%,显然,固定化反硝化菌所具有的耐低温性能在投加至人工湿地系统后同样体现了优势。由图 8和图 9还可以看出,随着系统运行时间的增加,投加固定化反硝化菌的人工湿地系统对氮素的去除率也增加。这表明,固定化反硝化菌不但具有耐低温性能,而且随着对低温环境的适应,能够表现出较好的脱氮性能。
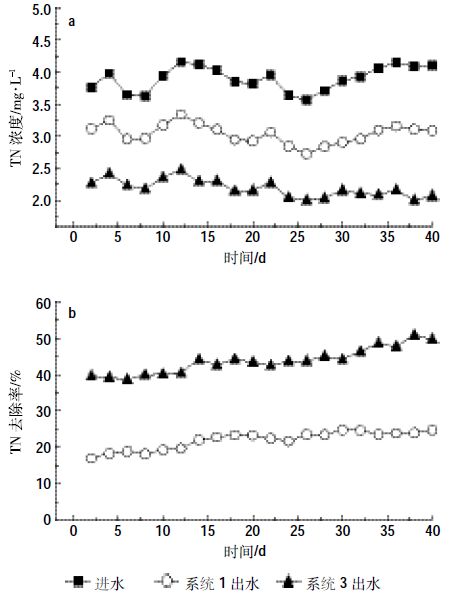
|
| 图 8 各处理系统对TN去除效果 Figure 8 Total nitrogen removal efficiency in CWs |
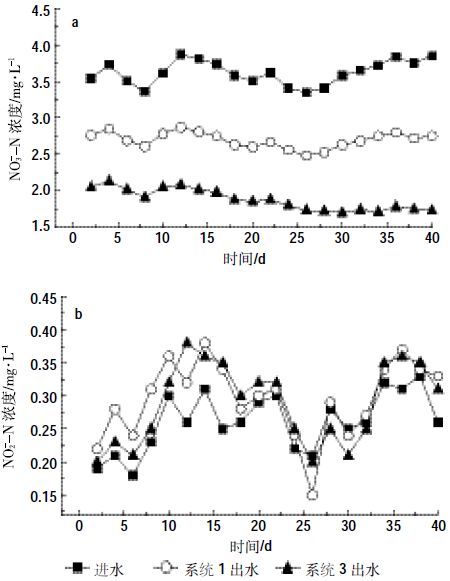
|
| 图 9 各处理系统出水NO3--N和NO2--N浓度变化 Figure 9 Changes of nitrite and nitrate concentrations in effluent of CWs |
由图 9可以看出,在15 ℃的运行条件下,空白对照组湿地系统与上层投加固定化反硝化菌的湿地系统出水NO2--N浓度相差不大,说明固定化反硝化菌的投加不会增加处理系统脱氮中的NO2--N积累。综合2.1.1中对两处理系统TN去除率的结果分析可以得出,在处理系统3脱氮效果优于处理系统2的同时(二者TN去除率分别为50.86%和24.81%),两处理系统出水NO2--N浓度相差不大。这说明,在低温条件下,固定化反硝化菌的投加也能够相对减少人工湿地系统脱氮过程中NO2--N的积累,从而对系统的脱氮效果起到强化作用。
3 结论在实验装置运行的50 d内,处理系统1、2、3、4的TN去除率分别达37.24%、44.35%、60.31%、57.74%。投加固定化反硝化菌强化了人工湿地脱氮效果,其中,上层投加固定化反硝化菌对人工湿地脱氮的强化效果最佳。
不同位置处投加固定化反硝化菌对湿地系统中微生物多样性产生不同程度的影响,但各处理系统间微生物群落多样性总体差异不大,均为Proteobacteria[变-6yChloroflexi(绿弯菌门)]所占比例最大,且上层与上下层均投加固定化反硝化菌的湿地系统出现的微生物群落多样性的细微变化,如Nitrospira(硝化螺旋菌门)所占比例增大,反而有利于提高系统脱氮效果。
在15 ℃条件下,上层投加固定化反硝化菌的湿地TN去除率可达50.86%,高于空白对照组湿地,说明固定化反硝化菌所具有的耐低温性能在投加至人工湿地系统后同样表现出较好的脱氮性能。
| [1] | Zhang T, Xu D, He F, et al. Application of constructed wetland for water pollution control in China during 1990-2010[J]. Ecological Engineering , 2012, 47 : 189–197. DOI:10.1016/j.ecoleng.2012.06.022 |
| [2] | Rai U N, Tripathi R D, Singh N K, et al. Constructed wetland as an ecotechnological tool for pollution treatment for conservation of Ganga river[J]. Bioresource Technology , 2013, 148 : 535–541. DOI:10.1016/j.biortech.2013.09.005 |
| [3] | Shen H, Hu H Y, Pan Y B. Study on enhanced measures for operation of subsurface flow constructed wetlands in winter[J]. China Water and Wastewater , 2007, 23 (5) : 44. |
| [4] | Lu S, Zhang P, Jin X, et al. Nitrogen removal from agricultural runoff by full-scale constructed wetland in China[J]. Hydrobiologia , 2009, 621 (1) : 115–126. DOI:10.1007/s10750-008-9636-1 |
| [5] | 王小晓, 龚珞军, 韩炜, 等. 自然复氧人工湿地处理农村污水动力学研究[J]. 环境科学与技术 , 2014, 37 (2) : 143–148. WANG Xiao-xiao, GONG Ge-jun, HAN Wei, et al. Dynamics study on two-stage constructed wetland treatment with natural reaeration to treat rural sewage[J]. Environmental Science and Technology , 2014, 37 (2) : 143–148. |
| [6] | Isaka K, Kimura Y, Osaka T, et al. High-rate denitrification using polyethylene glycol gel carriers entrapping heterotrophic denitrifying bacteria[J]. Water Research , 2012, 46 (16) : 4941–4948. DOI:10.1016/j.watres.2012.05.050 |
| [7] | Zhang J, Wu P, Hao B, et al. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001[J]. Bioresource Technology , 2011, 102 (21) : 9866–9869. DOI:10.1016/j.biortech.2011.07.118 |
| [8] | 张永栋, 汪龙眠, 张毅敏, 等. 聚乙烯醇凝胶包埋固定化细菌联合植物的除氮研究[J]. 生态与农村环境学报 , 2014, 30 (6) : 744–748. ZHANG Yong-dong, WANG Long-mian, ZHANG Yi-min, et al. Nitrogen removal of polyvinyl alcohol(PVA) gel embedded with nitrifying/denitrifying bacteria coupled with plant[J]. Journal of Ecology and Rural Environment , 2014, 30 (6) : 744–748. |
| [9] | 唐美珍, 张凤凤, 罗琳, 等. Pseudomonas flava WD-3固定化技术及其强化SBR污水处理的应用研究[J]. 环境科学学报 , 2016, 36 (5) : 1639–1647. TANG Mei-zhen, ZHANG Feng-feng, LUO Lin, et al. The immobilization of Pseudomonas flava WD-3 and its application in SBR for sewage treatment[J]. Acta Scientiae Circumstantiae , 2016, 36 (5) : 1639–1647. |
| [10] | 张会萍, 陈畅, 侯文华, 等. 陶粒固定化脱氮菌群对景观水中NO3--N的去除[J]. 环境科学研究 , 2013, 26 (6) : 684–688. ZHANG Hui-ping, CHEN Chang, HOU Wen-hua, et al. Utilizing denitrifying bacteria immobilized with ceramsite to remove NO3--N from landscape water[J]. Research of Environmental Sciences , 2013, 26 (6) : 684–688. |
| [11] | Shao Y, Pei H, Hu W, et al. Bioaugmentation in lab scale constructed wetland microcosms for treating polluted river water and domestic wastewater in Northern China[J]. International Biodeterioration & Biodegradation , 2014, 95 : 151–159. |
| [12] | 徐苏红. 浅谈我国环境监测站常用的分析方法[J]. 工业 , 2016 (14) : 67. XU Su-hong. Discussion on common analysis methods of environmental monitoring stations in China[J]. Industry , 2016 (14) : 67. |
| [13] | 崔利峰. 水口水库主要养殖水域水体溶解氧时空分布规律[J]. 福建农业科技 , 2016, 47 (1) : 28–31. CUI Li-feng. Spatial and temporal distribution of DO in main aquaculture water body in Shuikou reservoir[J]. Fujian Agricultural Science and Technology , 2016, 47 (1) : 28–31. |
| [14] | |
| [15] | 孔德川, 丁爱中, 郑蕾, 等. 分层式潜流人工湿地水力学特性数值模拟与分析[J]. 环境工程学报 , 2011, 5 (4) : 741–744. KONG De-chuan, DING Ai-zhong, ZHENG Lei, et al. Numerical simulation and analysis of hydraulic characteristics of layered subsurface flow constructed wetland[J]. Chinese Journal of Environmental Engineering , 2011, 5 (4) : 741–744. |
| [16] | Salvato M, Borin M, Doni S, et al. Wetland plants, micro-organisms and enzymatic activities interrelations in treating N polluted water[J]. Ecological Engineering , 2012, 47 : 36–43. DOI:10.1016/j.ecoleng.2012.06.033 |
| [17] | Henry S, Texier S, Hallet S, et al. Disentangling the rhizosphere effect on nitrate reducers and denitrifiers:Insight into the role of root exudates[J]. Environmental Microbiology , 2008, 10 (11) : 3082–3092. DOI:10.1111/emi.2008.10.issue-11 |
 2016, Vol. 35
2016, Vol. 35