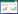文章信息
- 陈院真, 司友斌, 党菲, 李敏, 周东美
- CHEN Yuan-zhen, SI You-bin, DANG Fei, LI Min, ZHOU Dong-mei
- AgNP叶面和根系暴露对大豆(Glycine max L.xudou16)吸收及转运的影响
- Effect of foliar and root exposure of AgNP on the uptake and translocation of soybean (Glycine max L. xudou16)
- 农业环境科学学报, 2016, 35(12): 2285-2291
- Journal of Agro-Environment Science, 2016, 35(12): 2285-2291
- http://dx.doi.org/10.11654/jaes.2016-0912
文章历史
- 收稿日期: 2016-07-12
2. 中国科学院南京土壤研究所土壤环境与污染修复重点实验室, 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
近年来,纳米技术得到了迅猛发展。纳米材料是指在三维空间中至少有一维处于纳米尺度范围(1~100 nm)的颗粒或以这些颗粒为基本单元所构成的材料[1]。因具有优良的抗菌性能,纳米银(AgNP)是目前最常见的纳米材料之一。据相关报道,约有25%的纳米产品中含有AgNP[2-3]。AgNP兼具Ag元素和纳米材料的特性,广泛应用于卫生、医疗、保健、食品、化妆品、纺织品、环保材料、涂料等诸多领域[4]。AgNP的大量使用导致其不可避免地释放到自然环境中,并进入生态系统[5-8]。AgNP进入农田生态系统后可能对作物产生潜在风险,并通过食物链向高营养级传递和富集。因此,有必要研究作物对AgNP的吸收和累积。
大量研究表明,AgNP能够被植物根部吸收[9-11]。此外,还有学者就AgNP对植物根部根瘤菌的影响进行了研究,如Abd-Alla等[12]发现,在土壤中AgNP的含量为800 μg·kg-1时,蚕豆的发芽率减少了40%,并且根部的根瘤菌发生衰老、细胞恶化,固氮酶活性降低;Hossain等[13]、Mustafa等[14]研究了AgNP对大豆的蛋白组学的影响。国内关于AgNP对植物的吸收主要集中在AgNP对种子的萌发、生殖生长的影响。Yin等[15]对11种湿地植物的研究发现,AgNP粒径大小和培养环境一定程度影响种子萌发;王荣等[16]研究了AgNP对黑麦草生长特性的影响,结果表明AgNP显著降低了黑麦草根系总长度、活力和根尖数;Cui等[17]研究了AgNP对黄瓜和小麦的毒性,表明在较高暴露浓度情况下,AgNP和Ag+对小麦和黄瓜都具有明显的毒性,并且两种植物在营养生长阶段比萌发阶段对AgNP的毒性更敏感;彭小凤等[18]研究AgNP对拟南芥生殖生长的影响发现,2.5 mg·L-1的AgNP处理后,拟南芥的抽薹及开花时间均有推迟,且果荚发育也受到阻碍。这些均是基于根系暴露的基础上展开的研究,而对叶面暴露的研究较少。
事实上,AgNP已被报道作为植物的杀虫剂使用。例如,黑麦草叶面喷施含AgNP的杀虫剂后,有效减少了真菌病的发生[19]。Lamsal等[20]发现,通过给黄瓜和南瓜喷施AgNP,能够有效预防白粉病。植物可以通过叶片或者根系吸收环境中的纳米材料[21],在不同的暴露途径下,植物的吸收能力可能不同,且导致其在植物体内的转运和分配不同。Larue等[22]在莴苣叶面喷施AgNP,发现AgNP能够通过叶片气孔进入到莴苣叶脉中,并发生积累和转运;Dimkpa等[23]通过小麦根系暴露AgNP发现其能够从小麦根部转运到小麦芽中,说明AgNP能够在小麦体内积累和转化。但是,目前未见两种暴露途径的对比性研究报道。
本研究以大豆(Glycine max L.xudou16)为试验作物,采用水培方式,比较不同暴露途径下(叶面暴露、根系暴露、叶面和根系综合暴露)大豆对AgNP的吸收、累积和分布的差异,以期为深入研究AgNP对植物有效性和毒性提供基础数据。
1 材料与方法 1.1 试验材料AgNP的合成材料包括:硝酸银(AgNO3,>99.5%),盐酸羟胺(NH2OH·HCl,>98.5%),氢氧化钠(NaOH,>99.5%),聚丙烯吡咯烷酮(PVP,分子量58 000)。试验所用营养液参照文献[11],具体成分包括0.28 mmol·L-1 Ca(NO3)2·4H2O、0.12 mmol·L-1 NH4NO3、5.0 μmol·L-1 KH2PO4、0.1 mmol·L-1 CaSO4、0.15 mmol·L-1 K2SO4、0.1 mmol·L-1 MgSO4·7H2O、0.01 mmol·L-1 FeSO4·7H2O、0.01 mmol·L-1 Na2-EDTA·2H2O以及微量元素3.0 μmol·L-1 H3BO3、1.0 μmol·L-1 MnSO4·H2O、1.0 μmol·L-1 ZnSO4·7H2O、0.02 μmol·L-1 Na2MoO4、0.05 μmol·L-1 CuSO4·5H2O(pH=5.6)。以上药品均为分析纯,购自国药集团化学试剂有限公司。试验所用水均为超纯水(18.2 MΩ,Millipore,Bedford,USA)。浓硝酸(优级纯)购自上海安谱实验科技股份有限公司。试验过程中所用到的器皿在使用前均经10%硝酸浸泡清洗。试验所用大豆(Glycine max L.xudou16)购自徐州农业科学研究所。
1.2 AgNP的制备及表征试验中采用一种稳定性好、重复性高的方法合成AgNP[24]。具体步骤如下:将10 mL 0.01 mol·L-1 AgNO3在磁力搅拌下加入到90 mL含1.67×10-3 mol·L-1 NH2OH·HCl和3.33×10-3 mol·L-1 NaOH溶液中,溶液颜色迅速由无色变为黄色。反应2~3 min后向上述溶液中缓慢加入0.3 g的PVP,继续搅拌8 h,搅拌过程中容器用锡箔纸进行避光处理。搅拌8 h后4000×g下超滤离心(3 kDa,Amicon Ultra-15,Millipore,USA)30 min,滤去剩余的反应产物,用超纯水反复清洗滤膜,收集上层液体,于4 ℃避光保存。
采用BI-200SM光散射仪(Brookhaven Instruments,American)对合成的AgNP进行水合粒径及ζ电位分析,使用透射电镜(TEM,JEM-200CX,Japan)进行尺寸及晶格条纹的分析。由于量子尺寸效应,AgNP具有独特的非线性光学效应,在紫外-可见光光谱表现出特征吸收峰,因此采用紫外-可见光谱法对合成的AgNP进行UV-Vis吸收光谱测定,分析其特征峰。合成的AgNP母液在试验前均于三频数控超声波清洗器(KQ-300VDE,China)中45 kHz超声15 min,使其分散均匀。
对合成的AgNP溶液进行总Ag含量的测定:向AgNP溶液中按照1:1体积比加入浓硝酸并于25 ℃消解12 h,过0.1 mol·L-1 Cu(NO3)2预饱和的聚醚枫滤头[25](0.22 μm,America),采用火焰原子吸收分光光度计(F-AAS;Hitachi Z-2000,Japan)测定溶液中总Ag含量。
1.3 大豆育苗及培养选择饱满一致的种子,用0.5%的NaClO4溶液对种子进行杀菌消毒(30 min),经超纯水(18.2 MΩ,Millipore)反复清洗干净后,在超纯水中浸泡4 h。将种子转移到铺有湿润滤纸的托盘,在25 ℃、湿度为80%的黑暗条件下催芽。3 d后将发芽的种子转移至植物培养箱(MLR-351H,SANYO)中培养21 d。培养条件为14 h光照、25 ℃,10 h黑暗、20 ℃,湿度为80%。营养液每3 d更换一次。
1.4 植株AgNP暴露处理试验设置7个处理(表 1),分别为空白对照(CK)、叶面暴露AgNP(Foliar-NP 10)、叶面暴露AgNO3(Foliar-Ag+ 1)、根系暴露AgNP(Root-NP 10)、根系暴露AgNO3(Root-Ag+ 1)、综合暴露AgNP(Foliar+Root-NP 10)和综合暴露AgNO3(Foliar+Root-Ag+ 1)。每个处理均设置3个平行。其中,AgNP浓度设置为10 mg·L-1,该浓度虽然高于环境浓度[26],但根据美国环境保护局(EPA,2009)调查的污泥中AgNP浓度和污泥农田施用量,推测施用污泥10年后土壤AgNP可累积到10 mg·kg-1,且该浓度基于已见诸报道文献[23, 27];AgNO3浓度设置为1 mg·L-1,对应于营养液中AgNP溶出的溶解态Ag+浓度。
筛选长势一致的大豆幼苗移栽至HDPLE塑料盆钵,每盆2株,所有盆钵均用黑色材料进行避光处理。对于叶片暴露处理,大豆幼苗培养于不含AgNP或AgNO3的营养液中,用消毒棉签将Ag溶液(10 mg·L-1 AgNP或1 mg·L-1 AgNO3)均匀涂抹于大豆第Ⅶ节叶片的上表面。涂抹时将其他叶片用黑色塑料袋包裹,盆钵用铝箔纸包裹,防止交叉污染;通过测定其他叶片的Ag累积,研究Ag在大豆体内的吸收和分布,避免叶片表面Ag吸附对其含量测定的影响。每天涂抹3次(早、中、晚各1次,3次的时间间隔相同),每天使用新鲜配置的Ag溶液25 mL(大于根系的吸收量),涂抹后对营养液取样,分析测定Ag含量,发现Ag含量低于检测限,说明叶片涂抹过程中根系营养液没有受到Ag污染。对于根系暴露处理,将大豆幼苗暴露于含10 mg·L-1 AgNP或1 mg·L-1 AgNO3的营养液,且每3 d更换暴露溶液,同时用不含AgNP或者AgNO3的营养液对第Ⅶ节叶片进行涂抹。对于叶面+根系暴露处理,大豆幼苗同时通过叶片及根系吸收AgNP或AgNO3,操作方法同上。试验暴露14 d,在第7、14 d分别采集植物组织进行分析。
1.5 样品收获及Ag含量测定暴露7 d后收获大豆第Ⅲ~Ⅳ节叶片,称重后依次用超纯水、10 mmol·L-1 HNO3和10 mmol·L-1 EDTA浸泡10 min,最后再用超纯水冲洗[28]。暴露14 d后采集第Ⅰ~Ⅱ节和第Ⅶ节叶片(对于叶面暴露处理而言,该叶片直接接触暴露溶液),同时收集叶片暴露处理的根系,称重后依照上述方法进行清洗。所有样品105 ℃杀青15 min,70 ℃烘至恒重。为方便讨论,后文中将第Ⅰ~Ⅱ节和第Ⅲ~Ⅳ节叶片简称为“新叶”,将第Ⅶ节叶片简称为“老叶”。对于叶面暴露途径而言,老叶是直接暴露于AgNP或AgNO3的叶片,而新叶则未直接暴露于Ag。
依照EPA2001b的方法,使用微波消解仪(Ethos one,Milestone,Italy)对样品用浓HNO3进行微波消解,过0.1 mol·L-1 Cu(NO3)2预饱和的0.22 μm滤头,采用ICP-MS(iCAP Q,Thermo Scientific,USA)对大豆组织Ag含量进行测定,同时消煮空白与标准物质(柑橘叶,GBW10020)进行质控。测定结果显示标准物质的回收率为99.2%±8.3%,达到试验精度要求。
1.6 统计分析采用Nanomeasurer统计合成的AgNP在透射电镜下观测的粒径分布数据,采用SPSS16.0软件中的单因素统计(One-way ANOVA)分析第7、14 d不同处理间的显著性差异(P < 0.05),采用双因素统计(Two-way ANOVA)分析暴露途径与Ag形态对大豆总Ag浓度的影响,采用Origin8.5软件作图。数据表示为平均值±标准差。
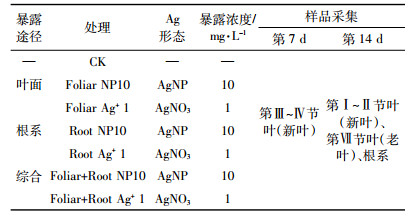
2 结果与分析 2.1 AgNP的表征试验合成的AgNP为球形(图 1a),其平均粒径为41.0±10.5 nm(图 1b,水分散相),且具有规整的晶格排列,其晶格间距为0.236 nm(图 1c),对应于Ag的(111)晶面。动态光散射(DLS)分析结果表明其水合粒径为45.8±4.3 nm,并且AgNP颗粒表面带有负电荷,ζ电势为-38.7±0.2 mV(pH=4.2)。本试验中合成的AgNP母液在412 nm出现了AgNP的特征吸收峰(图 1d)。母液的总Ag浓度为126.8±10.9 mg·L-1,后续试验中将母液逐级稀释,达到暴露试验所需要的浓度。
|
| 图 1 合成AgNP的TEM图(a), 粒径分布图(b), 晶格条纹图(c), Uv-vis图(d) Figure 1 TEM image (a), particle size distribution (b), lattice-fringe fingerprinting image (c) and UV-Vis (d) of AgNP in stock solution |
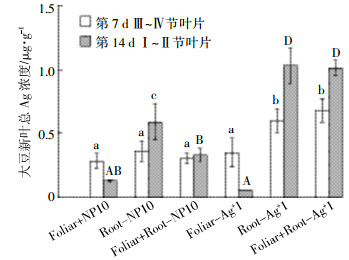
在空白处理的大豆新叶中没有检测到Ag( < 0.3 ng·g-1),而其他处理的大豆新叶中Ag含量显著性增加(P < 0.05)。暴露7 d后,新叶总Ag浓度范围为0.28~0.68 μg·g-1(图 2),并且Root-Ag+ 1和Foliar+Root-Ag+ 1处理新叶总Ag浓度是其他处理的1.9~2.3倍(One-way ANOVA,P < 0.05)。双因素方差分析的统计结果表明,暴露7 d后,Ag形态(即Ag+ vs.AgNP,P < 0.001)比暴露途径(叶面暴露vs.根系暴露,P>0.05)对新叶总Ag浓度影响更大。暴露14 d后,新叶总Ag浓度范围为0.06~1.03 μg·g-1(图 2),且不同处理间存在显著差异:Root-Ag+ 1处理浓度最高(1.03±0.14 μg·g-1),分别是Foliar Ag+ 1、Foliar-NP 10、Root-NP 10、Foliar+Root-NP 10处理的52、7.92、1.75、3.12倍。双因素方差分析的统计结果表明Ag形态(即Ag+ vs.AgNP)和暴露途径(叶面暴露vs.根系暴露)均会影响新叶总Ag浓度(P < 0.01)。
|
| 图 2 暴露7 d和14 d后大豆新叶中总Ag浓度 Figure 2 Total Ag concentrations in new leaves after 7 d or 14 d exposure 图中不同小写和大写字母分别表示暴露7 d和14 d后各处理的Ag浓度存在显著差异(P < 0.05) Different lower-case and upper-case letters indicated a significant difference at P < 0.05 among treatments of soybean exposed to Ag for 7 d and 14 d, respectively |
对比各处理7 d和14 d的结果发现,Foliar-NP 10和Foliar Ag+ 1处理的总Ag浓度随暴露时间增加而显著下降(P < 0.05)。这可能是随着暴露时间的增加,叶面暴露途径下老叶所受的损伤越来越强,减弱了其向上迁移的能力,也有可能是随着大豆的生长,一部分Ag通过某种途径而被排出。而Root-NP 10和Root-Ag+ 1处理的总Ag浓度随时间增加而逐渐增加,与Foliar+Root-NP 10和Foliar+Root-Ag+ 1处理趋势相同。
对于AgNP或AgNO3处理,大豆新叶通过根系暴露累积的Ag浓度与通过综合暴露累积的Ag浓度相近,高于通过叶面暴露累积的Ag浓度。这说明在该试验条件下,大豆根部吸收并转运Ag的效率高于叶面吸收转运的效率。
2.3 大豆老叶的总Ag浓度暴露第14 d大豆老叶中总Ag的浓度如表 2所示。经过连续14 d涂抹10 mg·L-1 AgNP后,老叶的总Ag积累量达到75.92±12.28 μg·g-1,而涂抹1 mg·L-1 AgNO3后老叶的总Ag积累量为6.28±1.08 μg·g-1,两者具有显著性差异(P < 0.01)。这可能是由于AgNP和AgNO3施用浓度不同所致。值得注意的是,尽管经过了清洗,仍然较难区分吸附于叶片表面的Ag和内化的Ag,因此本研究中叶面暴露的老叶中Ag积累量可能被高估。通过根系暴露10 mg·L-1 AgNP和1 mg·L-1 AgNO3的大豆老叶总Ag浓度分别为2.00±0.43 μg·g-1和1.32±0.51 μg·g-1,差异不显著(P>0.05)。这说明在根系暴露途径下,AgNP很可能以溶解态形式被吸收。总体而言,综合暴露途径下大豆老叶总Ag浓度和叶面暴露的总Ag浓度相近,且显著高于根系暴露的总Ag浓度。
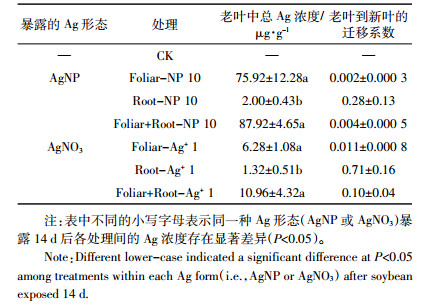 |
通过计算Ag从老叶到新叶的迁移系数(定义为新叶中Ag浓度与老叶中Ag浓度之比,表 2),发现无论哪种暴露途径AgNO3处理的迁移系数均大于AgNP处理(2.53~25倍),而且叶面暴露途径Ag的迁移系数远低于相应的根系暴露,例如叶面暴露AgNP和AgNO3处理的迁移系数分别为0.002±0.000 3和0.011±0.000 8,对应的根系暴露分别为0.28±0.13和0.71±0.16。综合暴露途径的迁移系数则介于叶面暴露与根系暴露的迁移系数之间。
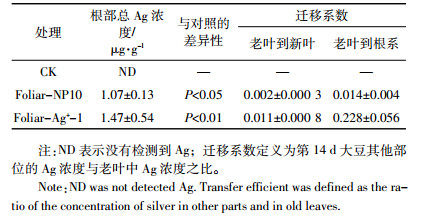
2.4 大豆根部的总Ag浓度经过14 d暴露后,相对于空白对照(未检测到Ag),经AgNP和AgNO3叶面暴露的大豆根部总Ag浓度分别为1.07±0.13 μg·g-1和1.47±0.54 μg·g-1,同时叶面暴露途径下营养液中未检测到Ag( < 5 ng·L-1),说明AgNP或AgNO3经叶面暴露后转运到了根部。通过计算Ag在大豆组织中的迁移系数(表 3)发现,无论暴露液中Ag为何种形态,Ag从老叶到根系的迁移系数均远大于老叶到新叶的迁移系数,说明Ag经叶面暴露吸收后,可能更倾向于向地下部转运。对此尚需要进一步深入研究。
 |
经AgNP暴露后,我们在大豆叶、根中检测到了Ag,与杨新萍等[29]关于纳米颗粒能够在植物组织器官中积累的结论一致。但是,目前尚不清楚AgNP是以颗粒还是以溶解的Ag+形式被大豆吸收。本试验利用TEM-EDS观察新叶组织中的纳米颗粒,但由于叶片中Ag的浓度远低于仪器检测限(0.1%~0.5%),最终没有得到相应结果。已有研究中,Lee等[30]用TEM-EDS在绿豆和高粱中发现了AgNP,Dimkpa等[23]用TEM在小麦体内首次发现了纳米颗粒的Ag。此外,基于同步辐射技术的X射线近边吸收精细结构(X-ray absorption near edge structure,XANES)分析也可以提供样品中纳米颗粒信息,如Wang等[11]采用XANE技术研究了AgNP以及Ag2S-NPs在豇豆和小麦体内的形态与分布。
试验中考察了叶面暴露、根系暴露、综合暴露途径下AgNP在大豆体内的累积和转移。不管哪种暴露途径,AgNP均能被大豆吸收。Hong等[31]研究了黄瓜在含纳米CeO2粉末的气溶胶沉降及喷施含纳米CeO2溶液两种不同暴露方式下植株内Ce的转运过程,结果表明,无论哪种暴露形式,纳米CeO2都能够进入到黄瓜体内并发生转运,特别是Ce可以由叶片运输到黄瓜的其他部位。这与我们的研究结果一致,暴露途径不同,植物吸收AgNP方式也不同。Eichert等[32]研究发现,AgNP经过叶面喷施途径进入生菜体内主要是通过角质层和气孔,然后进入到上皮、叶肉及维管束组织当中。Geisler-Lee等[9]在研究AgNP对拟南芥生长的影响(根系暴露)中发现,AgNP在被根吸收的过程中,先后通过外缘细胞、根冠、上皮细胞及小柱细胞,再进入顶端分生组织的初始细胞。本研究中进入植物体内的Ag能够向其他组织转移(如新叶、根系等),并且根系暴露处理向新叶的迁移系数高于叶面暴露处理的迁移系数,其具体机制有待进一步研究。
本研究结果表明,Ag的形态也会影响其在大豆体内的累积和转运:叶面暴露10 mg·L-1 AgNP和1 mg·L-1 AgNO3后,新叶Ag的积累量没有明显差异,而根系暴露及综合暴露途径下,AgNO3处理的积累量明显大于AgNP处理;无论哪种暴露途径,AgNO3处理的迁移系数均大于AgNP处理。这说明溶解态的Ag容易被植物吸收。Wang等[33]在白杨和拟南芥暴露AgNP的研究中发现,Ag+处理比AgNP处理更容易导致Ag在白杨体内积累。这表明植物吸收AgNP的可能机制之一是其吸收AgNP缓慢溶解出来的Ag+。由于Ag+毒性更强,被植物吸收的Ag+在植物体内也有可能再次转化为有利于自身的毒性更小的AgNP。Dimkpa等[23]发现无论是AgNP处理还是AgNO3处理,最后均在小麦体内发现了纳米颗粒的Ag。目前关于这些方面的研究还没有明确的结论,需要进一步探讨。
4 结论无论是通过叶面暴露还是根系暴露途径,AgNP均能够被大豆吸收并发生转运。根系暴露途径下Ag的迁移系数高于叶面暴露的Ag的迁移系数,但无论哪种暴露途径,AgNO3处理的迁移系数均大于AgNP处理。本研究表明暴露途径和Ag形态均会对大豆新叶中Ag的积累量及转运过程产生影响,因而在评估AgNP对农作物生长的风险时,应综合考虑其暴露途径和Ag的形态。
| [1] | 沈哲, 代朝猛, 张亚雷. 纳米材料应用对环境的潜在风险[J]. 材料导报, 2012, 5(26) : 19–23. SHEN Zhe, DAI Chao-meng, ZHANG Ya-lei. Nanomaterials applications:A review of their potential environmental risk[J]. Materials Review, 2012, 5(26) : 19–23. |
| [2] | Woodrow Wilson International Center for Scholars and the Pew Charitable Trusts. The Project on Emerging Nanotechnologies. http://www.nanotechproject.org/cpi/browse/nanomaterials/silver-nanoparticle/,2014. |
| [3] | Guo H Y, Zhang Z Y, Xing B S, et al. Analysis of silver nanoparticles in antimicrobial products using surface-enhanced raman spectroscopy (SERS)[J]. Environmental Science and Technology, 2015, 49(7) : 4317–4324. DOI:10.1021/acs.est.5b00370 |
| [4] | 彭小凤, 朱敏, 任洁, 等. 纳米银的植物毒性研究进展[J]. 生态毒理学报, 2014, 9(2) : 199–204. PENG Xiao-feng, ZHU Min, REN Jie, et al. Research progress in phytotoxicity of silver nanoparticles[J]. Asian Journal of Ecotoxicology, 2014, 9(2) : 199–204. |
| [5] | Hou L, Li K, Ding Y, et al. Removal of silver nanoparticles in simulated wastewater treatment processes and its impact on COD and NH4 reduction[J]. Chemosphere, 2012, 87(3) : 248–252. DOI:10.1016/j.chemosphere.2011.12.042 |
| [6] | Wang Y, Westerhoff P, Hristovski K D. Fate and biological effects of silver, titanium dioxide, and C60(fullerene) nanomaterials during simulated wastewater treatment processes[J]. Journal of Hazardous Materials, 2012, 201 : 16–22. |
| [7] | Lamsal K, Kim S W, Jung J H, et al. Inhibition effects of silver nanoparticles against powdery mildews on cucumber and pumpkin[J]. The Korean Society of Mycology, 2011, 39(1) : 26–32. |
| [8] | Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, Fullerenes) for different regions[J]. Environmental Science & Technology, 2009, 43(24) : 9216–9222. |
| [9] | Geisler-Lee J, Wang Q, Yao Y, et al. Phytotoxicity, accumulation and transport of silver nanoparticles by Arabidopsis thaliana[J]. Nanotoxicology, 2012, 7(3) : 323–337. DOI:10.3109/17435390.2012.658094 |
| [10] | Stegemeier J P, Schwab F, Colman B P, et al. Speciation matters:Bioavailability of silver and silver sulfide nanoparticles to alfalfa (Medicago sativa)[J]. Environmental Science & Technology, 2015, 49(14) : 8451–8460. |
| [11] | Wang P, Menzies N W, Lombi E, et al. Silver sulfide nanoparticles (Ag2S-NPs) are taken up by plants and are phytotoxic[J]. Nanotoxicology, 2015, 9(8) : 1–9. |
| [12] | Abd-Alla M H, Nafady N A, Khalaf D M. Assessment of silver nanoparticles contamination on faba bean-Rhizobium leguminosarum, bv. viciae-Glomus aggregatum symbiosis:Implications for induction of autophagy process in root nodule[J]. Agriculture Ecosystems & Environment, 2016, 218 : 163–177. |
| [13] | Hossain Z, Mustafa G, Sakata K, et al. Insights into the proteomic response of soybean towards Al2O3, ZnO, and Ag nanoparticles stress[J]. Journal of Hazardous Materials, 2016, 304 : 291–305. DOI:10.1016/j.jhazmat.2015.10.071 |
| [14] | Mustafa G, Sakata K, Komatsu S. Proteomic analysis of soybean root exposed to varying sizes of silver nanoparticles under flooding stress[J]. Journal of Proteomics, 2016, 148 : 113–125. DOI:10.1016/j.jprot.2016.07.027 |
| [15] | Yin L, Colman B P, McGill B M, et al. Effects of silver nanoparticle exposure on germination and early growth of eleven wetland plants[J]. PloS One, 2012, 7(10) : e47674. DOI:10.1371/journal.pone.0047674 |
| [16] | 王荣, 刘艳丽, 张民, 等. 纳米银对黑麦草生长特性的影响[J]. 农业环境科学学报, 2015, 34(4) : 639–645. WANG Rong, LIU Yan-li, ZHANG Min, et al. Effects of nano-silver on growth characteristics of perennial ryegrass[J]. Journal of Agro-Environment Science, 2015, 34(4) : 639–645. |
| [17] | Cui Di, Zhang P, Ma Y H, et al. Phytotoxicity of silver nanoparticles to cucumber (Cucumis sativus) and wheat (Triticum aestivum)[J]. Journal of Zhejiang University:Science A (Applied Physics & Engineering), 2014, 15(8) : 662–670. |
| [18] | 彭小凤.纳米银对拟南芥营养生长与开花的影响[D].杭州:浙江工业大学, 2013:49-57. PENG Xiao-feng. The effects of silver nanoparticles on the vegetative growth and flowing of Arabidopsis thaliana[D]. Hangzhou:Zhejiang University of Technology, 2013:49-57. |
| [19] | Jo Y-K, Kim B H, Jung G. Antifungal activity of silver ions and nanoparticles on phytopathogenic fungi[J]. Plant Disease, 2009, 93(10) : 1037–1043. DOI:10.1094/PDIS-93-10-1037 |
| [20] | Lamsal K, Kim S-W, Jung J H, et al. Inhibition effects of silver nanoparticles against powdery mildews on cucumber and pumpkin[J]. Mycobiology, 2011, 39(1) : 26–32. DOI:10.4489/MYCO.2011.39.1.026 |
| [21] | Maurer-Jones M A, Gunsolus I L, Murphy C J, et al. Toxicity of engineered nanoparticles in the environment[J]. Analytical Chemistry, 2013, 85(6) : 3036–3049. DOI:10.1021/ac303636s |
| [22] | Larue C, Castillo-Michel H, Sobanska S, et al. Foliar exposure of the crop Lactuca sativa, to silver nanoparticles:Evidence for internalization and changes in Ag speciation[J]. Journal of Hazardous Materials, 2014, 264(2) : 98–106. |
| [23] | Dimkpa C O, McLean J E, Martineau N, et al. Silver nanoparticles disrupt wheat (Triticum aestivum L.) growth in a sand matrix[J]. Environmental Science & Technology, 2013, 47(2) : 1082–1090. |
| [24] | Leopold N, Lendl B. A new method for fast preparation of highly surface-enhanced raman scattering (SERS) active silver colloids at room temperature by reduction of silver nitrate with hydroxylamine hydrochloride[J]. Journal of Physical Chemistry B, 2003, 107(24) : 5723–5727. DOI:10.1021/jp027460u |
| [25] | Li C C, Wang Y J, Dang F, et al. Mechanistic understanding of reduced AgNP phytotoxicity induced by extracellular polymeric substances[J]. Journal of Hazardous Materials, 2016, 308 : 21–28. DOI:10.1016/j.jhazmat.2016.01.036 |
| [26] | Abraham P M, Barnikol S, Baumann T, et al. Sorption of silver nanoparticles to environmental and model surfaces[J]. Environmental Science & Technology, 2013, 47(10) : 5083–5091. |
| [27] | Kaveh R, Li Y S, Ranjbar S, et al. Changes in Arabidopsis thaliana gene expression in response to silver nanoparticles and silver ions[J]. Environmental Science & Technology, 2013, 47(18) : 86–94. |
| [28] | Li C C, Dang F, Long C, et al. Integration of metal chemical forms and subcellular partitioning to understand metal toxicity in two lettuce (Lactuca sativa, L.) cultivars[J]. Plant & Soil, 2014, 384(1/2) : 201–212. |
| [29] | 杨新萍, 赵方杰. 植物对纳米颗粒的吸收、转运及毒性效应[J]. 环境科学, 2013, 34(11) : 4495–4502. YANG Xin-ping, ZHAO Fang-jie. A review of uptake, translocation and phytotoxicity of engineered nanoparticles in plants[J]. Environmental Science, 2013, 34(11) : 4495–4502. |
| [30] | Lee W M, Jin I K, An Y J. Effect of silver nanoparticles in crop plants Phaseolus radiatus and Sorghum bicolor:Media effect on phytotoxicity[J]. Chemosphere, 2012, 86(5) : 491–499. DOI:10.1016/j.chemosphere.2011.10.013 |
| [31] | Hong J, Peralta-Videa J R, Rico C, et al. Evidence of translocation and physiological impacts of foliar applied CeO2 nanoparticles on cucumber (Cucumis sativus) plants[J]. Environmental Science and Technology, 2014, 48(8) : 4376–4385. DOI:10.1021/es404931g |
| [32] | Eichert T, Kurtz A, Steiner U, et al. Size exclusion limits and lateral heterogeneity of the stomatal foliar uptake pathway for aqueous solutes and water-suspended nanoparticles[J]. Physiologia Plantarum, 2008, 134(1) : 151–160. DOI:10.1111/ppl.2008.134.issue-1 |
| [33] | Wang J, Koo Y, Alexander A, et al. Phytostimulation of poplars and Arabidopsis exposed to silver nanoparticles and Ag+ at sublethal concentrations[J]. Environmental Science & Technology, 2013, 47(10) : 5442–5449. |
 2016, Vol. 35
2016, Vol. 35