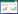文章信息
- 朱娜, 何娅梅, 梁栋, 桑楠
- ZHU Na, HE Ya-mei, LIANG Dong, SANG Nan
- 金属离子对噻嗪酮与小牛胸腺DNA相互作用的影响
- Interaction properties of buprofezin to calf thymus DNA in the presence of metal ions
- 农业环境科学学报, 2016, 35(12): 2314-2319
- Journal of Agro-Environment Science, 2016, 35(12): 2314-2319
- http://dx.doi.org/10.11654/jaes.2016-0737
文章历史
- 收稿日期: 2016-05-30
2. 中北大学化工与环境学院, 太原 030051
2. School of Chemical and Environmental Engineering, North University of China, Taiyuan 030051, China
对粮食与农业安全的忧虑迫使甲胺磷、久效磷、对硫磷等高毒农药退出市场,更多的低毒特效产品逐渐成为主流药物,而滥用农药导致的药物残留也带来新的环境风险。噻嗪酮(Buprnfezin)是一种噻二嗪类昆虫生长调节剂,对同翅目的飞虱、叶蝉、粉虱及介壳虫类害虫有特效,在水稻、茶叶、柑橘、棉花、蔬菜等作物病虫害防治中发挥着重要作用,属高效低毒杀虫剂[1-2]。目前全国每年噻嗪酮原药总设计产能8000 t左右,实际总产量4500 t,且呈逐年递增趋势[3]。
据报道菊酷类和噻嗪酮残留在我国出口茶叶超标农药中位居前列[4]。南京地区茶叶在用药7 d后仍残留约10 mg·kg-1[5]; 北京和山东等地番茄与种植土中也发现噻嗪酮的残留[6]; 长沙、杭州、贵阳等地柑橘生产中,噻嗪酮用药的安全期均在14 d以上[7].西班牙Almeria地区蔬菜大棚中胡椒、扁豆和茄子等也检测到噻嗪酮的残留[8]。因此,应对噻嗪酮引起非靶标生物暴露的环境安全风险引起重视。
重金属含量超标也是出口农产品中与农药残留伴生的主要问题之一,浙江省地方绿茶噻嗪酮残留最高达600 μg·kg-1, 鲜样中Cu、Cd的平均浓度分别为12.5 mg·kg-1和0.24 mg·kg-1[9-10]。越南湄公河的农业沉积物中不仅发现521 μg·kg-1的噻嗪酮,同时也检出Ni、Cu、Co等金属并存[11]; 印度与罗马尼亚的葡萄种植园也分别发现了噻嗪酮和重金属残留[12-13]。这些研究结果表明,农产品中金属与新型农药残留形成的复合污染已成为非靶标生物环境暴露及健康风险的重要形式。
流行病学研究表明,在非职业暴露人群血清样本中噻嗪酮检出率超出50%[14]; 噻嗪酮证实可干扰哺乳动物细胞有丝分裂[15],引起雄鼠体细胞和生殖细胞染色体畸变[16]; 金属离子也会参与到DNA与药物的识别和结合过程,对DNA的结构与功能造成损伤[17]。本文以亚甲基蓝(MB)为分子探针,通过紫外、荧光光谱法研究生理条件下噻嗪酮与DNA结合模式,同时选取与DNA结合强度不同的4种典型金属离子(Cd2+、Co2+、Cu2+、Ni2+),探讨重金属对噻嗪酮与DNA结合作用的影响机制。
1 材料与方法 1.1 仪器与试剂主要仪器:CARYEclipse960型荧光分光光度计(Varian),U-3900紫外可见分光光度计(Hitachi), HH-2型恒温水浴槽(国华电器)。
试剂:小牛胸腺DNA (Solarbio,ctDNA),用0.1 mol·L-1 NaCl配制,利用ε=6600 L·mol-1·cm-1确定溶液浓度为1.89×10-4 mol · L-1,溶液存于4℃备用。噻嗪酮(以下简称Bup)使用无水乙醇配制成浓度为4.92×10-2 mol·L-1贮备液。亚甲基蓝(MB)使用三蒸水配制成浓度为1 ×10-3 mol · L-1贮备液。金属离子(Ni2+、Cu2+、Co2+、Cd2+)均使用三蒸水配制成浓度为4.92×10-2 mol·L-1贮备液。
1.2 实验方法 1.2.1 噻嗪酮-ctDNA紫外光谱测定在10 mL比色管中,固定Bup的浓度为4.0×10-5mol·L-1,分别加人不同体积的ctDNA溶液(终浓度范围为6.0×10-5~1.0×10-4 mol·L-1),Tris-HCl缓冲溶液定容至刻度,混勻后静置5 min。扫描200~350 nm紫外吸收光谱,并扣除背景空白。
1.2.2 噻嗪酮、金属离子对MB-ctDNA荧光光谱的影响在10 mL比色管中,固定MB和ctDNA的浓度(CMB=1.0×10-5 mol·L-1,CDNA=1.89×10-5 mol·L-1),分别加人不同体积的Bup溶液(终浓度范围为4.92×10-6~4.43×10-5 mol·L-1)或金属离子溶液(终浓度范围为2.46×10-6~2.21×10-5mol·L-1),Tris-HCl缓冲溶液定容至刻度,混勻后静置5 min。以630 nm为激发波长,扫描650~750 nm荧光光谱,并分别记录25、31、37℃荧光强度变化。
1.2.3 金属离子对噻嗪酮与MB-ctDNA体系结合常数的影响在10 mL比色管中,固定MB、ctDNA和金属离子浓度(CMB=1×10-5 mol·L-1,CDNA=1.89×10-5 mol·L-1, CMTAL=2.46×10-6 mol · L-1),改变体系中Bup浓度(终浓度范围为4.92×10-6~4.43×10-5 mol·L-1),Tris-HCl缓冲溶液定容至刻度,混勻后静置5 min,记录荧光强度变化。依次改变体系中金属离子浓度(2.46×10-6~3.69×10-5 mol·L-1),分别记录荧光强度变化。
1.2.4 ctDNA熔点实验分别移取ctDNA溶液、Bup-ctDNA、Bup-ctDNA-Metal溶液于比色杯中,浓度依次为CDNA=5×10-5 mol·L-1,CBup=4×10-5 mol·L-1,CMetal=7.38×10-5 mol·L-1,利用紫外分光光度计记录20~95℃范围内溶液在260 nm处的吸光度值。
2 结果与讨论 2.1 ctDNA对噻嗪酮紫外光谱的影响在pH为7.4的Tris-HCl缓冲溶液中,噻嗪酮的最大紫外吸收峰为246 nm, 此吸收带主要由噻嗪酮分子结构中含硫氮的芳香杂环π-π*跃迁所引起。随着体系中ctDNA浓度的增加,最大吸收波长逐渐红移到257 nm,同时也呈现明显的增色效应(图 1),说明噻嗪酮与ctDNA之间发生了较强的相互作用。实验还发现Bup-ctDNA二元体系在最大吸收峰处的吸光度显著低于单一噻嗪酮与ctDNA吸光度之和,由此可推断加人ctDNA后,噻嗪酮与DNA发生结合并可能形成基态复合物,改变了原有分子结构中的紫外吸收官能团[18]。

|
| 图 1 ctDNA对噻嗪酮紫外光谱的影响 Figure 1 The absorption spectra of buprofezin in the presence of ctDNA CBup=4.0×10-5 mol·L-1; Curves 1→6: CDNA (×10-5 mol·L-1)=0, 6, 7, 8, 9, 10 |
亚甲基蓝(MB)是一种典型的荧光探针,可与DNA以嵌插方式结合。因为噻嗪酮自身荧光较弱,无法直接通过荧光光谱法研究二者作用方式,所以选择MB为荧光探针,间接考察农药与DNA之间的相互作用。在MB溶液中加人ctDNA后,前者的荧光强度发生明显降低(图 2),表明MB-ctDNA体系中由于电子间相互作用引起激发态发光团结构变化而导致荧光猝灭现象的发生。MB-ctDNA体系中加人不同浓度噻嗪酮时,其荧光谱图如图 2所示。随着噻嗪酮浓度的增加,体系发生了明显的增色效应。这是溶液中游离态MB的量增加所导致的[19],分析可能是由于噻嗪酮结构中有与MB相似的不饱和平面芳环和碱性亚氨基侧链,能参与竞争MB在ctDNA上的结合位点,致使部分结合到ctDNA上的MB释放出来,体系荧光增强。
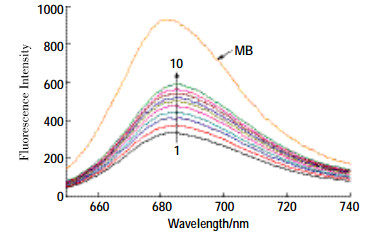
|
| 图 2 噻嗪酮对MB-ctDNA荧光光谱的影响 Figure 2 Fluorescence spectra of MB-ctDNA in the presence of buprofezin CMB=1.0×10-5 mol· L-1; Curves 1→10: CDNA=1.89×10-5 mol· L-1; CBup (× 10-6 mol·L-1)=0, 4.92, 9.84, 14.8, 19.7, 24.6, 29.5, 34.4, 39.4, 44.3 |
根据荧光增强效应公式:
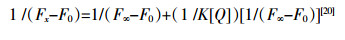
式中:F0和Fx分别表示未加人和加人噻嗪酮时体系的荧光强度,F∞为噻嗪酮与DNA相互作用的荧光强度最高值,K为结合常数,[Q]为噻嗪酮浓度。
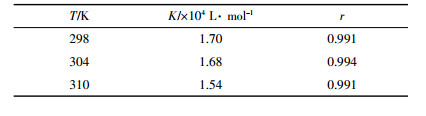
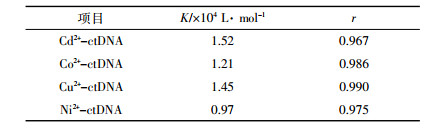
使用不同温度下加人噻嗪酮后体系荧光强度变化值1/(Fx -F0)对1/[Q]作图,由回归方程计算结合常数K值并列于表 1中。比较发现,不同温度下结合常数K随温度升高而略有降低,推断噻嗪酮可能与MB竞争结合DNA位点,但随着体系温度升高,二者结合形成的基态复合物稳定度下降致使K值降低,故该过程应属于静态结合[21]。
|
前期实验已证实金属离子、噻嗪酮单独存在时均未与MB发生结合。固定MB-ctDNA体系中金属离子浓度,通过调节噻嗪酮浓度可得到三元体系荧光光谱(图 3),结果表明:在Cu2+、Ni2+的存在下,噻嗪酮与MB-ctDNA体系的荧光增强效应显著,而Co2+、Cd2+存在下,多元体系的荧光强度变化减弱。实验还比较了不同金属离子单独存在时MB-ctDNA体系荧光强度变化(图 3)。通过变光强度变化值1/(Fx -F0)对1 /[Q]作图,分别计算了金属离子与MB-ctDNA的结合常数K值(表 2)。金属离子可通过配位作用与DNA双螺旋内侧的碱基和电子基团发生不同程度的结合[22],随着体系中金属离子浓度的增大,部分结合的MB游离出来而增强了体系的荧光强度。
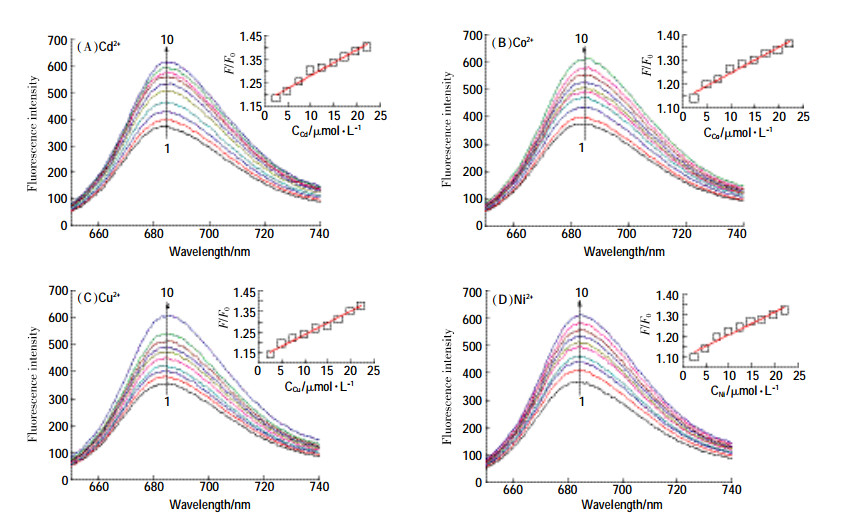
|
| 图 3 金属离子存在对Bup-MB-ctDNA及MB-ctDNA体系荧光光谱的影响 Figure 3 The effects of Cd2+, Co2+, Cu2+, Ni2+ on the fluorescence spectra of Bup-MB-ctDNA and MB-ctDNA, respectively Curve chart: CDNA=1.89×10-5 mol· L-1; CMB=1.0×10-5 mol· L-1; CMetal=2.46×10-6 mol·L-1; Curves 1→10: CBup (×10-6 mol·L-1)=0, 4.92, 9.84, 14.8, 19.7, 24.6, 29.5, 34.4, 39.4, 44.3; Line chart: CMetal(×10-6 mol· L-1)=2.46, 4.92, 7.38, 9.84, 12.3, 14.8, 17.2, 19.7, 22.1 |
|
为了进一步探讨在复杂环境中不同金属离子对噻嗪酮与MB-ctDNA结合作用的影响,分别采集了4种金属在不同浓度条件下的三元体系荧光数据,根据荧光增强公式计算了噻嗪酮与MB-ctDNA体系的结合常数,如图 4所示。结果表明:少量Cu2+可能先与噻嗪酮络合,再通过离子桥作用与DNA的磷酸基团结合[23],形成DNA-Bup-Cu2+的复合物,使结合常数明显增大; 随着Cu2+浓度的增加,由于形成DNA-Bup-Cu2+复合物的空间位阻效应以及使DNA结构松散的盐效应,不利于噻嗪酮与DNA的结合,导致结合常数略有下降[24]。

|
| 图 4 金属离子存在对Bup与MB-ctDNA结合常数的影响 Figure 4 Effects of metal ions on the binding constant of buprofezin and MB-ctDNA CMetal(μmol· L-1)=0, 2.46, 7.38, 14.8, 22.1, 29.5, 36.9 |
低浓度的Ni2+可使噻嗪酮与MB-ctDNA体系的结合常数有所上升,而高浓度的Ni2+会使之下降。这是由于Ni2+的结合位点为DNA的磷酸根骨架,噻嗪酮与少量Ni2+协同配合,可增加农药分子与DNA的结合量;高浓度的Ni2+则会渗透到DNA的碱基对中,与胸腺嘧啶的N3和鸟嘌呤的N1结合,造成DNA磷酸骨架和碱基破坏,进而影响噻嗪酮与DNA的结合[25]。对于Co2+、Cd2+来说,二者均能减弱噻嗪酮与MB-ctDNA间的结合,且K值随浓度增加而降低。这是由于低浓度的Co2+、Cd2+可能与DNA磷酸基团上的氧原子配位,中和磷氧负离子,使得DNA分子结构收缩,不利于噻嗪酮嵌插到DNA碱基对中;高浓度时则对DNA碱基表现出较强的亲和力,可能会与噻嗪酮竞争DNA嘌呤碱基上的N7结合位,导致其结合常数降低[26]。
2.4 金属离子存在下噻嗪酮对ctDNA熔点的影响药物与DNA结合方式的差异,会产生不同的生物学效应,也能直接影响DNA的熔点。如以沟槽或静电作用与DNA结合的药物不会影响DNA熔点,但是药物分子若以嵌插方式结合,则会使DNA的熔点上升5~8℃[27]。通过测定ctDNA、噻嗪酮-ctDNA和噻嗪酮-ctDNA-金属离子体系的熔点(Tm值),即DNA变性达到50%时的温度[28],可以间接确定噻嗪酮与DNA的结合模式以及金属离子的影响。
根据fss(fss=At/A20, 其中At和A20分别为t℃和20℃时体系的吸光度)与温度响应关系分别测得DNA、Bup-ctDNA和Bup-ctDNA-Metal不同体系Tm值,见表 3。结果表明,ctDNA熔点为75.0℃,当加人噻嗪酮后,二元体系熔点升至80.8℃,而加人不同金属离子后三元体系熔点温度与二元体系相比变化不大。由此判定,噻嗪酮与ctDNA之间的结合方式为嵌插作用,4种金属离子的存在并不影响噻嗪酮与ctDNA的结合模式。
紫外实验显示随着ctDNA浓度变化,噻嗪酮吸收光谱呈现出明显的增色效应,这提示二者之间有较强的相互作用,并可能通过形成二元复合物引起吸收带红移。MB荧光探针和DNA熔点实验则进一步证明噻嗪酮与DNA之间主要发生嵌插作用。环境中金属离子的存在并未改变噻嗪酮与DNA之间的作用模式,少量Cu2+、Ni2+可能与DNA的磷酸根结合并通过离子桥协助噻嗪酮与ctDNA的作用,使结合常数呈现一定的增强,但高浓度时所形成的复合物可能影响到DNA的空间结构,削弱噻嗪酮与DNA的结合;Co2+、Cd2+与DNA的配位不仅能改变DNA的分子结构,而且可与噻嗪酮竞争结合DNA上的结合位点,导致结合常数发生明显下降。
| [1] | Tiwari S, Clayson P J, Kuhns R H, et al. Effects of buprofezin and diflubenzuron on various developmental stages of Asian citrus psyllid, Diaphorina citri[J]. Pest Management Science, 2012, 68(10) : 1405–1412. DOI:10.1002/ps.v68.10 |
| [2] | Sohrabia F, Shishehbor P, Saber M, et al. Lethal and sublethal effects of buprofezin and imidacloprid on the whitefly parasitoid Encarsia inaron (Hymenoptera:Aphelinidae)[J]. Crop Protection, 2012, 32 : 83–89. DOI:10.1016/j.cropro.2011.10.005 |
| [3] | Liu Y, Qi S Z, Zhang W, et al. Acute and chronic toxicity of buprofezin on Daphnia Magna and the recovery evaluation[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(5) : 966–969. DOI:10.1007/s00128-012-0802-9 |
| [4] | 于萍萍, 谢涛, 唐文, 等. 气相色谱法检测茶叶中噻嗪酮(优乐得)和菊酯类农药的残留量[J]. 山东农业科学, 2007(3) : 99–101. YU Ping-ping, XIE Tao, TANG Wen, et al. Residual determination of buprofezin and chrysanthemum ester pesticides in tea by GC[J]. Shandong Agricultural Sciences, 2007(3) : 99–101. |
| [5] | 张存政, 孙星, 张志勇, 等. 噻嗪酮在茶园环境中的残留行为研究[J]. 农业环境科学学报, 2010, 29(8) : 1483–1489. ZHANG Cun-zheng, SUN Xing, ZHANG Zhi-yong, et al. Dissipation behavior of pesticide buprofezin in tea garden under different climate conditions in China[J]. Journal of Agro-Environmental Science, 2010, 29(8) : 1483–1489. |
| [6] | 邹广平, 王会利, 李淑芹. 噻嗪酮在番茄和土壤中的残留分析[J]. 环境化学, 2009, 28(2) : 298–301. ZOU Guang-ping, WANG Hui-li, LI Shu-qin. Residue analysis of buprofezin in tamato and soil[J]. Environmental Chemistry, 2009, 28(2) : 298–301. |
| [7] | 李小娇, 龚道新, 成应向, 等. 噻嗪酮在柑橘和土壤中的残留及消解动态[J]. 安徽农业科学, 2011, 39(9) : 5334–5336. LI Xiao-jiao, GONG Dao-xin, CHENG Ying-xiang, et al. Residue and degradation dynamic of buprofezin in citrus and soil[J]. Journal of Anhui Agricultural Sciences, 2011, 39(9) : 5334–5336. |
| [8] | Garcia V A, Gonzalez P E, Del A R. Analysis of buprofezin residues in vegetables:Application to the degradation study on eggplant grown in a greenhouse[J]. Journal of Agricultural and Food Chemistry, 1993, 41(12) : 2319–2323. DOI:10.1021/jf00036a019 |
| [9] | 励建荣, 陆海霞, 季静冰. 浙江省部分地区绿茶中重金属含量的调查和研究[J]. 中国食品学报, 2004, 4(1) : 87–92. LI Jian-rong, LU Hai-xia, JI Jing-bing. A survey on heavy metal contents of green teas in some areas of Zhejiang Province[J]. Journal of Chinese Institute of Food Science and Technology, 2004, 4(1) : 87–92. |
| [10] | 蒋迎.浙江茶叶农药残留与生态茶园的研究[D].杭州:浙江大学, 2008. JIANG Ying. Study on the pesticide residue and ecological tea plantation of Zhejiang Province[D]. Hangzhou:Zhejiang University, 2008. |
| [11] | Toan P V, Sebesvari Z, Bl?sing M, et al. Pesticide management and their residues in sediments and surface and drinking water in the Mekong Delta, Vietnam[J]. Science of the Total Environment, 2013, 452 : 28–39. |
| [12] | Oulkar D P, Banerjee K, Patil S H, et al. Degradation kinetics and safety evaluation of buprofezin residues in grape (Vitis vinifera L.) and three different soils of India[J]. Pest Management Science, 2009, 65(2) : 183–188. DOI:10.1002/ps.v65:2 |
| [13] | Voica C, Dehelean A, Pamula A. Method validation for determination of heavy metals in wine and slightly alcoholic beverages by ICP-MS[J]. Journal of Physics:Conference Series, 2009, 182 : 012036. DOI:10.1088/1742-6596/182/1/012036 |
| [14] | Burillo P G, Luzardo O P, García C P, et al. Exposure to persistent and non-persistent pesticides in a non-occupationally exposed population in Tenerife Island (Spain)[J]. Gaceta Sanitaria, 2014, 28(4) : 123–138. |
| [15] | Herrera L A, Ostrosky W P, Schiffmann D, et al. The insecticide buprofezin induces morphological transformation and kineto chore positive micronuclei in cultured Syrian hamster embryo cells in the absence of detectable DNA damage[J]. Mutation Research Genomics, 1993, 303(3) : 121–125. DOI:10.1016/0165-7992(93)90024-P |
| [16] | Fahmy M A, Abdalla E F. Genotoxicity evaluation of buprofezin, petroleum oil and profenofos in somatic and germ cells of male mice[J]. Journal of Applied Toxicology, 1998, 18(5) : 301–305. DOI:10.1002/(ISSN)1099-1263 |
| [17] | 孙伟, 李清军, 焦奎, 等. 有机小分子与DNA的相互作用及其在DNA分析中的应用[J]. 化学试剂, 2005, 27(3) : 149–152. SUN Wei, LI Qing-jun, JIAO Kui, et al. Interaction of small organic molecules with DNA and its aha-lyrical application[J]. Chemical Reagents, 2005, 27(3) : 149–152. |
| [18] | Wang L H, Zhang G W, Pan J H, et al. Intercalation binding of food antioxidant butylated hydroxyanisole to calf thymus DNA[J]. Journal of Photochemistry and Photobiology B:Biology, 2014, 141 : 253–261. DOI:10.1016/j.jphotobiol.2014.10.011 |
| [19] | 童裳伦, 胡洲, 刘维屏. 光谱法研究百草枯与小牛胸腺DNA的相互作用[J]. 化学学报, 2010, 68(14) : 1404–1410. TONG Shang-lun, HU Zhou, LIU Wei-ping. Study on the interaction between paraquat and calf thymus DNA by spectral methods[J]. Acta Chemica Sinica, 2010, 68(14) : 1404–1410. |
| [20] | Bhattacharya J, Bhattacharya M, Chakrabom A S, et al. Interaction of chlorpromazine with myoglobin and hemoglobin:A comparative study[J]. Biochemical Pharmacology, 1994, 47(11) : 2049–2053. DOI:10.1016/0006-2952(94)90080-9 |
| [21] | Shahabadi N, Kashanian S, Khosravi M, et al. Multispectroscopic DNA interaction studies of a water-soluble nickel (Ⅱ) complex containing different dinitrogen aromatic ligands[J]. Transition Metal Chemistry, 2010, 35(6) : 699–705. DOI:10.1007/s11243-010-9382-x |
| [22] | 王新莹, 纪鸣, 李志果, 等. 金属离子与DNA相互作用的研究进展[J]. 分析科学学报, 2005, 21(5) : 557–562. WANG Xin-ying, JI Ming, LI Zhi-guo, et al. Progress of research on the interactions between DNA and metal ions[J]. Journal of Analytical Science, 2005, 21(5) : 557–562. |
| [23] | Andrushchenko V, Sande J H V D, Wieser H. Vibrational circular dichroism and IR absorption of DNA complexes with Cu2+ ions[J]. Biopolymers, 2003, 72(5) : 374–390. DOI:10.1002/(ISSN)1097-0282 |
| [24] | Pritchard N J, Blake A, Peacocke A R. Modified intercalation model for the interaction of amino acridines and DNA[J]. Nature, 1966, 212(12) : 1360–1361. |
| [25] | 李珂, 董瑞新, 班戈, 等. 镍离子对DNA结构和导电性的影响[J]. 物理学报, 2009, 58(9) : 6477–6481. LI Ke, DONG Rui-xin, BAN Ge, et al. Effect of nickel ions on DNA structure and conductivity[J]. Acta Physica Sinica, 2009, 58(9) : 6477–6481. |
| [26] | 惠晓梅, 郭栋生, 袁小英. 四种金属离子对CHBr3和小牛胸腺DNA间结合作用的影响[J]. 环境科学学报, 2010, 30(4) : 820–824. HUI Xiao-mei, GUO Dong-sheng, YUAN Xiao-ying. The effect of Cu2+, Co2+, Cd2+ and Mg2+ on the interactions between bromoform and calf thymus DNA[J]. Acta Scientiae Circumstantiae, 2010, 30(4) : 820–824. |
| [27] | Tao M, Zhang G W, Pan J H, et al. Deciphering the groove binding modes of tau-fluvalinate and flumethrin with calf thymus DNA[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 155 : 28–37. DOI:10.1016/j.saa.2015.11.006 |
| [28] | Wang L H, Zhang G W, Pan J H, et al. Intercalation binding of food antioxidant butylated hydroxyanisole to calf thymus DNA[J]. Journal of Photochemistry and Photobiology B:Biology, 2014, 141 : 253–261. DOI:10.1016/j.jphotobiol.2014.10.011 |
 2016, Vol. 35
2016, Vol. 35