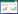文章信息
- 樊广萍, 仓龙, 王玉军, 崔晓丹, 周东美
- FAN Guang-ping, CANG Long, WANG Yu-jun, CUI Xiao-dan, ZHOU Dong-mei
- 电场驱动纳米Fe0在不同介质中的迁移行为研究
- The transport behavior of nano Fe0 in different mediums under electrical field
- 农业环境科学学报, 2016, 35(12): 2320-2326
- Journal of Agro-Environment Science, 2016, 35(12): 2320-2326
- http://dx.doi.org/10.11654/jaes.2016-1133
文章历史
- 收稿日期: 2016-09-02
2. 中建中环工程有限公司, 南京 210019
2. China Construction Power and Environment Engneering Co., Ltd., Nanjing 210019, China
纳米Fe0由于其较高的比表面积和较高的活性在污染地下水和土壤修复中受到越来越多的关注,它不仅可以降解无机污染物还可以降解有机污染物[1-3]。但是,由于纳米Fe0粒径小,比表面积大,在范德华力和磁力的作用下容易发生团聚。另外,纳米Fe0的还原脱氯过程是一个介面反应,只有保证纳米材料与污染物充分接触才能实现污染物的有效降解。纳米材料在土壤中的迁移距离很短,有研究表明纳米Fe0在介质中的迁移距离仅有几米[4-10]。因此,如何保证纳米Fe0在土壤中的迁移并使其在长距离迁移过程中既不团聚又能保持较高的活性是限制其成功应用的关键问题[8-9, 11]。为了增强纳米Fe0的稳定性,通常在其表面包被高分子聚合物类分散剂。很多试剂被用来增强纳米Fe0的稳定性,比如聚丙烯酸、瓜尔胶和羧甲基纤维素钠等,但并不是所有的分散剂都是环境友好的[12-14]。Comba等[15]采用生物高聚物黄原胶来分散纳米Fe0,发现6 g·L-1的黄原胶能使15 g·L-1的纳米Fe0溶液稳定10 d以上。柱迁移试验表明黄原胶是纳米Fe0的一种优良运输载体,在场地修复中具有广阔的应用前景[16]。虽然分散的纳米Fe0在多孔性介质比如石英砂中能迁移,但其在低渗透性土壤中的传输仍然十分困难。
将纳米技术与电动修复技术相结合,利用电场增强纳米Fe0在土壤中的传输性能,为其实际应用提供了可能性。电动修复技术能有效修复重金属、有机物或复合污染的土壤,特别适用于低渗透性土壤的修复。有研究表明直流电场能够促进纳米Fe0在石英砂和粘土中的迁移并对污染物进行降解,且对于粘土来说,电渗流是纳米Fe0在电动过程中的主要迁移方式[17-22],但是关于纳米Fe0在迁移过程中存在状态的研究很少。
本文的主要目的是考察不同介质对分散的纳米Fe0在电场中迁移行为的影响,探究电场驱动分散的纳米Fe0在不同介质中的迁移行为和存在状态,为电动-纳米Fe0联合修复技术的应用提供理论依据和技术支持。
1 材料与方法 1.1 供试材料石英砂和高岭土均购自国药化学试剂有限公司(中国)。石英砂粒径范围为0.50~0.60 mm,均匀度指数为1.2(Ui=d60 /d10),平均粒径0.55 mm[23]。纳米Fe0购自南京市艾普瑞纳米材料有限公司,粒径30~100 nm,保存于厌氧培养箱中(YQX-Ⅱ,上海新苗医疗器械设备有限公司)。黄原胶(粘度800~1200 cps)购自美国Sigma Aldrich公司。试验所用水均为超纯水(18 MΩ·cm-1),用Mill-Q系统制备,去氧水通过充氮气20 min制备。
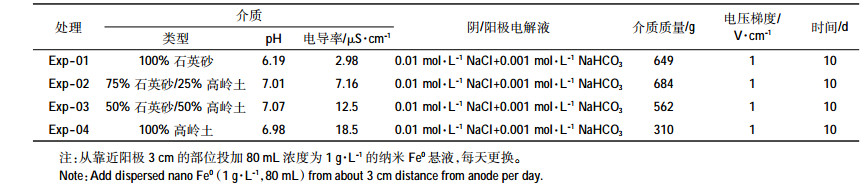
1.2 电动试验电动试验装置如图 1所示,包括电动修复池主体及外围设备。主体是用有机玻璃制成的长方形盒子,上部覆顶盖,其中电动修复池包括介质填充池(12.5 cm×8 cm×6 cm)、阳阴极电解池(2.5 cm×8 cm×6 cm)以及纳米材料投加池(2.5 cm×8 cm×6 cm)。纳米材料投加池位于介质填充池中靠近阳极3 cm位置,其外围设备包括钛合金电极(4.0 cm×4.0 cm)、直流电源、四通道蠕动泵和pH自动控制系统。纳米材料投加池两端采用包裹两层尼龙网(100目,孔径150 μm)的隔板框与介质填充池隔开,在分离介质的同时保证纳米材料通过。顶盖上开设有气孔以利于电解产生的气体排出。
|
| 图 1 电动试验装置图 Figure 1 Schematic diagram of electrokinetic apparatus 1.直流电源;2.介质填充池;3.纳米材料投加池;4.阳极;5.阴极;6.蠕动泵;7.钛合金电极;8.尼龙网隔板;9.阳极电解液储槽;10.阴极电解液储槽;11.酸度计;12.酸液瓶;13. pH电极 |
电动试验中选取的四种不同介质分别为100%石英砂、75%石英砂/25%高岭土、50%石英砂/50%高岭土和100%高岭土。试验开始前,清洗石英砂以去除杂质,具体方法为:先用0.01 mol· L-1 HCl清洗石英砂,浸泡过夜后用去离子水洗净,然后用0.01 mol· L-1 NaOH清洗石英砂,浸泡过夜后用去离子水洗净,最后在105 ℃下烘干备用[24]。对于石英砂和高岭土混合介质,先按质量比例配好,然后不断搅拌混匀。将不同介质填入电动装置介质填充池,然后压实。为了增加离子强度,电解液采用0.01 mol·L-1 NaCl和0.001 mol· L-1 NaHCO3的混合溶液。电动试验开始前,先用电解液对土柱饱和24 h,然后施加电场,电压梯度设置为1 V· cm-1。试验共设置四个处理,具体见表 1。
纳米Fe0投加点设置在靠近阳极3 cm的位置,这样可以避免阳极电解产生的O2和H+对纳米Fe0的溶解和腐蚀。另外,这个位置弱酸性的环境有利于纳米Fe0保持活性。电动过程中,从纳米材料投加点加入80 mL黄原胶(1 g· L-1)分散的纳米Fe0溶液(1 g· L-1),每天更换。配制纳米Fe0悬液时,先在厌氧培养箱中用去氧水(加入背景电解质0.01 mol·L-1 NaCl+0.001 mol· L-1 NaHCO3)配制2 g·L-1的纳米Fe0溶液,超声分散30 min后,迅速加入到同体积的2 g·L-1黄原胶溶液中,振荡5 min并超声1 min以保证混匀。最后制得1 g· L-1黄原胶分散的、浓度为1 g·L-1的纳米Fe0悬液,通过测定其pH为6.79。电动过程中,记录电流和电渗流量的大小。试验结束时,将介质从阳极到阴极平均分成4部分(纳米投加池除外),分别标记为S1、S2、S3和S4(如图 1所示)。测定每部分介质的pH、电导率以及总铁和二价铁含量。同时,采集100%高岭土处理中靠近投加口的S2部分样品,通过μ-XANES(Micro X-ray Absorption Near Edge Structure,微束X射线近边分析)测定并分析此处高岭土中铁的存在形态。
1.3 分析方法样品pH和EC分别用pH计(上海雷磁仪器,型号pHS-3B)和EC计(上海雷磁仪器,型号DDS-11A)测定,土水比为1:2.5[25]。电动过程中电流的变化采用万用表测定,电渗流量依据阴极电解液增加的体积计算得出。
样品中有效态二价铁和总铁的测定采用邻菲罗啉比色法[25]。具体方法是:称取5 g新鲜土样,加入0.1 mol· L-1 Al2(SO4)3(pH2.5)提取液50 mL,摇匀,放置5 min后用0.45 μm滤膜过滤,吸取5 mL滤液到25 mL的比色管中,加10%的盐酸羟胺0.5 mL,摇匀,持续作用数分钟后再加0.1%的邻菲罗啉2.5 mL,用蒸馏水定容,放置30 min以上,然后用1 cm光径比色槽,在分光光度计上用波长530 nm比色。根据读取的吸收值,从已绘制的Fe的工作曲线上,查得Fe2+浓度,最后测得的是总铁的浓度,不加盐酸羟胺的处理测得的是Fe2+的浓度。
μ-XANES数据采集在中国科学院上海应用物理研究所上海光源(BL15U1)进行。分析环境为空气,入射X射线由波荡器产生,用Si(111)单色器选取18.1 keV的X射线,经K-B镜聚焦2 μm×3 μm光斑,样品的扫描区间约为0.2 mm×0.2 mm,扫描时间为1 s,步长为0.005 mm,用硅漂移单元探测器(SDD,Vor原tex)采集元素的特征X射线信号,用多通道分析器记录。通过Igor软件处理数据得到基于μ-XRF(Micro X Ray Fluorescence,微束X射线荧光分析)的样品中元素空间分布,找出Fe富集的两个区域(即Hot spot 1和Hot spot 2)。在该两点处采集Fe的K边μ -XANES图谱,分析样品中目标元素富集区矿物的主要类型。选取六种标样,分别是纤铁矿(Lepi docrocite)、赤铁矿(Hematite)、针铁矿(Goethite)、磁铁矿(Magnetite)、6边水铁矿(6-line-ferrihydrite)和2边水铁矿(2-line-ferrihydrite),对其进行主成分分析后,从中选出三种主成分(磁铁矿、6边形水铁矿和2边水铁矿),通过用Ifeffit软件包中的Sixpack(用于PCA)和Athena(用于图谱处理和LCF)软件把样品的μ-XANES光谱拟合成标准光谱的线性组合,实验数据按一个理论模型拟合,并把计算的μ-XANES谱和实验数据进行比较,建立每个样品中铁不同形态的组成比例。
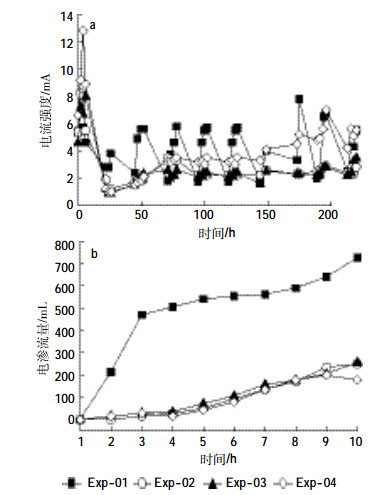
2 结果与分析 2.1 电动过程中电流和电渗流量的变化电动过程中电流和电渗流量的变化如图 2所示。各处理中,100%石英砂处理(Exp-01)中电流强度最大,变化也最明显。投加纳米Fe0之后,电流出现规律性的波动,先逐渐上升至较大值(约6 mA),然后逐渐降低到2 mA左右。电流的规律性波动说明加入的纳米Fe0溶解成Fe2+或Fe3+,增加了溶液的离子强度,进而提高了电流强度。混合介质的处理-75%石英砂/25%高岭土处理和50%石英砂/50%高岭土处理(Exp-02和Exp-03)中,电流强度均较小,第1 d上升至较大值(约8.0 mA)之后,逐渐降低并稳定至较小值(2.5 mA),电流的波动也不明显。100%高岭土处理(Exp-04)的电流强度高于混合介质处理,试验开始时4 h电流强度达到最大值12.8 mA后降低至最小值1 mA,试验后期逐渐升高至5.5 mA左右。这与高岭土较高的电导率有关。100%高岭土的电导率为18.5 μS·cm-1,远大于100%石英砂的电导率(2.98 μS· cm-1),由于石英砂的缓冲能力较弱,阳极电解水产生的H+很容易进入到介质中,进而对纳米Fe0产生溶解和腐蚀,造成Exp-01中较大的电流波动。
|
| 图 2 电动过程中电流(a)和电渗流量(b)的变化 Figure 2 Variation of electric current intensity (a) and electroosmotic flow (b) at different time in various treatments (the positive value means the electroosmotic flow towards cathode) |
电渗流量的变化如图 2b所示,四个处理中电渗流的方向都是从阳极流向阴极。Exp-01中电渗流量最大,为728 mL,且电渗流速率在试验初期较大,达到200 mL· d-1。随着试验的进行,电渗流速率逐渐减小并趋于稳定。其电渗流的变化与试验装置的结构有关,试验装置中电解液通过四通道蠕动泵进入阳阴极电解池中。由于纳米材料投加池位于靠近阳极的位置,因此土柱靠近阳极的阻力小于靠近阴极的阻力,石英砂孔隙比较大,阳极电解液更容易穿透石英砂进入阴极池。随着纳米Fe0的不断加入,纳米Fe0也在水力作用下向阴极迁移。在迁移的过程中,纳米Fe0不断溶解产生Fe2+或Fe3+,这些离子附着在石英砂表面,会降低其表面电荷,另外其生成的铁氧化物和羟基化合物也会降低石英砂的渗透性,因此电渗流速率呈现先增大后减小的趋势。加入高岭土的三个处理中电渗流变化趋势基本一致,试验结束时,电渗流量约为200 mL。Exp-03中的电渗流量略高于Exp-02和Exp-04。
2.2 pH和电导率图 3为电动试验结束后土柱各截面pH和电导率的分布。由于电动过程中电解水的作用会在阳极产生H+并在阴极产生OH-,这些离子随电子迁移进入土柱中,会使靠近阳极的pH降低,靠近阴极的pH升高。试验结束时,各处理中pH从阳极的3.5左右升高到阴极的7.0左右。Exp-01中靠近阳极S1部分的pH值为4.1,高于其他处理。这是因为石英砂的渗透性强,纳米Fe0很容易进入靠近投加点的S1部分,而阳极较低的pH有利于纳米Fe0的溶解(2Fe0+ 2H2O→ 2Fe2+ + H2 + 2OH-),其产生的OH-抑制了阳极pH的降低。Exp-02中的pH在S2和S3部分低于其他处理,可能跟铁的迁移量较小有关。而Exp-04中,S3部分的pH远远高于其他处理,达到7.7,可能与铁迁移到这部分有关,因为纳米Fe0及Fe2+的水解会产生OH-,升高体系的pH。电导率的分布如图 3b所示,各处理中电导率呈现从阳极到阴极逐渐下降的趋势,这与pH的变化趋势相反。Exp-01中的电导率低于其他处理,与石英砂本身较低的电导率(2.98 μS· cm-1)有关。另外,由于介质的孔隙较大,大部分离子都迁移进入到电解液中,导致石英砂各截面的电导率较低。Exp-04中S1和S2部分的电导率高于其他处理,则与高岭土本身较高的电导率(18.5 μS· cm-1)有关。Exp-03中S3和S4部分的电导率最高,其原因有待进一步研究。
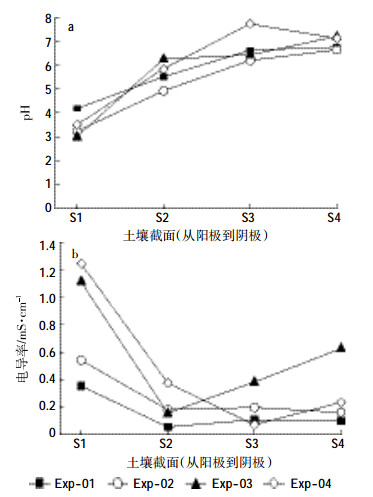
|
| 图 3 电动后土壤各截面pH(a)和电导率(b)的分布 Figure 3 Soil pH (a) and electrical (b) conductivity in soil after electrokinetic treatments |
电动处理后测定了介质各截面总铁和Fe2+的浓度(图 4)。四种介质中,总铁的初始值分别为9.06、9.33、9.60、10.7 mg· kg-1。从图 4a可以看出,铁的迁移量顺序为Exp-01>Exp-04>Exp-03>Exp-02。Exp-01中,铁的迁移量高于其他处理,主要与其较大的孔隙和较高的电渗流量有关。纳米Fe0在水力和电渗流的共同作用下很容易迁移进入石英砂中。在靠近阳极的S1部分,总铁的含量为87.6 mg· kg-1;靠近投加点的S2部分总铁的含量最高,达469 mg· kg-1;在S3和S4部分逐渐降低,分别为226、28.8 mg· kg-1。这说明纳米Fe0在水力和电场的作用下发生了向阴极迁移。大部分的铁在靠近投加点的S2部分积聚,因为纳米Fe0在迁移过程中容易发生溶解和腐蚀,在较高的pH条件下会生成铁的氧化物或者羟基化合物,这些化合物沉积在石英砂表面,容易造成纳米Fe0的吸附,并且这些化合物的粒径大于纳米Fe0的粒径,会造成介质孔隙的堵塞[26]。Exp-04中铁的迁移量要高于混合介质处理,且铁迁移到靠近阴极的S4部分,S4部分的铁浓度达到了277 mg·kg-1,远高于其他处理。图 5是电动试验结束以后各处理的照片。从照片上也可以看出Exp-04较Exp-02和Exp-03介质有明显的变色,说明铁迁移到了这部分。这与其较高的电流强度有关,由于离子的电迁移速率与电流强度正相关,较高的电流强度会促进铁离子从阳极向阴极移动。从Fe2+的分布(图 4b)可以看出,Exp-01中,靠近投加口的S2部分的Fe2+浓度与总铁的浓度相当,达到420 mg· kg-1,说明这部分铁都是以还原态(Fe2+和Fe0)存在的。从图 5也可以看出,Exp-01中S2部分石英砂的颜色呈现黑色(Fe0)和蓝绿色(Fe2+)。在靠近阴极的S4部分,Fe2+浓度仅为5.77 mg· kg-1,远远低于总铁的28.9 mg·kg-1,说明大部分铁已经被氧化成Fe3+。这与图 5(Exp-01)中S4部分蓝绿色的消失情况一致。而Exp-04中,Fe2+所占的比例较低,不及总铁浓度的一半,说明大部分铁是以Fe3+形态存在的。图 5(Exp-04)中S2、S3和S4部分铁的颜色为黄色也说明纳米Fe0发生了溶解和氧化。以上结果表明,在电场作用下,纳米Fe0在高岭土中迁移时更容易被溶解和腐蚀。
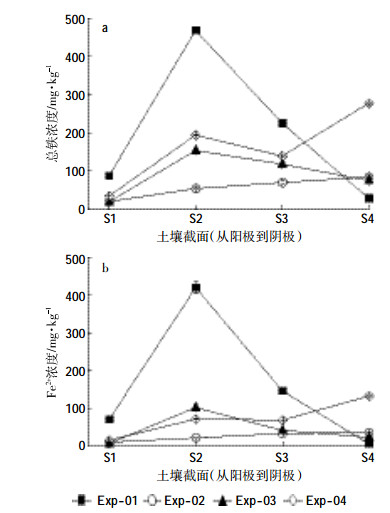
|
| 图 4 电动后土壤各截面总铁(a)和Fe2+(b)浓度 Figure 4 Total Fe (a) and Fe2+ (b) concentration in soil after electrokinetic treatments |

|
| 图 5 电动结束后各处理照片 Figure 5 The photo of different mediums after electrokinetic treatments |
新鲜的纳米Fe0通常含有Fe0内核和包被的Fe3O4氧化层[27-28]。纳米Fe0的氧化通常是从Fe0向Fe2+和Fe3+转化,通过XANES分析很容易判断[29-30]。为了考查纳米Fe0在电场中的存在状态(特别是高岭土中),选取Exp-04中靠近投加点的S2部分样品,对其做了μ-Mapping,得到了铁元素的空间分布图谱,如图 6所示,可以看出铁的浓度较高且空间分布较均匀。选取其中的两个点(Hot spot 1和Hot spot 2)做了Fe的K边μ-XANES测定,如图 7所示。结果表明:Hot spot 1中铁的成分为2边水铁矿81.0%、6边水铁矿10.6%和磁铁矿18.9%。Hot spot 2的成分为2边水铁矿15.0%、6边水铁矿57.3%和磁铁矿31.8%。成分分析进一步证实纳米Fe0在电动过程中很容易发生溶解和转化,其在高岭土中的迁移是以离子态进行的。

|
| 图 6 高岭土中Fe的μ-Mapping图谱 Figure 6 Fe μ-Mapping spectra of kaolin sample |
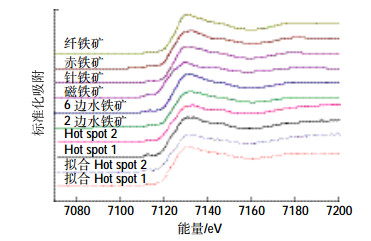
|
| 图 7 高岭土中Fe以及参照物Fe的K边μ-XANES谱 Figure 7 Fe K-edge μ-XANES spectra of kaolin sample |
纳米Fe0除了具有较高的比表面积和反应活性外,还可以作为液体泥浆注入土壤和地下水中,但是由于布朗运动、铁的密度以及磁性引力因素的作用,其在土壤中的迁移仍然受到限制。通过电场来驱动纳米Fe0在介质中的迁移,为其实际应用提供了可能性。电动强化纳米Fe0在不同介质中迁移行为的研究结果表明,纳米Fe0在石英砂中的迁移能力要强于高岭土,其在高岭土中的迁移是以离子态进行的。影响纳米Fe0在介质中迁移的因素有以下几点:
(1)纳米Fe0在高浓度时的团聚作用。试验结果表明迁移进入介质中的纳米Fe0的量较少,大部分的纳米Fe0都集中在纳米材料投加池或者靠近纳米投加池的S2部分,主要是因为纳米Fe0的团聚作用。当纳米Fe0悬液浓度大于1 g· L-1时,更易发生团聚和沉淀。虽然在试验中每天向纳米投加池投加新鲜制备的黄原胶分散的纳米Fe0悬液,但是当纳米Fe0的浓度高于可通过的孔体积时,部分纳米Fe0仍然会发生团聚和沉降。纳米Fe0团聚以后会形成比介质孔隙(特别是高岭土,其粒径范围在微米级)更大的团聚体,从而限制其在介质中的迁移。
(2)纳米Fe0的快速溶解反应。试验结果中纳米Fe0在远离投加口的位置主要是以Fe2+或Fe3+存在,因为纳米Fe0能快速发生溶解反应(2Fe0+4H ++O2→ 2Fe2++2H2O;2Fe0 + 2H2O → 2Fe2+ + H2 + 2OH-),其溶解产物(铁的羟基化合物或氧化物)的体积大于纳米Fe0的体积,这些溶解产物将会堵塞介质孔隙,进而形成更多的团聚物,限制其进一步向介质中移动。
(3)纳米Fe0在黏土矿物上的沉积作用。相比于石英砂,纳米Fe0在高岭土中的迁移更困难。因为石英砂表面所带电荷较少,而黏土矿物表面电荷的异质性使纳米Fe0更容易在高岭土表面发生沉积,从而限制其迁移。
(4)电解产生的离子强度的影响。在电动过程中,阳极电解不断产生H+,其向阴极的迁移会造成介质溶液中离子强度的增加,使纳米Fe0发生团聚和溶解。另外,阴极电解产生的OH-向阳极移动也会造成纳米Fe0的钝化,在实际应用中应对阴极pH进行调控。
4 结论通过对电场作用下分散的纳米Fe0在不同介质中的迁移行为研究,发现纳米Fe0在石英砂中的迁移高于加入高岭土的处理,大部分纳米Fe0集聚在靠近投加口的S1和S2部分,在远离投加口的S3和S4部分铁逐渐由Fe2+向Fe3+转化。100%高岭土中纳米Fe0的迁移能力强于混合介质处理,但大部分是以溶解态向阴极迁移,μ-XANES的分析结果证实了电场驱动下高岭土中的铁主要以纤铁矿和磁铁矿形式存在。该研究结果说明电场驱动纳米Fe0在高岭土中的迁移是以离子态进行的,纳米Fe0在低渗透性介质中的迁移仍然十分困难。
| [1] | Masciangioli T, Zhang W X. Peer reviewed:Environmental technologies at the nanoscale[J]. Environmental Science & Technology, 2003, 37(5) : 102A–108A. |
| [2] | Zhang W X. Nanoscale iron particles for environmental remediation:An overview[J]. Journal of Nanoparticle Research, 2003, 5(3/4) : 323–332. DOI:10.1023/A:1025520116015 |
| [3] | Zhang W X, Elliott D W. Applications of iron nanoparticles for groundwater remediation[J]. Remediation Journal, 2006, 16(2) : 7–21. DOI:10.1002/(ISSN)1520-6831 |
| [4] | Elliott D W, Zhang W X. Field assessment of nanoscale bimetallic particles for groundwater treatment[J]. Environmental Science & Technology, 2001, 35(24) : 4922–4926. |
| [5] | Quinn J, Geiger C, Clausen C, et al. Field demonstration of DNAPL dehalogenation using emulsified zero-valent iron[J]. Environmental Science & Technology, 2005, 39(5) : 1309–1318. |
| [6] | Henn K W, Waddill D W. Utilization of nanoscale zero-valent iron for source remediation:A case study[J]. Remediation Journal, 2006, 16(2) : 57–77. DOI:10.1002/(ISSN)1520-6831 |
| [7] | Wei Y T, Wu S C, Chou C M, et al. Influence of nanoscale zero-valent iron on geochemical properties of groundwater and vinyl chloride degradation:A field case study[J]. Water Research, 2010, 44(1) : 131–140. DOI:10.1016/j.watres.2009.09.012 |
| [8] | He F, Zhao D Y, Paul C. Field assessment of carboxymethyl cellulose stabilized iron nanoparticles for in situ destruction of chlorinated solvents in source zones[J]. Water Research, 2010, 44(7) : 2360–2370. DOI:10.1016/j.watres.2009.12.041 |
| [9] | Bennett P, He F, Zhao D Y, et al. In situ testing of metallic iron nanoparticle mobility and reactivity in a shallow granular aquifer[J]. Journal of Contaminant Hydrology, 2010, 116(1) : 35–46. |
| [10] | Johnson R L, Nurmi J T, O'brien Johnson G S, et al. Field-scale transport and transformation of carboxymethylcellulose-stabilized nano zero-valent iron[J]. Environmental Science & Technology, 2013, 47(3) : 1573–1580. |
| [11] | Comba S, Di Molfetta A, Sethi R. A comparison between field applications of nano-, micro-, and millimetric zero-valent iron for the remediation of contaminated aquifers[J]. Water, Air, & Soil Pollution, 2011, 215(1/2/3/4) : 595–607. |
| [12] | He F, Zhao D Y, Liu J, et al. Stabilization of Fe-Pd nanoparticles with sodium carboxymethyl cellulose for enhanced transport and dechlorination of trichloroethylene in soil and groundwater[J]. Industrial & Engineering Chemistry Research, 2007, 46(1) : 29–34. |
| [13] | Tiraferri A, Sethi R. Enhanced transport of zerovalent iron nanoparticles in saturated porous media by guar gum[J]. Journal of Nanoparticle Research, 2009, 11(3) : 635–645. DOI:10.1007/s11051-008-9405-0 |
| [14] | Phenrat T, Liu Y, Tilton R D, et al. Adsorbed polyelectrolyte coatings decrease Fe0 nanoparticle reactivity with TCE in water:Conceptual model and mechanisms[J]. Environmental Science & Technology, 2009, 43(5) : 1507–1514. |
| [15] | Comba S, Sethi R. Stabilization of highly concentrated suspensions of iron nanoparticles using shear-thinning gels of xanthan gum[J]. Water Research, 2009, 43(15) : 3717–3726. DOI:10.1016/j.watres.2009.05.046 |
| [16] | Vecchia E D, Luna M, Sethi R. Transport in porous media of highly concentrated iron micro-and nanoparticles in the presence of xanthan gum[J]. Environmental Science & Technology, 2009, 43(23) : 8942–8947. |
| [17] | Yang G C C, Hung C H, Tu H C. Electrokinetically enhanced removal and degradation of nitrate in the subsurface using nanosized Pd/Fe slurry[J]. Journal of Environmental Science and Health Part A, 2008, 43(8) : 945–951. DOI:10.1080/10934520801974517 |
| [18] | Yuan S H, Long H Y, Xie W J, et al. Electrokinetic transport of CMC-stabilized Pd/Fe nanoparticles for the remediation of PCP-contaminated soil[J]. Geoderma, 2012, 185 : 18–25. |
| [19] | Jones E H, Reynolds D A, Wood A L, et al. Use of electrophoresis for transporting nano-iron in porous media[J]. Ground Water, 2011, 49(2) : 172–183. DOI:10.1111/gwat.2011.49.issue-2 |
| [20] | Chowdhury A I, O'carroll D M, Xu Y, et al. Electrophoresis enhanced transport of nano-scale zero valent iron[J]. Advances in Water Resources, 2012, 40 : 71–82. DOI:10.1016/j.advwatres.2012.01.014 |
| [21] | Reddy K R, Darko-Kagya K, Cameselle C. Electrokinetic-enhanced transport of lactate-modified nanoscale iron particles for degradation of dinitrotoluene in clayey soils[J]. Separation and Purification Technology, 2011, 79(2) : 230–237. DOI:10.1016/j.seppur.2011.01.033 |
| [22] | Gomesa H I, Dias-Ferreira C, Ribeiro A B. Electrokinetic enhanced transport of zero valent iron nanoparticles for chromium (Ⅵ) reduction in soils[J]. Chemical Engineering, 2012, 28 : 102–108. |
| [23] | Wang D J, Zhang W, Hao X Z, et al. Transport of biochar particles in saturated granular media:effects of pyrolysis temperature and particle size[J]. Environmental Science & Technology, 2013, 47(2) : 821–828. |
| [24] | Zhou D M, Wang D J, Cang L, et al. Transport and re-entrainment of soil colloids in saturated packed column:Effects of pH and ionic strength[J]. Journal of Soils and Sediments, 2011, 11(3) : 491–503. DOI:10.1007/s11368-010-0331-2 |
| [25] | 鲁如坤. 土壤农化分析[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Analytical methods for soil and agro-chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [26] | Noubactep C, Caré S, Crane R. Nanoscale metallic iron for environmental remediation:Prospects and limitations[J]. Water, Air, & Soil Pollution, 2012, 223(3) : 1363–1382. |
| [27] | Nurmi J T, Tratnyek P G, Sarathy V, et al. Characterization and properties of metallic iron nanoparticles:Spectroscopy, electrochemistry, and kinetics[J]. Environmental Science & Technology, 2005, 39(5) : 1221–1230. |
| [28] | Liu Y, Majetich S A, Tilton R D, et al. TCE dechlorination rates, pathways, and efficiency of nanoscale iron particles with different properties[J]. Environmental Science & Technology, 2005, 39(5) : 1338–1345. |
| [29] | Waychunas G A, Apted M J, Brown Jr G E. X-ray K-edge absorption spectra of Fe minerals and model compounds:Near-edge structure[J]. Physics and Chemistry of Minerals, 1983, 10(1) : 1–9. DOI:10.1007/BF01204319 |
| [30] | Reinsch B C, Forsberg B, Penn R L, et al. Chemical transformations during aging of zerovalent iron nanoparticles in the presence of common groundwater dissolved constituents[J]. Environmental Science & Technology, 2010, 44(9) : 3455–3461. |
 2016, Vol. 35
2016, Vol. 35