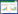文章信息
- 李涛, 葛晓颖, 何春娥, 欧阳竹
- LI Tao, GE Xiao-ying, HE Chun-e, OUYANG Zhu
- 豆科秸秆、氮肥配施玉米秸秆还田对秸秆矿化和微生物功能多样性的影响
- Effects of straw retention with mixing maize straw by alfalfa straw or N fertilizer on carbon and nitrogen mineralization and microbial functional diversity
- 农业环境科学学报, 2016, 35(12): 2377-2384
- Journal of Agro-Environment Science, 2016, 35(12): 2377-2384
- http://dx.doi.org/10.11654/jaes.2016-0539
文章历史
- 收稿日期: 2016-04-19
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
秸秆是农业生产的主要副产品,也是我国农村的传统能源[1]。随着农村能源问题的转变,秸秆的地位发生了很大的改变。由秸秆总量供应紧缺变为剩余,由生活能源和动物饲料变成了一种废弃物,秸秆处理已成为一大难题。秸秆还田是合理利用秸秆资源、培肥土壤和提高作物产量的重要手段[2-3],特别是随着农业机械化水平的不断提高,秸秆还田被大力推广。秸秆还田对农田土壤的碳氮过程具有决定性的作用,尤其影响接茬作物生长过程中的氮素矿化(固持)进程[4-5]。氮是影响农作物生产力的关键因子,秸秆还田后,保障氮素供应与作物需求同步对农业生产具有重要作用。秸秆还田后在微生物的参与下被逐渐分解,秸秆的质量,诸如C/N、氮素含量以及木质素含量,是影响秸秆分解和营养元素释放的重要因子,C/N比低,施入土壤后分解较快,并且能够提高氮素的矿化量以及土壤微生物活性;相反,C/N比高,施入土壤后分解缓慢并且导致对土壤氮素的固持,影响土壤氮素供应[6-7]。禾本科作物(如小麦和玉米)秸秆C/N比一般较高,因此秸秆直接还田后要补施氮肥以弥补秸秆降解过程中土壤微生物对氮素的固持,从而保证氮素的供应[8]。
间套作作为我国传统农业的重要生产措施,在充分利用土地资源和提高粮食产量上有着重要作用。禾本科、豆科间作是一种典型的间作系统,该系统产生两种类型的秸秆,即高质量(低C/N)的豆科秸秆和低质量(高C/N)的禾本科秸秆。豆科作物秸秆如蚕豆秸秆,C/N低,施入土壤后分解速率较禾本科秸秆快。有研究表明豆科秸秆施入土壤后具有与化学氮肥相媲美的供氮能力[9-11]。在自然界中,陆地生态系统是多物种的共同体,因而在生态系统中植物残体也是多物种的集合体。在多物种混合的情况下,比如森林生态系统,由于物种之间的相互作用,可能会改变植物凋落物(树叶)的降解速率以及养分动态[12],Schwendener等[13]发现高质量的植物凋落物(树叶)和低质量的植物凋落物(树叶)共同施用时,前者释放的氮素会被固持并保留在这种混合体的速效氮库中,在后者降解时被利用。混合残体之所以改变了秸秆的分解速率和养分动态,主要在于秸秆之间的相互作用改变了分解微环境中的物理、化学和生物过程,从而影响微生物的活性和群落结构,因此直接或间接地影响了植物凋落物的降解速率[14-15]。同时,土壤中存在“遗留效应”(Legacy effect),Marschner等[16]发现在施入低质量的秸秆(小麦)之前施入高质量的秸秆(狼尾草),相比于两次施入同样低质量的小麦秸秆,明显提高了土壤呼吸、土壤微生物生物量和活性以及土壤养分的可利用性。虽然还田秸秆的质量决定了还田后秸秆的养分动态,可秸秆自身的组成特性是不易改变的,但我们可以通过高质量秸秆和低质量秸秆的组合来提高土壤养分的可利用性。
一般认为C/N比为25:1是决定秸秆还田后对土壤氮素固持与否的关键拐点[17]。国内外学者针对添加外源氮对秸秆降解的影响做了大量研究,结果表明添加外源氮促进了秸秆的分解,提高了土壤无机氮含量[18-19]。但添加的外源氮往往为无机氮肥,而无机氮肥的大量施用不仅提高了农业生产成本,而且导致了土壤质量下降和水环境污染问题[20-21]。目前针对添加外源有机氮(如高质量豆科秸秆)对禾本科秸秆降解过程中无机氮含量的影响报道较少。因此,本试验在可控条件下,研究了豆科作物秸秆(苜蓿:紫花苜蓿)或氮肥与玉米秸秆共同还田对碳氮矿化和土壤微生物的影响,并比较豆科作物秸秆或者氮肥配施玉米秸秆在相同C/N(25:1)下还田对土壤供氮和土壤微生物功能多样性的影响。
1 材料与方法 1.1 土壤样品和植物秸秆的采集土壤样品采集于中国科学院禹城综合试验站(禹城站)农田耕层(0~20 cm)。禹城站位于山东省禹城市(116°36′E,36°57′N,海拔21.2 m),是典型的黄淮海平原引黄灌溉区,属暖温带半湿润季风气候区。年均温度13.1 ℃,降水偏少且集中,年均降水量593.2 mm,降水季节差异明显,夏季(6-8月)降水量占全年的68%,冬春只占15%左右,春旱明显。主要栽培作物为冬小麦、夏玉米,作物种植制度为冬小麦-夏玉米轮作,一年两熟。地下水位一般在1.5~4.0 m,地下水资源丰富。地貌类型为黄河冲积平原,土壤母质为黄河冲击物,土壤以潮土和盐化潮土为主,表土质地为轻、中壤土。
土壤样品采集后风干、过2 mm筛,并去除肉眼可见的植物残体和小砂砾,备用。土壤基本理化性质(表 1)的测定参考鲁如坤[22]方法。土壤有机碳采用重铬酸钾容量法测定,土壤全氮采用凯氏定氮法测定,土壤全磷采用酸溶-钼锑抗比色法测定,土壤全钾采用碱溶-火焰光度法测定,土壤速效氮(铵态氮和硝态氮)采用比色法测定,土壤速效磷采用Olsen法测定,土壤速效钾采用火焰光度法测定,土壤pH采用电位法测定。
玉米秸秆和苜蓿秸秆均采自于禹城站,所用均是地上部分。玉米秸秆和苜蓿秸秆采集后于60 ℃杀青、烘干,剪成约2 cm的小段备用。所用玉米、苜蓿秸秆的全碳和全氮含量分别为453.5、433.9 g·kg-1和9.6、31.3 g·kg-1。
1.2 试验设计在试验开始前,测定所用土壤的田间持水量并调节所用土壤至田间持水量的65%,于生化培养箱中25 ℃下预培养7 d,以恢复土壤微生物活性。本试验共包括4个处理:玉米秸秆单独还田(M),苜蓿秸秆配施玉米秸秆还田(MM),氮肥(尿素)配施秸秆还田(MF)以及一个不加秸秆的对照(CK)。每个处理重复3次。各处理碳源、氮源的施入量见表 2。
称取相当于80 g风干土的土壤于培养瓶中,加水调节到土壤田间持水量的65%,然后根据试验处理加入不同量的植物秸秆样品,在培养瓶中放入一个盛有20 mL 1 mol·L-1 NaOH溶液的小瓶以吸收培养期间释放的二氧化碳,25 ℃下恒温培养。培养瓶用塑料膜密封,为了保持培养瓶内的氧气供应,在塑料膜上留几个小孔保证气体交换。分别在培养的第1、3、5、7、9、13、16、19、23、27、32、39、53、74、104、134、164、194、224、270 d更换NaOH溶液,将取出的NaOH溶液完全洗入三角瓶中,加入1 mol·L-1的BaCl2溶液2 mL及酚酞指示剂2滴,用0.1 mol·L-1盐酸滴定至红色消失,根据盐酸的消耗量计算培养过程中CO2释放量[22]。测定碳素矿化时再加一无土对照,同时也加入盛有20 mL 1 mol·L-1 NaOH溶液的小瓶以吸收来自空气的CO2。在本试验条件下,根据对照和空白对照计算添加秸秆处理的CO2释放量,添加秸秆释放的CO2与对照释放的CO2的差值为秸秆中有机碳的净矿化量[23]。CO2累积释放量为培养初至取样时累积释放量,C矿化率为某时刻累积释放量除以施入的有机碳量。在培养的第1、3、7、15、30、60、90、120、150、210、270 d取样测定土壤无机氮(NH+4-N和NO-3-N)含量,为了保证土壤样品量能够满足样品测定时需要,采集土壤样品时采用破坏性取样,每次取样时采集其中3个培养瓶的土壤样品。在培养结束时测定土壤微生物功能多样性。为了保持培养过程中的土壤湿度,每周以称量法补充水分。
1.3 土壤样品分析 1.3.1 土壤铵态氮和硝态氮的测定称取一定质量的新鲜土壤,按照水土比为10:1用2 mol·L-1 KCl溶液浸提,在往复式振荡机上振荡30 min后过滤。滤液中铵态氮和硝态氮根据鲁如坤[22]的方法测定。
1.3.2 土壤微生物功能多样性的测定土壤微生物功能多样性根据Hitzl等[24]的方法采用BiologTM ECO微平板测定(Biolog Inc.,Hayward,CA,USA)。称取10 g新鲜土样,置于盛有90 mL无菌NaCl溶液(0.85%)的三角瓶中,振荡30 min后静置15 min取上清液。在超净工作台上,用无菌NaCl溶液(0.85%)将上清液稀释1000倍,用8通道加样器将稀释液接种到BiologTM ECO微平板,此时每孔接种150 μL稀释后的土壤悬浊液。将接种好的微平板置于生化培养箱中25 ℃培养,每隔24 h用BiologTMStation读取培养板在590 nm和750 nm下的吸光值。用平均每孔颜色变化率(Average Well Color Development,AWCD)来描述土壤微生物群落总体代谢活性,根据Zak等[25]计算方法,计算公式如下:

式中:C为微平板上某种碳源的吸光值;R为对照孔的吸光值;31为碳源数量。当(C-R)为负值时记为零。
根据培养期间AWCD曲线的变化趋势,选择某培养时刻的数据计算土壤微生物群落对不同碳源的代谢能力,以及群落的多样性指数和均匀度指数。依据碳源的化学结构和性质,按照Garland等[26]的分类,将BiologTM ECO微平板碳源分为6大类:糖类、羧酸类、氨基酸类、胺类、聚合物类和其他类。根据Zak等[25]计算方法计算Shannon多样性指数(H)和均匀度指数(E),计算公式如下:
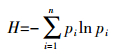
式中:Pi为第i孔的相对吸光值与所有整个微平板的相对吸光值总和的比值。
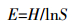
式中:H为Shannon多样性指数;S为微平板上阳性孔的数目,吸光值>0.25的即为阳性孔。
1.4 数据处理与分析采用Duncan检验比较不同处理对土壤无机氮、不同碳源利用率和土壤微生物功能多样性指数的影响。采用重复测量方差分析法分析不同处理对培养期间土壤无机氮含量的影响。所用分析均利用SPSS软件(SPSS 14.0,Chicago,USA)进行,显著性水平为P < 0.05。数据经Excel整理后,利用Sigmaplot软件(Sigmaplot 12.5,California,USA)作图。
2 结果与分析 2.1 不同处理秸秆有机碳的矿化特性在本试验条件下,培养过程中,添加秸秆释放的CO2与对照释放的CO2的差值为秸秆中有机碳的净矿化量。从累积CO2释放量来看,苜蓿秸秆或氮肥配施玉米秸秆提高了添加秸秆中有机碳的累积CO2释放量(图 1A),并且苜蓿秸秆配施玉米秸秆显著提高了添加秸秆中有机碳的累积CO2释放量(P < 0.05)。从添加秸秆有机碳的矿化率来看(图 1B),与玉米秸秆单施相比,氮肥配施玉米秸秆显著提高了有机碳矿化率(P < 0.05),促进了玉米秸秆降解;其次是玉米秸秆单施处理;苜蓿秸秆配施玉米秸秆的有机碳矿化率最低,显著低于玉米秸秆单施处理。这可能与苜蓿秸秆配施玉米秸秆处理施入的碳源量最高有关(表 2)。

|
| 图 1 不同处理对CO2累积排放量与秸秆中有机碳矿化率的影响 Figure 1 Effects of different treatments on cumulative CO2 emission and mineralization rate of carbon in straw |
土壤无机氮含量一定程度上反应了土壤的供氮能力,不同处理培养过程中无机氮含量的变化规律基本一致(图 2),呈现先升高、再降低、最后又升高的变化规律。培养开始后,各处理无机氮含量逐渐升高,除MF处理在培养的第7 d无机氮含量达到最高外,其余3个处理均在培养的第3 d无机氮含量达到最高,随后各处理无机氮含量逐渐降低,在培养第90 d时达到最低,之后各处理无机氮含量逐渐升高。从整个培养过程来看,M处理无机氮含量最低,MM处理无机氮含量最高。双因素方差分析表明,苜蓿秸秆或者氮肥配施显著提高了土壤无机氮含量(F=46.79,P < 0.001),苜蓿配施玉米秸秆处理的无机氮含量显著高于氮肥配施玉米秸秆。从整个培养过程来看,M、MM和MF 3个处理土壤无机氮含量均值分别为81.73、105.51、116.46 mg·kg-1。由图 2可以看出,在整个培养进程中,M处理无机氮含量均低于CK处理,说明单施玉米秸秆造成了对土壤无机氮的固持,MM处理从培养的第7 d无机氮含量低于CK处理,从培养的第120 d开始无机氮含量高于CK处理,MF处理从培养的第15 d无机氮含量低于CK处理,从培养的第210 d开始无机氮含量高于CK处理,这表明相比于玉米秸秆单施,苜蓿秸秆或者氮肥配施玉米秸秆均缓解了对土壤氮素的固持作用,而从时间上看这两个处理又有所不同,氮肥配施的相比于苜蓿秸秆配施的延长了对土壤氮素的固持作用。

|
| 图 2 不同处理对土壤无机氮含量的影响 Figure 2 Effects of different treatments on soil mineral N |
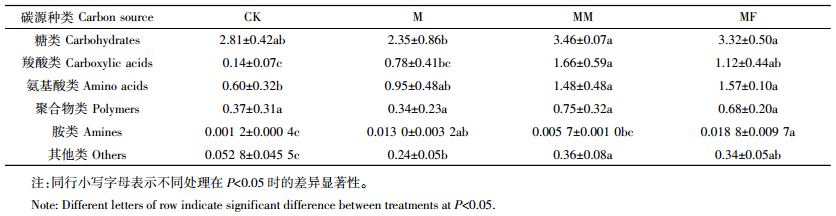
培养期间平均每孔颜色变化率(AWCD)反映了接种微生物对微平板上碳源的代谢能力,代表了接种微生物群落的总体活性。不同处理对AWCD的影响如图 3。各处理在培养的第24 h,AWCD值变化不大,之后开始快速升高。培养结束时,各处理AWCD值的大小顺序为MM>MF>M>CK。苜蓿秸秆或氮肥配施玉米秸秆处理相比于玉米秸秆单施处理显著提高了AWCD值,但苜蓿秸秆配施或氮肥配施玉米秸秆对AWCD值的影响差异不显著。这表明施入秸秆提高了微生物群落的代谢活性,相比于玉米秸秆单施处理,苜蓿秸秆配施或氮肥配施玉米秸秆处理显著提高了微生物群落的代谢活性。采用培养96 h数据计算了土壤微生物群落对不同碳源的代谢能力(表 3)以及群落的多样性指数和均匀度指数。除糖类和聚合物类外,不同处理显著影响了土壤微生物对碳源的利用能力(P < 0.05),各处理土壤微生物主要利用糖类、羧酸类、氨基酸类和聚合物类碳源,对胺类和其他类碳源利用率比较低。与玉米秸秆单施处理相比,苜蓿秸秆配施或氮肥配施玉米秸秆均提高了土壤微生物对6类碳源的利用能力。苜蓿秸秆配施处理相比氮肥配施处理均提高了除氨基酸类外的5类碳源的利用能力,表明配施可能改变了土壤中有机物组成,从而导致培养期间土壤微生物对微平板中碳源利用能力的不同。
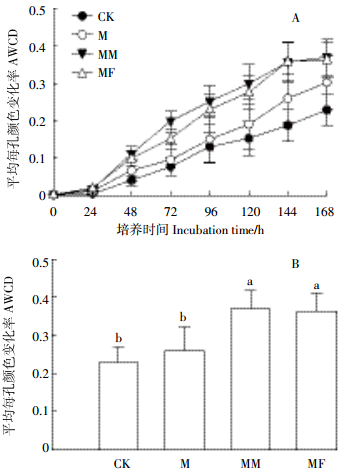
|
| 图 3 不同处理培养期间平均每孔颜色变化率(AWCD)以及培养168 h时平均每孔颜色变化率 Figure 3 Average well color development (AWCD) of metabolized substrates in BiologTM ECO plate during incubation and at 168 h incubation of different treatments 图中小写字母表示不同处理在P < 0.05时的差异显著性。下同 Different letters indicate significant difference between treatments at P < 0.05. The same below |
|
不同处理对Shannon多样性指数和均匀度指数的影响如图 4所示。秸秆施入显著提高了微生物群落多样性指数,虽然苜蓿秸秆配施或者氮肥配施玉米秸秆处理相比于玉米秸秆单施处理提高了微生物群落多样性指数,但3个处理之间影响差异不显著。各处理对微生物群落Shannon均匀度指数影响差异不显著。
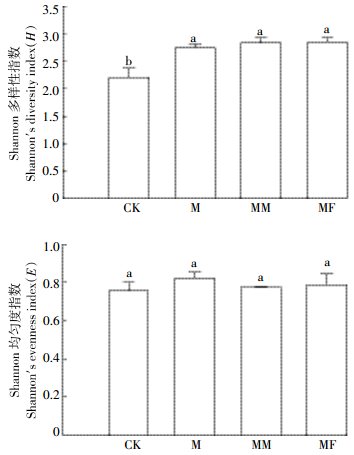
|
| 图 4 不同处理对Shannon多样性指数和均匀度指数的影响 Figure 4 Functional diversity indexes of soil microbial communities under different treatments |
在本试验条件下,与玉米秸秆单施处理相比,苜蓿秸秆或氮肥配施玉米秸秆处理提高了土壤累积CO2释放量。秸秆施入土壤后,在土壤中的矿化可分为三个阶段,即前期快速矿化,然后逐渐缓慢,最后达到相对稳定的阶段,这与秸秆的化学组成有关。秸秆中的有机碳可分为易分解部分(如淀粉、葡萄糖)和难分解部分(如木质素)[17],在培养的前期由于大量易分解碳源的加入刺激了土壤微生物的生长,大幅提高了CO2释放量,随着培养时间的推进,易分解组分逐渐消耗完毕,CO2释放量逐渐降低,达到一个相对平衡的阶段。从最终的CO2累积释放量来看,MM处理显著提高了CO2累积释放量,MF处理相比于M处理亦提高了CO2累积释放量,但差异不显著。相比于其他处理,MM处理提高了微生物群落生理代谢活性,因此MM处理显著提高CO2累积释放量可能与MM处理微生物活性最高有关。MM处理中高微生物活性原因可能在于玉米秸秆和苜蓿秸秆的混合分解效应,植物凋落物的种类显著影响了凋落物的降解[14, 27],而且相比于单一凋落物,混合凋落物通过混合组分中凋落物之间的交互效应影响了土壤微生物活性[27];此外,氮的可利用性限制了土壤中的微生物活性,从而限制了土壤微生物对秸秆碳的矿化[28-29],在整个培养进程中MM处理无机氮含量最高,无机氮含量的提高使得土壤微生物活性提高,促进了CO2的释放。从最终的有机碳矿化率来看,MM处理显著低于MF和M处理,可能与MM处理高的碳输入量有关,因为碳的输入量会影响碳的降解率[30-31]。图 5为培养结束时施入秸秆处理的土壤有机碳含量,MM处理有机碳含量最高,MF处理最低,表明苜蓿秸秆配施玉米秸秆处理提高了土壤有机碳含量,这对土壤碳存储是有利的。
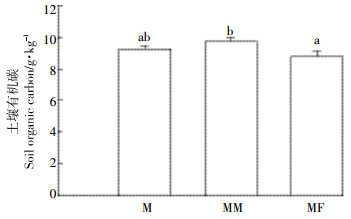
|
| 图 5 不同处理培养结束时土壤有机碳含量 Figure 5 Soil organic carbon content at the end of incubation under different treatments |
玉米秸秆单施处理在整个培养期间表现为对氮素的固持作用,苜蓿秸秆或者氮肥配施玉米秸秆处理均提高了土壤无机氮含量,缓解了固持作用。这与前人的研究结果类似[13, 29-30, 32],即高质量秸秆或者氮肥配施低质量秸秆施入土壤会缓解对土壤氮素的固持。从整个培养进程上看,玉米秸秆单施处理无机氮含量始终低于对照,表现为强烈的对土壤氮素的固持作用,苜蓿配施或氮肥配施玉米秸秆处理均缓解了土壤微生物对氮素的固持作用,在时间上表现为培养的前期和后期。但是两个处理又有所不同,苜蓿秸秆配施处理从培养的第7 d开始表现为对氮素的固持作用,氮肥配施从第15 d开始表现为对氮素的固持作用,苜蓿秸秆配施和氮肥配施对氮固持时间上的差异可能会降低氮素的淋溶损失。在培养的中后期,苜蓿秸秆配施处理相比于氮肥配施处理提前了氮素的矿化作用,苜蓿配施处理从培养的第120 d开始,而氮肥配施处理从第210 d开始,表明苜蓿秸秆配施相对于氮肥配施在前期延缓了氮素的释放,而在后期延长了氮的可利用性(后期净氮矿化量持续时间长),在种植作物的情况下,这种效应会使氮的释放与作物对氮的需求更加同步。虽然MF和MM处理碳氮源施入量均是在C/N比为25:1施入,但是苜蓿秸秆既含氮源又含碳源,使得苜蓿秸秆配施处理施入碳氮总量高于氮肥配施处理,从而增强了土壤微生物活性,提高了无机氮含量,延长了氮的可利用性。
3.2 不同处理对微生物量氮和微生物功能多样性的影响BiologTM ECO微平板分析法是一种基于微生物群落生理代谢的方法,能够表征土壤微生物群落的功能多样性,已被广泛用于土壤微生物功能多样性的测定[33]。秸秆施入后为微生物提供了丰富的碳源、氮源和能源,刺激了微生物的生长,从而提高了微生物生物量和活性[33-34]。在本试验中,施用秸秆的处理提高了AWCD和Shannon多样性指数,对Shannon均匀度指数没有影响。施入秸秆处理中MM处理的AWCD最高,其次是MF处理,M处理最低。相关性分析表明AWCD与氮输入量(r=0.715,P < 0.05)和无机氮含量(r=0.82,P < 0.01)呈正相关关系,这表明氮的输入量和氮的可利用性显著影响了土壤微生物群落活性。苜蓿秸秆或者氮肥配施玉米秸秆处理提高了土壤无机氮含量,从而提高了AWCD,并且苜蓿秸秆配施延长了土壤中氮的可利用性,所以AWCD最高。这表明相比于氮肥配施处理,苜蓿秸秆配施处理为微生物提供了更多的碳源和氮源,延长了营养的供给,提高了微生物的活性[35]。一些研究也表明,相比于施用化肥或者谷物秸秆,施用高氮含量的豆科秸秆提高了微生物生物量和活性[36-37]。对于Shannon多样性指数来说,虽然苜蓿秸秆或氮肥配施处理高于玉米秸秆单施处理,但是玉米秸秆单施处理与配施玉米秸秆处理之间并没有显著性差异。Bending等[38]发现不同质量秸秆施入土壤后最终并没有导致土壤微生物功能多样性的不同,他们认为群落生理代谢在秸秆降解过程中有趋同现象。取样时间也可能影响Shannon多样性指数,本研究中测定Shannon多样性指数所采用的为培养结束时的土壤,此时施入的秸秆剩余的未分解部分多是难降解物质。对于Shannon均匀度指数来说,秸秆施入并没有影响微生物群落均匀度指数,包括对照在内各处理之间并没有显著性差异。施入秸秆提高了微生物群落Shannon多样性指数,但对均匀度却没有影响,可能与秸秆施入改变了群落结构多样性有关[37],而且不同处理改变了土壤微生物对不同碳源的利用率。这表明施入秸秆的处理可能改变了群落的组成,从而使得均匀度指数没有显著提高。
4 结论通过270 d的培养试验,我们发现苜蓿秸秆配施提高了碳矿化量,降低了施入有机碳的矿化率,提高了土壤有机碳含量。单施玉米秸秆导致了对土壤的氮素固持作用,苜蓿秸秆或者氮肥配施玉米秸秆在相同C/N(25:1)下施入土壤均缓解了对土壤氮素的固持作用,提高了土壤无机氮含量,并且以苜蓿秸秆配施处理最高,苜蓿秸秆配施相比于氮肥配施延长了氮素的可利用性。秸秆施入提高了微生物群落的生理代谢活性,但对微生物功能多样性指数影响不显著。
| [1] | 闫丽珍, 闵庆文, 成升魁. 中国农村生活能源利用与生物质能开发[J]. 资源科学, 2005, 27(1) : 8–13. YAN Li-zhen, MIN Qing-wen, CHENG Sheng-kui. Energy consumption and bio-energy development in rural areas of China[J]. Resource Science, 2005, 27(1) : 8–13. |
| [2] | 柏彦超, 陈国华, 路平, 等. 秸秆还田对稻田渗漏液DOC含量及土壤Cd活度的影响[J]. 农业环境科学学报, 2011, 30(12) : 2491–2495. BAI Yan-chao, CHEN Guo-hua, LU Ping, et al. Effect of wheat straw return in percolating water and Cd activity in rice soil[J]. Journal of Agro-Environment Sciences, 2011, 30(12) : 2491–2495. |
| [3] | 湛方栋, 陈建军, 秦丽, 等. 镉铅污染的玉米秸秆还田对蚕豆生长、养分和镉铅含量的影响[J]. 农业环境科学学报, 2016, 35(4) : 661–668. ZHAN Fang-dong, CHEN Jian-jun, QIN Li, et al. Effects of applying Cd/Pb contaminated maize stalks on growth and nutrient and Cd and Pb content of faba bean[J]. Journal of Agro-Environment Sciences, 2016, 35(4) : 661–668. |
| [4] | Jensen L S, Salo T, Palmason F, et al. Influence of biochemical quality on C and N mineralization from a broad variety of plant materials in soil[J]. Plant and Soil, 2005, 273(1/2) : 307–326. |
| [5] | Hadas A, Kautsky L, Goek M, et al. Rates of decomposition of plant residues and available nitrogen in soil, related to residue composition through simulation of carbon and nitrogen turnover[J]. Soil Biology and Biochemistry, 2004, 36(2) : 255–266. DOI:10.1016/j.soilbio.2003.09.012 |
| [6] | Fang M, Motavalli P P, Kremer R J, et al. Assessing changes in soil microbial communities and carbon mineralization in Bt and non-Bt corn residue-amended soils[J]. Applied Soil Ecology, 2007, 37(1/2) : 150–160. |
| [7] | Yanni S F, Whalen J K, Simpson M J, et al. Plant lignin and nitrogen contents control carbon dioxide production and nitrogen mineralization in soils incubated with Bt and non-Bt corn residues[J]. Soil Biology and Biochemistry, 2011, 43(1) : 63–69. DOI:10.1016/j.soilbio.2010.09.012 |
| [8] | Bhupinderpal-Singh, Rengel Z. The role of crop residues in improving soil fertility[M]. 2007: 183-214. |
| [9] | Schroth G, Teixeira W G, Seixas R, et al. Effect of five tree crops and a cover crop in multi-strata agroforestry at two fertilization levels on soil fertility and soil solution chemistry in central Amazonia[J]. Plant and Soil, 2000, 221(2) : 143–156. DOI:10.1023/A:1004743122678 |
| [10] | Thippayarugs S, Toomsan B, Vityakon P, et al. Interactions in decomposition and N mineralization between tropical legume residue components[J]. Agroforestry Systems, 2008, 72(2) : 137–148. DOI:10.1007/s10457-007-9062-9 |
| [11] | Jensen L S, Salo T, Palmason F, et al. Influence of biochemical quality on C and N mineralisation from a broad variety of plant materials in soil[J]. Plant and Soil, 2005, 273(1/2) : 307–326. |
| [12] | Schweitzer J A, Bailey J K, Hart S C, et al. Nonadditive effects of mixing cottonwood genotype on litter decomposition and nutrient dynamics[J]. Ecology, 2005, 86(10) : 2834–2840. DOI:10.1890/04-1955 |
| [13] | Schwendener C M, Lehmann J, Camargo P B D, et al. Nitrogen transfer between high-and low-quality leaves on a nutrient-poor Oxisol determined by 15N enrichment[J]. Soil Biology and Biochemistry, 2005, 37(4) : 787–794. DOI:10.1016/j.soilbio.2004.10.011 |
| [14] | Gartner T B, Cardon Z G. Decomposition dynamics in mixed-species leaf litter[J]. Oikos, 2004, 104(2) : 230–246. DOI:10.1111/oik.2004.104.issue-2 |
| [15] | Chapman S K, Newman G S. Biodiversity at the plant-soil interface:Microbial abundance and community structure respond to litter mixing[J]. Oecologia, 2010, 162(3) : 763–769. DOI:10.1007/s00442-009-1498-3 |
| [16] | Marschner P, Hatam Z, Cavagnaro T R. Soil respiration, microbial biomass and nutrient availability after the second amendment are influenced by legacy effects of prior residue addition[J]. Soil Biology and Biochemistry, 2015, 88 : 169–177. DOI:10.1016/j.soilbio.2015.05.023 |
| [17] | Goh K M, Kumar k. Nitrogen release from crop residues and organic amendments as affected by biochemical composition[J]. Communications in Soil Science and Plant Analysis, 2003, 34(17) : 2441–2460. |
| [18] | 丁雪丽, 何红波, 李小波, 等. 不同供氮水平对玉米秸秆降解初期碳素矿化及微生物量的影响[J]. 土壤通报, 2008, 39(4) : 784–788. DING Xue-li, HE Hong-bo, LI Xiao-bo, et al. Effect of nitrogen level on carbon mineralization and microbial biomass during initial decomposition of maize straw[J]. Chinese Journal of Soil Science, 2008, 39(4) : 784–788. |
| [19] | Abro S A, Tian X, Wang X, et al. Decomposition characteristics of maize (Zea mays L.) straw with different carbon to nitrogen (C/N) ratios under various moisture regimes[J]. African Journal of Biotechnology, 2011, 10(50) : 10149–10156. DOI:10.5897/AJB |
| [20] | 李东坡, 武志杰. 化学肥料的土壤生态环境效应[J]. 应用生态学报, 2008, 19(5) : 1158–1165. LI Dong-po, WU Zhi-jie. Impact of chemical fertilizers application on soil ecological environment[J]. Chinese Journal of Applied Ecology, 2008, 19(5) : 1158–1165. |
| [21] | Lebauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed[J]. Ecology, 2008, 89(2) : 371–379. DOI:10.1890/06-2057.1 |
| [22] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 156-161. LU Ru-kun. Soil and agricultural chemistry analysis[M]. Beijing: China Agriculture ScienTech Press, 2000: 156-161. |
| [23] | 陈兴丽, 周建斌, 刘建亮, 等. 不同施肥处理对玉米秸秆碳氮比及其矿化特性的影响[J]. 应用生态学报, 2009, 20(2) : 314–319. CHEN Xing-li, ZHOU Jian-bin, LIU Jian-liang, et al. Effects of fertilization on carbon/nitrogen ratio of maize straw and its mineralization in soil[J]. Chinese Journal of Applied Ecology, 2009, 20(2) : 314–319. |
| [24] | Hitzl W, Rangger A, Sharma S, et al. Separation power of the 95 substrates of the BIOLOG system determined in various soils[J]. FEMS Microbiology Ecology, 1997, 22(3) : 167–174. DOI:10.1111/j.1574-6941.1997.tb00368.x |
| [25] | Zak J C, Willig M R, Moorhead D L, et al. Functional diversity of microbial communities:A quantitative approach[J]. Soil Biology and Biochemistry, 1994, 26(9) : 1101–1108. DOI:10.1016/0038-0717(94)90131-7 |
| [26] | Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8) : 2351–2359. |
| [27] | Handa I T, Aerts R, Berendse F, et al. Consequences of biodiversity loss for litter decomposition across biomes[J]. Nature, 2014, 509(7499) : 218–221. DOI:10.1038/nature13247 |
| [28] | Schimel J P, Cates R G, Ruess R. The role of balsam poplar secondary chemicals in controlling soil nutrient dynamics through succession in the Alaskan taiga[J]. Biogeochemistry, 1998, 42(1) : 221–234. |
| [29] | Henriksen T M, Breland T A. Nitrogen availability effects on carbon mineralization, fungal and bacterial growth, and enzyme activities during decomposition of wheat straw in soil[J]. Soil Biology and Biochemistry, 1999, 31(8) : 1121–1134. DOI:10.1016/S0038-0717(99)00030-9 |
| [30] | Sakala W D, Cadisch G, Giller K E. Interactions between residues of maize and pigeonpea and mineral N fertilizers during decomposition and N mineralization[J]. Soil Biology and Biochemistry, 2000, 32(5) : 679–688. DOI:10.1016/S0038-0717(99)00204-7 |
| [31] | Majumder B, Kuzyakov Y. Effect of fertilization on decomposition of 14C labelled plant residues and their incorporation into soil aggregates[J]. Soil and Tillage Research, 2010, 109(2) : 94–102. DOI:10.1016/j.still.2010.05.003 |
| [32] | Chen L, Zhang J B, Zhao B Z, et al. Carbon mineralization and microbial attributes in straw-amended soils as affected by moisture levels[J]. Pedosphere, 2014, 24(2) : 167–177. DOI:10.1016/S1002-0160(14)60003-5 |
| [33] | Partey S T, Preziosi R F, Robson G D. Improving maize residue use in soil fertility restoration by mixing with residues of low C-to-N ratio:Effects on C and N mineralization and soil microbial biomass[J]. Journal of Soil Science and Plant Nutrition, 2014, 14(3) : 518–531. |
| [34] | Islam M R, Chauhan P S, Kim Y, et al. Community level functional diversity and enzyme activities in paddy soils under different long-term fertilizer management practices[J]. Biology and Fertility of Soils, 2011, 47(5) : 599–604. DOI:10.1007/s00374-010-0524-2 |
| [35] | Yang Q, Wang X, Shen Y, et al. Functional diversity of soil microbial communities in response to tillage and crop residue retention in an eroded Loess soil (Soil biology)[J]. Soil Science and Plant Nutrition, 2013, 59(3) : 311–321. DOI:10.1080/00380768.2013.775004 |
| [36] | Muhammad S, Muhammad T S. Comparative use of organic substrates and mineral fertilizers in growing maize (Zea mays L.) for maintaining soil fertility in rainfed area of Pakistan[J]. Pakistan Journal of Botany, 2007, 39(6) : 1953–1959. |
| [37] | Nair A, Ngouajio M. Soil microbial biomass, functional microbial diversity, and nematode community structure as affected by cover crops and compost in an organic vegetable production system[J]. Applied Soil Ecology, 2012, 58 : 45–55. DOI:10.1016/j.apsoil.2012.03.008 |
| [38] | Bending G D, Turner M K, Jones J E. Interaction between crop residue and soil organic matter quality and the functional diversity of soil microbial communities[J]. Soil Biology and Biochemistry, 2002, 34(8) : 1073–1082. DOI:10.1016/S0038-0717(02)00040-8 |
 2016, Vol. 35
2016, Vol. 35