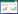文章信息
- 张慧慧, 李春荣, 王文科, 邓红章, 张徽, 韩枫
- ZHANG Hui-hui, LI Chun-rong, WANG Wen-ke, DENG Hong-zhang, ZHANG Hui, HAN Feng
- 高通量测序助力地质封存CO2泄漏情景下土壤细菌群落信息的挖掘
- Study on soil bacterial community under sealed CO2 leakage scenarios by high-throughput sequencing technology
- 农业环境科学学报, 2016, 35(12): 2440-2448
- Journal of Agro-Environment Science, 2016, 35(12): 2440-2448
- http://dx.doi.org/10.11654/jaes.2016-0835
文章历史
- 收稿日期: 2016-06-22
2. 中国地质调查局水文地质环境地质调查中心, 河北 保定 071051
2. Center for Hydrogeology and Environmental Geology Survey, China Geological Survey, Baoding 071051, China
自1950年以来,全球气候变暖已是毋庸置疑的事实,它将成为21世纪人类所要面临的一项巨大挑战,严重制约着人类社会和经济的可持续发展。在导致气候变化的自然因素和人为因素中,大量人为排放的温室气体如CO2、CH4和N2O等已引起各国的广泛关注,尤其是CO2作为最重要的人为温室气体,其排放量及对全球气候变暖的贡献远超过其他温室气体[1]。预计我国2015-2030年期间,CO2排放量的年均增长率为3.3%,2030年将排放CO2 114Gt[2]。在以此为背景的气候条件下,寻求新兴的、具有巨大规模碳减排潜力的技术已刻不容缓。目前,CO2捕集与储存(Carbon capture and storage,CCS)技术被认为是最有效的且最具有前景的CO2减排方法之一,并且各国在CO2地质储存技术方面的研究已经实现了工程化[3]。但是,从埋存的安全角度来考虑,该方法并不是一劳永逸的,仍存在泄漏的风险。渗漏的CO2可能会导致地下水污染,诱发地震等自然灾害,对植被、土壤等产生不同程度的负面影响,进而威胁到人类的生存和健康[4]。因此,研究地质储存CO2泄漏对生态环境的影响显得至关重要。目前国内有关CO2浓度升高对土壤环境及植物生长影响的报道较多,但关于CCS泄漏对土壤生态环境的影响却鲜见报道,尤其是关于高浓度CO2对土壤微生态环境的影响及其作用机制的研究尚未得到一致结论[5-6]。
近年来,分子生物学和高通量测序技术的飞速发展,为这一领域的研究提供了极大的便利。土壤宏基因组学尤为值得关注。它使得人类对环境微生物的研究已不再局限于传统的实验室培养,而是结合丰富的生物学技术和方法,揭示微生物与环境之间、微生物之间相互作用的规律,为从群落结构水平上深入解析微生物的结构和功能以及微生物对气候变化的响应和反馈研究提供了全新的视角[7]。
本文通过人工模拟封存CO2泄漏试验,探讨了玉米对封存CO2泄漏的耐受性并在确定作物阈值上限的前提下,采用高通量测序技术系统地分析了CO2泄漏条件下土壤细菌群落组成以及遗传多样性的变化,旨在为封存CO2泄漏的风险评估提供理论支持。
1 材料与方法 1.1 试验点概况试验在“旱区地下水文与生态效应教育部重点实验室”及“陕西省地下水与生态环境工程中心”进行。模拟试验供试土壤样品采自鄂尔多斯靖边境内未扰动黄土,土壤置室外堆放约数月。试验前测得土壤pH值为8.28,全氮0.240 g·kg-1,全磷0.505 g·kg-1,全钾18.60 g·kg-1,速效磷13.24 mg·kg-1,速效钾109.0 mg·kg-1,铵态氮0.73 mg·kg-1,硝态氮18.09 mg·kg-1。试验周期为2015年7月至2015年9月。
1.2 模拟试验平台设计 1.2.1 CO2控制释放装置试验采取桶栽植株底部通CO2的处理方式,工艺流程如图 1。每个试验桶直径60 cm,高70 cm,距桶底5 cm设进气连接阀,距桶底10 cm处内埋设气体分布盘支架并平置多孔性气体分布盘,分布盘管上铺垫双层80目的树脂网。称取50 kg供试土壤分别装入各个试验桶、压实,使得土壤厚度均为50 cm,在距土层表面30 cm处埋设土壤气相CO2浓度监测探头,监测耕作层土壤中CO2浓度。充分喷淋润湿土层,使土壤含水率处于9%~11%,放置48 h,下种。玉米幼苗生长10 d后,人工控制CO2气体以不同速率和通量由试验桶底向土壤中释放。

|
| 图 1 人工模拟CO2释放流程图 Figure 1 Flow chart of manual simulation for CO2 leakage ①二氧化碳气罐;②气体流量计;③进气导管;④多孔性气体分布盘;⑤土室;⑥植株玉米 |
为了系统考查高浓度CO2入侵条件下,玉米对封存CO2泄漏的耐受性并确定作物的阈值上限,把CO2入侵浓度作为衡量其泄漏程度的重要指标[8]。结合国内外相关研究成果[9-10],尽量将玉米对泄漏CO2的耐受阈值包含在内的原则,四个试验区之间的CO2浓度施加梯度设置得较宽,即:对照Y0(不通CO2)、Y1 50×104 μL·L-1、Y2 70×104 μL·L-1、Y3 100×104 μL·L-1。运行过程中,3个泄漏处理利用二氧化碳气罐作为供气源,连接气体流量计控制流量,各试验桶均自处理之日起至试验结束整个过程中不间断通入CO2。通过调节球阀气压大小和各试验桶流量计的注入速率使植株下部到达的CO2气体浓度尽量保持在设定范围内。试验中,利用便携式CO2测定仪监测土壤30 cm埋深处CO2浓度,发现各组泄漏情景实测CO2浓度近似,依次为:0.05×104 μL·L-1(对照Y0)、30×104 μL·L-1(Y1)、40×104 μL·L-1(Y2)、92×104 μL·L-1(Y3)。
1.3 测定指标及分析方法 1.3.1 植物生长形态及生理指标测定采用常规方法测量玉米株高、叶片数与根长。在玉米生长不同时段开展4次株高和叶片数测定,选择每个试验桶长势较均匀的20株进行测量,取其平均值作为该处理下玉米的株高和叶片数。待试验结束时,按相同方法测定玉米根长。对玉米的叶绿素、可溶性蛋白含量以及过氧化物酶活性等主要生理生化指标按照文献方法[11]进行监测分析。
1.3.2 土壤细菌群落的分子生物学分析(1)土壤样品细菌DNA的制备
按照土壤基因组快速抽提试剂盒(生工SK8233)提取基因组。离心收集菌体,溶于5 mL提取缓冲液(100 mmol·L-1 Tris·Cl,100 mmol·L-1 EDTA-Na2,200 mmol·L-1 NaCl,2% CTAB,pH 8.0)中,37 ℃振荡45 min;加入0.75 mL 20%SDS,65 ℃水浴1 h;12 000 r·min-1、10 min离心,收集上清液。上清液用等体积的酚:氯仿:异戊醇(25:24:1)抽提2次,加入终浓度0.3 mol·L-1的NaAC(pH5.2)及2倍体积的无水乙醇,室温沉淀1 h;4 ℃下12 000 r·min-1离心20 min,收集沉淀,并用70%乙醇漂洗2次,晾干后溶于50 μL TE缓冲液中。DNA的纯化采用纯化试剂盒GeneClean Turbo Kit(Qbiogene公司),纯化后保存于-20 ℃。
(2)16S rRNA基因序列V3可变区的PCR扩增
选用引物F357-GC(5′-CCTACGGGAGGCAGCAG -3′)和R518(5′-ATT ACC GCG GCT GCT GG -3′)进行PCR扩增。反应体系总体积为20 μL:5×FastPfu Buffer 4 μL,dNTPs(2.5 mmol·L-1)1 μL,F357-GC(5 μmol·L-1)0.8 μL,R518(5 μmol·L-1)0.8 μL,FastPfu聚合酶(5 U/μL)0.4 μL,模板DNA 0.5 μL,最后补加ddH2O至20 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火1 min,72 ℃延伸30 s,共30个循环;最后72 ℃终延伸10 min结束。通过PCR聚合酶链式反应得到不同土壤样品细菌的PCR产物后,取PCR产物各3 μL,用1.5%琼脂糖凝胶(加5%Goldview染液),于1×TAE缓冲液中,120 V稳压条件下电泳30 min,通过UVI凝胶成像系统进行分析,针对目标条带进行割胶回收,获得纯化的PCR产物,进行高通量测序和分析。
(3)基于高通量测序的细菌群落分析
操作分类单元(Operational taxonomic units,OTUs):试验采用Miseq双端测序,获得最终用于分析的16S rRNA序列。在此基础上,应用软件QIIME(Quantitative insights into microbial ecology)统计各个土壤样本含有OTUs情况。其中,每个OTU对应于一个不同的16S rRNA序列,即每个OTU对应于一个不同的细菌种。选取序列相似度在97%条件下的OUT生成Venn图,研究样品OTUs之间的相关性[12]。
样品间Alpha多样性分析:通过Mothur软件,对多样性指数Simpson和Shannon指数、丰富度指数Chao1和均匀度指数ACE以及覆盖度指数(Good′s coverage)等指标进行Alpha多样性分析,用以比较各试验区样品的细菌多样性和丰度变化特征。
样品间Beta多样性分析:利用Unifrac metric对样品进行Beta多样性分析,主要包括样本距离计算、样本聚类、样本PCA分析,用来衡量样本间物种组成的相似度。Unifrac metric是通过计算不同环境样本间Unique branch长度总和获得。Unifrac metric值在0~1之间,值越小说明样本间相似度越高。最后根据分类学分析结果,绘制菌群分布条形图,直观地观测样品在不同分类水平的菌群相对丰度变化,并观察样本与样本之间的菌群结构。
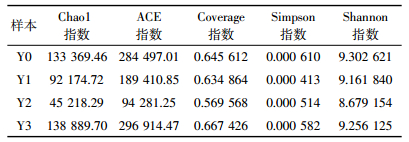
2 结果与分析 2.1 高浓度CO2入侵对玉米生理系统及代谢功能的影响 2.1.1 玉米株高、叶片数及根长对CO2胁迫的响应玉米播种幼苗生长10 d后,对照区Y0、泄漏区Y1、Y2、Y3玉米长势较为均一,自7月24日开始通入CO2气体,在玉米生长不同时期监测其主要生长性状指标。观察发现,92×104 μL·L-1 CO2处理下玉米在通气15 d后开始出现叶片发黄、卷曲等现象,第20 d大面积萎缩、倒伏接近死亡。通过对生长时段玉米株高、叶片数以及植株死亡阈值条件下的根长进行统计,结果见图 2。可以看出,随着CO2泄漏量的增大,玉米平均株高有降低的趋势;叶片数在泄漏初期随浓度变化规律不是非常明显,但当施加浓度足够长时发现各泄漏情景下玉米的叶片数均低于对照;当土壤CO2浓度达40×104 μL·L-1时根系明显变短,根系生长受到负面影响,表明高浓度CO2入侵,玉米株高对CO2泄漏浓度反应敏感;92×104 μL·L-1的泄漏浓度已达到玉米濒临死亡的阈值上限,且泄漏通量越大,生长受抑制程度越明显。原因可能是土壤CO2浓度升高,改变了土壤原有生态环境,使得植物生长所需的营养供给不足,导致植株长势矮小、叶片增长减缓,最终可能会造成粮食作物大幅减产[13]。
|
| 图 2 不同浓度CO2对玉米株高、叶片数以及根长的影响 Figure 2 Height, leaf number, and root length of maize under different CO2 concentrations |
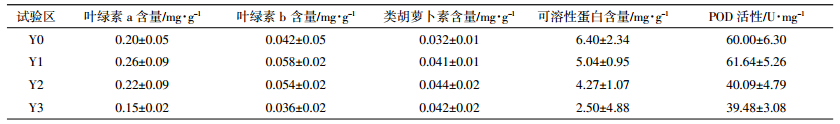
叶绿素在植物光合作用中起着重要的传递作用,玉米叶片中叶绿素含量的高低是表征其光合能力的关键指标[14]。在玉米的耐受阈值浓度下监测植物的各项生理生化指标见表 1。可以看出,高浓度CO2胁迫下,玉米叶片叶绿色含量整体都很低,而叶片中类胡萝卜素含量略有增加后保持稳定。这表明高浓度CO2胁迫对玉米整个生长期叶片叶绿素的合成具有抑制作用。
|
植物体内的可溶性蛋白质含量是一个重要的生理生化指标,是植物体内氮素存在的主要形式,其含量的多少与植物体代谢和衰老有密切的关系,不仅反映植株氮素代谢水平,而且常被作为衡量叶片衰老程度的重要指标[15]。表 1显示,对照区玉米叶片中可溶性蛋白含量最高,Y1、Y2、Y3试验区的可溶性蛋白含量较对照情景依次降低了21.25%、33.28%、60.94%。可见,高浓度CO2入侵土壤会导致植物氮代谢功能减弱,植株衰老加快。
过氧化物酶(POD)被称为保护植物细胞免受自由基伤害的第三道防线,在清除超氧自由基、H2O2和过氧化物以及阻止或减少羟基自由基形成等方面发挥重要作用[16]。植物在正常的情况下,体内自由基维持在浓度很低的水平[17],但当植物遭受某种环境胁迫时体内自由基就会增多。一般情况下,POD活性随植物受逆境胁迫程度的增强而呈现先增大后减小的趋势[18]。表 1数据揭示当土壤CO2超过40×104 μL·L-1时,POD酶活性开始大幅下降,此时玉米细胞清除过氧化物的能力降低,植物的呼吸代谢功能受到抑制,衰老速度加快。
2.2 高通量测序下土壤样品细菌群落相关性分析以各样品中分布的OTUs数为计算依据,构建韦恩图(图 3)。依据图 3中的数据可以看出,4种不同泄漏情景下玉米试验区土壤中总OTUs为70 948个,其中有83.60%分布于个别样本中;13.08%同时分布于两种或两种以上泄漏土壤中;仅3.32%为4种泄漏情景下土壤所共有,共有OTUs数目为2355个,表明不同浓度CO2胁迫对这2355个OTUs所代表的微生物种群影响不大。经统计还发现,随着CO2泄漏浓度的升高,每种泄漏情景下土壤总OUTs相比于对照主要表现为降低趋势,依次降了27.11%、62.69%、3.11%;高、中、低浓度即Y3、Y2、Y1土壤样品与对照样品Y0中各相关OTUs分别为6831、3684、5963个,分别占两两相关OTUs的22.93%、12.36%和20.01%。可见,随着CO2泄漏浓度的增高,Y3(土壤CO2浓度92×104 μL·L-1)土壤样品与对照样品中微生物群落相关性更高,Y2(土壤CO2浓度40×104 μL·L-1)最低,其原因可能与高浓度CO2胁迫下玉米生长代谢调节物的产生在植物体内受到抑制的同时,根系分泌物、根系生物量、细根周转、地下碳分配量[19]可能降低等因素有关;根系分泌物的降低势必会导致根际土壤细菌C、N源在数量和结构方面的平衡被打破[20],从而可能会导致细菌群落分布发生相应改变。
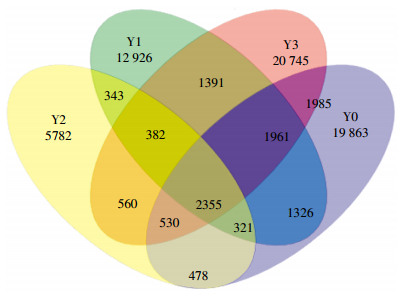
|
| 图 3 各试验区土壤样品共有和特有OUTs分析 Figure 3 Analysis of soil samples′ shared and unique OTUs in each test area |
利用Alpha多样性分析试验区土壤细菌群落的丰富度和多样性。各土壤样本的丰富度指数Chao1、均匀度指数ACE、覆盖度指数(Good′s coverage)和多样性指数Simpson/Shannon如表 2所示。可见,不同泄漏情景下土壤的物种丰富度和均匀度变化规律是一致的。对照区Y0土壤样本中细菌丰富度指数Chao1数值和均匀度指数ACE数值远远比Y1和Y2两个泄漏区大,进一步提升CO2浓度使之达作物致死的阈值浓度(Y3区,CO2浓度92×104 μL·L-1)时,细菌丰富度指数和ACE指数与对照相比非但没有降低反而略有增加。这一结果表明,土壤微生物是土壤中敏感而又活跃的部分,玉米在生长过程中,30×104~40×104 μL·L-1通量的CO2处理可能抑制了土壤细菌中某些菌类的发育,使得土壤细菌丰富度大幅降低,细菌种类减少甚至消亡;同时ACE指数结果也表明30×104~40×104 μL·L-1的CO2泄漏情景下土壤细菌群落中某些细菌种群发育较好,在群落中的优势度上升。土壤细菌种群优势度的变化可能与土壤细菌群落丰富度的变化有关,这就意味着30×104~40×104 μL·L-1通量的CO2泄漏不仅会影响土壤细菌丰富度,而且还有可能为某些菌类提供良好的生长与繁殖环境,使得某些菌类成为优势菌种。阈值条件(92×104 μL·L-1通量的CO2泄漏)下土壤的物种丰富度和均匀度表现出略微增大的趋势,其原因可能是土壤的环境较为复杂,CO2作为胁迫因子,使得部分细菌被活化,抗逆性增强,通过其种群结构、组成和代谢功能的变化对土壤环境的高CO2浓度做出积极响应,并通过生理性调控和遗传变异来适应不断变化的环境[21-22]。
Simpson和Shannon指数表明,玉米生长过程中对照区土壤细菌群落多样性最大,其他泄漏区土壤细菌群落多样性指数相比于对照分别降低32.30%、15.74、4.59%(Simpson指数法)。
2.4 高浓度CO2入侵对土壤样本物种组成的影响Heatmap可以用颜色变化来反映菌群的丰度信息,可以直观地将菌群丰度值用定义的颜色深浅来表示。同时将样品以及菌群信息进行聚类并重新排布,将聚类之后的结果显示在Heatmap中。因此,可以很好地反映各分类水平上菌群组成的异同。为进一步探讨不同CO2泄漏情景下土壤样本与样本之间的距离关系,也就是表明样本与样本之间的相似程度,对土壤样本进行Beta多样性分析,并采用样本间Unifrac距离矩阵绘制距离热图,颜色块代表Unifrac metric值,颜色越红表示样本间距离越近,相似度越高,颜色越蓝则距离越远。图 4a显示,各泄漏区样本与对照区的相似度存在明显差异,其中Y3与对照相似度最大,Y1次之,Y2最低。结合样品相似性聚类分析结果(图 4b)可见,试验区Y2的分类位置较远于其他区,对照Y0介于泄漏区Y1、Y3与Y2之间,且Y1与Y3聚类位置异常接近。随着CO2浓度增加,各泄漏区土壤细菌群落与对照区细菌群落相似性系数分别为16.90%、0%、16.90%,表明高浓度CO2对土壤样本物种组成及土壤细菌群落结构产生一定影响。
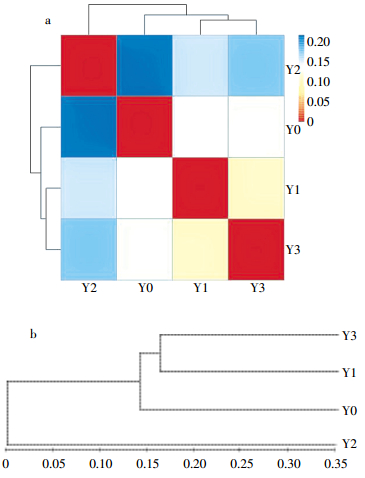
|
| 图 4 样本距离热图(a)及细菌群落结构相似性聚类分析(b) Figure 4 Heat map of sample distance (a) and cluster analysis of soil bacterial community structure similarity (b) |
对细菌群落组成的变化进行PCA分析(图 5),结果显示:主成分1(PC1)和主成分2(PC2)分别在样品差异性贡献率上达到66.50%和19.80%,合计达到86.30%,是差异的主要来源。样品Y1和Y3均位于PC2的负值区域,分别位于PC1坐标轴正负两侧,位置较为靠近,说明两样品间的主成分变化不显著;而样品Y0与样品Y2均位于PC2坐标轴正值区域,但分处于PC1的正负值间隔较远的位置,同时与样品Y1、Y3分布较远,进一步说明不同试验区土壤的CO2浓度对土壤样品的影响情况。这表明,不同浓度CO2胁迫下土壤细菌群落在分布上存在较大差异。

|
| 图 5 不同CO2泄漏情景下土壤细菌群落主成分分析 Figure 5 PCA results of soil bacterial communities under different CO2 leakage scenarios |
在门水平上对土壤样本主要菌群的相对丰度进行分析,结果如图 6所示。可以看出,土壤样本细菌类型较为丰富,主要包含有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿屈挠菌门(Chloroflexies)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、硬壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、蓝菌门(Cyanobacteria)、硝化螺旋菌门(Nitrospira)、未分类菌群、TM7、奇异球菌-栖热菌门(Deinococcus-Thermus)等菌群。其中,变形菌门、拟杆菌门、绿屈挠菌门、酸杆菌门、放线菌门为最主要菌群,在土壤细菌中相对丰度较高。不同浓度CO2胁迫下土壤样品中变形杆菌门、拟杆菌门相对丰度出现先下降后提高的趋势;绿屈挠菌门、酸杆菌门和放线菌门相对丰度变化规律相反,呈现出先显著上升后下降趋势,尤其是在中浓度土样(土壤CO2浓度为40×104 μL·L-1)中,上述比例分布变化特别明显;土壤浮霉菌门、硬壁菌门、疣微菌门相对丰度则无明显变化。
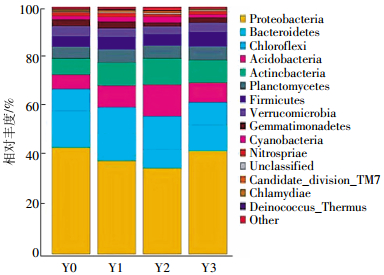
|
| 图 6 门(phylum)水平上各土壤样本菌群分布图 Figure 6 Relative abundance of phylum in microbial communities from samples |
由于CO2是酸性气体,泄漏的CO2一旦溶解于土壤水中与基质中,会使得土壤介质环境发生改变[23]。自养菌是利用空气中的CO2或碳酸盐作为合成细胞中有机物的唯一碳源。因此,CO2浓度升高可能有利于某些自养菌的生长,从而使其微生物相对丰度增加。与此同时,CO2浓度升高会驱替土壤中的空气,导致土壤气相O2分压降低,对一些好氧微生物生长产生抑制,甚至使其消亡,从而引起微生物丰度降低。如40×104 μL·L-1泄漏情景下土壤变形菌门和拟杆菌门细菌相对丰度降至最低,而92×104 μL·L-1情景下又有回升,可能是由于α变形菌中好氧细菌减少,部分自养菌增加引起的,具体的原因还有待进一步研究。另外,土壤酸杆菌和放线菌门相对丰度的增加可能与封存CO2持续泄漏导致土壤酸碱性及其他理化性质和营养成分发生变化有关[5]。土壤的酸化对嗜酸菌属的生长繁殖有刺激作用,对某些适宜在中性或偏碱性环境中生长的细菌属有抑制作用,细菌一般在土壤pH值为6.5~7.5时表现出高的活性,放线菌最适的土壤pH值为7.5~8.0,嗜碱菌必须在土壤pH值高于8的环境中生存。拟杆菌门和酸杆菌门细菌相对丰度分别在土壤CO2浓度达40×104 μL·L-1时的显著下降和上升,有望作为地质封存CO2泄漏对农田土壤生态系统影响的生物监测指标。
3 讨论本文主要通过人工模拟封存CO2泄漏桶栽植株试验,采用耐酸能力强的玉米对不同泄漏情景的阈值响应实现对地质封存CO2泄漏的影响评估,在此基础上,通过第二代高通量测序技术探讨CCS泄漏对土壤微生物群落的影响。试验发现,地质封存CO2泄漏对近地表作物的影响可通过株高、叶片数、地下部根长等植物生理形态和光合作用、代谢功能等生化指标因素的改变初步被识别。在CO2泄漏量较小的条件下(CO2浓度为30×104 μL·L-1),玉米对环境胁迫具有较好的适应能力,作物长势较好,各项指标均受到促进;当CO2泄漏量达40×104 μL·L-1以上,玉米作物的生长发育开始受到抑制;92×104 μL·L-1 CO2为植物生长耐受性的极限值(阈值上限),此泄漏情景下玉米出现光合作用下降、植株早衰、枯萎、死亡等状况。这一结论与Pfanz等[24]、刘义玲等[25-26]、郭超等[27]研究发现的作物根际CO2达到一定浓度后会抑制作物的生长,对作物株高、茎粗、生物量(地上部/地下部)、茎块产量和果实发育产生负面影响的研究结论一致;也与Patil等[28]、Kruger等[29]得出的地下控制释放CO2试验引起植物叶绿素含量和生物量下降,植被颜色呈现不健康迹象,作物死亡数上升等研究成果相一致。导致该变化的原因可能是泄漏的高浓度CO2入侵土壤,使得土壤中CO2浓度不断上升并很快达到最大值[30]。土壤中大量CO2的存在置换了土壤O2,导致O2分压不断降低,形成O2匮乏的土壤环境,进一步使得土壤原有氧化还原反应条件发生改变,这种土壤环境的长期作用致使土壤中氧化矿物减少,还原矿物增加,同时还原性气体通量有增加趋势[31]。再则,高浓度CO2作为胁迫因子,促使植物体内产生特定的抗性物质以抵抗外界环境变化所带来的影响,而这些抗性物质会消耗土壤部分氮,从而导致土壤C、N源结构平衡被打破。而所有条件的变化最终对地表农作物的光合作用以及生长代谢等功能造成不利影响,同时也会间接作用于土壤细菌群落的活性和种群数量,影响到土壤固碳、固氮能力。
关于土壤微生物群落和物种遗传多样性信息的研究结果显示,土壤主要菌群的变化不仅与作物生长发育密切相关,同时也与土壤环境中CO2泄漏的强度有关,特别是土壤酸杆菌门细菌在土壤CO2泄漏浓度达40×104 μL·L-1时相对丰度达到最大值得思考。酸杆菌属于嗜酸菌,在发生CO2泄漏的土壤中大量出现可能与土壤pH降低密切相关[5, 32]。酸化的土壤为酸杆菌提供了适宜的生存环境,促使酸杆菌大量繁殖,但是进一步提升浓度达阈值CO2浓度(92×104 μL·L-1),酸杆菌相对丰度非但没有继续下降反而有所增加。这一结果与土壤细菌群落结构和菌群间亲缘关系方面的分析结果相一致,可能的原因是微生物生物量本身就存在高度的变异性(变异系数为193%[34]),阈值浓度处理下,土壤CO2可能使得部分细菌的遗传物质发生改变,通过生理性调控和遗传变异来适应不断变化的环境,即有可能影响到微生物的活性而不改变其丰度,或改变了丰度而没有影响到种群结构,或增强了群落功能而破坏了它的遗传,这些都会影响到对实验结果的判断,还有待进一步分析和论证。
同时也有研究指出根瘤菌、氨化细菌、褐色固氮菌和硝化细菌等菌群在酸性土壤中难以存活[34]。可见土壤高CO2浓度引起菌群组成发生改变的同时,会对土壤功能带来巨大影响,使得粮食作物明显减产。虽然现有研究已初步模拟了地质封存CO2泄漏的各种情景,并且对CO2泄漏所可能会造成的一系列农业生态和环境影响指标进行了试验分析,结果亦证实影响非常显著,但是对其响应机理仍有待进一步深入研究。
4 结论(1)根际土层下部发生40×104 μL·L-1以上的封存CO2泄漏,会对玉米的生长发育产生不利影响,可能导致植株矮小,叶片卷曲、枯黄、生长迟缓,光合作用受到极大阻碍,玉米细胞清除过氧化物能力降低,植物的呼吸代谢功能受到抑制,衰老加快,并且随着泄漏浓度增大,影响程度越严重。
(2)高浓度CO2入侵对土壤微生物群落多样性影响较大,主要表现为原有细菌丰度和多样性的增加或被削弱。
(3)土壤细菌群落中的优势菌群有变形菌门、拟杆菌门和酸杆菌门等,其中土壤酸杆菌门在土壤CO2浓度达40×104 μL·L-1时相对丰度的大幅增加可能用作地质封存CO2泄漏对土壤生态系统响应的指示菌。
| [1] | 聂莉娟, 马俊杰, 赵雪峰, 等. 模拟CCS技术CO2泄漏对C3、C4作物土壤化学性质的影响[J]. 水土保持学报, 2015, 29(5) : 200–205. NIE Li-juan, MA Jun-jie, ZHAO Xue-feng, et al. Effects of simulation CO2 leakage of CCS on soil chemical properties under C3 and C4 crops[J]. Journal of Soil and Water Conservation, 2015, 29(5) : 200–205. |
| [2] | I EA. World energy outlook 2010[J]. International Energy Agency, 2010, 4(3) : 60–62. |
| [3] | Diamante J A R, Tan R R, Foo D C Y, et al. Unified pinch approach for targeting of carbon capture and storage (CCS) systems with multiple time periods and regions[J]. Journal of Cleaner Production, 2014, 71(4) : 67–74. |
| [4] | 吴江莉, 马俊杰. 浅议CO2地质封存的潜在风险[J]. 环境科学导刊, 2012, 31(6) : 89–93. WU Jiang-li, MA Jun-jie. A Discussion about potential risks of geological storage of CO2[J]. Environmental Science Survey, 2012, 31(6) : 89–93. |
| [5] | 田地, 马欣, 李玉娥, 等. 利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J]. 环境科学, 2013, 34(10) : 4096–4104. TIAN Di, MA Xin, LI Yu-e, et al. Research on soil bacteria under the impact of sealed CO2 leakage by high-through put sequencing technology[J]. Environmental Science, 2013, 34(10) : 4096–4104. |
| [6] | 田地.地质封存CO2泄漏对农田作物及其土壤环境的影响研究[D].安徽师范大学, 2013. TIAN Di. Research on the effect of captured CO2 leakageon crops, grass and soil environment[D]. Anhui Normal University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10370-1014103984.htm |
| [7] | Zengler K, Palsson B O. A road map for the development of community systems (CoSy) biology[J]. Nature Reviews Microbiology, 2012, 13(10) : 366–372. |
| [8] | Al-Traboulsi M, Sjögersten S, Class J, et al. Potential impact of CO2 leakage from carbon capture and storage (CCS) systems on growth and yield in spring field bean[J]. Environmental and Experimental Botany, 2012, 80(1) : 43–53. |
| [9] | 伍洋, 马欣, 李玉娥, 等. 地质封存CO2泄漏对农田生态系统的影响评估及耐受阈值[J]. 农业工程学报, 2012, 28(2) : 196–205. WU Yang, MA Xin, LI Yu-e, et al. Impact assessment and tolerable threshold value of CO2 leakage from geological storage on agro-ecosystem[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(2) : 196–205. |
| [10] | West J M, Pearce J M, Coombs P, et al. The impact of controlled injection of CO2 on the soil ecosystem and chemistry of an English lowland pasture[J]. Energy Procedia, 2009, 1(1) : 1863–1870. DOI:10.1016/j.egypro.2009.01.243 |
| [11] | 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 134-182. LI He-sheng. The experiment principle and technology of plant physiology[M]. Beijing: Higher Education Press, 2000: 134-182. |
| [12] | 张志东, 顾美英, 王玮, 等. 基于高通量测序的辐射污染区细菌群落特征分析[J]. 微生物学报, 2016, 43(6) : 1218–1226. ZHANG Zhi-dong, GU Mei-ying, WANG Wei, et al. Analysis of bacterial community in radiation polluted soils by high-through put sequencing[J]. Microbiology China, 2016, 43(6) : 1218–1226. |
| [13] | 王蓉.地质储存二氧化碳泄漏对地表典型植物的影响[D].西安:长安大学, 2015. WANG Rong. The impacts of leakaged carbon dioxide from underground on surface typical vegetations[D]. Xi'an:Chang'an University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10710-1015802399.htm |
| [14] | 王品, 李雪, 冯静. 二氧化碳地质储存泄漏对玉米生理特性的影响[J]. 科技创业月刊, 2015, 14 : 108–110. WANG Pin, LI Xue, FENG Jing. Effects of geological storage of carbon dioxide leakage on physiological characteristics of maize[J]. Pioneering with Science and Technology Monthly, 2015, 14 : 108–110. |
| [15] | 周婵, 邹志远, 杨允菲. 盐碱胁迫对羊草可溶性蛋白质含量的影响[J]. 东北师大学报:自然科学版, 2009, 42(3) : 94–96. ZHOU Chan, ZOU Zhi-yuan, YANG Yun-fei. Effect of salt-alkali stress on soluble protein of Leymus chinensis[J]. Journal of Northeast Normal University (Natural Science Edition), 2009, 42(3) : 94–96. |
| [16] | 田晓艳, 刘延吉, 张蕾, 等. 盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J]. 草原与草坪, 2009(6) : 11–14. TIAN Xiao-Yan, LIU Yan-Ji, ZHANG Lei, et al. Effects of salt stress on MDA, protective enzyme system, proline and soluble sugar of Sedum aizoon seedling[J]. Grassland and Turf, 2009(6) : 11–14. |
| [17] | 彭艳, 李洋, 杨广笑, 等. 铝胁迫对不同小麦SOD、CAT、POD活性和MDA含量的影响[J]. 生物技术, 2006, 16(3) : 38–42. PENG Yan, LI Yang, YANG Guang-xiao, et al. Effects of aluminum stress on the activities of SOD, POD, CAT and the contents of MDA in the seeding of different wheat cultivars[J]. Biotechnology, 2006, 16(3) : 38–42. |
| [18] | 孙静, 王宪泽. 盐胁迫对小麦过氧化物酶同工酶基因表达的影响[J]. 麦类作物学报, 2006, 26(1) : 42–44. SUN Jing, WANG Xian-ze. Effects of salt stress on gene expression of peroxidase isozyme in wheat[J]. Journal of Triticeae Crops, 2006, 26(1) : 42–44. |
| [19] | 贾夏, 韩士杰, 周玉梅, 等. 不同二氧化碳浓度条件下红松和长白赤松幼苗根际土壤微生物数量研究[J]. 应用生态学报, 2005, 16(7) : 1295–1298. JIA Xia, HAN Shi-jie, ZHOU Yu-mei, et al. Effects of elevated CO2 concentration on rhizosphere soil microbes under Pinus koraiensis and Pinus sylvestriformis seedlings[J]. Chinese Journal of Applied Ecology, 2005, 16(7) : 1295–1298. |
| [20] | Natasa-Sibanc, Alex J D, Ines Mandic-Mulec, et al. Impacts of naturally elevated soil CO2 concentrations on communities of soil archaea and bacteria[J]. Soil Biology and Biochemistry, 2014, 68 : 348–356. DOI:10.1016/j.soilbio.2013.10.018 |
| [21] | 张慧慧, 李春荣, 邓红章, 等. 二氧化碳入侵土壤包气带对微生物群落的影响[J]. 安全与环境学报, 2016, 16(2) : 377–381. ZHANG Hui-hui, LI Chun-rong, DENG Hong-zhang, et al. Effect of carbon dioxide permeation into soil's unsaturated layer on the microbial community[J]. Journal of Safety and Environment, 2016, 16(2) : 377–381. |
| [22] | 刘慧杰, 杨彩云, 田蕴, 等. 基于PCR-DGGE技术的红树林区微生物群落结构[J]. 微生物学报, 2010, 50(7) : 923–930. LIU Hui-jie, YANG Cai-yun, TIAN Yun. Analysis of microbial community structure in mangrove sediments by PCR-DGGE technique[J]. Acta Microbiologica Sinica, 2010, 50(7) : 923–930. |
| [23] | 程凯.储层二氧化碳泄露对浅部含水层水质的影响研究[D].长春:吉林大学, 2013. CHENG Kai. Reservoir study on the effect of carbon dioxide leak on the shallow aquifer water quality[D]. Changchun:Jilin University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013194393.htm |
| [24] | Pfanz H, Vodnik D, Wittmann C, et al. Photosynthetic performance (CO2-compensation point, carboxylation efficiency, and net photosynthesis) of timothy grass is affected by elevated carbon dioxide in post-volcanic mofette areas[J]. Environmental and Experimental Botany, 2007, 61(1) : 41–48. DOI:10.1016/j.envexpbot.2007.02.008 |
| [25] | 刘义玲, 李天来, 孙周平, 等. 根际CO2浓度对网纹甜瓜生长和根系氮代谢的影响[J]. 中国农业科学, 2010, 43(11) : 2315–2324. LIU Yi-ling, LI Tian-lai, SUN Zhou-ping, et al. Effects of rhizosphere CO2 concentration on plant growth and root nitrogen metabolism of muskmelon[J]. Scientia Agricultura Sinica, 2010, 43(11) : 2315–2324. |
| [26] | 刘义玲, 李天来, 孙周平, 等. 根际低氧胁迫对网纹甜瓜光合作用、产量和品质的影响[J]. 园艺学报, 2009, 36(10) : 1465–1472. LIU Yi-ling, LI Tian-lai, SUN Zhou-ping, et al. Effects of root-zone hypoxia stress on the photosynthesis, yield and quality of muskmelon[J]. Acta Horticulturae Sinica, 2009, 36(10) : 1465–1472. |
| [27] | 郭超, 牛全文. 根际通气对盆栽玉米生长与根系活力的影响[J]. 中国生态农业学报, 2010, 18(6) : 1194–1198. GUO Chao, NIU Quan-wen. Effects of rhizosphere ventilation on growth and root activity of potted maize[J]. Chinese Journal of Eco-Agriculture, 2010, 18(6) : 1194–1198. DOI:10.3724/SP.J.1011.2010.01194 |
| [28] | Patil R H, Colls J J, Steven M D. Effects of CO2 gas as leaks from geological storage sites on agro-ecosystems[J]. Energy, 2010, 35(12) : 1–5. |
| [29] | Kruger M, Jones D, Frerichs J, et al. Ecosystem effects of elevated CO2 concentrations on microbial populations at a terrestrial CO2 vent at Laacher See, Germany[J]. International Journal of Greenhouse Gas Control, 2011, 5(4) : 1093–1098. DOI:10.1016/j.ijggc.2011.05.002 |
| [30] | Amonette J E, Barr J L, Dobeck L M, et al. Spatiotemporal changes in CO2 emissions during the second ZERT injection, August-September 2008[J]. Environmental Earth Sciences, 2010, 60(2) : 263–272. DOI:10.1007/s12665-009-0402-0 |
| [31] | 田地, 马欣, 查良松, 等. 地质封存CO2泄漏对近地表陆地生态系统的影响综述[J]. 生态与农村环境学报, 2013, 29(2) : 137–145. TIAN Di, MA Xin, ZHA Liang-song, et al. Review of impact of CO2 leakage from geologic storage on near-surface terrestrial ecological system[J]. Journal of Ecology and Rural Environment, 2013, 29(2) : 137–145. |
| [32] | 王春香, 田宝玉, 吕睿瑞, 等. 西双版纳地区热带雨林土壤酸杆菌(Acidobacteria)群体结构和多样性分析[J]. 微生物学通报, 2010, 37(1) : 24–29. WANG Chun-xiang, TIAN Bao-yu, LÜRui-rui, et al. Distribution and diversity of acidobacteria in tropical rain forest soil of Xishuangbanna[J]. Microbiology China, 2010, 37(1) : 24–29. |
| [33] | 罗艳. 土壤微生物对大气CO2浓度升高的响应[J]. 生态环境, 2003, 12(3) : 357–360. LUO Yan. Response of soil microorganism to elevated atmospheric CO2 concentration[J]. Ecology and Environment, 2003, 12(3) : 357–360. |
| [34] | 孙儒泳, 李博, 诸葛阳, 等. 普通生态学[M]. 北京: 高等教育出版社, 1993: 48-50. SUN Ru-yong, LI Bo, ZHUGE Yang, et al. General ecology[M]. Beijing: Higher Education Press, 1993: 48-50. |
 2016, Vol. 35
2016, Vol. 35