文章信息
- 张喜庆, 勾长龙, 娄玉杰, 徐佳萍, 高云航
- ZHANG Xi-qing, GOU Chang-long, LOU Yu-jie, XU Jia-ping, GAO Yun-hang
- 高效纤维素分解菌的分离鉴定及堆肥效果研究
- Isolation and identification of a cellulolytic bacterium and its composting application
- 农业环境科学学报, 2016, 35(2): 380-386
- Journal of Agro-Environment Science, 2016, 35(2): 380-386
- http://dx.doi.org/10.11654/jaes.2016.02.024
-
文章历史
- 收稿日期: 2015-07-18
2. 吉林农业大学动物生产及产品质量安全教育部重点实验室, 长春 130118;
3. 中国农业科学院特产研究所, 长春 130112
2. Key Laboratory of Animal Production, Product Quality and Security, Jilin Agriculture University, Changchun 130118, China;
3. Institute of Special Animal and Plant Sciences of CAAS, Changchun 130112, China
在中国,畜禽粪便是农业废弃物的主要来源之一,每年产生的粪便量超过3亿t [1]。大量的畜禽粪便如不经有效处理,会造成严重的环境污染。目前,堆肥发酵被认为是实现有机废弃物资源化利用的理想途径之一[2],该方法既可以有效杀灭粪便中的病原菌、消除恶臭,使粪便达到无害化,又可以将粪便中的有机物生物转化为可被植物吸收的小分子物质,使粪便达到肥料化[3]。然而传统的自然堆肥发酵周期长、腐熟程度低,已远远不能满足粪便资源化处理的需要。近年来,一些研究证明在堆肥过程中接种外源微生物既可以缩短堆肥周期,又可以提高堆肥质量。沈根祥等[4]在牛粪和秸秆的堆肥中接种外源微生物,结果显示比自然堆肥提前10 d达到腐熟;李玉红等[5]在牛粪和玉米秸秆的堆肥中接种外源微生物菌剂,结果表明添加菌剂可以使堆肥的高温期延长3~4 d;Jiang等[6]在牛粪和麦秆的堆肥中接种氮转化菌剂,结果显示氮损失达到最低,总氮含量增加了36.1%。然而堆料中木质纤维素难降解的问题仍是限制堆肥腐熟的关键问题。因此,本研究从自然发酵的牛粪中筛选出高效纤维素分解菌,优化其产酶条件,并接种于牛粪进行堆肥发酵,研究其对堆肥温度及堆肥质量的影响,以便开发出具有应用价值的微生物接种剂,为促进堆肥腐熟提供优良的菌种资源。
1 材料与方法 1.1 材料试验用牛粪来源于吉林农业大学牛场自然腐熟的牛粪。
1.2 培养基NA培养基、羧甲基纤维素钠培养基、产酶发酵培养基均参照勾长龙[7]方法配制。
1.3 菌株的筛选与鉴定采用羧甲基纤维素钠平板法和刚果红染色法[8]筛选出具有纤维素分解能力的菌株,并测量菌落直径(D)和水解圈直径(d)。
1.4 酶活力测定参照江国忠[8]介绍的方法对菌株的滤纸酶活力(FPA)和羧甲基纤维素酶活力(CMCA)进行测定。
1.5 形态学鉴定筛选出纤维素分解能力较强的菌株(Y2),为确定菌株菌属,对其进行菌落形态和培养特征观察,并进行革兰氏染色、芽孢染色鉴定,同时进行生化试验鉴定。
1.6 16S rDNA鉴定细菌DNA提取按参考文献[9]进行。以提取菌株的基因组为模板,用细菌16S rDNA通用引物进行PCR扩增,PCR产物经纯化后连接至pMD-18T转化到DH5α大肠杆菌中,将提取重组质粒送至生工生物公司进行序列测定。所得序列与GenBank数据库中序列进行Blast比对分析,利用MEGA6.0构建系统进化树,根据菌株间的亲缘关系确定菌株的种属。
1.7 产酶条件优化 1.7.1 种子液制备将Y2的菌种接种到发酵培养基中,置于振荡培养箱中28 ℃、160 r·min-1振荡培养2 d,制成种子液备用。
1.7.2 不同因素对菌株Y2酶活的影响保持培养基中其他成分不变,设定以下条件:碳源,羧甲基纤维素钠、微晶纤维素、淀粉、秸秆、麸皮;氮源,牛肉膏、酵母粉、蛋白胨、硫酸铵、酵母粉和蛋白胨混合物、尿素。分别在初始pH值5.0、6.0、7.0、8.0、9.0,温度25、28、33、37、40 ℃,将种子液以2%的接种量接入发酵培养基中,28 ℃、160 r·min-1振荡培养2 d,测定酶活力;按不同接种量(2%、4%、6%、8%、10%)接入培养基中28 ℃、160 r·min-1振荡培养2 d,测定酶活力;将种子液以2%的接种量接入发酵培养基中,28 ℃、160 r·min-1分别振荡培养24、48、72、96、120 h,测定酶活力。
1.8 堆肥试验 1.8.1 堆肥物料堆肥物料为牛粪和稻壳(表 1)。牛粪取自吉林农业大学牛场,稻壳取自吉林农业大学养殖基地。 菌株Y2,有效活菌数调制为≥108个·mL-1;EM菌剂购于河南省鹤壁市人元生物技术发展有限公司。
试验共设A、B、C 3组(每组3个重复)。每组均用新鲜牛粪与稻壳按体积比6∶4进行配比,C/N调节至25~30之间,水分控制在55%左右,其中A组按体积比接种0.5%的Y2,B组接种0.5%的EM菌剂,空白组接种0.5%的无菌水。充分混匀后装入容积10 L的泡沫箱中,每3 d翻堆一次。每天上午9:00和下午16:00进行温度测定,以测定的平均值作为当天的温度值。
1.9 纤维素降解率的测定纤维素降解率的测定参照刘旭[10]的测定方法。
1.10 数据处理试验数据采用Microsoft Excel 2010和SPSS 19.0软件进行整理和统计,用SPSS 19.0统计软件进行单因素方差分析,用邓肯氏新复极差测验法(Duncan′s Multiple Range Test,DMRT法)进行差异显著性分析。
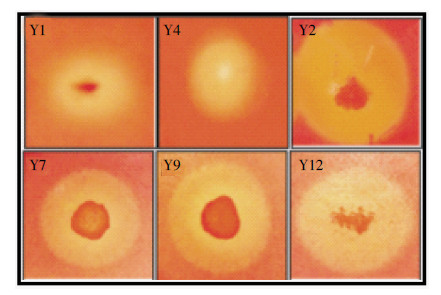
2 结果与分析 2.1 菌株的筛选经过CMC-Na平板法和刚果红染色法初步筛选,挑取6株菌落直径与水解圈直径比值(D/d)较大的菌株(图 1)进行复筛。
|
| 图 1 菌株在筛选平板上的水解圈 Figure 1 Clear hydrolytic zone on screening plate |
将初筛获得的6株菌进行酶活力测定(表 2)。结果显示菌株Y2的FPA(12.15 U·mL-1)和CMCA(36.57 U·mL-1)均显著高于其他菌株的酶活力,且差异显著(P < 0.05),结合初筛D/d值,选取菌株Y2进行后续试验。
菌株Y2的形态学鉴定结果如图 2所示。在NA培养基上的呈灰白色,表面多褶皱,干燥不透明,边缘不整齐。革兰氏染色阳性,显微镜下观察菌体呈长杆状;孔雀石绿染色芽孢呈绿色,芽孢在菌体的中央位置,属于中间芽孢体,营养体呈红色。

|
| 图 2 菌株Y2 的菌落形态(a)、革兰氏染色(b)、芽孢染色(c) Figure 2 Colony morphology(a), Gram staining(b), spore staining(c)of strain Y2 |
生化试验结果如表 3。结合菌体形态和培养特征的观察,初步判断菌株Y2为芽孢杆菌属。
以Y2菌株基因组DNA为模板,获得的核苷酸片段大小约为23 000 bp。利用16S rDNA细菌通用引物进行PCR扩增,测得菌株Y2的16S rDNA核苷酸序列长度为1450 bp。该结果与预期相符。将序列通过GenBank比对后,选取相似序列构建基因系统进化树(图 3),结果显示拮抗菌Y2与Bacillus subtilis strain M15J同源性达到98%,综合菌体形态、生化试验结果和16S rDNA序列分析,鉴定菌株Y2 为枯草芽孢杆菌。

|
| 图 3 Y2 系统进化树 Figure 3 Phylogenetic tree of stain Y2 |
不同培养条件下,菌株Y2的酶活力如图 4所示。当以麸皮为碳源时,菌株Y2的FPA和CMCA均最高,分别为(13.78±2.23)U·mL-1和(66.35±2.05)U·mL-1,与其他各物质差异显著(P < 0.05)。因此可以认为麸皮为菌株Y2产酶的最优碳源(图 4a)。

|
| 图 4 不同因素对菌株Y2 酶活力的影响 Figure 4 Enzymatic activities of strain Y2 |
以蛋白胨、酵母粉、硫酸铵、牛肉膏、蛋白胨+酵母粉和尿素为氮源的结果如图 4b。当以酵母粉和硫酸铵为氮源时,FPA较高分别为(15.51±2.18)U·mL-1和(18.49±1.82)U·mL-1,与其他物质差异显著(P < 0.05);当以酵母粉为氮源时,Y2的CMCA最高为(86.75±2.84)U·mL-1,其余各物质的CMCA差异均显著(P < 0.05)。综合上述结果,酵母粉为最适氮源。
当初始pH为5时,菌株Y2的FPA和CMCA最高,分别为(14.33±1.15)U·mL-1和(68.61±1.12)U·mL-1,随着pH的增加,菌株Y2的CMCA逐渐降低,可以初步判定菌株Y2为嗜酸性纤维素分解菌(图 4c)。
当种子液接种量为4%时,菌株Y2的FPA和CMCA分别为(15.58±1.22)U·mL-1和(40.67±1.91)U·mL-1,相比接种量为2%时菌株Y2的FPA和CMCA均有所升高,其中CMCA差异显著(P < 0.05);当接种量大于4%时,菌株的FPA和CMCA随着接种量的增加而呈下降趋势。由该结果可知,4%为最佳接种量(图 4d)。
由图 4e可知,温度在25~28 ℃之间时,菌株Y2的FPA和CMCA均呈上升趋势。28 ℃时菌株Y2的FPA和CMCA均达到最高,分别为(14.26±1.17)U·mL-1和(44.76±1.52)U·mL-1;当培养温度高于28 ℃时,FPA和CMCA均随温度的增加而降低。由此推断,28 ℃为最佳培养温度。
由图 4f可知菌株Y2的FPA在72 h增到最高,可达(29.86±1.52)U·mL-1,与其他时间段差异显著(P < 0.05);72 h后,随着时间的增长,FPA逐渐下降。而菌株Y2的CMCA变化则相对平缓,在48 h达到最高(41.14±1.76)U·mL-1,与其他时间段差异显著(P < 0.05),之后缓慢下降。
2.4 堆肥试验结果由图 5可知,接种Y2组和EM菌剂组均在第3 d达到高温期,接种无菌水组未进入高温期。接种Y2组最高温度为61 ℃,EM菌剂组最高温度达64 ℃;接种Y2组在高温期(>50 ℃)维持了9 d,EM菌剂组高温期维持了8 d;两组均在第30 d降至20 ℃左右;接种无菌水组在第5 d有过升温迹象,但随后温度下降,一直未进入高温期。

|
| 图 5 不同菌剂对堆肥温度的影响 Figure 5 Effects of different microbial agents on composting temperature |
由图 6可知,接种Y2组和EM菌剂组纤维素降解率从堆肥开始至第12 d呈平缓上升趋势,此后直至堆肥结束时,接种Y2组纤维素降解率达到42%,而EM菌剂组只达到35%,Y2组的纤维素降解率比EM菌剂组高了7个百分点;自然发酵组的纤维素降解率至堆肥结束时只有10.5%。

|
| 图 6 不同菌剂对堆肥中纤维素分解率的影响 Figure 6 Effects of different microbial agents on cellulose decomposition |
本研究采用刚果红染色法和摇瓶复筛从自然发酵的牛粪中获得一株高效纤维素分解菌Y2,经鉴定菌株为枯草芽孢杆菌(Baclitis sublitis)。目前国内外选育出的优良纤维素分解菌主要包括里氏木霉(T.reesei)[11]、斜卧青霉(Penicillium decumbens)、草酸青霉(Penicillium oxalicum)等真菌和放线菌(Streptomyces sp.),关于纤维素酶高产细菌的报道较少。与真菌和放线菌相比,细菌增殖速度更快,可以在短期内产生大量的生物热,有利于堆体的升温。而在细菌中枯草芽孢杆菌具有良好的耐高温、耐酸能力,适应环境能力很强。另外一些研究表明[12],枯草芽孢杆菌还有很强的生物同化作用,能有效降低粪便中的吲哚、氨气等有害气体的浓度,有利于粪便的资源化利用。纤维素酶活力的高低决定了菌株对纤维素物质的分解能力。刘清锋等[13]对产纤维素酶菌株青霉T24-2进行优化后,获得的最大滤纸酶活力和内切酶活力分别为6.89、45.01 U·mL-1;李保深等[14]研究对秸秆降解效果较好的斜卧青霉的产酶条件,28 ℃、120 r·min-1培养4 d,滤纸酶活力和内切酶活力分别达到7.085、3.856 IU·mL-1。本试验筛选出的菌株Y2在28 ℃、pH5.0培养48 h,FPA和CMCA分别可达15.83、100.81 U·mL-1,远远高于以上报道的真菌和放线菌的酶活力。这说明细菌Y2属于高产优良纤维素分解菌,有利于堆体中纤维素物质的降解。
温度是反映堆肥是否顺利进行的重要标志,温度变化可以作为堆肥过程评价的指标[7]。本试验中接种Y2组和EM菌剂组均在第3 d进入高温期,而且接种Y2组高温期维持了9 d,比EM菌剂组多维持了1 d。分析认为可能是枯草芽孢杆菌能够产生芽孢,抗热性较强,经过高温阶段的休眠,温度下降后仍可大量繁殖产生热量,因此高温期维持时间更长。根据国家卫生合格标准,堆体温度在50 ℃以上保持5~7 d,是杀灭粪便中致病菌和寄生虫卵的重要条件(GB 7959—2012)[15]。结果显示接种Y2组和EM菌剂均达到无害化腐熟标准。纤维素降解率是反映堆肥腐熟程度的重要指标,Zhou等[16]在牛粪和秸秆的堆肥中通过三阶段接种不同的微生物,结果显示堆肥结束后接种微生物组纤维素的降解率达到43%,而空白组只有15%;Wang等[17]研究结果显示,接种青霉组的鸡粪和牛粪堆肥纤维素降解率均显著高于对照组,达到41%左右。本研究的纤维素降解率达到42%,高于接种EM组7个百分点,与Zhou和Wang等的研究结果相近,说明本实验所用的纤维素降解菌Y2对堆肥发酵的腐熟具有较好的促进作用。
4 结论(1)从自然发酵的牛粪中获得一株高效纤维素分解菌Y2,经形态特征、生化特性及16S rDNA分子序列分析鉴定菌株为枯草芽孢杆菌(Baclitis sublitis)。
(2)通过单因素试验和正交试验优化菌株Y2的产酶条件,经产酶条件优化后,菌株Y2的滤纸酶活(FPA)为15.83 U·mL-1,羧甲基纤维素酶活力(CMCA)高达100.81 U·mL-1,分别是优化前的1.3、2.76倍。
(3)采用Y2接种牛粪进行堆肥试验,不仅延长了堆肥的高温期,也提高了堆肥质量。
| [1] | Qian X Y, Shen G X, Wang Z Q, et al. Co-composting of livestock manure with rice straw:Characterization and establishment of maturity evaluation system[J]. Waste Management, 2014, 34(2):530-535. |
| [2] | 艾海舰, 刘翠英. 生物活性水对堆肥腐熟过程的效应研究[J]. 西北农业学报, 2006, 15(5):258-260. AI Hai-jian, LIU Cui-ying. Effect of added the bacteria mineral water in the process of compost fermentation[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2006, 15(5):258-260. |
| [3] | 张传富. 禽粪好氧堆肥效应细菌的筛选与鉴定[D]. 哈尔滨:东北农业大学, 2007. ZHANG Chuan-fu. Isolation and identification of effective bacteria in aerobic composting of poultry manure[D]. Harbin:Northeast Agricultural University, 2007 |
| [4] | 沈根祥, 尉良, 钱晓雍, 等. 微生物菌剂对农牧业废弃物堆肥快速腐熟的效果及其经济性评价[J]. 农业环境科学学报, 2009, 28(5):1048-1052. SHEN Gen-xiang, WEI Liang, QIAN Xiao-yong, et al. Effect of microbial inoculation on quick composting of animal manure with crop straws and economic analysis[J]. Journal of Agro-Environment Science, 2009, 28(5):1048-1052. |
| [5] | 李玉红, 王岩, 李清飞. 外源微生物对牛粪高温堆肥的影响[J]. 农业环境科学学报, 2006, 25(增刊2):609-612. LI Yu-hong, WANG Yan, LI Qing-fei. Effect of inoculating microbes on composting process of cattle manure[J]. Journal of Agro-Environment Science, 2006, 25(Suppl2):609-612. |
| [6] | Jiang J S, Liu X L, Huang Y M, et al. Inoculation with nitrogen turnover bacterial agent appropriately increasing nitrogen and promoting maturity in pig manure composting[J]. Waste Management, 2015, 39:78-85. |
| [7] | 勾长龙. 低温纤维素降解菌的筛选及其复合菌系在牛粪堆肥中的应用研究[D]. 长春:吉林农业大学, 2014. GOU Chang-long. Identification of cold-adapted cellulose bacterium and effects of complex microbial agents on cattle manure composting[D]. Changchun:Jilin Agricultural University, 2014. |
| [8] | 江国忠. 高产纤维素酶枯草芽孢杆菌的筛选、应用及其产酶条件研究[D]. 南昌:南昌大学, 2010. JIANG Guo-zhong. Screening, application and conditions of enzyme production research of bacillus subtilis strains with high-cellulase yielded[D]. Nanchang:Nanchang University, 2010. |
| [9] | Mapula Kgomotso A M, Jean-Baptiste R, Marla T, et al. Impact of metagenomic DNA extraction procedures on the identifiable endophytic bacterial diversity in Sorghum bicolor(L. Moench)[J]. Journal of Microbiological Methods, 2015, 112(5):104-117 |
| [10] | 刘旭. 奶牛粪便高效降解菌的筛选及混合菌发酵研究[D]. 成都:四川农业大学, 2005. LIU Xu. Screening of high-efficiency degrading microbes of the cow excrement and fermentation by mixed microorganism[D]. Chengdu:Sichuan Agricultural University, 2005. |
| [11] | 马怀良, 郭文学, 柴军红. 常温高效纤维素分解菌的筛选[J]. 东北农业大学学报, 2010, 41(1):52-55. MA Huai-liang, GUO Wen-xue, CHAI Jun-hong. Screening high-performance cellulose-degrading microbes at normal temperature[J]. Journal of Northeast Agricultural University, 2010, 41(1):52-55. |
| [12] | 李春凤, 林显华, 谷巍. 枯草芽孢杆菌在饲料生产及环境防治中的应用[J]. 中国饲料, 2013(1):10-13. LI Chun-feng, LIN Xian-hua, GU Wei. Bacillus subtilis in feed production and environmental prevention and treatment[J]. China Feed, 2013(1):10-13. |
| [13] | 刘清锋, 支晓鹏, 徐惠娟, 等. 纤维素降解菌青霉T24-2的分离及产酶特性[J]. 工业微生物, 2007, 37(3):15-19. LIU Qing-feng, ZHI Xiao-peng, XU Hui-juan, et al. Screening and characterization of cellulase-producing Penicillium sp. T24-2[J]. Industrial Microbiology, 2007, 37(3):15-19. |
| [14] | 李保深, 高大文, 张博. 一株产纤维素酶真菌的筛选鉴定及降解[J]. 东北林业大学学报, 2011, 39(7):135-137. LI Bao-shen, GAO Da-wen, ZHANG Bo. Screening and identification of a prolific fungus strain producing cellulase and its degradation effect[J]. Journal of Northeast Forestry University, 2011, 39(7):135-137. |
| [15] | GB 7959-2012, 粪便无害化卫生要求[S]. 2012. GB 7959-2012, Hygienic requirements for harmless disposal of night soil[S]. 2012. |
| [16] | Zhou C, Liu Z, Huang Z L, et al. A new strategy for co-composting dairy manure with rice straw:Addition of different inocula at three stages of composting[J]. Waste Management, 2015(40):38-43. |
| [17] | Wang H Y, Fan B Q, Hu Q X, et al. Effect of inoculation with Penicillium expansum on the microbial community and maturity of compost[J]. Bioresource Technology, 2011, 102(24):11189-11193. |
 2016, Vol. 35
2016, Vol. 35