文章信息
- 张云芳, 陈楚, 陈晨, 束良佐
- ZHANG Yun-fang, CHEN Chu, CHEN Chen, SHU Liang-zuo
- 镉胁迫对青菜幼苗某些生理特性以及基因组多态性的影响
- Effects of cadmium stresses on physiological characteristics and genomic DNA polymorphism of Brassica chinensis L. seedlings
- 农业环境科学学报, 2016, 35(3): 432-439
- Journal of Agro-Environment Science, 2016, 35(3): 432-439
- http://dx.doi.org/10.11654/jaes.2016.03.004
-
文章历史
- 收稿日期: 2015-10-13
镉(Cd)是一种相对稀有的重金属元素,在工农业生产中应用较为广泛,是电镀、冶金、塑料以及电子元件等生产的重要原料。随着现代工农业的快速发展,工业“三废”和农业生产中农药、化肥的广泛使用,导致农田和水体受Cd污染的情况日益严峻。Cd是环境中移动性和生物毒性最强的重金属之一[1],据全国第二次污灌普查显示,Cd污染面积占重金属污染超标土壤面积的59.6%[2]。Cd不仅影响农作物的产量和品质,而且经食物链可富集于人体内,导致肝、肾器官的功能损伤,诱发心血管疾病及癌症[3]。20世纪60年代日本发生的“痛痛病”就是典型的慢性Cd中毒事例,国内近年发现的“镉米”和“镉菜”事件,反映出我国粮食和蔬菜的重金属安全问题,已引起人们的高度重视。为此,进行Cd污染的诊断与治理研究具有重要的理论和实践意义。
随着现代分子生物学技术的快速发展,监测环境污染胁迫已从宏观转向微观,通过分子水平检测能快速诊断污染物对生物体的遗传毒害。前人研究表明,Cd对于生物的遗传毒性主要是造成细胞DNA的损伤,引起染色体畸变,改变DNA的甲基化水平导致基因的表达与调控发生紊乱等[4, 5, 6]。随机扩增多态性DNA(RAPD)技术可以检测整个基因组的多态性,反映基因组的特征,已广泛应用于植物的品种分类、分子进化以及遗传图谱构建等领域[7]。近来RAPD技术也被用于研究重金属污染对植物基因组DNA的遗传损伤,已有大麦[8]、蚕豆[9]、草莓[10]、菜豆[11]、拟南芥[12, 13]及谷子[14]等相关报道,均表明RAPD变化谱带可以作为检测重金属污染毒性的潜在生物标记物。
青菜(Brassica chinensis L.)在我国栽培广泛,是居民消费最多的叶类蔬菜之一,而人类摄入的重金属可能与叶菜类蔬菜所吸收累积的重金属有关[15]。Cd对青菜幼苗的生长和生理特性影响已有相关报道,水培或盆栽条件下的试验结果均表明,低浓度Cd处理对于青菜幼苗的生长影响不大,而高浓度Cd胁迫会明显抑制青菜幼苗的生长,降低叶片的叶绿素含量及抗氧化能力,加剧细胞膜脂的过氧化[16, 17, 18]。陆文妹[16]研究指出,青菜对Cd的富集能力较强,低浓度Cd污染下青菜的生长不受影响,但叶片中Cd含量已超过国家标准(GB 2762—2005)中所规定的最高Cd限值0.2 mg·kg-1。因此,在Cd污染土壤中种植的青菜存在较高的食用风险,而目前缺乏快速评价青菜Cd污染的方法。本研究应用RAPD技术和生理生化方法,检测和分析了不同浓度的Cd胁迫下青菜幼苗的生理响应以及基因组多态性的变化,并通过RAPD图谱构建污染评价体系,从而探讨Cd胁迫对青菜生长发育的影响,为农业生产中青菜Cd污染的早期预警和诊断提供理论依据。
1 材料与方法 1.1 实验材料供试青菜(Brassica chinensis L.)品种为“苏州青”,购自淮北市种子公司。
1.2 实验方法 1.2.1 材料的培养及处理青菜种子用0.5% NaClO消毒20 min,经灭菌水反复冲洗,再放入垫有两层滤纸的培养皿中,恒温培养箱中25 ℃催芽。选取萌发一致的种子播种于蛭石∶砂=1∶1(V/V)的混合基质中,智能光照培养箱中培养,昼夜温度为28 ℃/22 ℃,光照/黑暗为12 h/12 h,光强120 μmol·m-2·s-1,先用1/2 Hoagland营养液浇灌,后用完全Hoagland营养液浇灌。培养到两叶一心时,分别用含有0(CK)和1、5、10、20、40 mg·L-1 Cd的Hoagland营养液浇灌,Cd以CdCl2·2.5H2O形式加入。处理20 d后,取青菜上部完全展开的叶片提取基因组DNA以及测定相关的形态和生理指标。
1.2.2 青菜幼苗形态指标的测定取不同Cd浓度处理下的青菜幼苗各30株,用直尺测量幼苗的最大根长,并称量幼苗的鲜重。鲜重和根的抑制率按下式计算:抑制率=(1-x/y)×100%,其中y为对照组幼苗的平均鲜重或平均根长,x为各处理组幼苗的平均鲜重或平均根长。
采用SPSS 13.0软件中的Duncan氏法进行数据差异显著性分析。
1.2.3 青菜幼苗生理指标的测定叶绿素含量的测定采用浸提法[19];蛋白质含量的测定参照Bradford方法[20];丙二醛含量采用硫代巴比妥酸法[21];质膜透性以相对电导率表示[22]。所有指标数据均为三次重复,采用SPSS 13.0软件中的Duncan氏法进行数据差异显著性分析。
1.2.4 青菜幼苗基因组DNA的提取与RAPD分析称0.2 g青菜叶片,液氮研磨,采用CTAB法提取DNA[23],紫外分光光度计检测A260和A280,并计算A260/A280,以检测DNA的浓度和纯度。
10 bp RAPD随机引物,Taq DNA聚合酶以及dNTPs购自上海生物工程股份有限公司。PCR反应总体积25 μL,体系中含有10×PCR Buffer 2.5 μL,25 mmol·L-1 MgCl2 2.5 μL,dNTPs混合物1 μL(4种成分均为2.5 mmol·L-1),5 U·μL-1 Taq DNA聚合酶0.2 μL,10 μmol·L-1随机引物1 μL,100 ng基因组DNA,加灭菌水至25 μL。RAPD随机引物序列如表 1所示。PCR反应程序:94 ℃预变性5 min,94 ℃变性1 min,39 ℃退火60 s,72 ℃延伸60 s,35个循环,最后72 ℃保温10 min,PCR产物4 ℃保存待用。RAPD扩增产物用1.2%琼脂糖凝胶电泳分离,在凝胶成像分析系统(Tanon-1600,上海天能)拍照保存,后续进行统计分析基因组模板的稳定性。基因组模板稳定性(GTS)的计算:
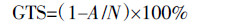
式中A为处理组幼苗的RAPD多态性谱带数,N为对照组的总谱带数。多态性谱带数指与对照组相比,处理组新出现的和消失的RAPD谱带之和[24]。
2 结果与分析 2.1 Cd胁迫对青菜幼苗根长以及鲜重的影响由表 2可见,Cd处理抑制了青菜幼苗的生长,显著降低了幼苗的鲜重和根长。随着Cd处理浓度的增加,Cd对幼苗鲜重和根长的抑制率显著增强(P <0.05),分别为19.6%~74.9%和14.6%~59.3%。表明幼苗鲜重和根长的抑制与Cd浓度之间存在剂量效应关系,并且在相同Cd浓度处理下,Cd对幼苗鲜重的抑制大于根长,如在40 mg·L-1 Cd胁迫下,幼苗鲜重抑制率达到74.9%,而根长的抑制率为59.3%。
 |
由图 1和图 2可知,1~40 mg·L-1 Cd处理青菜幼苗后,叶片的叶绿素和蛋白质含量呈下降趋势,并显著低于对照(P <0.05),叶绿素含量分别比对照下降25.0%、32.0%、51.9%、72.1%和91.1%,蛋白质含量分别比对照下降17.8%、32.9%、52.1%、64.4%和86.5%。表明叶绿素和蛋白质含量下降的幅度与Cd处理浓度之间存在正相关性。

|
| 图 1 Cd胁迫对青菜幼苗叶片叶绿素含量的影响 Figure 1 Effects of cadmium stresses on chlorophyll content of Brassica chinensis seedlings |

|
| 图 2 Cd胁迫对青菜幼苗叶片蛋白质含量的影响 Figure 2 Effects of cadmium stresses on protein content of Brassica chinensis seedlings |
由图 3和图 4可知,1~40 mg·L-1 Cd处理青菜幼苗后,幼苗叶片的膜透性和丙二醛含量呈递增趋势,并且显著高于对照(P <0.05)。叶片的膜透性分别比对照增加61.8%、158.3%、211.6%、279.1%和344.5%,丙二醛含量分别比对照增加61.8%、142.0%、247.1%、332.6%和510.8%。表明膜透性和丙二醛含量的增加幅度与Cd处理浓度正相关。

|
| 图 3 Cd胁迫对青菜幼苗叶片质膜透性的影响 Figure 3 Effects of cadmium stresses on leaf membrane permeability of Brassica chinensis seedlings |

|
| 图 4 Cd胁迫对青菜幼苗叶片丙二醛含量的影响 Figure 4 Effects of cadmium stresses on leaf malondialdehyde content of Brassica chinensis seedlings |
选用的8条10 bp寡核苷酸序列引物均能扩增出特异稳定的PCR产物。对照青菜幼苗基因组DNA的RAPD图谱可以分辨出55条清晰的谱带,分子量大小在150~2500 bp之间(图 5)。1~40 mg·L-1 Cd处理青菜幼苗后,叶片基因组DNA的RAPD图谱发生明显变化,表现为谱带的缺失和增加,以及荧光强度的减弱或增强(图 5)。

|
| M: DL 2000 marker; a: control; b: 1 mg·L-1 Cd; c: 5 mg·L-1 Cd;d: 10 mg·L-1 Cd;e: 20 mg·L-1 Cd; f: 40 mg·L-1 Cd图 5 Cd胁迫对青菜幼苗叶片基因组RAPD图谱的影响 Figure 5 Effects of cadmium stresses on RAPD profiles of genomic DNA from leaves of Brassica chinensis seedlings |
表 3表明,1~40 mg·L-1 Cd处理青菜幼苗后,叶片基因组DNA的RAPD图谱中的多态性谱带增加,多态性值(P/总谱带数)分别为16.4%、25.5%、29.1%、30.9%和36.4%,与Cd处理浓度正相关。图 6表明,1~40 mg·L-1 Cd处理青菜幼苗后,叶片基因组模板稳定性(GTS)呈下降趋势,依次为83.6%、74.5%、70.9%、69.1%和63.6%,与Cd处理浓度负相关。
 |

|
| 图 6 Cd胁迫对青菜幼苗叶片基因组稳定性的影响 Figure 6 Effects of cadmium stresses on stability of genome template of Brassica chinensis seedlings |
表 4表明,1~40 mg·L-1 Cd处理青菜幼苗后,叶片的叶绿素含量、蛋白质含量与DNA多态性条带数和变化条带数间呈显著负相关(P <0.05或P <0.01),而丙二醛含量、膜透性与DNA多态性条带数和变化条带数间呈显著正相关(P <0.05或P <0.01)。
 |
植物遭受Cd毒害后,主要表现为生长迟缓,叶片卷曲失绿,生物量降低等症状[25],Cd毒害的生理机制可能是Cd结合和取代蛋白分子中的自由巯基和金属辅因子致使蛋白变性或失活[25],诱发氧化胁迫反应致使细胞生理代谢紊乱[26, 27],干扰植物对其他离子的吸收和转运致使营养亏缺、离子失衡[28]。本研究发现,在1~40 mg·L-1 Cd处理20 d后,青菜幼苗的鲜重、根长、叶绿素以及蛋白质含量均逐渐降低,而丙二醛含量和细胞膜透性逐渐增加,表明Cd浓度越大,对青菜幼苗的毒害抑制效应越强,与前人的研究结果相似。任安芝等[18]研究表明,溶液培养条件下,Cd浓度超过0.9 mmol·L-1时,随着时间的延长,Cd毒性急剧增强,致使青菜的膜透性增加,叶绿素含量降低。陆文妹[16]盆栽试验结果表明,土壤中Cd浓度超过25 mg·kg-1时,青菜的生长受到明显抑制,叶片的抗氧化酶活性降低,脂质过氧化损伤加剧。本研究虽然以蛭石和砂石的混合物作为培养基质,与溶液培养或土培不同,且在Cd处理的浓度和时间上也有差异,但研究结果与前人的相似,均表明Cd对于青菜的生理毒害呈现浓度-剂量效应。这在大麦、蚕豆以及草莓中也有相应的研究结果[8, 9, 10]。也有研究表明,Cd浓度对菜豆幼苗的蛋白质含量、拟南芥幼苗的叶绿素和蛋白质含量均表现出低促高抑的现象[11, 12]。这可能是低浓度Cd处理时,叶片组织的蛋白质合成优于分解,含量因而上升;高浓度Cd处理时,叶片组织受到Cd毒害已超过生物体的适应能力,蛋白质的合成反应受到抑制,含量因而下降[12]。不同研究中,Cd处理引起的蛋白质、叶绿素含量变化趋势不同,可能是与各试验选用Cd处理的浓度、时间以及植物对Cd的耐受性有关。
Cd的遗传毒性主要是损伤基因组DNA。前人研究表明,Cd与DNA链上的碱基相互作用生成8-羟基脱氧鸟苷,引起DNA链断裂[29],损伤DNA修复系统[30],导致DNA损伤和突变,而应用RAPD技术可以有效检测DNA损伤和突变的位点[31]。与微核试验、彗星电泳试验等传统的遗传毒性检测方法相比,RAPD技术可以检测出生物细胞DNA的临时变化,因而更加灵敏[31]。虽然RAPD技术的重现性、可靠性存在疑问,但通过筛选引物和优化PCR反应体系能够克服这些缺点,仍可在短时间内获得稳定可靠的研究结果[32]。本研究主要采用前期试验筛选出的8条随机引物来评价Cd污染造成的青菜基因组DNA损伤,结果表明,Cd胁迫下青菜幼苗的RAPD图谱发生了明显变化,包括RAPD谱带发生增加、缺失以及荧光强度的增强、减弱等,并且RAPD多态性与Cd浓度之间存在剂量效应。这与刘宛等[8]、李慧等[10]、吕金印等[11]在大麦、草莓、菜豆中的研究结果相似。
Cd胁迫下RAPD图谱的变化主要是因为基因组DNA受损后,与引物结合的模板DNA片段会发生缺失、插入、碱基突变或位点序列改变等,导致扩增片段的大小、片段数发生了改变,RAPD谱带出现质差与量差的现象[32, 33, 34]。本文研究中,随着Cd处理浓度的增高,RAPD图谱中新增和缺失的条带逐渐增多(表 3)。Cd浓度为1~5 mg·L-1时,RAPD谱带中新增、消失的DNA条带数比较接近;Cd浓度为10 mg·L-1和40 mg·L-1时,RAPD谱带中消失的DNA条带数超过新增的DNA条带数;当Cd浓度为20 mg·L-1,RAPD谱带中新增的DNA条带数却又超过消失的DNA条带数。这可能是Cd处理后青菜叶片基因组的损伤形式较多,导致RAPD条带新增、消失的变化较为复杂,不完全相依Cd浓度的变化,其中机理有待深入研究。同样,随着Cd处理浓度的增高,RAPD图谱中荧光强度发生改变的条带数也逐渐增加。当Cd处理浓度为1~20 mg·L-1时,RAPD谱带中大多数条带的荧光强度增强,主要是因为Cd处理后青菜DNA序列发生改变,导致与引物互补结合的互补位点增多,扩增片段由此而增加;而Cd浓度继续增加为40 mg·L-1时,DNA损伤加剧,与引物互补结合的位点减少,扩增片段由此而减少。Gupta等[35]研究指出,RAPD图谱的变化趋势可以衡量基因组模板DNA的稳定性。本文研究表明,Cd胁迫对青菜幼苗基因组稳定性造成了较大影响,随着Cd浓度的增高,RAPD图谱中新增和缺失的条带逐渐增多(表 3),基因组稳定性逐步下降(图 6),与幼苗的鲜重、根长、叶绿素以及蛋白质含量的变化趋势相似,进一步的相关分析表明,RAPD多态性与青菜幼苗的生理指标具有显著的相关性(表 4)。这说明,利用RAPD技术所获得的DNA多态性变化条带可以作为检测Cd对植物遗传毒性效应的生物标记物。
4 结论(1)随着Cd处理浓度的增加,青菜幼苗的生长受到抑制,叶片的叶绿素以及蛋白质含量下降,丙二醛含量和细胞膜透性增加。
(2)以筛选的8条引物进行RAPD扩增,获得多态性条带,其中对照青菜的叶片基因组DNA共获得55条RAPD谱带。Cd胁迫后的RAPD图谱发生改变,呈现出谱带的增加、缺失和荧光强度的改变,并且与Cd浓度剂量-效应相关,叶片基因组的模板稳定性随着Cd浓度的增加逐步下降。RAPD多态性与青菜幼苗的生理指标具有显著的相关性。
(3)RAPD谱带可以作为监测青菜生长遭受重金属污染伤害的生物标记物,结合生理生化指标可以为青菜品种的Cd污染毒性评价提供依据。
| [1] | 郭笃发. 环境中铅和镉的来源及其对人和动物的危害[J]. 环境科学进展, 1994, 2(3):71-76. GUO Du-fa. Environmental sources of Pb and Cd and their toxicity to man and animals[J]. Advance in Enviromental Science, 1994, 2(3):71-76. |
| [2] | 张微, 吕金印, 柳玲. 不同基因型番茄幼苗对镉胁迫的生理响应及镉吸收差异[J]. 农业环境科学学报, 2010, 29(6):1065-1071. ZHANG Wei, LÜ Jin-yin, LIU Ling. Different of cadmium absorption and physiological responses of different varieties of tomatoes to cadmium stress[J]. Journal of Agro-Environment Science, 2010, 29(6):1065-1071. |
| [3] | 李裕, 张强, 王润元, 等. 镉的致癌性与食品中镉的生物有效性[J]. 生命科学, 2010, 22(2):179-184. LI Yu, ZHANG Qiang, WANG Run-yuan, et al. The carcinogenic potential and bioavailability of cadmium(Cd) from food[J]. Chinese Bulletin of Life Sciences, 2010, 22(2):179-184. |
| [4] | Müller T, Schuckelt R, Jaenicke L. Cadmium/zinc-metallothionein induces DNA strand breaks in vitro[J]. Archives of Toxicology, 1991, 65(1):20-26. |
| [5] | Palus J, Rydzynski K, Dziubaltowska E, et al. Genotoxic effects of occupational exposure to lead and cadmium[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2003, 540(1):19-28. |
| [6] | 杨金兰, 柳李旺, 龚义勤, 等. 镉胁迫下萝卜基因组DNA甲基化敏感扩增多态性分析[J]. 植物生理与分子生物学学报, 2007, 33(3):219-226. YANG Jin-lan, LIU Li-wang, GONG Yi-qin, et al. Analysis of genomic DNA methylation level in radish under cadmium stress by methylation-sensitive amplified polymorphism technique[J]. Journal of Plant Physiology and Molecular Biology, 2007, 33(3):219-226. |
| [7] | 胡裕清, 赵树进. RAPD技术及其在植物研究中的应用[J]. 生物技术通报, 2010(5):74-77. HU Yu-qing, ZHAO Shu-jin. RAPD technology and its application on plant research[J]. Biotechnology Bulletin, 2010(5):74-77. |
| [8] | 刘宛, 郑乐, 李培军, 等. 镉胁迫对大麦幼苗基因组DNA多态性影响[J]. 农业环境科学学报, 2006, 25(1):19-24. LIU Wan, ZHENG Le, LI Pei-jun, et al. Effects of cadmium stress on DNA polymorphism of genome in Barley seedlings[J]. Journal of Agro-Environment Science, 2006, 25(1):19-24. |
| [9] | 解莉婧, 刘宛, 李培军, 等. 镉胁迫对蚕豆幼苗基因组DNA多态性的影响[J]. 生态学杂志, 2007, 26(1):35-39. XIE Li-jing, LIU Wan, LI Pei-jun, et al. Effects of cadmium stress on DNA polymorphism of genome in Vicia faba seedling[J]. Chinese Journal of Ecology, 2007, 26(1):35-39. |
| [10] | 李慧, 丛郁, 王宏伟, 等. 镉对草莓幼苗根尖氧化系统和基因组DNA损伤的影响[J]. 园艺学报, 2010, 37(5):721-730. LI Hui, CONG Yu, WANG Hong-wei, et al. Effects of cadmium stress on oxygen enzyme system and genome DNA polymorphism in the root tips of strawberry plants[J]. Acta Horticulturae Sinica, 2010, 37(5):721-730. |
| [11] | 吕金印, 邸丽俊, 叶庆富. 镉胁迫对菜豆幼苗基因组DNA多态性的影响[J]. 中国环境科学, 2012, 32(5):892-899. LÜ Jin-yin, DI Li-jun, YE Qing-fu. Effects of cadmium stress on DNA polymorphism of genome in Phaseolus vulgaris seedling[J]. China Environmental Science, 2012, 32(5):892-899. |
| [12] | 詹振楠, 刘宛, 孙梨宗. 镉胁迫对拟南芥幼苗基因组DNA多态性的影响[J]. 生态学杂志, 2011, 30(6):1234-1239. ZHAN Zhen-nan, LIU Wan, SUN Li-zong, et al. Effects of cadmium stress on DNA polymorphism of genome in Arabidopsis thaliana seedlings[J]. Chinese Journal of Ecology, 2011, 30(6):1234-1239. |
| [13] | 孙梨宗, 刘宛, 马珊珊, 等. 镉诱导拟南芥幼苗DNA损伤[J]. 生态学杂志, 2012, 31(9):2337-2343. SUN Li-zong, LIU Wan, MA Shan-shan, et al. Cadmium induced DNA damage of Arabidopsis seedlings[J]. Chinese Journal of Ecology, 2012, 31(9):2337-2343. |
| [14] | 张义贤, 付亚萍, 肖志华, 等. 铜胁迫对不同基因型谷子幼苗基因组DNA多态性的影响[J]. 环境科学, 2013, 34(10):4090-4095. ZHANG Yi-xian, FU Ya-ping, XIAO Zhi-hua, et al. Effects of Cu2+ stress on DNA polymorphism of genome in foxtail millet of different genotypes[J]. Environmental Science, 2013, 34(10):4090-4095. |
| [15] | 刘景红, 陈玉成. 中国主要城市蔬菜重金属污染格局的初步分析[J]. 微量元素与健康研究, 2004, 21(5):42-44. LIU Jing-hong, CHEN Yu-cheng. Primary investigation on contamination pattern of vegetables by heavy metals in Chinese cities[J]. Studies of Trace Elements and Health, 2004, 21(5):42-44. |
| [16] | 陆文妹. 镉胁迫对青菜生长和抗氧化系统的影响[J]. 安徽农业科学, 2011, 39(5):2703-2705, 2833. LU Wen-mei. Effects of Cd stress on growth and antioxidative system of Brassica chinensis[J]. Journal of Anhui Agricultural Sciences, 2011, 39(5):2703-2705, 2833. |
| [17] | 郑爱珍, 刘传平, 沈振国. 镉处理下青菜和白菜MDA含量、POD和SOD活性的变化[J]. 湖北农业科学, 2005(1):67-69. ZHENG Ai-zhen, LIU Chuan-ping, SHEN Zhen-guo. Effect of cadmium on MDA content, POD and SOD activities Brassica pekinensis and Brassica chinensis[J]. Journal of Anhui Agricultural Sciences, 2005(1):67-69. |
| [18] | 任安芝, 高玉葆, 刘爽. 铬、镉、铅胁迫对青菜叶片几种生理生化指标的影响[J]. 应用与环境生物学报, 2000, 6(2):112-116. REN An-zhi, GAO Yu-bao, LIU Shuang. Effects of Cr, Cd and Pb on free proline content etc in leaves of Brassica chinensis L.[J]. Chinese Journal of Applied and Environmental Biology, 2000, 6(2):112-116. |
| [19] | 张宪政. 植物叶绿素含量测定-丙酮乙醇混合液法[J]. 辽宁农业科学, 1986(3):26-28. Zhang Xian-zheng. Determination of plant chlorophyll content by a mixture with acetone and ethanol[J]. Liaoning Agricultural Sciences, 1986(3):26-28. |
| [20] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1):248-254. |
| [21] | 赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 1994, 30(3):207-210. ZHAO Shi-jie, XU Chang-cheng, ZOU Qi, et al. Improvements of method for measurement of malondialdehyde in plant tissues[J]. Plant Physiology Communications, 1994, 30(3):207-210. |
| [22] | 张志良, 瞿伟箐. 植物生理学实验指导[M]. 三版. 北京:高等教育出版社, 2002. ZHANG Zhi-liang, QU Wei-jing. The experimental guide for plant physiology[M]. Third Edition. Beijing:Higher Education Press, 2003. |
| [23] | 魏群. 分子生物学实验指导[M]. 北京:高等教育出版社, 2007. 110-115. WEI Qun. Laboratory manual for molecular biology[M]. Beijing:Higher Education Press, 2007:110-115. |
| [24] | Gichner T, Patková Z, Száková J, et al. Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals[J]. Ecotoxicology and Environmental Safety, 2006, 65(3):420-426. |
| [25] | Di Toppi L S, Gabbrielli R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41(2):105-130. |
| [26] | Stohs S J, Bagchi D. Oxidative mechanisms in the toxicity of metal ions[J]. Free Radical Biology and Medicine, 1995, 18(2):321-336. |
| [27] | Heyno E, Klose C, Krieger-Liszkay A. Origin of cadmium-induced reactive oxygen species production:Mitochondrial electron transfer versus plasma membrane NADPH oxidase[J]. New Phytologist, 2008, 179(3):687-699. |
| [28] | Li S, Yu J, Zhu M, et al. Cadmium impairs ion homeostasis by altering K+ and Ca2+ channel activities in rice root hair cells[J]. Plant, Cell and Environment, 2012, 35(11):1998-2013. |
| [29] | Mikhailova M V, Littlefield N A, Hass B S, et al. Cadmium-induced 8-hydroxydeoxyguanosine formation, DNA strand breaks and antioxidant enzyme activities in lymphoblastoid cells[J]. Cancer Letters, 1997, 115(2):141-148. |
| [30] | Asmuss M, Mullenders L H F, Eker A, et al. Differential effects of toxic metal compounds on the activities of Fpg and Xpa, two zinc finger proteins involved in DNA repair[J]. Carcinogenesis, 2000, 21(11):2097-2104 |
| [31] | Atienzar F A, Venier P, Jha A N, et al. Evaluation of the random amplified polymorphic DNA(RAPD) assay for the detection of DNA damage and mutations[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2002, 521(1):151-163. |
| [32] | Atienzar F A, Jha A N. The random amplified polymorphic DNA(RAPD) assay and related techniques applied to genotoxicity and carcinogenesis studies:A critical review[J]. Mutation Research/Reviews in Mutation Research, 2006, 613(2):76-102. |
| [33] | Jones C, Kortenkamp A. RAPD library fingerprinting of bacterial and human DNA:Applications in mutation detection[J]. Teratogenesis, Carcinogenesis, and Mutagenesis, 2000, 20(2):49-63. |
| [34] | 齐雪梅, 李培军, 刘宛, 等. DNA指纹技术在污染土壤生态毒理诊断中的应用[J]. 生态学杂志, 2005, 24(11):1351-1356. QI Xue-mei, LI Pei-jun, LIU Wan, et al. Application of DNA fingerprint in eco-toxicological diagnosis of contaminated soil[J]. Chinese Journal of Ecology, 2005, 24(11):1351-1356. |
| [35] | Gupta M, Sarin N B. Heavy metal induced DNA changes in aquatic macrophytes:Random amplified polymorphic DNA analysis and identification of sequence characterized amplified region marker[J]. Journal of Environmental Sciences, 2009, 21(5):686-690. |
 2016, Vol. 35
2016, Vol. 35




