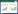文章信息
- 和淑娟, 王宏镔, 王海娟, 赵宾, 李勤椿
- HE Shu-juan, WANG Hong-bin, WANG Hai-juan, ZHAO Bin, LI Qin-chun
- 砷胁迫下3-吲哚乙酸对不同砷富集能力植物根系形态和生理的影响
- Effects of indole-3-acetic acid on morphologic and physiological characteristics of root systems of plants with different arsenic-accumulating abilities under As stress
- 农业环境科学学报, 2016, 35(5): 878-885
- Journal of Agro-Environment Science, 2016, 35(5): 878-885
- http://dx.doi.org/10.11654/jaes.2016.05.009
-
文章历史
- 收稿日期: 2015-12-16
虽然植物的根、茎、叶均可吸收污染物,但因根系与土壤或水环境直接接触,所以根是植物吸收污染物的主要器官。植物要维持自身的生长和发育必须依赖根从环境中吸收营养物质和水分[1],随之也会有污染物的吸入。生长素是最早发现的植物激素,3-吲哚乙酸(IAA)又是生长素的常见代表物,植物体内微量的IAA具有调控植物生长发育的功能,如促进植物细胞分裂、伸长生长以及新器官的分化和形成[2]。通过在Cd处理的水稻中分别添加浓度为10-9~10-7 mmol·L-1的生长素萘乙酸(NAA)、IAA、吲哚丁酸(IBA)和2,4-二氯苯氧乙酸(2,4-D)发现,当4种生长素浓度为10-8 mmol·L-1时,均促进了初生根和不定根的生长[3]。对于外源添加生长素后研究植物体内重金属分布和解毒机制已有很多文献报道,如周建民等[4]研究发现外源施加一定浓度IAA后,受Pb、Zn、Cu、Cd复合污染土壤上生长的玉米(Zea mays)植株地上部生物量显著增加,且增加了重金属富集量,提高了植物修复效率,但相关机理尚不明确。
一般认为,生长素能诱导质膜ATPase的激活,从而产生离子跨膜运输的变化[5]。在重金属胁迫下,植物的生长一般会受抑制,尤其是当重金属浓度较高时[6]。重金属胁迫下植物体内会产生大量活性氧自由基[7],但植物可以通过抗氧化系统来清除[8],如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等。胡拥军等[9]发现,大叶井口边草叶片内源IAA含量与CAT活性显著负相关;向言词等[10]研究施用外源IAA对生长在铅污染土壤(500 mg·kg-1)上的芥菜型油菜(Brassica juncea)SOD活性的影响发现,添加IAA后,SOD活性比对照升高77.3%,POD参与IAA的分解,具有催化IAA氧化脱羧的能力[11]。Srivastava等[12]研究也发现,在As(Ⅴ)胁迫下,砷超富集植物蜈蚣草(Pteris vittata)具有比非超富集植物剑叶凤尾蕨(Pteris ensiformis)和波士顿肾蕨(Nephrolepis exaltata L.)更高的SOD、CAT和POD活性,因而具有更强的抗氧化能力。然而,在IAA作用下不同砷富集能力植物中这些生理指标的变化研究尚少。
发达的根系为植物超量吸收砷提供了可能。Forino等[13]发现在砷超富集植物蜈蚣草中,低、中浓度的砷处理(250~334 μmol·L-1)引起根毛倾向于根尖部位发育,且数量和长度增加,但高浓度砷处理(500 μmol·L-1)却未观察到该现象。这种砷诱导的根系形态的反应调整了根对砷的吸收速率。然而,在砷胁迫下,如果有外源IAA介入,砷超富集植物根系形态和生理是否会作出相应的调整,以吸收和富集更多的砷,目前文献还报道较少。
大叶井口边草(Pteris cretica var. nervosa)是砷超富集植物[14],剑叶凤尾蕨是与大叶井口边草同属的非超富集植物[12],同属中不同砷富集能力的植物为比较生理学的研究提供了极好材料。本研究通过室内水培实验,在固定的五价砷胁迫浓度下,通过外源添加不同浓度IAA,考察大叶井口边草和剑叶凤尾蕨的株高、生物量、砷含量、根系形态(根长、根尖数、根表面积)、根系活力、根细胞质膜ATPase活性以及抗氧化酶活性等形态和生理指标的变化,并结合逐步回归法揭示植物根部砷含量与所测定根系形态和生理指标的关系。
1 材料与方法 1.1 供试植物
砷超富集植物大叶井口边草初生小苗采自昆明理工大学校园,非砷超富集植物剑叶凤尾蕨初生小苗采自云南省红河州河口县附近橡胶林中。初生小苗带回温室后进行修剪并于清洁土壤中适应性培养2个月,选取长势良好、大小一致的幼苗(高8~9 cm、带7~8片小叶)进行水培试验。
1.2 植物培养采用室内水培法,以容积为2.5 L的塑料小桶作容器,培养液含有1/10的Hoagland营养液和不同浓度的IAA。根据预实验结果确定As(Ⅴ)浓度为2 mg·L-1,以砷酸钠(Na3AsO4·12H2O)的形式添加,As离子浓度以纯As计。生长素IAA浓度设定为对照(0 mg·L-1)、低浓度(10 mg·L-1)、中浓度(20、40 mg·L-1)和高浓度(60 mg·L-1),每一处理设置3个重复。每桶放置2~4株植物,且保证每桶中植株的大小和鲜重较为一致,连续充氧,每隔3 d更换一次培养液[15],室温为15~25 ℃。
1.3 样品处理及测定植物培养14 d后收获。先用自来水清洗,再用0.1 mol·L-1稀HCl冲洗[16],最后用去离子水洗净。用滤纸吸干植物表面水分,将植株分为两部分:一部分装入自封袋放入冰箱于-18 ℃保存,以进行根系活力、根细胞质膜ATPase酶活性以及根系形态和抗氧化酶活性的测定;另一部分于烘箱105 ℃杀青30 min,在70 ℃下烘干至恒重,磨碎混匀,称取0.2 g左右样品,用HNO3-H2O2加热消化,定容至25 mL进行砷含量测定。
测定砷含量前待测液加入60 g·L-1的硫脲和抗坏血酸混合液进行还原(至少0.5 h),并用5% HCl按一定稀释倍数进行定容。植物砷含量运用原子荧光光谱仪(北京瑞利仪器公司,AF-610D型)测定。砷的标准样品(100 mg·L-1)购自国家标准物质研究中心。测定砷的工作曲线为y=27.159x+8.461,R2=0.999 4,式中y为荧光强度,x为标样砷浓度(μg·L-1)。砷的加标回收率为93%~95%,符合砷测定质量控制要求。
参照张中峰等[17]方法,利用扫描仪(HP LaserJet M 1005 MEP)扫描完整根系图像,用Winrhizo根系系统分析软件分析总根长、根系总面积和根尖数量。
根系活力测定采用氯化三苯基四氮唑(TTC)法[18];根细胞质膜H+-ATPase活性测定采用高俊凤等[19]介绍的方法;CAT酶活性测定采用紫外分光光度法[20];SOD活性测定用氮蓝四唑法[21];POD活性测定用愈创木酚法[22];细胞膜脂过氧化产物丙二醛(MDA)含量测定用硫代巴比妥酸法[18]。
1.4 数据处理数据先用Microsoft Excel 2007进行简单处理,再用SAS 9.2软件进行双因素方差分析,并用Tukey's HSD法进行多重比较。显著性差异水平P取0.05,极显著差异水平P取0.01。采用SPSS 19.0软件进行多元逐步回归分析,用Origin 8.0软件绘图。
2 结果与分析 2.1 IAA对砷胁迫下植物株高和生物量的影响不同IAA浓度处理下,砷超富集植物大叶井口边草的株高除60 mg·L-1处理显著降低外,其他处理与对照相比均无显著差异(P>0.05);非超富集植物剑叶凤尾蕨在20 mg·L-1 IAA处理下,株高显著高于对照和60 mg·L-1 IAA处理(P<0.05),但对照与60 mg·L-1处理相比无显著差异(图 1a)。
|
|
图中不同字母表示同一植物在不同IAA处理浓度之间的差异显著(P<0.05)。下同 Different letters indicate a significant difference(P<0.05) among different IAA concentrations within a plant species. The same below 图 1 2 mg·L-1 As(Ⅴ)胁迫下IAA对植物株高和生物量的影响 Figure 1 Effects of IAA on plant biomass and height under 2 mg·L-1 As(Ⅴ) stress |
在20 mg·L-1 IAA处理下,两种植物的鲜重均达最大值;在40、60 mg·L-1 IAA处理下,大叶井口边草鲜重与对照相比显著降低,而剑叶凤尾蕨在60 mg·L-1 IAA处理下与对照相比无显著变化(图 1b)。双因素方差分析结果显示,两种植物之间、生长素浓度之间对植物的生物量和株高均有极显著影响(P<0.01),两者交互作用对生物量也具有极显著影响。
2.2 IAA对植物根系形态的影响在2 mg·L-1 As(Ⅴ)胁迫下,10、20 mg·L-1 IAA显著增加了两种植物的根长和根尖数(P<0.05),且大叶井口边草的根长(图 2a)和根尖数(图 2b)显著高于剑叶凤尾蕨。在20 mg·L-1 IAA处理下,两种植物的根表面积均最大(图 2c)。双因素方差分析结果表明,两种植物之间、生长素处理浓度之间以及两者交互作用对植物根长、根尖数和根表面积具有极显著影响(P<0.01)。

|
| 图 2 2 mg·L-1 As(Ⅴ)胁迫下IAA对植物根系形态的影响 Figure 2 Effect of IAA on plant root morphology under 2 mg·L-1 As(Ⅴ) stress |
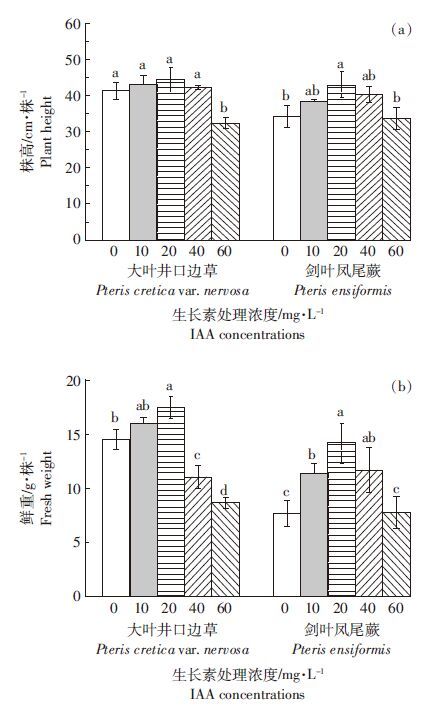
植物培养14 d后,在20 mg·L-1 IAA处理下,大叶井口边草叶片和叶柄的砷含量均显著增加,与不加IAA的对照相比存在显著差异(表 1)。在10、40 mg·L-1 IAA处理下,大叶井口边草叶柄砷含量与对照相比显著增加,但在叶片中砷含量与对照并无显著变化;剑叶凤尾蕨叶片和叶柄砷含量在20~40 mg·L-1 IAA处理下显著增加,其余IAA浓度处理则与对照无显著差异。IAA处理下,两种植物根部砷含量均未发生显著变化。
 |
在20 mg·L-1 IAA处理下,大叶井口边草叶片、叶柄和根中的砷含量分别达到215、323、408 mg·kg-1,而剑叶凤尾蕨中只分别有158、123、186 mg·kg-1。与不添加IAA的对照相比,大叶井口边草叶片和叶柄砷含量增加了29.5%和84.4%,而剑叶凤尾蕨这两个部位砷含量却增加了165.7%和182.4%。
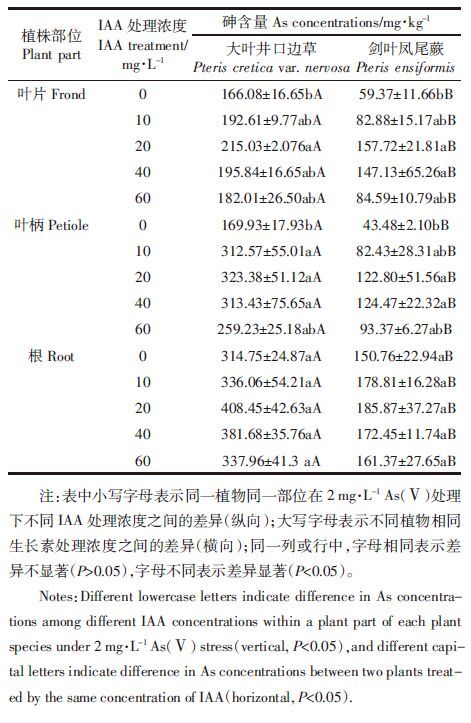
2.4 IAA对植物根系活力和根细胞质膜ATPase酶活性的影响在不同浓度IAA处理下,两种植物的根系活力与对照相比均显著增加,但大叶井口边草比剑叶凤尾蕨增加显著(图 3a,P<0.05)。
|
| 图 3 2 mg·L-1 As(Ⅴ)胁迫下IAA对植物根系活力和根细胞质膜ATPase活性的影响 Figure 3 Effects of IAA on root activities and ATPase activity in root cytoplasmic membrane of plants under 2 mg·L-1 As(Ⅴ) stress |
两种植物根中的细胞质膜ATPase活性在IAA处理下显著增加(图 3b)。在20 mg·L-1 IAA处理下,大叶井口边草根细胞质膜ATPase活性最高,而剑叶凤尾蕨则在40 mg·L-1 IAA作用下最高。在相同的IAA处理浓度下,大叶井口边草根细胞质膜ATPase活性显著高于剑叶凤尾蕨(P<0.05)。
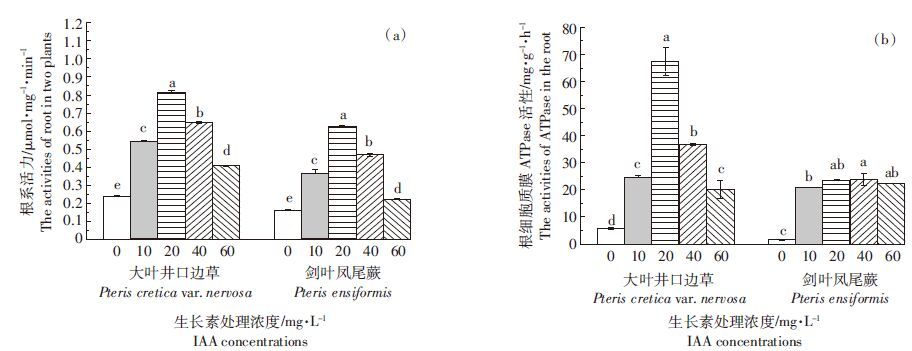
2.5 IAA对植物根系抗氧化酶活性的影响2 mg·L-1 As(Ⅴ)胁迫下,IAA处理使大叶井口边草根中的CAT和SOD活性显著增加(图 4a),但使剑叶凤尾蕨根中的CAT活性显著降低。除10 mg·L-1 IAA处理外,其余IAA浓度作用下剑叶凤尾蕨根中的SOD活性均显著增加(图 4b)。20~60 mg·L-1 IAA添加显著增加了大叶井口边草根中的POD活性,但剑叶凤尾蕨中未发生显著改变(图 4c)。从细胞膜脂过氧化产物MDA的生成情况看,在20~40 mg·L-1 IAA处理下,两种植物根中的MDA含量显著降低,但大叶井口边草降低的程度显著高于剑叶凤尾蕨(P<0.05)(图 4d)。双因素方差结果表明,两种植物之间、IAA处理浓度之间以及两者交互作用对植物根中的抗氧化酶活性和MDA含量具有显著影响(P<0.05)。
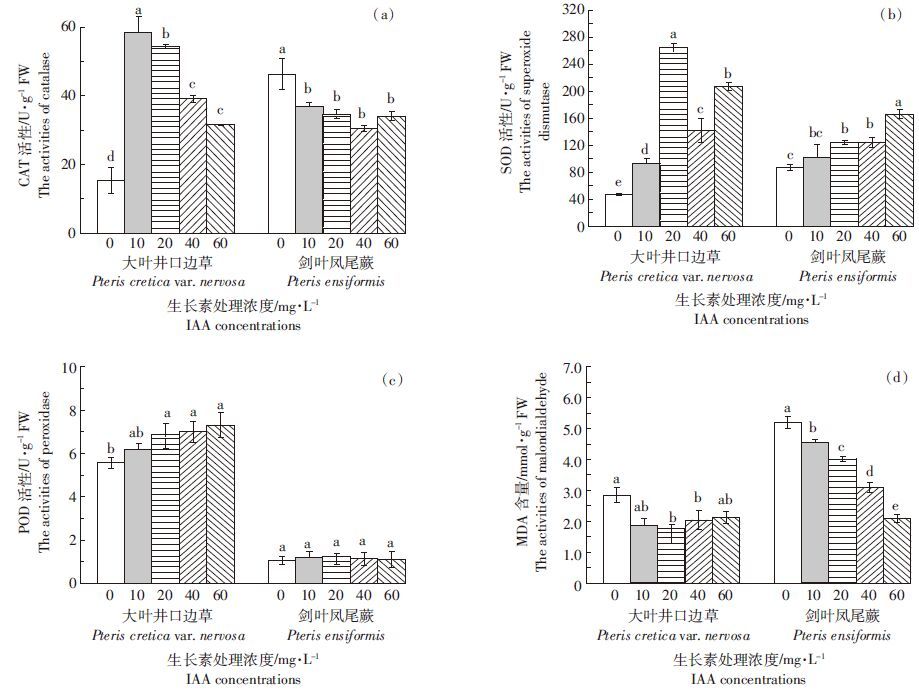
|
| 图 4 2 mg·L-1 As(Ⅴ)胁迫下IAA对植物根部抗氧化酶活性和丙二醛含量的影响 Figure 4 Effects of IAA on antioxidative enzyme activities and MDA content in roots of plants under 2 mg·L-1 As(Ⅴ) stress |
令y为植物根部砷含量,x1为生长素处理浓度、x2为根长、x3为根尖数、x4为根表面积、x5为根细胞质膜ATPase活性、x6为根系活力、x7为CAT活性、x8为SOD活性、x9为POD活性、x10为MDA含量,对两种植物分别进行多元逐步回归分析,得到大叶井口边草根中砷含量与根系活力(x6)显著正相关:y=274.495+164.626x6,P=0.004,r=0.695,F=12.179。剑叶凤尾蕨则没有变量进入方程。
3 讨论本文研究了在2 mg·L-1 As(Ⅴ)胁迫下,IAA对不同砷富集能力植物根系形态和生理指标的影响。结果表明,20 mg·L-1 IAA显著增加了两种植物的生物量(图 1b)以及叶片和叶柄的砷含量(表 1)。在20 mg·L-1 IAA处理下,两种植物的根系形态有显著改善(图 2),根系活力以及根细胞质膜ATPase活性均显著增加(图 3a、图 3b),且大叶井口边草各指标均优于剑叶凤尾蕨;20~60 mg·L-1 IAA添加显著增加了大叶井口边草根部的POD活性,但剑叶凤尾蕨中未发生显著改变(图 4c)。逐步回归分析结果显示,只有大叶井口边草根中的砷含量与其根系活力显著正相关。
有研究发现,在Pb、Zn、Cu、Cd复合污染土壤中生长的玉米(Z. mays),IAA处理显著增加了其地上部生物量,增幅为19%[4]。在本研究中,20 mg·L-1 IAA处理下,大叶井口边草和剑叶凤尾蕨的生物量均显著增加,该结果与之一致。但在60 mg·L-1 IAA作用下,两种植物的生物量显著降低,可能是高浓度的生长素抑制了植物的生长,因为植物对生长素有一定的耐受范围[23]。
重金属胁迫下,植物根系的生长通常被抑制,包括主根的生长和侧根的形成。IAA、NAA能够促进植物细胞的分裂、根的生长以及根表面积增加,以利于其吸收重金属[24]。本研究发现,20 mg·L-1 IAA 处理显著改善了两种植物的根系形态,包括根长、根尖数和根表面积。这可能是IAA促进细胞分裂、分化从而促进了植物的生长[25]。
Fässler等[26]对向日葵(Helianthus annuus)添加10-10 mol·L-1 IAA后,叶片中Pb和Zn含量显著增加。外源添加一定浓度的IAA后,植物吸收和转运了一部分IAA,进入植物体内的IAA在加强植物抵抗重金属能力的同时也提高了植物吸收重金属的能力[27]。本研究发现,20 mg·L-1 IAA均显著增加了两种植物叶片和叶柄中的砷含量,但从增加的相对数看,超富集植物叶片和叶柄砷含量只增加了29.5%和84.4%,而非超富集植物却增加了165.7%和182.4%,而两种植物根中砷含量与对照相比均无显著增加。这说明生长素有利于非超富集植物根部的砷向地上部转移。Liu等[28]研究发现,100 μmol·L-1 IAA处理下超富集东南景天(S. alfredii)生态型地上部Pb含量比对照增加了59%,而非超富集生态型地上部却增加了121.6%。究其原因:一方面可能是IAA诱导质膜上的ATPase酶活性,产生了离子跨膜运输的变化[5];另一方面可能是超富集植物对砷的富集有一阈值,超过该阈值,转运砷的速率变缓,而非超富集植物对砷的吸收尚未饱和,还有较大的提升空间。关于IAA更有利于非砷超富集植物根部砷向地上转运的机理还需进一步研究。
根系活力是植物生长的一个重要生理指标,可反映植株的生长健壮程度和抗逆能力[29]。本研究发现,不同浓度IAA处理下,两种植物的根系活力显著增加,但大叶井口边草增加的程度显著高于剑叶凤尾蕨;而在高浓度处理下两种植物的根系活力均有回落,但仍显著高于对照。田俊霞等[30]发现当IAA 浓度为200 mg·L-1时,月季(Rosa chinensis)扦插植株根系活力最大(73 μg·g-1·h-1),根系生长较好,可能是IAA促进细胞分裂和维管束的分化,形成不定根和侧根,使植物旺盛生长,从而具有较高的根系活力。
在 IAA作用下,两种植物根细胞质膜ATPase酶活性显著增加。有研究发现IAA可以激活细胞质膜上的H+-ATPase[31],使IAA的转运加快。对烟草(Nicotiana tabacum)和玉米(Z. mays)的研究发现,定位于细胞膜的ABP1蛋白通过激活膜上的H+-ATPases参与生长素对细胞伸长的促进,而H+-ATPases向胞外泵出质子,导致细胞壁的酸化松弛,从而使细胞以膨胀的方式伸长[32]。
IAA显著增加了植物一些抗氧化酶的活性,以减少重金属的毒性,如CAT活性的增加有利于清除细胞内出现的活性氧[9]。本研究中,不同浓度IAA处理使大叶井口边草根中的CAT和SOD活性显著增加,剑叶凤尾蕨在20~60 mg·L-1 IAA处理时SOD活性增加,而CAT活性则显著降低,说明大叶井口边草清除ROS的能力比剑叶凤尾蕨强。添加20~60 mg·L-1 IAA后大叶井口边草根中POD的活性显著增加。一方面,POD可以调节活性氧的水平,催化过氧化物参与的各种氧化反应[33];另一方面,POD可以分解IAA,使植物体内的IAA保持动态平衡[34]。因此,大叶井口边草根中由IAA诱导的较高的POD活性和高的根系活力可能有利于其富集更多的重金属。但是,外源IAA未改变剑叶凤尾蕨根中POD的活性。在2 mg·L-1As(Ⅴ)胁迫下,当不添加IAA时,大叶井口边草和剑叶凤尾蕨地上部生物量(叶片加叶柄干重)分别为1.17、0.57 g·株-1,地上部砷含量分别为336.01、102.85 mg·kg-1,大叶井口边草砷去除率为19.66%,剑叶凤尾蕨砷去除率仅为2.93%(假定每盆种1株)。但是,添加20 mg·L-1的IAA后,大叶井口边草和剑叶凤尾蕨地上部生物量(叶片加叶柄干重)分别增至1.57、1.03 g·株-1,其地上部砷含量也分别增至538.41、280.52 mg·kg-1,此时大叶井口边草砷去除率为42.27%,剑叶凤尾蕨也增至14.45%。与不加IAA相比,两种植物的砷去除效率分别提高了22.61%和11.52%。因此,IAA的添加使两种植物都增加了对砷的去除,但大叶井口边草增加更为明显。一般认为植物修复效率取决于植物重金属含量和生物量[35]。因此从应用的角度看,在砷污染土壤和水体的植物修复实践中,可以考虑施用合适浓度的IAA,以达到植物生物量和砷吸收量的双赢。
4 结论(1)20 mg·L-1的IAA处理使两种植物的生物量显著增加,同时,大叶井口边草根系活力、根细胞质膜ATPase酶活性以及叶片和叶柄砷含量显著增加并高于剑叶凤尾蕨。
(2)20~60 mg·L-1 IAA处理下,大叶井口边草根中的CAT、SOD和POD活性显著增加,而剑叶凤尾蕨根中的CAT活性显著降低,SOD活性显著增加,POD活性则无显著变化。20~40 mg·L-1 IAA处理下,两种植物根中的MDA含量显著降低,且大叶井口边草显著低于剑叶凤尾蕨。
(3)大叶井口边草根中砷含量与根系活力呈显著正相关,而剑叶凤尾蕨根中砷含量与各变量无关。因此,保持较高的根系活力有助于大叶井口边草超量富集砷。
致谢:衷心感谢昆明理工大学环境科学与工程学院潘波教授协助修改润色英文摘要。
| [1] | Bertin C, Yang X, Weston L A. The role of root exudates and allelochemicals in the rhizosphere[J]. Plant & Soil, 2003, 256(1):67-83. |
| [2] | 吕 剑, 喻景权. 植物激素的作用机制[J]. 植物生理学通讯, 2004, 40(5):624-628. Lü Jian, YU Jing-quan. Mechanism of auxin action[J]. Plant Physiology Communications, 2004, 40(5):624-628. |
| [3] | Han M M, Hu F, Wang K, et al. Effects of different kinds of exogenous auxin on the growth of rice roots under cadmium stress[J]. Agricultural Science & Technology-Hunan, 2010, 11(7):45- 48. |
| [4] | 周建民, 党 志, 陈能场, 等. 3-吲哚乙酸协同螯合剂强化植物提取重金属的研究[J]. 环境科学, 2007, 28(9):2085-2088. ZHOU Jian-min, DANG Zhi, CHEN Neng-chang, et al. Ehanced phytoextraction of heavy metal contaminated soil by chelating agents and auxin indole-3-acetic acid[J]. Environmental Science, 2007, 28(9):2085-2088. |
| [5] | Altabella T, Chrispeels M J. Tobacco plants transformed with the bean alphaai gene express an inhibitor of insect alpha-amylase in their seeds[J]. Plant Physiology, 1990, 93(2):805-810. |
| [6] | Hu Y F, Zhou G, Na X F, et al. Cadmium interferes with maintenance of auxin homeostasis in Arabidopsis seedlings[J]. Journal of Plant Physiology, 2013, 170(11):965-975. |
| [7] | Kanwar M K, Bhardwaj R, Arora P, et al. Plant steroid hormones produced under Ni stress are involved in the regulation of metal uptake and oxidative stress in Brassica juncea L.[J]. Chemosphere, 2012, 86(1):41-49. |
| [8] | Ranieri A, Castagna A, Scebba F, et al. Oxidative stress and phytochelatin characterisation in bread wheat exposed to cadmium excess[J]. Plant Physiology and Biochemistry, 2005, 43(1):45-54. |
| [9] | 胡拥军, 王海娟, 王宏镔, 等. 砷胁迫下不同砷富集能力植物内源生长素与抗氧化酶的关系[J]. 生态学报, 2015, 35(10):3214-3224. HU Yong-jun, WANG Hai-juan, WANG Hong-bin, et al. The relationship between endogenous auxin and antioxidative enzymes in two plants with different arsenic-accumulative ability under arsenic stress[J]. Acta Ecologica Sinica, 2015, 35(10):3214-3224. |
| [10] | 向言词, 官春云, 黄 璜, 等. 3-吲哚乙酸和水杨酸对芥菜型油菜耐受/积累铅的影响[J]. 湖南科技大学学报:自然科学版, 2008, 23(4):103-106. XIANG Yan-ci, GUAN Chun-yun, HUANG Huang, et al. The effect of indole-3-acetic acid and salicylic acid on tolerance and accumulation for lead in seedlings of Brassica juncea[J]. Journal of Hunan University of Science and Technology(Natural Science Edition), 2008, 23(4):103-106. |
| [11] | Beffa R, Martin H V, Pilet P E. In vitro oxidation of indoleacetic acid by soluble auxin-oxidases and peroxidases from maize roots[J]. Plant Physiology, 1990, 94(2):485-491. |
| [12] | Srivastava M, Ma L Q, Singh N, et al. Antioxidant responses of hyper-accumulator and sensitive fern species to arsenic[J]. Journal of Experimental Botany, 2005, 56(415):1335-1342. |
| [13] | Forino L M C, Castiglione M R, Bartoli G, et al. Arsenic-induced morphogenic response in roots of arsenic hyperaccumulator fern Pteris vittata[J]. Journal of Hazardous Materials, 2012, 235/236(20):271-278. |
| [14] | 韦朝阳, 陈同斌, 黄泽春, 等. 大叶井口边草:一种新发现的富集砷的植物[J]. 生态学报, 2002, 22(5):777-778. WEI Chao-yang, CHEN Tong-bin, HUANG Ze-chun, et al. Cretan brake(Pteris cretica L.):An arsenic-accumulating plant[J]. Acta Ecologica Sinica, 2002, 22(5):777-778. |
| [15] | Robinson B H, Lombi E, Zhao F J, et al. Uptake and distribution of nickel and other metals in the hyperaccumulator Berkheya coddii[J]. New Phytologist, 2003, 158(2):279-285. |
| [16] | Tu C, Ma L Q, Zhang W, et al. Arsenic species and leachability in the fronds of the hyperaccumulator Chinese brake(Pteris vittata L.)[J]. Environmental Pollution, 2003, 124(2):223-230. |
| [17] | 张中峰, 张金池, 黄玉清, 等. 水分胁迫和接种菌根真菌对青冈栎根系形态的影响[J]. 生态学杂志, 2015, 5(5):1198-1204. ZHANG Zhong-feng, ZHANG Jin-chi, HUANG Yu-qing, et al. Effects of water stress and mycorrhizal fungi on root morphology of Cyclobalanopsis glauca seedlings[J]. Chinese Journal of Ecology, 2015, 5(5):1198-1204. |
| [18] | 张志良. 植物生理学实验指导[M]. 三版. 北京:高等教育出版社, 1990:34, 123. ZHANG Zhi-liang. Plant physiology experiment guidance[M]. Third edition. Beijing:Higher Education Press, 1990:34, 123. |
| [19] | 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社, 2006:66-68. GAO Jun-feng. Plant physiology experiment guidance[M]. Beijing:Higher Education Press, 2006:66-68. |
| [20] | Aebi H. Catalase in vitro[J]. Methods in Enzymology, 1984, 105:121-126. |
| [21] | Durak I, Yurtarslanl Z, Canbolat O, et al. A methodological approach to superoxide dismutase(SOD) activity assay based on inhibition of nitroblue tetrazolium(NBT) reduction[J]. Clinica Chimica Acta, 1993, 214(1):103-104. |
| [22] | Liao J H, Li J M, Li Y F, et al. Analysis for measuring peroxidase activity in wheat seeds[J]. Research on Crops, 2014, 15(2):352-357. |
| [23] | Salisbury F B, Ross C W. Plant physiology[M]. Belmont, California:Wadsworth Publishing Company, 1992. |
| [24] | Magidin M, Pittman J K, Hirschi K D, et al. ILR2, a novel gene regulating IAA conjugate sensitivity and metal transport in Arabidopsis thaliana[J]. Plant Journal, 2003, 35(4):523-534. |
| [25] | Xiang D F, Harberd N P. Auxin promotes Arabidopsis root growth by modulating gibberellin response[J]. Nature, 2003, 421(6924):740-743. |
| [26] | Fässler E, Evangelou M W, Robinson B H, et al. Effects of indole-3-acetic acid(IAA) on sunflower growth and heavy metal uptake in combination with ethylene diamine disuccinic acid(EDDS)[J]. Chemosphere, 2010, 80(8):901-907. |
| [27] | Ouzounidou G, Ilias I. Hormone-induced protection of sunflower photosynthetic apparatus against copper toxicity[J]. Biologia Plantarum, 2005, 49(2):223-228. |
| [28] | Liu D, Li T, Yang X, et al. Enhancement of lead uptake by hyper-accumulator plant species Sedum alfredii Hance using EDTA and IAA[J]. Bulletin of Environmental Contamination and Toxicology, 2007, 78(3):280-283. |
| [29] | 王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 三版. 北京:高等教育出版社, 2015:123-124. WANG Xue-kui, HUANG Jian-liang. Plant physiological and biochemical experiment principle and technology[M]. Third edition. Beijing:Higher Education Press, 2015:123-124. |
| [30] | 田俊霞, 陈小玲, 王 威, 等. 不同浓度IAA 和水杨酸对月季水生根系诱导的影响[J]. 现代园艺, 2015, 9:16-19. TIAN Jun-xia, CHEN Xiao-ling, WANG wei, et al. The influence of different concentrations of IAA and salicylic acid on Rosa chinensis Jacq root induction[J]. Modern Gardening, 2015, 9:16-19. |
| [31] | Altabella T, Palazon J, Ibarz E, et al. Effect of auxin concentration and growth phase on the plasma membrane H+-ATPase of tobacco calli[J]. Plant Science, 1990, 70(90):209-214. |
| [32] | 张新蕊. 生长素和赤霉素参与调节低磷胁迫下玉米根系形态的改变[D]. 济南:山东大学, 2011:15-16. ZHANG Xin-rui. Auxin and gibberellins involved in the changes of maize root morphology during phosphorous starvation[D]. Jinan:Shandong University, 2011:15-16. |
| [33] | Verma S, Dubey R S. Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants[J]. Plant Science, 2003, 164(4):645-655. |
| [34] | Gazaryan I, Lagrimini L, Ashby G, et al. Mechanism of indole-3-acetic acid oxidation by plant peroxidases:Anaerobic stopped-flow spectrophotometric studies on horseradish and tobacco peroxidases[J]. Biochemical Journal, 1996, 313:841-847. |
| [35] | Blaylock M J, Salt D E, Dushenkov S, et al. Enhanced accumulation of Pb in Indian mustard by soil-applied chelating agents[J]. Environmental Science & Technology, 1997, 31(31):860-865. |
 2016, Vol. 35
2016, Vol. 35