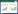文章信息
- 范小欢, 单振华, 杨腾飞, 严静娜, 任源
- FAN Xiao-huan, SHAN Zhen-hua, YANG Teng-fei, YAN Jing-na, REN Yuan
- 土壤的老化对PCB138的可提取性和生物可利用性的影响
- Effect of aging on extractability and bioavailability of PCB138 in soils
- 农业环境科学学报, 2016, 35(5): 919-925
- Journal of Agro-Environment Science, 2016, 35(5): 919-925
- http://dx.doi.org/10.11654/jaes.2016.05.015
-
文章历史
- 收稿日期: 2015-11-03
2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006, China
持久性有机污染物多氯联苯(Polychlorinated biphenyls,PCBs)作为斯德哥摩公约中优先控制的12种POPs之一,从一氯联苯到十氯联苯共有209种同系物。由于电容器、变压器的不当封存、拆解等原因,PCBs可能通过大气、水等途径进入土壤环境,对人居环境、农产品及生态系统的安全构成严重威胁。高军等[1]对长江三角洲PCBs典型污染区调查发现,农田土壤中PCBs平均含量为30.6 ng·g-1,最高含量为484.5 ng·g-1,其中以四至六氯代PCBs为主,大约占到60%以上,且主要存在于0~15 cm的表层土壤。屈伟月[2]测试了中国最大的电子垃圾拆解区(汕头贵屿)工人和附近居民(汕头濠江)血液样品中PCBs的含量和分布,发现PCBs在拆解区工人、附近居民样品中的含量差别不大,中值分别为90.7、66.5 ng·g-1 LW(LW为脂重,lipid weight),主要同系物为PCB138和PCB153。有研究发现当多氯联苯进入土壤后,一些“新鲜”PCBs较易被土壤中的微生物所降解[3],但是随着与土壤接触时间的延长,PCBs易被土壤强烈吸附,以结合态、可解吸态、游离态3种形态存在[4],其生物可利用性降低,因而老龄PCBs难以被微生物降解。目前认为土壤中结合态污染物不会引起生物毒性效应,仅游离态和可解吸态组分会对生物体产生毒性效应,用总浓度进行风险评估通常导致对风险的高估,因此开展有关土壤中 PCBs生物有效态研究具有重要意义。
目前,国内外对通过化学提取和生物吸收评价土壤中持久性污染物的生物有效性进行了不少研究,目标污染物主要集中于多环芳烃、农药等。郭丽清等[5]研究发现,有机氯与土壤的结合程度与土壤老化时间关系密切,正己烷可作为反映土壤中有机氯生物有效性的化学提取剂。菲在土壤中老化90 d后,其提取率可由0 d的82%下降到150 d的65%[6]。Kottler等[7]在研究中发现,在污染物加入前对土壤进行干湿交替处理,未老化菲的可提取性明显增加,但是在污染物加入土壤后,同样操作下菲的可提取性下降。研究发现,微生物将土壤中多环芳烃降解后,蚯蚓仍能富集土壤中残留的多环芳烃,显示蚯蚓与微生物对污染物的利用性存在较大差异[8, 9, 10],因而选用合适的生物种类对于评价生物有效性至关重要。蚯蚓是评估土壤中污染物生物有效性的敏感指示生物。Peters等[11]研究表明赤子爱胜蚓(Eisenia fetida)在土壤中蓄积p,p′-DDE的能力是陆正蚓(Lumbricus terrestris)的6倍,在堆肥中E. fetida蓄积p,p′-DDE的能力是L.terrestris的3倍。因此,许多研究将蚯蚓体内富集的污染物浓度与用各种提取方法得到的相应浓度作比较,来评价土壤中污染物的生物有效性[12]。
前期研究中,我们发现广东清远地区电子垃圾拆解地的PCBs含量在0.36~13.16 μg·g-1之间,处于浅层(0~40 cm)区域,PCBs浓度随着深度的增加而降低,PCBs以三至七氯PCBs为主,占PCBs总量的70%左右,土层深处以低氯代PCBs为主,表层土以高氯代PCBs为主[13]。由于该地区从事电子垃圾拆解已有近40年历史,而且拆解业在今后一段时间内仍将是当地的重要经济来源,所以污染物也会持续排放。为考察土壤中已有PCBs的生物有效性,本研究选择六氯的PCB138为目标污染物,研究土壤中PCBs的化学提取量与蚯蚓体内蓄积量随时间的动态变化进程,期望能为土壤PCBs风险评价与生物修复提供基础数据。
1 材料与方法 1.1 药品与仪器PCB138(2,2′,3,4,4′,5′-六氯联苯)购自北京百灵威试剂有限公司,纯度为99.7%,用色谱纯正己烷配成100 mg·L-1的标准溶液;赤子爱胜蚓E. fetida购于广东清颐养殖场;提取实验所需正己烷、二氯甲烷等有机溶剂为色谱纯,正丁醇、丙酮等有机溶剂为分析纯,均购自上海安谱有限公司;无水硫酸钠为分析纯,经105 ℃烘烤12 h后置于干燥器中备用;弗罗里硅土(60~100目)为色谱纯;中性硅胶(100~200目)经225 ℃烘干12 h,加3%的水,在干燥器中平衡12 h,加入正己烷浸泡若干小时后备用;酸性硅胶用中性硅胶按44%(W/W)加入浓硫酸制备,加入时振荡,防止板结,置于干燥器中备用。
灭菌锅(SYQ.DSX-280B)购自上海申安医疗器械厂;台式恒温振荡器(THZ-D)购自太仓市实验设备厂;旋涡混合器(XW-80A)和电子天平(JA1003N)购自上海精密科技有限公司;超声清洗机(9B5200DT)购自宁波新芝生物科技有限公司;离心机(GL-20G-C)购自上海安亭有限公司;旋转蒸发器(RE-52AA)购自上海荣亚有限公司。
1.2 土壤样品的制备土壤样品取自广州市大学城华南理工大学,混匀研磨后过2 mm筛,去除石块、植物根茎以及其他较大的颗粒物,保存于自封袋中。供试土壤于华南农业大学环境科学与工程研究室测定,其土样基本理化性质如表 1所示。
蚯蚓在室温、黑暗条件下于实验室培养箱供试土壤内培养两周,保持土壤含水量为田间持水量70%,培养期间每隔5 d喂养一次西瓜皮、香蕉等易腐烂瓜果的果皮。经测定,喂养蚯蚓所使用的食物中不含PCB138污染物。两周后,挑选出具有成熟环带的蚯蚓进行试验,平均体重为0.40~0.60 g。
1.4 PCB138的添加及老化所有供试土壤事先均用高压蒸汽连续处理3 d,每次30 min,以排除细菌对污染物老化过程的影响。用微量进样针向每份土壤中滴加100 mg·L-1的PCB138储备液,混匀,使PCB138浓度分别为10、30、50 mg·kg-1。每个浓度均设置3个平行,置于风橱中挥发溶剂,待溶剂挥发完毕,将土壤装入无菌广口瓶中,补充水分至70%,加封口膜在25 ℃恒温箱避光老化,分别在第1、15、30、45、60、90 d取样分析。
1.5 老化土壤中PCB138的提取使用超纯水、正丁醇溶液为提取剂提取土壤中PCB138,并与超声提取法(1∶1的正己烷/丙酮为溶剂)和索氏提取法(1∶1的正己烷/二氯甲烷为溶剂)比较,所有样品萃取后经浓缩、净化、定容至l mL,测定前过0.45 μm有机滤膜。具体方法如下: (1)超纯水提取:取约1 g土样于50 mL离心管中,用移液管加入10 mL超纯水,用铝箔封口后加盖,20 ℃恒温振荡24 h,于3500 r·min-1下离心20 min,静置数分钟,吸取l mL上清液,重复3次操作,合并3次上清液移入分液漏斗中,再加入丙酮/正己烷(1∶1混合)6 mL,充分摇匀5 min,移入分液漏斗中,摇1 min,开盖放气,再充分振荡5min,加入几滴饱和硫酸钠溶液(破乳),静置15~20 min待分层,用胶头滴管吸取上层有机相,移入100 mL梨形瓶中。重复该步骤3次,并合并3次萃取液。
(2)正丁醇溶液提取:取约1 g土样于50 mL离心管中,用移液管加入10 mL正丁醇溶液,用铝箔封口后加盖,恒温振荡24 h,于3500 r·min-1下离心20 min,静止数分钟,吸取l mL上清液。重复3次操作并合并3次萃取液。
(3)超声提取:取约1 g土样于50 mL离心管中,用移液管加入10 mL正己烷/丙酮溶液,用铝箔封口后加盖,用封口膜封口,用四维旋转混合器旋转振荡过夜,超声25 min,离心15 min,重复3次,并将3次萃取液收集于鸡心瓶,然后进行净化浓缩,氮吹仪上用氮气吹至近干,加入正己烷。
(4)索氏提取:取约1 g土样于滤纸包中,加入0.3 g左右灼烧过的无水硫酸钠,封口,索提管中加入90 mL 1∶1正己烷/二氯甲烷溶液,于65 ℃下提取12 h左右,补加10 mL正己烷/二氯甲烷溶液,继续提取12 h,提取完毕后,先使用旋转蒸发仪将溶液体积浓缩至3~5 mL,剩余溶液转移至容量瓶,氮吹仪上用氮气吹至近干。
1.6 蚯蚓体内富集PCB138实验与样品提取取一定量的100 mg·L-1 PCB138正己烷溶液,用微量进样针加入到每份10 g(过0.25 mm 筛,烘干)土壤中充分搅拌,待正己烷全部挥发后,将其转移至装有190 g土壤的烧杯中搅拌混匀,使每份土壤中PCB138浓度分别为1、10、30、50 mg·kg-1(每个浓度设置3个平行)。挑选大小、年龄相近,单一质量为0.40~0.60 g的蚯蚓600条,分别加入到不同浓度PCB138的土壤烧杯中,每杯土壤里放入10条蚯蚓,用铝箔封口,并在铝箔上打孔数个,以保持土壤中的有氧环境,调节土壤含水量为田间持水量70%,于20~23 ℃的恒温箱里培养,在第5、15、30、45、60 d将蚯蚓从对应浓度土壤中取出,8条用于测定PCB138含量,2条用于测定脂肪含量。
1.6.1 蚯蚓体内PCB138的富集提取用无菌水冲洗除去蚯蚓表面的土壤和附着物,将蚯蚓放入底部垫有湿润滤纸的培养皿中48 h,使蚯蚓排出体内的代谢物,冷冻干燥后称量蚯蚓的干重,后将蚯蚓放在-20 ℃下保存备测。提取时称取一定量的蚯蚓放入研钵,同时加入等量石英砂和10.0 g烘干的无水硫酸钠,充分混合和研磨后,把磨碎的样品一起转移到50 mL离心管中,加入正己烷/丙酮(1∶1)作为提取剂,按照土壤样品超声提取的方法进行提取、浓缩、净化和测定[14]。
1.6.2 蚯蚓脂肪含量的分析测定将冷冻干燥的蚯蚓与3倍重量的石英砂和5 g无水硫酸钠混合充分后研磨,加入10 mL丙酮/二氯甲烷作为助溶剂超声降解1 min,平衡离心4 h后回收悬浮液,重复前两步,并合并悬浮液,加入5 mL水去除蛋白质,提取物50 ℃烘干后称重计量[15]。
1.7 土壤中和蚯蚓体内PCB138的分析PCB138用气相色谱法检测,色谱条件:CD-5MS色谱柱;载气(He)流量1.0 mL·min-1(恒流);脉冲不分流进样;进样口温度280 ℃;柱箱程序升温为50 ℃保持2 min,以15 ℃·min-1升至280 ℃并保持5 min;以10 ℃·min-1升至290 ℃并保持5 min;离子源温度230 ℃;质量扫描范围50~650 amu;溶剂延迟4 min;进样量2 μL。PCB138的含量采用外标法测定,将测定结果换算为单位质量土壤、蚯蚓中PCBs浓度[13]。
1.8 数据分析与质量控制在样品分析过程中进行空白样、平行样以及加标回收率的测定。在土壤和蚯蚓样品中分别添加PCB209作为替代物,采用1.7节的方法测定土壤和蚯蚓样品中PCB138的回收率,指示物PCB209 回收率在85%~110% 之间,RSD在1.0%~2.5% 之间。土壤和蚯蚓中的PCB138浓度用干重表示,所有数据用Excel 2013和SPSS 13.0 软件进行统计分析。PCBs提取率(%)=C0/C1(其中C0为污染物的提取量,mg·kg-1;C1为污染物添加量,mg·kg-1)。
2 结果与讨论 2.1 土壤老化时间对PCB138 提取率的影响如图 1所示,4种提取方法对PCB138的提取能力相差很大,在所有取样时间点对PCBs的提取量均有显著差异。图 1a为超纯水的提取结果,由于PCB138的lgKow =7.22,在水中的提取量十分有限,显示出最低的提取能力而且是非重复性的结果,随着老化时间的延长,可提取量下降甚至低于检出限。说明PCB138在土壤中随水的迁移量、生物可利用性均可忽略。图 1b中,正丁醇的提取率在0~45 d内不断降低,60 d之后趋于稳定,90 d后,在PCB138含量为10、30、50 mg·kg-1的老化土壤中提取率分别从最初的58%、62%和48%下降到45%、22%和34%。这是因为随着老化时间的延长,PCB138与土壤结合时间增加,进入土壤孔隙的量增多,与土壤中的腐植酸结合更为紧密,被温和溶剂提取的能力显著降低,被土壤生物利用的能力也显著降低[17]。

|
| 图 1 不同老化时段超纯水、正丁醇、索氏抽提、超声提取对不同浓度PCB138的提取率 Figure 1 Time-dependence of PCB138 extractability by ultra-pure water,n-butanol,soxhlet,and ultrasonic(US) extraction |
索氏提取法经过加热回流等过程,是最强烈的提取法,所以其提取率最高。索氏法对PCB138的提取率(图 1c)在0~15 d内可提取量迅速降低,在45 d左右提取率逐渐稳定,趋于平衡。这可能是由于PCB138具有疏水性,在零时间即在各个土壤有机组分中进行了快速的相间分配,在很短的时间内就己经完成快速吸附,其后就进入了慢速过程而趋于平衡,有机污染物在土壤中会形成不可提取的“结合残留态”(用极性与非极性的有机溶剂在剧烈萃取条件下都不能提取的部分)。Macleod[18]等发现随着多环芳烃与土壤接触时间的延长,其可提取态部分减少,土壤中检测出多环芳烃的结合残留态,且该部分随着时间的延长而增加,而且受土壤类型、环境因素以及生物活动的影响非常大。
超声提取(图 1d)对PCB138的提取率与索氏提取很接近,分别从最初的85%~90%、87%~93%下降到65%~73%、70%~76%。分析认为,这几种提取剂的极性从小到大为正己烷/二氯甲烷≈丙酮/正己烷<正丁醇,而PCB138是典型的非极性污染物,所以丙酮/正己烷超声提取、正己烷/二氯甲烷索氏提取对PCB138的提取率高于正丁醇。Northcott等[16]比较了使用正丁醇、索氏提取两种方法提取土壤中的菲、芘及苯并(a)芘,发现正丁醇提取法是一种强烈的提取法,所提取含量有时会高于索氏提取法,最高提取率达99.3%。这可能与土壤中可溶性有机碳、矿物成份、软硬碳、土壤颗粒物粒径、污染物性质有关,本实验土壤粒经小于0.05 mm的颗粒物占55%以上,随着老化时间的延长,PCB138进入土壤微孔后难以被比索氏提取剂温和的正丁醇提取出来,而且土壤微孔结构越多,PCB138被土壤固定量就越大。
以上实验结果显示,老化过程显著改变了土壤中PCB138的赋存状态,随着老化时间的延长,PCB138与土壤中有机质结合更紧密,因此无论是温和的溶剂还是强烈的提取剂,其提取能力都随老化时间延长出现不同程度的下降,导致污染物解吸能力以及其生物可利用性下降,即使是体积微小的微生物也对其无法利用[19, 20]。
2.2 蚯蚓对PCB138的富集如图 2所示,在所设置的PCB138含量下,蚯蚓在5 d内对PCB138的积累量较少,因为多数的污染物在5 d内依然被土壤吸附,蚯蚓仅能利用那些弱吸附在土壤固体表面和溶解在间隙水中的化合物;而在10~30 d的积累时间内,在高浓度PCB138的土壤中,蚯蚓体内富集量快速增加,说明蚯蚓能利用一些结合态的PCB138;在30 d左右,各浓度下的蚯蚓体内PCB138的含量都达到峰值,尤其是在50 mg·kg-1土壤中,蚯蚓体内的PCB138富集量高达123 μg·kg-1;老化30~60 d时,在中高浓度PCB138的老化土壤中,蚯蚓体内PCB138富集量有下降的趋势,很可能是因为随着老化时间的延长,蚯蚓与其周围土壤中的PCBs达到分配平衡后,同时也在不断地进行着生物转化和净化作用,会解吸部分PCB138,从而使PCB138生物可利用性下降。在高浓度PCB138的老化土壤中,60 d内蚯蚓没有死亡,是因为PCBs是一种慢性致死物质,蚯蚓体内的污染物,一部分进入贮存组织,一部分进入蚯蚓体内的毒性作用位点,当蚯蚓体内毒性作用位点的PCBs的量低于引起毒性作用的阈值时,不足以对蚯蚓产生毒性作用。

|
| 图 2 不同的老化时间蚯蚓体内PCB138的富集量 Figure 2 Variation of PCB138 content in earthworm tissue in soil at different PCB concentrations |
当蚯蚓对PCBs的吸收过程与消除过程达到动态平衡时,蚯蚓体内的PCBs含量即为理论最大平衡浓度。我们常以近平衡状态下的富集量与理论最大平衡浓度相比作为有效态浓度用于生物有效性的评估。有研究者以L.terrestris为模式生物的研究[21, 22, 23]表明,对于PCB101、PCB118、PCB138和PCB153,其在培养15 d时的富集量能够达到平衡状态最大平衡浓度的80%~90%,15 d的富集可作为整个动力学过程的近平衡状态。Krauss等[24]曾将蚯蚓暴露于受PCBs和PAHs污染的土壤中15 d,发现经过15 d的暴露,污染物在蚯蚓体内基本达到平衡状态。本研究分别以第5、15、30、45、60 d的蚯蚓富集量与理论最大平衡浓度相比较,发现蚯蚓对PCB138的富集量在15 d内能够达到理论最大平衡浓度的80%以上,15 d的富集可作为整个动力学过程的近平衡状态。这与前人有关部分PCBs、酞酸酯等疏水性有机污染物的近平衡状态估算相一致[21, 23, 24, 25]。
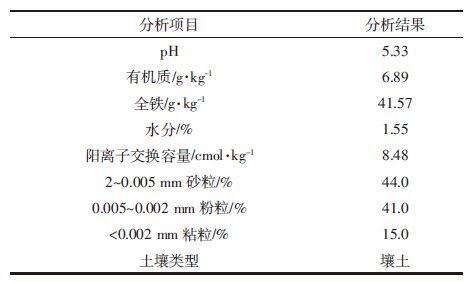
2.3 蚯蚓脂肪含量以及脂肪内PCB138的含量经60 d培养后,蚯蚓体内脂肪含量如图 3所示。和空白对照组相比,无论在高浓度(50 mg·kg-1)污染物设置组,还是在低浓度(1 mg·kg-1)污染物设置组中,蚯蚓的脂肪含量均有所下降但不明显,说明蚯蚓的部分生理活动基本维持不变。一般来说,蚯蚓富集土壤中化合物的途径主要有两种:一种经过简单的扩散作用,化合物通过蚯蚓表皮进入体内;另外一种是蚯蚓摄食时将吸附着化合物的土壤一起摄取,化合物由此进入蚯蚓体内并富集在蚯蚓脂肪中[26, 27],蚯蚓对化合物的被动吸收主要是针对那些溶解在间隙水中或者被弱吸附在土壤固体表面的化合物。
|
| 图 3 不同老化时间蚯蚓的脂肪含量 Figure 3 Fat content in earthworm tissue in soil at various PCB concentrations |
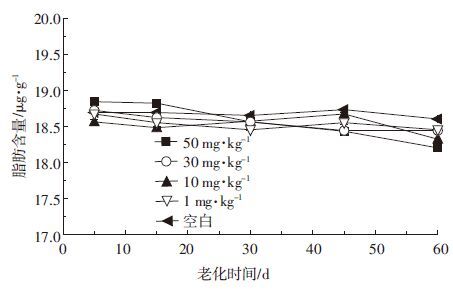
图 4为蚯蚓体内脂肪中PCB138的积累量。在30 d左右,当土壤中PCB138浓度为50 mg·kg-1时,蚯蚓脂肪内的PCB138富集量达到峰值790 μg·kg-1;在老化30~60 d后,其中PCB138的含量有下降的趋势。这很可能是因为随着老化时间的延长,蚯蚓与其周围土壤中的PCBs达到分配平衡后,同时也在不断进行着生物转化和净化作用,在老化过程中,越来越多的PCB138从土壤中容易解吸或具有生物有效性的结合点位迁移到不容易解吸或有效性低下的点位,甚至进入蚯蚓不可接触的区域,致使其生物可利用性下降。
|
| 图 4 不同老化时间蚯蚓的脂肪内PCB138含量 Figure 4 Content of PCB138 in earthworm fat in soil at various PCB concentrations |
(1)PCB138在土壤中的可提取率随着老化时间的延长逐渐降低,并呈现先快后慢的趋势,表明长时间的老化使PCB138的生物可利用性下降。
(2)蚯蚓体内PCB138富集量在10~30 d快速增加,30~60 d后有下降的趋势,表明多氯联苯与土壤颗粒接触时间越长,其生物有效性越低。
| [1] | 高 军. 长江三角洲典型污染农田土壤多氯联苯分布、微生物效应和生物修复研究[D]. 杭州:浙江大学, 2005. GAO Jun. Distribution, microbial effects and bioremediation of PCBs in typical polluted agricultural soils in the Yangtze River delta[D]. Hangzhou:Zhejiang University, 2005. |
| [2] | 屈伟月. 广东省特殊人群血液和母乳中多溴联苯醚、有机氯农药和多氯联苯的初步研究[D]. 广州:中国科学院研究生院(广州地球化学研究所), 2007. QU Wei-yue. Preliminary study of polybrominated diphenyl ethers, oranochlorine pesticides and polybrominated biphenyls in human blood and milk of special populations from Guangdong Province[D]. Guangzhou:Chinese Academy of Sciences(Guangzhou Institute of Geochemistry), 2007. |
| [3] | Wong F, Bidleman T F. Aging of organochlorine pesticides and polychlorinated biphenyls in muck soil:Volatilization, bioaccessibility, and degradation[J]. Environmental Science & Technology, 2011, 45(3):958-963. |
| [4] | Cvancarova M, Cajthaml T. Methods for determination of bioaccessibility and bioavailability of hydrophobic organic pollutants[J]. Chemicke Listy, 2015, 109(4):254-268. |
| [5] | 郭丽青, 巨天珍, 陶 澍. 土壤中不同老化时间的DDT对小麦根系的生物有效性[J]. 土壤与环境, 2002, 11(4):335-338. GUO Li-qing, JU Tian-zhen, TAO Shu. Bioavailability of DDT for wheat root dependent on soil aging time[J]. Soil and Environmental Sciences, 2002, 11(4):335-338. |
| [6] | Ma L L, Zhang J, Han L S. The effects of aging time on the fraction distribution and bioavailability of PAH[J]. Chemosphere, 2012, 86(22):1072-1078. |
| [7] | Kottler B D, Alexander M. Relationship of properties of polycyclic aromatic hydrocarbons to sequestration in soil[J]. Environmental Pollution, 2001, 113(3):293-298. |
| [8] | Tang J X, Carroquino M J, Robertson B K, et al. Combined effect of sequestration and bioremediation in reducing the bioavailability of polycyclic aromatic hydrocarbons in soil[J]. Environmental Science & Technology, 1998, 32(22):3586-3590. |
| [9] | McKelvie J R, Wolfe D M, Celejewski M. Correlations of Eisenia fetida metabolic responses to extractable phenanthrene concentrations through time[J]. Environmental Pollution, 2010, 158(6):2150-2157. |
| [10] | Kelsey J W, Kottler B D, Alexander M. Selective chemical extractants to predict bioavailability of soil-aged organic chemicals[J]. Environmental Science & Technology, 1996, 31(1):214-217. |
| [11] | Peters R, Kelsey J W, White J C. Differences in p, p'-DDE bioaccumulation from compost and soil by the plants Cucurbita pepo and Cucurbita maxima and the earthworms Eisenia fetida and Lumbricus terrestris[J]. Environmental Pollution, 2007, 148(2):539-545. |
| [12] | Liste H H, Alexander M. Butanol extraction to predict bioavailability of PAHs in soil[J]. Chemosphere, 2002, 46(7):1011-1017. |
| [13] | 林娜娜. 电子垃圾拆解区底泥中重金属和多氯联苯的污染及其厌氧修复[D]. 广州:华南理工大学, 2015. LIN Na-na. Pollution of heavy metals and PCBs and their anaerobic repair in sediments of e-waste dismantling area[D]. Guangzhou:South China University of Technology, 2015. |
| [14] | 王静婷, 谷成刚, 叶 茂, 等. 土壤中多氯联苯的生物有效性及其影响机制研究[J]. 土壤, 2015, 47(1):80-86. WANG Jing-ting, GU Cheng-gang, YE Mao, et al. Study on bioavailability and influential mechanism of polychlorinated biphenyls in soil[J]. Soils, 2015, 47(1):80-86. |
| [15] | Qi Y C, Chen W. Comparison of earthworm bioaccumulation between readily desorbable and desorption-resistant naphthalene:Implications for biouptake routes[J]. Environmental Science & Technology, 2010, 44(1):323-328. |
| [16] | Northcott G L, Jones K C. Partitioning, extractability, and formation of nonextractable PAH residues in Soil.1. Compound differences in aging and sequestration[J]. Environmental Science & Technology, 2001, 35(6):1103-1110. |
| [17] | Alexander M. Aging, bioavailability overestimation of risk from environmental pollutants[J]. Environmental Science & Technology, 2000, 34(20):4259-4265. |
| [18] | Macleod C J A, Semple K T. Sequential extraction of low concentrations of pyrene and formation of non-extractable residues in sterile and non-sterile soils[J]. Soil Biology Biochemistry, 2003, 35(11):1443-1450. |
| [19] | Mohamad I, Lorenz W. Persistant organic pollutants(POPs) in agricultural soils of Syrian Mediterranean region:A preliminary study[J]. Fresenius Environmental Bulletin, 2009, 18(5B):897-899. |
| [20] | Site A D. Factors affecting sorption of organic compounds in natural sorbent/water systems and sorption coefficients for selected pollutants:A review[J]. Journal of Physical and Chemical Reference Data, 2001, 30(1). |
| [21] | Cachada A, Pereira R, Ferreira da Silva E. The prediction of PAHs bioavailability in soils using chemical methods:State of the art and future challenges[J]. Science of the Total Environmental, 2014, 472:463-480. |
| [22] | Zhao S Y, Zhu L Y, Liu L. Bioaccumulation of perfluoroalkyl carboxylates(PFCAs) and perfluoroalkane sulfonates(PFSAs) by earthworms(Eisenia fetida) in soil[J]. Environmental Pollution, 2013, 179:45-52. |
| [23] | Shang H T, Wang P, Wang T. Bioaccumulation of PCDD/Fs, PCBs and PBDEs by earthworms in field soils of an e-waste dismantling area in China[J]. Enviroment International, 2013, 54(3):50-58. |
| [24] | Krauss M, Wilcke W, Zech W. Availability of polycyclic aromatic hydrocarbons(PAHs) and polychlorinated biphenyls(PCBs) to earthworms in urban soil[J]. Environmental Science & Technology, 2000, 34(20):4335-4340. |
| [25] | Katayama A, Bhula R, Burns G R. Bioavailability of xenobiotics in the soil environment[J]. Reviews of Environmental Contamination and Toxicology, 2010, 203:1-86. |
| [26] | 史志明, 徐 莉, 胡 锋, 等. 蚯蚓蓄积疏水性有机污染物的过程及预测模型[J]. 土壤学报, 2014, 51(1):1-10. SHI Zhi-ming, Xu Li, HU Feng, et al. Processes of earthworm accumulation of hydrophobic organic pollutants and their prediction models[J]. Acta Pedologica Sinica, 2014, 51(1):1-10. |
| [27] | 刘嫦娥. 四种除草剂对蚯蚓生理生态的影响及其降解特征[D]. 昆明:云南大学, 2011. LIU Chang-e. Physiological ecological effects in earthworms treated with four herbicides and their degdradation in soils[D]. Kunming:Yunnan University, 2011. |
 2016, Vol. 35
2016, Vol. 35