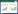文章信息
- 罗香文, 严清平, 陈武瑛, 陈昂, 李宗云, 杨芳, 刘勇
- LUO Xiang-wen, YAN Qing-ping, CHEN Wu-ying, CHEN Ang, LI Zong-yun, YANG Fang, LIU Yong
- 土壤和水中啶氧菌酯的环境行为研究
- Environmental behaviors of picoxystrobin in soils and water
- 农业环境科学学报, 2016, 35(5): 926-930
- Journal of Agro-Environment Science, 2016, 35(5): 926-930
- http://dx.doi.org/10.11654/jaes.2016.05.016
-
文章历史
- 收稿日期: 2016-01-18
2. 园艺作物病虫害治理湖南省重点实验室, 湖南省植物保护研究所, 长沙 410125
2. Management of Horticultural Crop of Hunan Province, Hunan Plant Protection Institute, Hunan Academy of Agricultural Science, Changsha 410125, China
啶氧菌酯,(E)-Α-甲氧基亚甲基-2-(3-三氟甲基-2-吡啶氧甲基)乙酸苯甲酯,一种甲氧基丙烯酸酯类广谱、内吸性杀菌剂,在我国2008年获得临时登记,主要用于防治麦类叶面病害,如座枝孢属(Ramulispora)导致的叶斑病等[1]。与现有甲氧基丙烯酸酯类杀菌剂如嘧菌酯、肟菌酯等相比,啶氧菌酯对座枝孢属(Septoria)、丝核菌属(Rhizoctonia)等导致的小麦病害有更强的治疗效果[2]。在我国,啶氧菌酯还用于水稻稻曲病等病害的防治[3],其使用范围和使用量正逐步上升。
按推荐剂量施用的啶氧菌酯在香蕉和土壤中的半衰期分别为10.7~12.1 d和12.5~13.4 d,若按1.5倍推荐剂量施用,15 d后在香蕉和土壤中的残留分别为0.686、0.159 mg·kg-1,表明啶氧菌酯的残留期较长[4]。啶氧菌酯能够抑制啤酒酵母(Saccharomyces cerevisiae)的生长[5],对土壤微生物的呼吸作用及土壤微生物结构具有不可逆转的影响[6]。4倍推荐剂量的啶氧菌酯能够显著降低家蚕的全茧量和茧层量[7],可以推测高浓度的啶氧菌酯对非靶标和环境具有潜在的毒性风险。因此,需研究啶氧菌酯在环境中,特别是农药重要的载体土壤和水中的环境行为,从而明确其累积性,为分析啶氧菌酯的环境风险以及其在不同亚农田生态环境中的应用提供科学依据。
本试验力图建立一种啶氧菌酯残留量的高效灵敏的检测方法,并通过对啶氧菌酯在三种典型土壤表面和水中挥发性和光降解、淋溶性等研究,以期明确啶氧菌酯在土壤和水中的环境行为,为指导啶氧菌酯的科学施用提供理论参考。
1 材料与方法 1.1 试剂和仪器主要试剂:啶氧菌酯原药(95%),啶氧菌酯标准品,其他试剂为分析纯或色谱纯。
主要仪器:挥发性装置恒温箱(XT5107-IB1000,杭州雪中炭恒温技术有限公司),液相色谱仪(型号1200,安捷伦科技有限公司),氙弧灯光稳定性试验箱(XT5409-XPC80,杭州雪中炭恒温技术有限公司)。
1.2 土壤样品实验采用3 种土壤:潮土、褐土和红壤土,其理化性质见表 1。
啶氧菌酯的表面挥发试验参考文献[8]并略做修改。称取50 g土壤和5 mL水样(ddH2O)平铺于9 cm直径的玻璃培养皿中,均匀滴加0.5 mg的供试物(0.5 mL浓度为1000 mg·L-1的以乙腈为溶剂的母液),搅拌均匀;加适量蒸馏水使土壤持水量约为饱和持水量的60%,置于气流式密闭系统运行在20~25 ℃(挥发性装置恒温箱设定的温度是23 ℃)条件下,空气以500 mL·min-1的流速通过密闭装置,使挥发出来的供试物随气流通过吸收管(设4级吸收管)并截留在吸收液(乙腈)中,24 h后分别测定吸收液及土壤和水中供试物含量。
啶氧菌酯的光降解试验参考文献[9]并略做修改。分别称取4 g土壤,加适量的水,使其均匀展布于玻璃平板上,室温下阴干,制备土壤薄层系列,使土层厚度为1~2 mm。将供试物溶液均匀滴加于各土壤薄层表面,或将供试物加入5 mL ddH2O,使土壤中供试物浓度为10 mg·kg-1,水中供试物浓度为5 mg·kg-1,盖上石英玻璃盖,然后将其置于光化学反应装置中进行光解试验。光照条件,测定波长254 nm,紫外强度25 μW·cm-2。试验过程中定期取样,测定土样和水样中供试物浓度的变化,记录紫外强度,试验进行至光解率达90%以上或最长7 d时终止。同时设黑暗条件下的对照试验。光解试验期内隔离其他光源,以减少对试验结果的影响。
土壤淋溶试验采用土壤薄层层析法[10]。称10 g过0.25 mm 筛的土壤于烧杯中加水(约7.5 mL)搅拌,直至成均匀的泥浆状,用玻璃棒将泥浆均匀涂布于层析玻璃板上,土层厚度随土质的粗细程度不同,控制在0.5~1.0 mm之间。在温度为(23±2)℃、避光条件下,将涂布好的土壤薄板晾干后,于距薄板底部1.5 cm 处点上药液,点药量为10.0 μg,每种处理设置三个平行。待溶剂挥发后,放在装有纯水的层析槽(液面高度0.5 cm)中展开(18 cm),然后晾干。将薄板上的土壤按等距离分成6段,分别测定各段土壤中的供试物含量。
1.4 啶氧菌酯残留量检测啶氧菌酯残留量检测参考Rao等[11]的方法,将文献中的固相萃取改为液相萃取[12]。
1.4.1 前处理表面挥发试验样品前处理:取整个处理样本置于三角瓶中,分三次加入100 mL乙腈振荡提取30 min,过滤至装有5 g氯化钠的离心管中,涡旋提取1 min,静置30 min待分层,取1 mL上清液过0.2 μm的有机系微孔滤膜,待测。
表面光降解试验样品前处理:取整个处理样本加入8 mL乙腈,涡旋提取1 min,再加入1 g氯化钠后涡旋1 min,静置30 min待分层后4000 r·min-1离心5 min,取1 mL上清液过0.2 μm的有机系微孔滤膜,待测。
土壤淋溶试验样品前处理:称取每个分段的所有土壤于离心管中,加入4 mL乙腈涡旋提取1 min,静置30 min待分层,在4000 r·min-1下离心5 min,取1 mL上清液过0.2 μm的有机系微孔滤膜,待测。
1.4.2 仪器条件液相色谱仪,配紫外检测器(型号1200,安捷伦科技有限公司)。色谱柱:ZOBAX SB C-18(4.6×250,5 μm),柱温30℃,检测波长225 nm,上样量10 μL,流速1 mL·min-1,流动相为30∶70=水∶乙腈。
1.4.3 检测方法验证啶氧菌酯标准品,加入乙腈至啶氧菌酯的终浓度分别为0.1、0.5、1、2、10 mg·L-1,然后对样品进行前处理,经萃取和净化,采用HPLC进行检测,根据HPLC的光吸收值与啶氧菌酯的浓度建立啶氧菌酯残留量检测的标准曲线。
三种土壤、吸收液和水中分别添加0.4 mg·L-1和10 mg·L-1啶氧菌酯,萃取和净化土壤和吸收液中的啶氧菌酯,采用HPLC进行检测,根据建立的啶氧菌酯残留量检测标准曲线计算土壤和水中啶氧菌酯含量,与添加啶氧菌酯的残留量进行比较,计算添加回收率。
1.5 数据处理与分析所有数据的平均值及标准误差均采用Excel 2010统计计算。
啶氧菌酯的表面挥发率,根据测得的数据,分别计算挥发试验回收率(R)和挥发率(Rv)[8]。

式中:Rv为挥发率,%;mv为供试物挥发量,μg;mo为供试物加入量,μg。
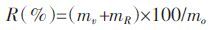
啶氧菌酯的表面光解一级动力学方程[9]Ct=C0e-kt
啶氧菌酯的半衰期t1/2 = ln2/K
式中:Ct 为t时供试物质量浓度,mg·L-1;C0为供试物起始质量浓度,mg·L-1;k为光解速率常数;t为反应时间;t1/2为光解半衰期。
啶氧菌酯在土壤中的淋溶性以迁移率(Rf)表示[10]。根据各段土壤中的供试物含量:
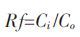
啶氧菌酯的定量标准曲线,采用5个添加浓度,每个添加浓度重复5次。据检测结果绘制土壤中啶氧菌酯的定量标准曲线如图 1。

|
| 图 1 啶氧菌酯残留量检测标准曲线 Figure 1 Standard curve for picoxystrobin quantification |
定量限(LOQ)为 0.001 8 mg·kg-1。土壤(图 2)、水和吸收液中啶氧菌酯的添加回收率具有差异,除潮土添加10 mg·kg-1啶氧菌酯的回收率较低(75.52%~78.36%),其他添加回收率均较高,且所有添加回收率的变异度均较低。

|
| 图 2 土壤中啶氧菌酯残留量检测图谱 Figure 2 Peaks of picoxystrobin quantification by HPLC |
啶氧菌酯在三种土壤表面的光降解规律均符合一级反应动力学模型,降解回归方程及半衰期见表 2。啶氧菌酯在红壤表面光降解最快,褐土表面光降解最慢。根据农药光降解等级划分,啶氧菌酯在潮土和褐土表面的光降解半衰期大于24 h,属于难光降解农药;而在红壤土表面的光降解等级为较难光解。图 3结果表明,啶氧菌酯在水中的光解也符合一级反应动力学模型,其在水中的半衰期为3.20 h,属较易光解农药。

|
| 图 3 啶氧菌酯在水中光解曲线 Figure 3 Curve of picoxystrobin photodegradation in water |
啶氧菌酯在三种土壤表面挥发性试验(表 3)结果表明,啶氧菌酯绝大部分存在于三种土壤中,其回收率达到92%~96.87%;而在挥发物吸收液中,未检测到啶氧菌酯。根据农药挥发性等级划分,啶氧菌酯在三种土壤表面的挥发率(Rv)均未检测到,属于难挥发农药。在水中的挥发性结果表明,啶氧菌酯在水中也属难挥发性农药。
啶氧菌酯在土壤中的淋溶性采用薄层层析法。图 4结果表明,在褐土和潮土0~3 cm的土层中,啶氧菌酯的浓度最高,其他土层极低;而在红壤中,不同土层中啶氧菌酯的浓度基本一致。

|
| 图 4 啶氧菌酯在三种土壤不同土层中的分布 Figure 4 Distribution of picoxystrobin in different layers of three typical soils |
啶氧菌酯在三种土壤中的迁移率(表 4)与图 4结果基本一致。在褐土和潮土中,啶氧菌酯的迁移率为0.083,均小于0.10,其移动性等级为不移动;而其在红壤中的迁移率为0.25,移动性等级为不易移动。
杀菌剂在环境介质中的环境行为,与农药本身的分子特性等密切相关,同时也与土壤的理化性质具有复杂的相互关联;如土壤有机质含量能够影响杀菌剂在固液相间分配系数(Kd),从而影响杀菌剂的环境行为[13]。啶氧菌酯在三种土壤表面的光降解结果表明,啶氧菌酯在红壤土中半衰期仅为其他两种土壤的一半;且在红壤中迁移率高于其他两种类型的土壤,可能与不同类型土壤中的有机质含量有关。甲氧基丙烯酸酯类另一种重要的杀菌剂嘧菌酯在不同类型土壤中的吸附强弱顺序为褐土>河潮土>红壤[14],表明土壤有机质含量越高,嘧菌酯在固液相间的分配系数越高,嘧菌酯趋向于固相。啶氧菌酯在不同类型土壤中的光降解和迁移结果与嘧菌酯类似,其在有机质含量高的土壤(潮土和褐土)中相对稳定,而在有机质含量较低的红壤中不稳定,易迁移和降解(表 2,图 3)。与嘧菌酯在稻田土壤中的半衰期(7.77~9.33 d)相比[14, 15],啶氧菌酯在三种典型土壤中的半衰期均较长(12.80~30.80 d),表明在土壤中,啶氧菌酯的稳定性高于嘧菌酯,其残留风险可能高于嘧菌酯。
啶氧菌酯在红壤土的稳定性低于其他两种类型土壤(半衰期短、迁移率高),还可能与土壤pH相关[16]。嘧菌酯在土壤中的环境行为研究还表明,pH值变化对嘧菌酯在土壤上的固液相间分配系数(或吸附)有明显的影响,pH值为5时,土壤吸附的嘧菌酯量最低(Kd值最小)[14]。相较于其他两种土壤,红壤土pH偏酸性(pH 5.5),啶氧菌酯在红壤土中的固液相间分配系数低,啶氧菌酯趋向于迁移和降解。
啶氧菌酯在水中光降解的半衰期为3.20 h,属易光降解农药。其光稳定性低于嘧菌酯(不同pH水中半衰期为17.2~47.9 d)[17],表明啶氧菌酯在水中的残留风险低于嘧菌酯。
啶氧菌酯在三种土壤和水的表面都难挥发,表明啶氧菌酯分子本身稳定性高[18],与介质的理化性质关联不大。
啶氧菌酯的环境行为还可能与介质的其他理化因素相关,所以啶氧菌酯的施用剂量及频次,应该根据环境介质的条件、气候等环境因子,以及农田亚生态环境实际情况加以限制,如啶氧菌酯在潮土和褐土中稳定性高、迁移率低,长期高频次施用容易导致土壤中啶氧菌酯累积,影响农产品质量以及造成潜在的环境风险。
4 结论啶氧菌酯在三种土壤、水和空气中均难挥发,在土壤表面难光降解,而在水表面较易光降解;在潮土和褐土中的移动性等级为不移动,而在红壤中为不易移动。啶氧菌酯在三种土壤中稳定性高、迁移率低,长期高频次施用,容易导致土壤中啶氧菌酯累积;而在水中易于降解,不容易累积。
| [1] | Malinske Z T. Studies on in vitro activity of picoxystrobin and its mixtures with other fungicides against Ramulispora herpotrichoides and Ramulispora acuformis[J]. Pestycydy, 2008, 1/2:75-85. |
| [2] | Gaurilčikienė I, Ronis A. The effect of strobilurin fungicides on the development of foliar diseases of winter wheat[J]. Agronomy Research, 2006, 4(Special issue):177-180. |
| [3] | 阮宏椿, 杨秀娟, 石妞妞, 等. 不同杀菌剂对水稻稻曲病菌的室内毒力及田间药效[J]. 福建农业学报, 2013, 28(6):580-583. RUAN Hong-chun, YANG Xiu-juan, SHI Niu-niu, et al. Toxicity and field efficiency of several fungicides against Ustilaginiodea virens[J]. Fujian Journal of Agrcultural Science, 2013, 28(6):580-583. |
| [4] | Wang Y H, Yang Y X, Zhou Q F, et al. Dissipation and residue of picoxystrobin in banana and soil under field conditions[J]. Polish Journal of Environmental Studies, 2014, 23(4):1361-1365. |
| [5] | Patricia F, Alastair G. A rapid resazurin bioassay for assessing the toxicity of fungicides[J]. Chemosphere, 2009, 74(9):1165-1170. |
| [6] | Stenrød M, Klemsdal S S, Norli H R, et al. Effects of picoxystrobin and 4-n-nonylphenol on soil microbial community structure and respiration activity[J]. PLoS ONE, 2013, 8(6):e66989. |
| [7] | 谢道燕, 杨振国, 田梅金, 等. 7 种杀菌剂对桑树及家蚕的安全性评价[J]. 中国农学通报, 2014, 30(22):310-315. XIE Dao-yan, YANG Zhen-guo, TIAN mei-jin, et al. Safety evaluation of seven fungicides to Morus alba and Bombyx mori[J]. Chinese Agricultural Science Bulletin, 2014, 30(22):310-315. |
| [8] | Clifford P R, Cristina B N, Pedro Z. Volatilization of trifluralin, atrazine, metolachlor, chlorpyrifos, r-endosulfan, and endosulfan from freshly tilled soil[J]. Journal of Agricultural Food and Chemistry, 2002, 50:4009-4017. |
| [9] | Bandala E R, Gelover S, Leal M T, et al. Solar photocatalytic degradation of Aldrin[J]. Catalysis Today, 2002, 76(2):189-199. |
| [10] | Kalbe U, Bandow N, Bredow A, et al. Column leaching tests on soils containing less investigated organic pollutants[J]. Journal of Geochemical Exploration, 2014, 147:291-297. |
| [11] | Rao T N, Ramesh A, Parvathamma T, et al. Development and validation of a HPLC-UV methods for simultaneous determination of strobilurin fungicide residues in tomato fruits followed by matrix solid-phase dispersion(MSPD)[J]. Indian Journal of Science Research, 2012, 3(1):113-118. |
| [12] | Luo X W, Zhang D Y, Chen P M, et al. Dynamics of ethametsulfuron-methyl residue in paddy soils revealed by HPLC-MS/MS[J]. Journal of Agricultural Science, 2014, 6(10):119-127. |
| [13] | García-Jaramillo M, Cox L, Cornejo J, et al. Effect of soil organic amendments on the behavior of bentazone and tricyclazole[J]. Science of the Total Environment, 2014, 466-467:906-913. |
| [14] | 谢 惠. 嘧菌酯在稻田中的残留消解及吸附行为研究[D]. 长沙:湖南农业大学, 2013:42-45. XIE Hui. Residue, decomposition and adsorption behavior of azoxystrobin in rice field[D]. Changsha:Hunan Agricultural University, 2013:42-45. |
| [15] | 王雅丽. 嘧菌酯和苯醚甲环唑在稻田中的残留与吸附效应研究[D]. 长沙:湖南农业大学, 2012:52-54. WANG Ya-li. Residue and adsorption behavior of azoxystrobin and difenoconazole in rice field[D]. Changsha:Hunan Agricultural University, 2013:52-54. |
| [16] | Wong F, Bidleman T. Aging of organochlorine pesticides and polychlorinated biphenyls in muck soil:Volatilization, bioaccessibility, and degradation[J]. Environmental Science and Technology, 2011, 45(3):958-963. |
| [17] | 刘晓旭, 侯志广, 吴敬慧, 等. 嘧菌酯水解动力学研究[J]. 农业环境科学学报, 2012, 31(8):1603-1607. LIU Xiao-xu, HOU Zhi-guang, WU Jing-hui, et al. Hydrolyze kinetics and mechanism of azoxystrobin[J]. Journal of Agro-Environment Science, 2012, 31(8):1603-1607. |
| [18] | Dornellasa R M, Rômulo A, Franchinib A, et al. Determination of the fungicide picoxystrobin using anodic stripping voltammetry on a metal film modified glassy carbon electrode[J]. Aucelio Electrochimica Acta, 2013, 97:202-209. |
 2016, Vol. 35
2016, Vol. 35