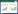文章信息
- 刘梦, 王华静, 王鲲鹏, 杨金燕
- LIU Meng, WANG Hua-jing, WANG Kun-peng, YANG Jin-yan
- 腐植酸对水体中五价钒的吸附
- Adsorption of pentavalent vanadium by humic acid in water
- 农业环境科学学报, 2016, 35(5): 969-975
- Journal of Agro-Environment Science, 2016, 35(5): 969-975
- http://dx.doi.org/10.11654/jaes.2016.05.022
-
文章历史
- 收稿日期: 2015-11-19
2. 四川大学建筑与环境学院, 成都 610065
2. College of Architecture and Environment, Sichuan University, Chengdu 610065, China
随着我国经济快速增长,环境污染呈现出种类多、数量大、波及范围广等特点。钒在自然界分布很广,常伴生在钛磁铁矿、风化堆积残留矿、含钒铁矿、含钒磷矿等矿床中[1]。钒是人与动物正常生长都需要的营养元素[2, 3],在调节酶活、降低血糖、生物固氮等方面起着重要作用[4, 5],但钒在生物体内含量过多,则会产生毒害作用。20世纪80年代末,钒被列为环境危险元素[6, 7]。
未被钒污染的水体中钒含量为0.2~100 μg·L-1[8],而沉钒废水中的钒含量为100~400 mg·L-1[9],高于我国地表水环境质量标准中钒的限值。我国水体中钒的主要污染源为原油冶炼厂、燃油和燃煤工厂以及含钒矿物冶炼厂等在生产过程中产生的废水[10]。因此,研究去除污染水体中的钒很有必要。
腐植酸是自然界中的天然高分子聚合物,具有结合金属离子和有机分子的活性[11, 12],能与重金属形成稳定的络合体[13, 14],其结构含有大量硫羟基、酚羟基、羧基、醇羟基、氨基等活性基团,且彼此间以氢键结合成网络状,因此分子表面具有孔状结构,可提供良好的吸附表面,是良好的吸附载体。目前,国内有关腐植酸的研究主要有四个方面:腐植酸对重金属的吸附作用及重金属间的竞争、腐植酸与重金属之间的相互作用、腐植酸对重金属的络合/螯合作用、腐植酸对重金属的氧化-还原作用。也有学者以腐植酸或者富里酸作为吸附剂,研究其对重金属离子的解吸特征。但腐植酸对钒离子的吸附研究鲜见报道,吸附特征及机制也尚不明确。本文以腐植酸作为吸附剂,探讨其对水体中钒的吸附特性,为钒污染水体的修复提供理论依据和技术支持。
1 材料与方法 1.1 主要试剂来源腐植酸(HA)购于Sigma-Aldrich公司,主要元素组成见表 1。钒标液由分析纯NaVO3配制。
溶液中钒的浓度采用磷酸-钨酸钠分光光度法测定,该方法的检测下限约为0.5 mg·L-1,上限为21.5 mg·L-1 [15],样品加标回收率为98.33%~101.25%。
1.3 反应物浓度与反应时间对腐植酸吸附钒的影响 1.3.1 腐植酸浓度的影响实验分别称取0、10、20、30、40、50、80 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液(以NaVO3的形式加入)和2.5 mL的0.005 mol·L-1的NaNO3[16, 17, 18]电解质溶液,使溶液中腐植酸的浓度为0.00、0.36、0.73、1.09、1.45、1.82、2.91 g·L-1,钒溶液浓度为90.91 mg·L-1,放入恒温振荡器中,在25 ℃下以200 r·min-1的速度振荡24 h,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理3个重复。
1.3.2 钒溶液浓度的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,分别加入25 mL浓度为10、30、50、100、200、300、500、1000、1500、2000、3000、4000、5000、7000、8000 mg·L-1的钒溶液,再加入0.005 mol·L-1 NaNO3电解质溶液2.5 mL,使钒的最终浓度依次为9.09、27.27、45.46、90.91、181.82、272.73、454.55、909.09、1 363.64、1 818.18、2 727.27、3 636.36、4 545.46、6 363.64、7 272.73 mg·L-1,放入恒温振荡器中,在25 ℃下以200 r·min-1的速度振荡24 h,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
1.3.3 反应时间的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液和2.5 mL的0.005 mol·L-1 NaNO3电解质溶液,使钒溶液浓度为90.91 mg·L-1,在25 ℃恒温振荡器中以200 r·min-1的速度振荡,分别反应10、30、60、150、240、300、360、420、480、600、660、720、960、1200、1440 min取出,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
1.4 环境因素对腐植酸吸附钒的影响 1.4.1 pH的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液和0.005 mol·L-1 的NaNO3电解质溶液2.5 mL,分别用0.1 mol·L-1 HCl和0.1 mol·L-1 NaOH调节溶液pH为(2.00±0.05)、(3.00±0.05)、(4.00±0.05)、(5.00±0.05)、(6.00±0.05)、(7.00±0.05)、(8.00±0.05)、(9.00±0.05)、(10.00±0.05),放入25 ℃恒温振荡器中以200 r·min-1的速度振荡 24 h,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
1.4.2 离子强度的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液,依次加入0.005、0.010、0.050、0.100、0.500、1.000 mol·L-1 NaNO3电解质溶液2.5 mL,放入25 ℃恒温振荡器中以200 r·min-1的速度振荡 24 h,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
1.4.3 温度的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液和0.005 mol·L-1的NaNO3电解质溶液2.5 mL,分别在4、25、40、60、80 ℃进行24 h吸附试验,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
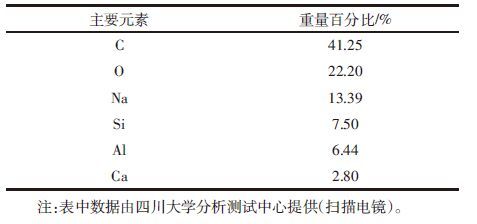
1.4.4 电解质的影响实验称取30 mg 腐植酸于50 mL塑料离心管中,加入25 mL浓度为100 mg·L-1的钒溶液,分别加入2.5 mL 浓度为0.005 mol·L-1的NaCl、Na2CO3、Na2SO4、NaNO3、NaNO3+NaCl、NaNO3+Na2CO3、NaNO3+Na2SO4电解质溶液,放入25 ℃恒温振荡器中以200 r·min-1的速度振荡 24 h,在5000 r·min-1下离心5 min,过滤,用紫外可见光分光光度计测定滤液中钒的浓度。每个处理重复3次。
1.5 扫描电镜与红外光谱分析方法分别取适量的吸附前后的腐植酸粉末样品,粘在有导电双面胶的样品台,在真空镀膜机中喷金处理,再用日本电子公司JSM-7500F扫描电子显微镜观察腐植酸表面的微观形貌。
分别取少量吸附前后的腐植酸样品于玛瑙研钵中,加入高纯度溴化钾,充分研磨后用压力机压制成透明的片状,用美国Thermo Nicolet公司Nicolet6700傅里叶变换红外分光光度计测定红外光谱,扫描范围为400~4000 cm-1。
1.6 统计分析采用SPSS 16.0软件进行数据统计分析,用最小显著差数法(LSD法)在P=0.05水平下进行检验分析。
2 结果与分析 2.1 反应物浓度与反应时间对腐植酸吸附钒的影响 2.1.1 腐植酸浓度的影响当腐植酸浓度≤1.09 g·L-1时,腐植酸对钒的吸附量和吸附率均呈上升趋势,吸附量由趋于0增加至47.58 mg·g-1,吸附率由趋于0增加至47.19%;当腐植酸浓度>1.09 g·L-1时,吸附量由47.58 mg·g-1减少至22.84 mg·g-1,吸附率继续呈上升趋势(图 1)。这是由于腐植酸浓度的增加增大了腐植酸的表面积和有效活性位点;继续增加腐植酸浓度时,由于腐植酸质量增加,溶液中钒的质量浓度不断降低,同时过多的腐植酸聚合或者重叠,使得可利用的腐植酸表面积减少,有效活性位点减少,以致吸附量减少[19]。当钒溶液浓度为90.91 mg·L-1、腐植酸浓度为1.09 g·L-1时,腐植酸对钒的吸附量达到最大。因此,后续实验腐植酸的添加量确定为30 mg,即最终溶液中腐植酸浓度为1.09 g·L-1。
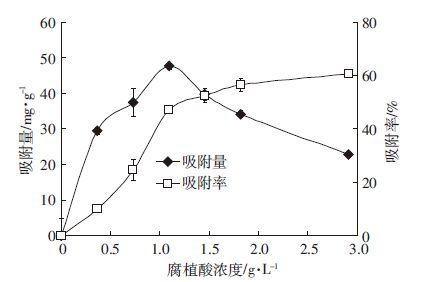
|
| 图 1 腐植酸添加量对吸附钒的影响 Figure 1 Effects of humic acid concentrations on V adsorption from solution |
随着钒溶液浓度的增加,腐植酸对钒的吸附量逐渐增加,而吸附率呈下降趋势(图 2)。当钒溶液浓度≤2 7.27 mg·L-1时,腐植酸对钒的吸附率接近100%;随着钒离子初始浓度的升高,腐植酸对钒的吸附率逐渐趋于0,吸附量呈缓慢增加趋势直至平衡。当钒溶液浓度≤454.55 mg·L-1时,吸附量增加较快;钒溶液浓度在454.55~1 818.18 mg·L-1时,吸附量呈缓慢增加趋势;当钒溶液浓度为1 818.18 mg·L-1时,吸附量达到最大值172.10 mg·g-1;当钒溶液浓度>1 818.18 mg·L-1时,腐植酸对钒的吸附量趋于平衡。这是因为在腐植酸的量一定的情况下,吸附剂的表面积和有效活性位点是固定的,随着钒溶液浓度的增加,腐植酸表面的吸附位点逐渐被占据或覆盖。因此,当钒溶液浓度持续增加时,吸附率逐渐降低并趋于0;吸附量呈增加-缓慢增加-平衡的趋势。
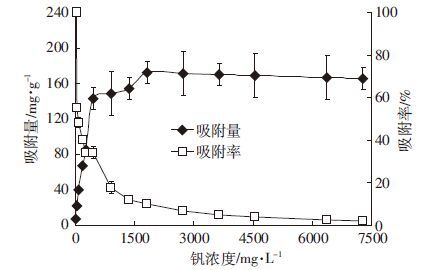
|
| 图 2 钒离子初始浓度对腐植酸吸附钒的影响 Figure 2 Effects of initial V(Ⅴ) concentrations on V adsorption by humic acid |
用Langmuir模型和Freundlich模型对等温吸附曲线进行拟合(表 2)。Langmuir模型拟合结果相关性系数为0.998 9,最大吸附量为169.49 mg·g-1,与实际最大吸附量172.10 mg·g-1较为接近;而Freundlich模型的拟合结果略差,相关性系数为0.827 4,拟合最大吸附量为143.09 mg·g-1,与实际最大吸附量相差较大。Langmuir等温吸附模型是基于吸附作用发生在单分子层,吸附剂表面的吸附位点具有同一性[20],忽略被吸附分子间的横向作用的一种理论模型[21],能较好地表征腐植酸对水体中钒的吸附过程;而Freundlich等温吸附模型拟合效果略差,可能是因为Freundlich等温吸附模型是以实验观察数据为依据建立的经验模型[20],环境因素的选取对实验结果影响较大。
在0~150 min内,腐植酸对钒离子的吸附量和吸附率随时间增加而迅速增加,此后吸附量与吸附率略有下降,而到660 min后逐渐趋于平衡(图 3)。在吸附初始阶段,腐植酸与钒的反应可能发生在腐植酸分子表面,因此反应速率较快,而到吸附后期,吸附反应主要发生在腐植酸内部,因此减缓了吸附速率[16]。
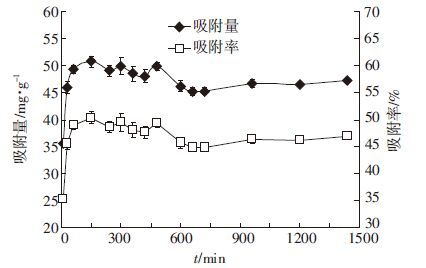
|
| 图 3 吸附时间对腐植酸吸附钒的影响 Figure 3 Effect of time on V adsorption by humic acid |
用拟一级速率方程、拟二级速率方程和双常数动力学模型对吸附动力学数据进行拟合(表 3),结果表明拟一级速率方程和双常数动力学模型不能较好地表征腐植酸对钒吸附的动力学过程;拟二级动力学模型能够较好地表征腐植酸对钒的吸附规律,拟合最大吸附量52.25 mg·g-1 与150 min时实际值50.74 mg·g-1 较为接近;动力学模型表明在整个吸附过程中表面吸附、液膜扩散等都在进行,起主要作用的是腐植酸与钒通过电子交换或电子共享引起的化学吸附,整个吸附过程呈现多级线性关系,表明整个吸附过程伴随着多个控制速率的步骤参与。
腐植酸不溶于酸,溶于碱,是一种聚电解质[17],pH值会影响腐植酸在溶液中的溶解度。溶液pH值在2~7之间时,腐植酸对钒的吸附量无显著性差异(P>0.05),吸附量在50.03 mg·g-1以上;而当pH值在7~10时,吸附量由50.03 mg·g-1下降为4.76 mg·g-1,吸附量减少幅度高达90.49%(图 4)。随着pH值的增大,由酸性环境逐渐过渡到碱性环境时,腐植酸对钒的吸附量和吸附率均呈下降趋势,即酸性和中性条件较利于腐植酸对钒的吸附,二者相比酸性环境更佳。这是因为,腐植酸不溶于酸,酸性环境有利于腐植酸与钒形成强螯合物,促进了腐植酸对钒的吸附;当反应在碱性环境下进行时,腐植酸溶于碱性溶液而发生离解[22],使得固态的腐植酸量减少,从而减少了腐植酸的表面积和有效活性位点,不利于腐植酸对钒的吸附作用。因此欲提高腐植酸对钒的吸附效果,可以适当降低溶液的pH值。
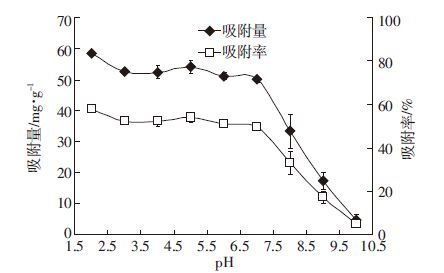
|
| 图 4 pH对腐植酸吸附钒的影响 Figure 4 Effect of pH on V adsorption by humic acid |
加入电解质是为了减小由于溶液的离子失衡而对吸附效果造成的影响,不同电解质的存在对腐植酸吸附钒的能力有不同程度的影响(表 4)。NaNO3和Na2SO4这两种电解质存在时,与不加电解质时腐植酸对钒离子的吸附相比没有显著性差异(P>0.05),其余五种电解质及电解质组合的存在,与不加电解质时腐植酸对钒的吸附存在显著性差异(P<0.05)。这可能是因为有些离子与钒离子结合,形成络合离子而出现沉淀,使得腐植酸不能较好地与钒离子结合,因此腐植酸对钒的吸附量出现差异。
在温度≤25 ℃时,腐植酸对钒的吸附效果较好,且吸附量没有显著差异;而当温度≥40 ℃时,腐植酸对钒的吸附显著降低。从图 5可以看出,60 ℃时吸附量由4 ℃的53.36 mg·g-1降为31.12 mg·g-1,减少了约41.68%。研究表明,温度高于25 ℃不利于腐植酸对钒的吸附,即常温和低温条件下的吸附效果较佳。原因可能是低温条件可以保持腐植酸的有效活性位点,随着温度的升高,腐植酸的溶解度增加,减少了固态腐植酸含量,腐植酸的表面吸附位点和有效活性位点减少[16],从而在一定程度上降低腐植酸对钒的吸附能力。因此,在利用腐植酸吸附水体中的钒时,可以选择在常温条件下进行。
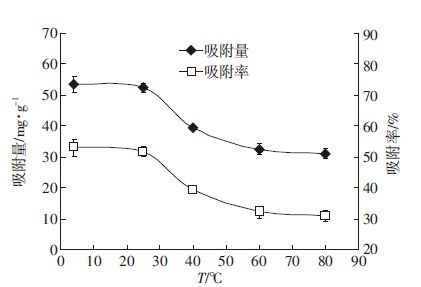
|
| 图 5 温度对腐植酸吸附钒的影响 Figure 5 Effect of temperature on V adsorption by humic acid |
在低离子强度条件下(0.005~0.1 mol·L-1),腐植酸对钒的吸附量随着NaNO3浓度的增加而快速下降,而随着离子强度的进一步增加,腐植酸对钒的吸附并没有显著变化(图 6)。这是因为电解质NaNO3的浓度增加会抑制腐植酸分子官能团的离解,溶液中正负电荷增多,导致腐植酸分子间斥力减弱,由于电性的中和使得腐植酸分子卷曲或聚集凝集,从而减少腐植酸的表面积和有效活性位点[23],减少钒离子与腐植酸的结合位点,因此降低了腐植酸吸附钒的能力,使得腐植酸对钒的吸附量和吸附率均降低。
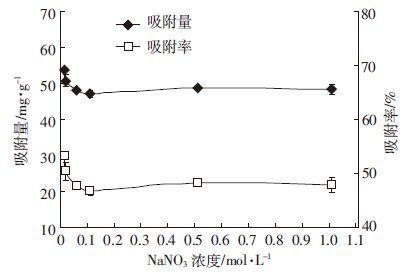
|
| 图 6 离子强度对腐植酸吸附钒的影响 Figure 6 Effect of ionic strength on V adsorption by humic acid |
为表征吸附钒前后腐植酸结构和化学基团的变化特征,对其做了吸附前后的扫描电镜(SEM)分析和红外光谱(FTIR)分析。
从扫描电镜图(图 7)可以看出吸附前的腐植酸表面呈零碎的片状或颗粒状,并有松散小裂缝。腐植酸的碎片状表面结构有利于钒离子扩散到腐植酸的内部,与其形成稳定的络合物;吸附后的腐植酸表面变得均匀板结,几乎没有裂缝存在。这可能是由于腐植酸对钒的吸附不仅发生在表面,而且深入到腐植酸的内部,并与腐植酸结合形成稳定的络合物。也可能是实验过程中由于震荡等造成的腐植酸表面均匀板结。

|
| 图 7 腐植酸吸附钒前后的扫描电镜图像 Figure 7 SEM images of humic acid before and after V adsorption |
从红外光谱谱图(图 8)可以看出,吸附钒后的腐植酸主要官能团发生了相应的变化,3403 cm-1处的吸收峰移动至3407 cm-1附近,是由于O-H或N-H的氢键伸缩振动;1592 cm-1处的吸收峰移动至1596 cm-1附近和1382 cm-1处的吸收峰移动至1384 cm-1附近,是由于肪烃类-CH3、-CH2的伸缩振动;1031 cm-1处的吸收峰移动至1033 cm-1附近和912 cm-1处的吸收峰移动至914 cm-1附近,是由于多聚糖和类多聚糖结构的C-O键伸缩振动,也可能是存在硅酸盐杂质的Si-O键;796 cm-1处的吸收峰移动至798 cm-1附近,是由于C-H的伸缩振动;538 cm-1处吸收峰小幅移动至539 cm-1附近,是由于C-O-C的伸缩振动;468 cm-1处的吸收峰移动至470 cm-1附近,是由于腐植酸芳香环和-OH的存在。主要官能团的变化说明腐植酸上的羟基、甲基、碳氧键和硅氧键参与了腐植酸对水体中钒的吸附过程。
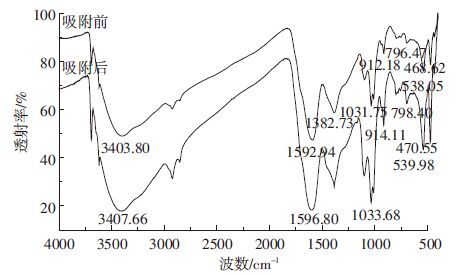
|
| 图 8 腐植酸吸附钒前后的红外光谱谱图 Figure 8 FTIR of humic acid before and after V adsorption |
(1)溶液钒浓度为90.91 mg·L-1时,随着腐植酸浓度的增加,其对水体中钒离子的吸附量逐渐增加;当腐植酸添加浓度为1.09 g·L-1时,腐植酸对钒离子的吸附量达到最大,继续增加腐植酸浓度,吸附量减少。腐植酸对钒离子的等温吸附曲线可以用Langmuir模型拟合,最大吸附量为169.49 mg·g-1。
(2)随着吸附时间的延长,腐植酸对钒的吸附量呈现迅速增加-缓慢增加-略有减少-吸附平衡的趋势。腐植酸对钒的吸附符合拟二级动力学模型。
(3)随着溶液pH、温度的增加,腐植酸对钒的吸附量均逐渐减少;溶液中电解质浓度增加,可能会与钒离子产生竞争吸附;加入不同的电解质时,会有不同的离子与钒结合形成螯合离子,或是与钒发生竞争吸附,吸附效果差异较大。
(4)红外光谱结果表明腐植酸上的羟基、甲基、碳氧键和硅氧键参与了腐植酸对水体中钒的吸附过程。
基于以上结论,去除水体中的钒污染,可以考虑用适量的腐植酸作吸附剂,在条件允许的情况下,可以适当降低溶液的pH值和温度。同时,应考虑腐植酸本身对水环境的影响。
| [1] | 杨金燕, 唐 亚, 李廷强, 等. 我国钒资源现状及土壤中钒的生物效应[J]. 土壤通报, 2010, 41(6):1511-1517. YANG Jin-yan, TANG Ya, LI Ting-qiang, et al. Soil biogeochemistry and resources situation of vanadium in China[J]. Chinese Journal of Soil Science, 2010, 41(6):1511-1517. |
| [2] | 滕彦国, 矫旭东, 王金生. 攀枝花矿区土壤对钒的吸附特征研究[J]. 土壤学报, 2009, 46(2):356-360. TENG Yan-guo, JIAO Xu-dong, WANG Jin-sheng. Adsorption characteristics of vanadium on soils in Panzhihua mining area[J]. Acta Pedologica Sinica, 2009, 46(2):356-360. |
| [3] | 汪金舫, 刘 铮. 钒在土壤中的含量分布和影响因素[J]. 土壤学报, 1994, 31(1):61-67. WANG Jin-fang, LIU Zheng. Vanadium distribution and its affecting factors in soil of China[J]. Acta Pedologica Sinica, 1994, 31(1):61-67. |
| [4] | Cammack R. Nitrogen fixation:A role for vanadium at last[J]. Nature, 1986, 322:312. |
| [5] | 李青仁, 王月梅, 李晓波. 钒的生物学功能及与疾病的关系[J]. 微量元素与健康研究, 2007, 24(2):65-66. LI Qing-ren, WANG Yue-mei, LI Xiao-bo. Vanadium biology function and disease relations[J]. Studies of Trace Elements and Health, 2007, 24(2):65-66. |
| [6] | Hindy K T, Abdel Shafy H I, Farag S A. The role of the cement industry in the contamination of air, water, soil and plant with vanadium in Cairo[J]. Environmental Pollution, 1990, 66:195-205. |
| [7] | 樊 灏, 杨金燕, 边静虹, 等. V(Ⅴ)与V(Ⅳ)在不同土壤中的吸附-解吸行为研究[J]. 环境科学与技术, 2014, 37(8):1-7. FAN Hao, YANG Jin-yan, BIAN Jing-hong, et al. Study on adsorption-desorption of V(Ⅳ) and V(Ⅴ) in different soils[J]. Environmental Science & Technology, 2014, 37(8):1-7. |
| [8] | 吴 涛, 兰昌云. 环境中的钒(V)及其对人体健康的影响[J]. 广东微量元素科学, 2004, 11(1): 11-15. WU Tao, LAN Chang-yun. Vanadium in environment and its harm to human health[J]. Guangdong Trace Elements Science, 2004, 11(1): 11-15. |
| [9] | 王 英. 沉钒废水处理技术的研究现状[J]. 铁合金, 2012, 43(6): 41-45. WANG Ying. Current situation of the vanadium precipitating waste water treatment technology[J]. Ferro-Alloys, 2012, 43(6): 41-45. |
| [10] | 邹宝方, 何增耀. 钒的环境化学[J]. 环境污染与防治, 1993, 15(1):26-31. ZOU Bao-fang, HE Zeng-yao. Environmental chemistry of vanadium[J]. Environment Pollution & Control, 1993, 15(1):26-31. |
| [11] | Marang L, Eidner S, Kumke M U, et al. Spectroscopic characterization of the competitive binding of Eu(Ⅲ), Ca(Ⅱ), and Cu(Ⅱ) to a sedimentary originated humic acid[J]. Chemical Geology, 2009, 264(1-4):154-161. |
| [12] | 周岩梅, 张 琼, 汤鸿霄. 多环芳烃类有机物在腐植酸上的吸附行为研究[J]. 环境科学学报, 2010, 30(8): 1564-1571. ZHOU Yan-mei, ZHANG Qiong, TANG Hong-xiao. Sorption behavior of polycyclic aromatic hydrocarbons onto humic acid particulates[J]. Acta Science Circumstantiae, 2010, 30(8):1564-1571. |
| [13] | 陈 颖, 袁旭音. 河口湿地沉积物中腐植酸含量对外源重金属分布的影响研究[J]. 水土保持学报, 2008, 22(4): 185-189. CHEN Ying, YUAN Xu-yin. Effects of humic acid on partitioning of extrinsic heavy metal for the estuarine wetland sediment[J]. Journal of Soil and Water Conservation, 2008, 22(4):185-189. |
| [14] | Dong L H, Yang J S, Yuan H L, et al. Chemical characteristics and influences of two fractions of Chinese lignite humic acid on urease[J]. European Journal of Soil Biology, 2008, 44(2):166-171. |
| [15] | 周 静, 於利慧. 磷钨钒杂多酸分光光度法测定钛精矿中五氧化二钒[J]. 冶金分析, 2014, 34(12):66-69. ZHOU Jing, YU Li-hui. Determination of vanadium pentoxide in titanium concentrate by phosphorus-tungsten-vanadium heteropoly acid spectrophotometry[J]. Metallurgical Analysis, 2014, 34(12): 66-69. |
| [16] | 马明广, 周 敏, 蒋煜峰. 不溶性腐植酸对重金属离子的吸附研究[J]. 安全与环境学报, 2006, 6(3):68-71. MA Ming-guang, ZHOU Min, JIANG Yu-feng. Study on adsorption of heavy metal ions onto insolublized humic acid[J]. Journal of Safety and Environment, 2006, 6(3): 68-71. |
| [17] | 孔德星. 腐植酸在土壤中对Cu2+的吸附特性影响[J]. 广东化工, 2014, 41(17):41-42. KONG De-xing. Adsorption characteristic of Cu2+ on loess soil affected by humic acid[J]. Guangdong Chemical Industry, 2014, 41(17): 41-42. |
| [18] | 蒋煜峰, 张 媛, 马明广, 等. 腐植酸对Cd在西部黄土上吸附特性影响的研究[J]. 农业环境科学学报, 2006, 25(5):1379-1382. JIANG Yu-feng, ZHANG Yuan, MA Ming-guang, et al. Adsorption characteristic of Cd on loess soil affected by humic acid[J]. Journal of Agro-Environment Science, 2006, 25(5): 1379-1382. |
| [19] | 于春光. 改性山桃壳吸附水中重金属的效能研究[D]. 哈尔滨:哈尔滨工业大学, 2013. YU Chun-guang. The study of adsorption efficiency of heavy metal from aqueous solution using Chinese walnut shell[D]. Harbin:Harbin Institute of Technology, 2013. |
| [20] | 蒋新宇, 黄海伟, 曹理想, 等. 毛木耳对Cd2+、Cu2+、Pb2+、Zn2+生物吸附的动力学和吸附平衡研究[J]. 环境科学学报, 2010, 30(7):1431-1438. JIANG Xin-yu, HUANG Hai-wei, CAO Li-xiang, et al. Kinetics and equilibrium of biosorption of Cd2+, Cu2+, Pb2+, Zn2+ by mancrofungus(Auricularia polytricha) biomass[J]. Acta Scientiae Circumstantiae, 2010, 30(7): 1431-1438. |
| [21] | 马宏飞, 李 薇, 韩秋菊, 等. 茶叶渣对Ni(Ⅱ)的吸附动力学及等温吸附模型研究[J]. 科学技术与工程, 2013, 13(16):4761-4764. MA Hong-fei, LI Wei, HAN Qiu-ju, et al. Research on the adsorption kinetics and thermal adsorption model of Ni(Ⅱ) with tea dust[J]. Science Technology and Engineering, 2013, 13(16): 4761-4764. |
| [22] | 王亚军, 朱 琨, 王进喜, 等. 腐植酸对铬在砂质土壤中吸附行为的影响研究[J]. 安全与环境学报, 2007, 7(5): 42-47. WANG Ya-jun, ZHU Kun, WANG Jin-xi, et al. Study on the humic acid adsorption of chromium in sandy soil[J]. Journal of Safety and Environment, 2007, 7(5): 42-47. |
| [23] | 杨 毅, 王晓昌, 金鹏康, 等. 水环境中腐植酸与镉离子结合作用的影响因素[J]. 环境工程学报, 2013, 7(12):4603-4606. YANG Yi, WANG Xiao-chang, JIN Peng-kang, et al. Influencing factors of binding of humic acid and cadmium ion in the water environment[J]. Chinese Journal of Environment Engineering, 2013, 7(12):4603-4606. |
 2016, Vol. 35
2016, Vol. 35