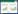文章信息
- 徐慧琳, 曾文炉, 陈翠红, 周启星
- XU Hui-lin, ZENG Wen-lu, CHEN Cui-hong, ZHOU Qi-xing
- 镉污染土壤中吐纳麝香的生物有效性及其评价
- Bioavailability of AHTN in cadmium-polluted soil and its assessment
- 农业环境科学学报, 2016, 35(6): 1021-1027
- Journal of Agro-Environment Science, 2016, 35(6): 1021-1027
- http://dx.doi.org/10.11654/jaes.2016.06.001
文章历史
- 收稿日期: 2015-12-12
吐纳麝香(AHTN)是多环麝香中使用量最多的化合物之一,和佳乐麝香(HHCB)一起共占多环麝香使用量的95%。由于AHTN在土壤表面吸附性强、扩散慢,因此随着污水和污泥反复施用于农田[1],土壤中AHTN浓度逐渐升高,其导致的生态风险也随之增大。近年来,AHTN在陆生生物胡萝卜、蚯蚓和水生生物鱼体内等均有检出,表明AHTN易累积于动植物体内[1-3]。镉是植物非必需且毒性很大的重金属元素之一,它不仅会影响动植物的生长发育,还具有很强的动植物累积性,并通过食物链危害人体健康[4]。由于土壤中的Cd污染主要来源于污泥利用、化肥施用、工业生产、金属采矿和冶炼[5],因此Cd与AHTN在环境中共存也将成为必然。共存重金属会影响有机污染物在动植物体内累积。我们发现在Cd与HHCB不同的浓度组合下,Cd会对HHCB在小麦体内的累积起到促进或抑制作用[6],共存重金属Cd会抑制多环芳烃在蓝藻内的累积[7]。因此,研究重金属存在条件下AHTN在动植物体内的累积对复合污染环境中污染物的迁移转化具有重要意义。
土壤中有机污染物的生物有效性是其在土壤中的重要环境效应之一。生物有效性是指化学物质被生物吸收和可能的毒性,反映了一定时间内化学物质从环境介质中穿过生物膜进入生物体的量[8]。目前,对有机污染物生物有效性的评价方法主要有生物法和化学提取法,其中化学提取法由于其快速、简便的特点受到广泛关注[9]。常用的化学提取方法有温和溶剂提取、固相萃取(Tenax[10]、XRD树脂提取)、固相微萃取(SPME)[11]、三油酸甘油酯-醋酸纤维素复合膜萃取技术(TECAMs)[12]以及液相微萃取技术(LPME)[13]等。Sun等[14]采用Tenax提取法来评估厌氧微生物对多环芳烃的降解效率。Stringer等[15]的研究表明原位SPME萃取可以很好地评估沉积物孔隙水中多环芳烃的浓度和生物可利用性。同时研究表明,化学提取与土壤中污染物的植物吸收、蚯蚓富集等具有很好的相关性[16],但化学提取法对复合污染土壤中多环麝香类物质生物有效性的研究鲜有报道。
本研究以AHTN为多环麝香类物质的代表,分析了重金属Cd污染土壤中AHTN在植物体内的迁移累积,并采用Tenax、SPME、TECAMs提取法评价AHTN和Cd单一及复合污染土壤中AHTN的生物有效性,以期阐明土壤中重金属Cd对AHTN生物有效性的影响,并寻找到一种合适的化学法用来评价复合污染环境中AHTN的生物有效性。
1 材料与方法 1.1 实验材料吐纳麝香AHTN[1-(5,6,7,8-tetrahydro-3,5,5,6,8,8-hexamethyl-2-naphthalenyl-)-Ethanone],纯度≥98%,购自Sigma公司,分子结构式如图 1所示。实验中所用Cd(NO3)2为分析纯,二氯甲烷、正己烷、丙酮等有机试剂均为色谱纯。硅胶(100~200目)、无水硫酸钠和玻璃棉使用前均用二氯甲烷超声2次去除杂质,每次30 min。硅胶在180 ℃活化12 h,并用3%的超纯水脱活,然后存于正己烷中备用。无水硫酸钠在450 ℃下干燥6 h。供试土壤采自沈阳,其理化性质如表 1所示。小麦种子购自天津农业科学院。
|
| 图 1 AHTN分子结构式 Figure 1 Structural formula of AHTN |
土壤用吐纳麝香的丙酮溶液染毒,染毒浓度为10 mg·kg-1,然后置于阴凉处一年后进行实验。实验共设7个处理组,各处理组AHTN和Cd表观浓度(以土壤干重计)分别为0、5、10 mg·kg-1及0、10、100 mg·kg-1,每处理组3个重复。
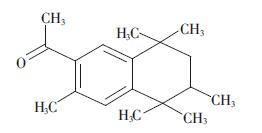
将染毒土按每盆800 g装入特制的根际盒中,如图 2所示。Cd(NO3)2以水溶液的形式加入上述土壤中,使土壤含水量保持在24%(质量分数),平衡48 h后混匀并种植小麦。选出籽粒饱满的小麦种子,种植前用10%的双氧水灭菌10 min,然后用蒸馏水反复冲洗数次后种植,每盆30粒种子,每处理组3个重复。将种植后的根际盒置于人工气候箱中培养,温度为(25±2) ℃,12 h光照,每日适量补充水分。培养2个月后,收获小麦植株,分地下和地上部分分别存放,冷冻干燥后称重,测定AHTN的含量。
|
| 图 2 根际盒示意图 Figure 2 Schematic diagram of rhizosphere box 图中间的4个框分别代表4块尼龙网隔板,每块隔板之间的水平距离为3 mm |
样品经冷冻干燥后,进行研磨粉碎,参照文献[17]进行索氏萃取。萃取液用旋转蒸发仪浓缩至1~2 mL,再用自制的固相萃取小柱净化,洗脱液经氮吹至近干后,用色谱纯正己烷定容至1 mL,待测。
1.2.3 Tenax-TA、SPME和TECAMs提取土壤中AHTN的方法取2 g染毒土于40 mL棕色试剂瓶中,依次加入1 mL 1 mg·L-1的叠氮化钠(NaN3)水溶液,39 mL超纯水,0.1 g Tenax树脂,每组设3个平行。于25 ℃、150 r·min-1的恒温摇床中振荡24 h,之后在3000 r·min-1的离心机中离心10 min,用钢勺取出其中的树脂,加入10 mL正己烷超声萃取30 min 2次,萃取液用旋转蒸发仪浓缩至1~2 mL,转移氮吹至近干,用色谱纯正己烷定容至1 mL,过0.45 μm的有机滤膜,储存待测。
取2 g染毒土于8 mL棕色小瓶中,加入1 mL NaN3水溶液,3 mL超纯水,3根4 cm长的SPME纤维丝,每组3个平行,于25 ℃、150 r·min-1的恒温摇床中振荡12 h,之后取出纤维丝,用湿纸巾擦干,加入8 mL正己烷超声萃取30 min 2次,然后以同样的方法进行旋蒸,氮吹,定容至1 mL,过0.45 μm的有机滤膜,待测。
取5 g染毒土于40 mL棕色试剂瓶中,加入1 mL NaN3水溶液,10 mL超纯水,4片2 cm×3 cm的自制TECAMs膜,每组3个平行,于25 ℃、150 r·min-1的恒温摇床中振荡12 h,取出TECAMs膜,用蒸馏水洗净,加入15 mL正己烷超声萃取30 min 2次,以相同的方法进行旋蒸,氮吹,定容至1 mL,过0.45 μm的有机滤膜,待测。
1.3 AHTN的含量分析AHTN含量的测定采用气质联用仪(Agilent 7890A GC-5975C MS),色谱柱型号为J&W HP-5MS(30 m×0.25 mm×0.25 μm),用SIM模式进行分析,定量离子为243,离子源电压为70 eV,温度为230 ℃。气相色谱升温程序为:从100 ℃开始,保持1 min,以30 ℃·min-1升至280 ℃;进样口温度为270 ℃,载气流速为2 mL·min-1。升温程序运行的总时间为7 min,AHTN的出峰时间为4.822 min。
1.4 数据处理实验结果用“平均值±标准偏差”表示,用SPSS统计软件进行分析,用ANOVA进行显著性分析,显著性水平为P<0.05。
2 结果与讨论 2.1 AHTN和Cd对小麦植株生物量的影响种植2个月后小麦植株各部位生物量如表 2所示。单一AHTN污染土壤中小麦植株地下和地上部生物量均低于对照组,且AHTN浓度越高,小麦植株生物量越低。AHTN和Cd复合污染土壤中小麦生物量均低于AHTN单一污染土壤,说明AHTN-Cd复合污染的毒性效应大于AHTN单一污染。许超等[18]通过盆栽实验研究了两种基因型玉米的生长对土壤Cd和芘复合污染的响应,结果表明Cd与芘复合污染显著降低了白玉米和黑玉米茎、叶和根的生物量,特别是根的生物量。本课题组前期研究HHCB和Cd污染对小麦生物量的影响时发现,复合污染处理组植物生物量低于单一HHCB处理组[6]。AHTN与HHCB同属于多环麝香,且化学性质相似,尽管本研究中AHTN污染土壤经过老化,但是二者对小麦生物量的影响仍具有相似性。Cd是植物非必需且毒性最大的金属元素之一,植物受到Cd毒害的常见症状有生长缓慢和萎黄等。因此,Cd的共存加剧了多环麝香对小麦植株生长的抑制作用。
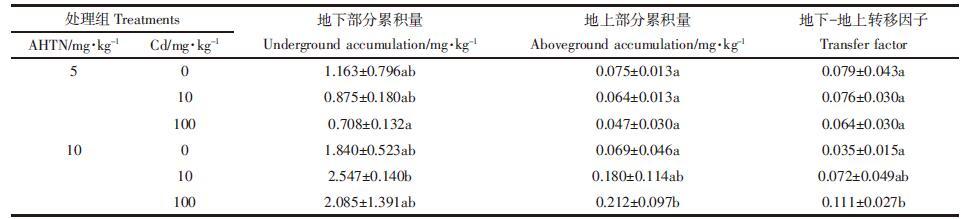
土壤中不同浓度的Cd对小麦植株中AHTN生物有效性的影响如表 3所示。当AHTN浓度为5 mg·kg-1时,共存Cd抑制AHTN在植物地下和地上部位的积累,降低了AHTN对小麦的生物有效性,且重金属Cd浓度越高,抑制作用越强,抑制率最高达39.1%。Sun等[19]研究发现Cd、Pb和Cu抑制苯并芘在根际的去除率,其中Cd的抑制作用最为明显。在AHTN浓度为10 mg·kg-1时,Cd的存在促进了小麦根系对AHTN的吸收,增强了AHTN对小麦的生物有效性,促进率最高达38.4%。本课题组在HHCB和Cd复合污染对小麦幼苗的影响研究中也有类似的结果,潮土中Cd可显著促进HHCB在小麦根部的累积[6]。这可能是由于Cd2+与细胞膜表面的亲水基团发生配合反应,使细胞膜表面亲水基的亲水性减弱,有利于疏水性的AHTN与细胞膜接近[20]。另外,有研究表明 Cd2++能够影响生物的耐受性,减少异生质的外排[21],可能导致AHTN的累积量即生物有效性的提升。由于人工合成麝香具有亲脂性和难降解性,环境中的人工合成麝香一旦被动植物吸收,就有可能长久地蓄积在这些生物体内,最终使处在食物链顶端的消费者,如人类成为受害最深的生物[22]。因此,研究Cd对AHTN在小麦体内累积的影响对准确评价复合污染环境中AHTN的生态风险提供了科学依据,有关内在机理需进一步探讨。
|
通过计算转移因子得知,AHTN在小麦体内的转移同样受到Cd的影响(表 3)。在AHTN浓度为5 mg·kg-1时,AHTN在小麦体内从地下到地上的迁移随着Cd浓度的增加受到抑制,且浓度越高抑制性越强,抑制率可达到19.0%,即Cd的存在间接抑制了AHTN对小麦的生物有效性;在AHTN浓度为10 mg·kg-1时,AHTN从地下到地上的迁移受到诱导,诱导作用随着Cd浓度的增加而增强,促进率高达68.5%,即Cd浓度的增加间接促进了AHTN对小麦的生物有效性。这与Cd存在时AHTN在小麦体内的生物有效性变化规律基本一致。周启星等[23]在研究乙草胺和铜的复合污染时也发现了类似的结论,在低浓度铜和乙草胺的复合污染中,乙草胺抑制了茎和叶对铜的吸收;而在高浓度铜和乙草胺的复合污染中,乙草胺促进了茎和叶对铜的吸收。这是因为在复合污染时,污染物的生物有效性及生物毒性不仅与污染物的理化性质有关,还与复合污染物的浓度组合之间有着密不可分的关系。
2.3 AHTN-Cd单一及复合污染土壤中Tenax、SPME、TECAMs提取AHTN量与小麦根部AHTN累积量的相关性将AHTN-Cd单一及复合污染土壤中Tenax 24 h提取的AHTN量与小麦根部AHTN的累积量进行相关性分析(图 3),发现Tenax 24 h提取量与植物根部累积量之间存在显著的正相关关系(R2=0.969 2,P<0.05),表明Tenax 24 h提取可以在一定程度上作为AHTN生物有效性的预测方法之一。重金属Cd存在时,两者仍呈现显著的正相关关系,说明Tenax 24 h提取也可以用来评价AHTN-Cd复合污染土壤中AHTN对小麦的生物有效性。Harwood等[24]的研究表明在实验室环境和野外环境均可用Tenax提取法对多种疏水性有机物的生物有效性进行评估。这是因为Tenax可以不断吸附土壤孔隙水中的污染物,从而导致与土壤结合力较弱的那部分污染物因为热力学平衡关系不断解吸进入土壤孔隙水中,最终在两者之间达到平衡[25]。
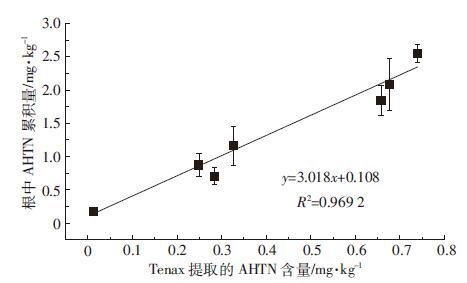
|
| 图 3 AHTN-Cd单一及复合污染土壤中Tenax提取AHTN的量与小麦根部AHTN累积量之间的关系 Figure 3 Relationship between AHTN concentrations extracted by Tenax and AHTN concentrations in wheat roots exposed in soil polluted individually and jointly by AHTN and Cd |
从SPME 12 h提取AHTN-Cd单一及复合污染土壤中AHTN的实验结果可以看出(图 4),AHTN-Cd单一及复合污染土壤中SPME提取的AHTN量和小麦根部AHTN的累积量之间具有很好的线性相关性(R2=0.936 5,P<0.05),表明SPME能很好地表征土壤中AHTN-Cd单一及复合污染土壤中AHTN的生物有效性,重金属Cd存在时,SPME提取法也可以用来评价土壤中AHTN的生物有效性。Maruya等[26]的研究指出SPME被动采样法可以作为预测沉积物中有机氯农药在生物体内积累的有效方法。由于SPME作为一种平衡采样器,能预测化学物质在间隙水中真实的自由溶解态浓度和内暴露浓度,被广泛用于模拟水体和土壤环境中的生物富集行为,并以此预测环境介质中有机污染物的生物有效性[27]。

|
| 图 4 AHTN-Cd单一及复合污染土壤中SPME提取AHTN的量与小麦根部AHTN累积量之间的关系 Figure 4 Relationship between AHTN concentrations extracted by SPME and AHTN concentrations in wheat roots exposed in soil polluted individually and jointly by AHTN and Cd |
同样,TECAMs从AHTN-Cd单一及复合污染土壤中提取的AHTN量与小麦根部累积的AHTN量之间也呈显著的正相关关系(R2=0.891 8,P<0.05),如图 5所示,这表明TECAMs具有替代小麦用于评价AHTN-Cd单一及复合污染土壤中AHTN生物有效性的作用。TECAMs膜中的酯成分类似于植物体内的脂肪组织,能有效并迅速地富集水中自由溶解态的疏水性有机物,模拟生物组织对目标污染物进行积累直至分配平衡,从而达到预测的目的[28],因此具有很好的应用前景。Ke等[29]的研究表明,TECAMs能有效并迅速地富集水中自由溶解态的疏水性有机物。Tao等[7]利用TECAMs膜研究了Cd对多环芳烃在蓝藻体内累积量变化的相关机制,Wang 等[30]利用TECAMs膜提取方法评价了生物炭对多氯联苯对陆生植物生物有效性的影响。
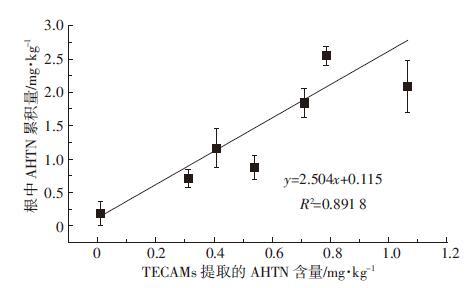
|
| 图 5 AHTN-Cd单一及复合污染土壤中TECAMs提取AHTN的量与小麦根部AHTN累积量之间的关系 Figure 5 Relationship between AHTN concentrations extracted by TECAMs and AHTN concentrations in wheat roots exposed in soil polluted individually and jointly by AHTN and Cd |
综上所述,3种化学提取法都可用于评价AHTN-Cd单一及复合污染土壤中AHTN对小麦的生物有效性,相比于生物法省时省力。SPME和TECAMs是目前应用较广泛的用于选择性地测定自由溶解态浓度的被动采样技术,它们是通过平衡分配理论推测能从固相解吸进入水相的组分,而Tenax通过解吸的难易程度推测可能解吸进入水相的组分。尽管3种方法提取机理有所差异,但它们从土壤中提取的AHTN量和植物累积量存在显著的正相关关系。同时,不同浓度的Cd存在时,Tenax、SPME和TECAMs 3种方法提取的土壤中AHTN量与小麦根部累积的AHTN量之间也存在显著的正相关性,即在重金属Cd存在时,3种化学法仍可替代小麦等生物法来评价土壤中AHTN的生物有效性。3种方法从AHTN-Cd单一及复合污染土壤中提取的AHTN浓度高低关系为SPME>TECAMs>Tenax,其中SPME的吸附量与小麦根的累积量最相近,说明SPME这种被动采样技术更适合于评价AHTN-Cd单一及复合污染土壤中AHTN对小麦植株的生物有效性。由于Tenax固相萃取技术提取的是AHTN-Cd单一及复合污染土壤中AHTN的快解吸部分,而其吸附量低于小麦根的累积量,可推测随着染毒时间的延长,土壤中AHTN的慢解吸部分也能被小麦累积,只是比较缓慢,其机理还有待进一步证明。由于复合污染土壤中污染物之间的协同和拮抗作用很复杂,如果能够找到一种化学方法评价复合污染环境中污染物的生物有效性,并通过模型建立化学评价法与生物法之间的相关关系,这将使复合污染环境中生态风险的评价变得更加省时省力,因此我们将继续完善此方法并对其内在机制进行深入探讨。
3 结论(1) 单一AHTN处理组小麦植株生物量显著低于对照组,AHTN-Cd复合污染处理组小麦植株生物量低于单一AHTN处理组。
(2) AHTN浓度为5 mg·kg-1时,Cd抑制AHTN在植物体内的累积;AHTN浓度为10 mg·kg-1时,Cd则促进AHTN在植物体内累积。AHTN浓度为5 mg·kg-1时,AHTN在小麦体内从地下到地上的迁移随着Cd浓度的增加受到抑制;AHTN浓度为10 mg·kg-1时,AHTN从地下到地上的迁移受到诱导。表明不同浓度的Cd对AHTN在小麦体内的生物有效性产生了不同程度的抑制或促进作用。
(3) 在AHTN单一和AHTN-Cd复合污染中,Tenax、SPME、TECAMs法的提取量与植物根部累积量之间呈线性相关,说明可以用Tenax、SPME、TECAMs提取法评价重金属Cd污染土壤中AHTN的生物有效性。
| [1] | Litz N T, Muller J, Bohmer W. Occurrence of polycyclic musks in sewage sludge and their behaviour in soil sand plants[J]. Journal of Soils and Sediments, 2007, 7 (1) :36–44 . |
| [2] | Chen G S, Jiang R F, Qiu J L, et al. Environmental fates of synthetic musks in animal and plant:An invivo study[J]. Chemosphere, 2015, 138 :584–591 . |
| [3] | Wu M W, Yeh P C, Chen H C, et al. A microwave-assisted headspace solid-phase microextraction for rapid determination of synthetic polycyclic and nitro-aromatic musks in fish samples[J]. Journal of the Chinese Chemical Society, 2013, 60 (9) :1169–1174 . |
| [4] | Smeets K, Opdenakker K, Remans T, et al. Oxidative stress-related responses at transcriptional and enzymatic levels after exposure to Cd or Cu in a multipollution context[J]. Journal of Plant Physiology, 2009, 166 (18) :1982–1992 . |
| [5] | 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22 (10) : 1727–1736 . FAN Ting, YE Wen-ling, CHEN Hai-yan, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environmental Sciences, 2013, 22 (10) :1727–1736 . |
| [6] | 陈翠红, 周启星, 张志能, 等. 土壤中佳乐麝香和镉污染对苗期小麦生长及其污染物累积的影响[J]. 环境科学, 2011, 32 (2) : 199–205 . CHEN Cui-hong, ZHOU Qi-xing, ZHANG Zhi-neng, et al. Effects of soil HHCB and Cd contamination on the growth of wheat seedlings(Triticum aestivum) and the pollutants accumulation in plants[J]. Environmental Science, 2011, 32 (2) :199–205 . |
| [7] | Tao Y Q, Xue B, Yang Z, et al. Effects of metals on the uptake of polycyclic aromatic hydrocarbons by the cyanobacterium Microcystis aeruginosa[J]. Chemosphere, 2015, 119 :719–726 . |
| [8] | Semple K T, Doick K J, Jones K C, et al. Defining bioavailability and bioaccessibility of contaminated soil and sediment is complicated[J]. Environmental Science and Technology, 2004, 38 (12) :228–231 . |
| [9] | 陈珊, 许宜平, 王子健. 有机污染物生物有效性的评价方法[J]. 环境化学, 2011, 30 (1) : 158–164 . CHEN Shan, XU Yi-ping, WANG Zi-jian. Methods for evaluating the bioavailability of organic contaminats in environments[J]. Environmental Chemistry, 2011, 30 (1) :158–164 . |
| [10] | Yang X L, Wang F, Gu C G, et al. Tenax TA extraction to assess the bio-availability of DDTs in cotton field soils[J]. Journal of Hazardous Materials, 2010, 179 (1/3) :676–683 . |
| [11] | Cui X Y, Bao L J, Gan J. Solid-phase microextraction(SPME) with stable isotope calibration for measuring bioavailability of hydrophobic organic contaminants[J]. Environmental Science and Technology, 2013, 47 (17) :9833–9840 . |
| [12] | Wang Y, Wang Y J, Wang L, et al. Reducing the bioavailability of PCBs in soil to plant by biochars assessed with triolein-embedded cellulose acetate membrane technique[J]. Environmental Pollution, 2013, 174 (5) :250–256 . |
| [13] | De Bairros A V, De Almeidaa R M, Pantaleao L, et al. Determination of low levels of benzodiazepines and their metabolites in urine by hollow-fiber liquid-phase microextraction(LPME) and gas chromatography mass spectrometry(GC-MS)[J]. Journal of Chromatography B, 2015, 975 :24–33 . |
| [14] | Sun M M, Ye M, Hu F, et al. Tenax extraction for exploring rate-limiting factors in methyl-beta-cyclodextrin enhanced anaerobic biodegradation of PAHs under denitrifying conditions in a red paddy soil[J]. Journal of Hazardous Materials, 2014, 264 :505–513 . |
| [15] | Stringer R D, Burken J G, Elmore A C, et al. Using in situ solid phase microextraction(SPME) for depth profiling in sediments treated with activated carbon[J]. Journal of Soils Sediments, 2014, 14 (5) :1013–1020 . |
| [16] | Gomez-Eyles J L, Collins C D, Hodson M E. Relative proportions of polycyclic aromatic hydrocarbons differ between accumulation bioassays and chemical methods to predict bioavailability[J]. Environmental Pollution, 2010, 158 (1) :278–284 . |
| [17] | Chen C H, Zhou Q X, Cai Z, et al. Effects of soil polycyclic musk and cadmium on pollutant uptake and biochemical responses of wheat(Triticum aestivum)[J]. Archives of Environmental Contamination and Toxicology, 2010, 59 (4) :564–573 . |
| [18] | 许超, 夏北成. 玉米根系形态对土壤Cd和芘复合污染的响应[J]. 生态环境, 2007, 16 (3) : 771–774 . XU Chao, XIA Bei-cheng. Responses of maize(Zea mays L.) root morphology to Cd and pyrene contamination in soil[J]. Ecology and Environment, 2007, 16 (3) :771–774 . |
| [19] | Sun Y B, Zhou Q X, Xu Y M, et al. Phytoremediation for co-contaminated soils of benzo[J]. Journal of Hazardous Materials, 2011, 186 (2/3) :2075–2082 . |
| [20] | Cao Q, Hu Q H, Khan S, et al. Wheat phytotoxicity from arsenic and cadmium separately and together in solution culture and in a calcareous soil[J]. Journal of Hazardous Materials, 2007, 148 (1/2) :377–382 . |
| [21] | Timofeyev M A, Shatilina Z M, Bedulina D S, et al. Natural organic matter(NOM) has the potential to modify the multixenobiotic resistance(MXR) activity in freshwater amphipods Eulimnogammarus cyaneus and E. verrucosus[J]. Comparative Biochemistry and Physiology, Part B:Biochemistry and Molecular Biology, 2007, 146 (4) :496–503 . |
| [22] | 周启星, 王美娥, 范飞, 等. 人工合成麝香的环境污染、生态行为与毒理效应研究进展[J]. 环境科学学报, 2008, 28 (1) : 1–11 . ZHOU Qi-xing, WANG Mei-e, FAN Fei, et al. Research progress in environmental pollution ecological behavior and toxicological effects of synthetic musks[J]. Acta Scientiae Circumstantiae, 2008, 28 (1) :1–11 . |
| [23] | 周启星, 孔繁翔, 朱琳. 生态毒理学[M]. 北京: 科学出版社, 2004 : 68 -74. ZHOU Qi-xing, KONG Fan-xiang, ZHU Lin. Ecotoxicology[M]. Beijing: Science Press, 2004 : 68 -74. |
| [24] | Harwood A D, Nutile S A, Landrum P F, et al. Tenax extraction as a simple approach to improve environmental risk assessments[J]. Environmental Toxicology and Chemistry, 2015, 34 (7) :1445–1453 . |
| [25] | Liu M, Tian S, Chen P, et al. Predicting the bioavailability of sediment-associated polybrominated diphenyl ethers using a 45 d sequential tenax extraction[J]. Chemosphere, 2011, 85 (3) :424–431 . |
| [26] | Maruya K A, Lao W J, Tsukada D, et al. A passive sampler based on solid phase microextraction(SPME) for sediment-associated organic pollutants:Comparing freely-dissolved concentration with bioaccumulation[J]. Chemosphere, 2015, 137 :192–197 . |
| [27] | Kraaij R, Mayer P, Busser F J M, et al. Measured porewater concentrations make equilibrium partitioning work a data analysis[J]. Environmental Science and Technology, 2003, 37 (2) :268–274 . |
| [28] | Xu Y, Wang Z, Ke R, et al. Accumulation of organochlorine pesticides from water using triolein embedded cellulose acetate membranes[J]. Environmental Science and Technology, 2005, 39 (4) :1152–1157 . |
| [29] | Ke R, Luo J, Sun L, et al. Predicting bioavailability and accumulation of organochlorine pesticides by Japanese medaka in the presence of humic acid and natural organic matter using passive sampling membranes[J]. Environmental Science and Technology, 2007, 41 (19) :6698–6703 . |
| [30] | Wang Y, Wang Y J, Wang L, et al. Reducing the bioavailability of PCBs in soil to plant by biochars assessed with triolein-embedded cellulose acetate membrane technique[J]. Environmental Pollution, 2013, 174 :250–256 . |
 2016, Vol. 35
2016, Vol. 35