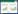文章信息
- 刘仕翔, 黄益宗, 罗泽娇, 黄永春, 保琼莉, 王培培, 袁彪, 李文华
- LIU Shi-xiang, HUANG Yi-zong, LUO Ze-jiao, HUANG Yong-chun, BAO Qiong-li, WANG Pei-pei, YUAN Biao, LI Wen-hua
- 外源褪黑素处理对镉胁迫下水稻种子萌发的影响
- Effects of exogenous melatonin on germination of rice seeds under Cd stresses
- 农业环境科学学报, 2016, 35(6): 1034-1041
- Journal of Agro-Environment Science, 2016, 35(6): 1034-1041
- http://dx.doi.org/10.11654/jaes.2016.06.003
文章历史
- 收稿日期: 2015-11-10
2. 农业部环境保护科研监测所, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China
随着工农业生产的迅猛发展,各种污染物不断排放,并在环境中不断累积和转化,导致土壤环境污染日益严重。土壤重金属污染因其高富集、难降解、毒性强等原因越来越受到人们的广泛关注。近年来我国土壤重金属污染问题越来越严重,据报道,我国受Cd、As、Pb、Hg、Zn等重金属污染的耕地面积近2000万hm2,约占总耕地面积的五分之一;每年因重金属污染减产粮食超1000万t,被重金属污染粮食达1200万t,由此造成的经济损失至少达200亿元[1]。据2014年环保部和国土资源部联合发布的全国首次土壤污染状况调查公报[2]显示,我国土壤总样点超标率为16.1%,耕地超标率达到19.4%,其中重金属超标比较严重,Cd污染超标不断加重。长江三角洲、珠江三角洲、东北老工业基地等部分区域土壤污染问题比较突出,西南、中南地区土壤重金属超标范围较大。土壤重金属污染来源主要是人为来源,包括矿产开采、金属冶炼、化工、汽车尾气排放、污泥使用、污水灌溉、农药和化肥施用、大气沉降等[3]。土壤中重金属通过植物吸收、积累、富集,并通过食物链途径进入人体,从而对人类健康造成威胁,因而有必要采取不同技术措施对重金属污染进行有效修复。
Cd是水稻生长发育非必需元素,水稻对其有一定的耐受性。研究表明低浓度Cd对水稻的生长表现出一定的促进作用,但当Cd浓度增加时,水稻的生长会受到明显抑制[4]。Cd可通过抑制种子中的淀粉酶、蛋白酶活性影响淀粉和蛋白质的分解,从而对种子萌发产生影响[5]。水稻作为我国主要粮食作物,种子萌发时期幼芽的生长状况对其日后的生长及产量有重要的影响,因而提高水稻种子在萌发时期对重金属的耐受性,缓解重金属对水稻种子萌发的毒害作用就显得尤为重要。褪黑素(Melatonin,MT),又名果体素,1958年首次从牛的松果体分离出来[6],早期被认为仅存在于动物体内,其与生物个体的发育、生殖等调节机制密切相关。由于褪黑素廉价易得,医学上早已将其用于疾病的预防和重金属造成的神经毒害的缓解[7]。随着近年来褪黑素在越来越多的植物体内被发现,其在植物体内的作用逐渐被人们所认知[8]。越来越多的研究发现,外源褪黑素的添加能提高植物对逆境(紫外线辐射、高温、低温、干旱、重金属等胁迫)的耐受性以及提高植物对病虫害的抵抗能力[9-13],褪黑素对植物逆境的缓解作用主要通过清除自由基、提高抗氧化酶活性等方式实现。Turk等[14]的研究发现通过调节矿质元素及抗氧化能力,外源施加褪黑素能缓解低温导致的水稻种子氧化损伤。Tal等[15]的研究表明,大型海藻在不同重金属(Cd、Pb、Zn等)的胁迫下,褪黑素的含量均明显增加,其中金属Cd对褪黑素含量的影响最大,Pb和Zn的影响相对较小。这也证明了内源褪黑素对Cd毒害的缓解作用及外源褪黑素的施加对缓解植物重金属胁迫的可行性。然而迄今为止褪黑素对Cd胁迫下植物生长发育的影响尚未见报道。本文以水稻为研究对象,探讨外源褪黑素添加对Cd胁迫下水稻种子萌发的影响。
1 材料与方法 1.1 材料水稻品种为湘早灿24号。选取饱满的水稻种子,在试验前均用3%NaClO浸泡消毒10 min,蒸馏水反复冲洗3~5遍。
1.2 实验方法在预实验中,设置5、10、20、50、100、200 μmol·L-1 6个不同Cd浓度处理,选出与空白处理相比对水稻幼苗萌发产生不同程度影响的10、100 μmol·L-1两个处理浓度作为正式Cd处理浓度实验,即设置3个Cd浓度处理0、10、100 μmol·L-1。褪黑素处理浓度参考Posmyk等[12]和Zhang等[16]早期对外源褪黑素抗逆研究所选用的浓度,设置4个褪黑素浓度处理:0、10、100、1000 μmol·L-1。共组合成12个实验处理。Cd以CdCl2形式加入。将消毒过的种子均匀放入直径9 cm的培养皿中,内铺两层无菌试纸。每个培养皿50粒种子,按照设置浓度加入10 mL含有Cd和褪黑素的处理液,移入28 ℃生化培养箱中进行暗培养。每个处理3次重复。培养期间每日观察和记录种子的发芽情况,并用称重法补充蒸发的水分。
1.3 测定项目与方法 1.3.1 萌发指标测定培养时期每天记录水稻种子萌发的数量,第3 d统计种子的发芽势,第8 d测定水稻幼芽的根长、芽长、根鲜重和芽鲜重(其中芽鲜重、根鲜重按皿计算),并统计水稻种子的发芽率。发芽势和发芽率的计算公式如下:
发芽势=3 d内发芽种子粒数/供试种子数×100%
发芽率=8 d内发芽种子粒数/供试种子数×100%
1.3.2 生理指标测定取萌发8 d的幼芽,于-80 ℃下超低温保存,用于生理指标的测定。水稻根系活力用α-萘胺法测定[17],丙二醛(MDA)含量的测定参考《植物生理生化实验原理和技术》[18],超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的测定采用Zhang等[16]的方法。采用根系扫描仪(Epson Expression 10000XL)对水稻根系进行扫描,并用WinRhizo根系分析软件进行根形态指标分析。
1.4 数据处理实验数据采用Origin 9.0和 SPSS 19统计分析软件进行分析及差异显著性检验。对不同处理的数据进行单因素方差分析(ANOVA)和Duncan多重比较。数据以平均值±标准差表示。
2 结果与分析 2.1 褪黑素对水稻种子发芽率和发芽势的影响图 1为外源添加褪黑素对Cd胁迫下水稻种子发芽率的影响。Cd胁迫对水稻种子的发芽势和发芽率均有降低作用,10 μmol·L-1 Cd胁迫分别降低水稻种子发芽势和发芽率5%和8%,100 μmol·L-1 Cd胁迫降低水稻种子发芽势和发芽率幅度均为6%。褪黑素添加对Cd胁迫下水稻种子发芽具有一定的促进作用。当Cd浓度为10 μmol·L-1时,添加10 μmol·L-1褪黑素相比对照处理显著提高水稻种子发芽率7.8%,而添加100、1000 μmol·L-1褪黑素时种子发芽率没有显著变化;当Cd浓度提高到100 μmol·L-1时,添加100 μmol·L-1褪黑素相比对照处理显著提高水稻种子发芽率5.3%。褪黑素浓度过高抑制水稻种子的发芽,在没有Cd胁迫时,10、100 μmol·L-1褪黑素添加对水稻种子发芽没有影响,而当其浓度提高到1000 μmol·L-1时,水稻种子发芽率比对照降低5.7%。
|
| 图 1 褪黑素(MT)对Cd胁迫下水稻种子发芽率的影响 Figure 1 Effects of exogenous melatonin on germination rates of rice seeds under Cd stresses 不同小写字母表示同一Cd处理不同褪黑素处理之间差异显著(P<0.05)。下同 |
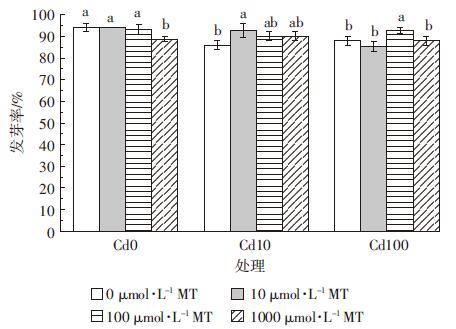
外源添加褪黑素对Cd胁迫下水稻种子发芽势的影响见图 2。外源添加褪黑素对Cd胁迫下水稻种子发芽势也有一定的促进作用。当Cd浓度为100 μmol·L-1时,与没有添加褪黑素的对照相比,添加10、100、1000 μmol·L-1褪黑素分别提高水稻种子发芽势9.0%、10.2%和5.6%。褪黑素浓度过高对水稻种子的发芽势有抑制作用,在没有Cd胁迫时,1000 μmol·L-1褪黑素导致水稻种子发芽势比对照降低6.1%。
|
| 图 2 褪黑素(MT)对Cd胁迫下水稻种子发芽势的影响 Figure 2 Effects of exogenous melatonin on germination potentials of rice seeds under Cd stresses |
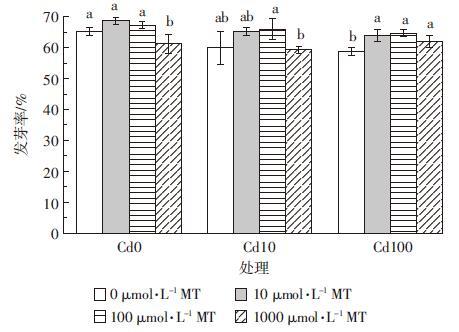
外源添加褪黑素对Cd胁迫下水稻根长、芽长的影响如图 3所示。Cd胁迫下,水稻幼芽、根的生长受到明显的限制,根系尤为显著。10 μmol·L-1 Cd胁迫下,与对照组相比水稻幼芽芽长、根长分别下降了19.9%和25.3%;而100 μmol·L-1 Cd胁迫下,相应指标下降幅度更为明显,分别为33.2%和50.2%。 外源褪黑素的添加对Cd胁迫下水稻根长有明显的促进作用。当Cd浓度为10 μmol·L-1时,与没有添加褪黑素的对照相比,添加10 μmol·L-1褪黑素显著提高根长19.3%;当Cd胁迫浓度达100 μmol·L-1时,100、1000 μmol·L-1褪黑素相比对照处理均提高水稻根长28.9%,而当褪黑素浓度提高至1000 μmol·L-1时,对根长的影响反而表现为抑制作用,比对照处理下降39.5%。外源褪黑素的加入对Cd胁迫下水稻芽长的变化没有显著影响。在没有Cd胁迫时,添加1000 μmol·L-1褪黑素使水稻芽长比对照处理下降13.3%。
|
| 图 3 褪黑素(MT)对Cd胁迫下水稻幼芽根长和芽长的影响 Figure 3 Effects of exogenous melatonin on root and shoot length of rice seedlings under Cd stresses |
图 4为外源褪黑素添加对Cd胁迫下水稻根鲜重和芽鲜重的影响。Cd胁迫下,水稻幼芽芽鲜重、根鲜重明显下降。与对照处理相比,10 μmol·L-1 Cd胁迫下,与对照组相比水稻幼芽芽鲜重、根鲜重分别下降了21.2%、43.9%;而100 μmol·L-1 Cd胁迫下,相应指标下降幅度更为明显,分别为50.7%、67.2%。添加外源褪黑素能明显提高水稻的根鲜重。当Cd浓度为10 μmol·L-1时,与没有添加褪黑素的对照相比,添加10 μmol·L-1褪黑素使水稻根鲜重提高40.0%;当Cd胁迫浓度为100 μmol·L-1时,10、100 μmol·L-1褪黑素的添加使水稻根鲜重分别比对照处理提高31.0%和42.0%,但当褪黑素浓度为1000 μmol·L-1时,根鲜重反而下降35.7%。外源褪黑素的添加对水稻芽鲜重也有一定的提高作用。10 μmol·L-1 Cd胁迫下,添加10 μmol·L-1褪黑素相比对照处理明显提高水稻芽鲜重9.6%,而添加100、1000 μmol·L-1褪黑素对水稻芽重没有显著影响;当Cd浓度增加到100 μmol·L-1时,与对照处理相比,添加100 μmol·L-1褪黑素可提高8.1%芽鲜重,但是褪黑素浓度为10、1000 μmol·L-1时,对Cd胁迫下水稻芽鲜重无明显影响。在无Cd胁迫的情况下,10、100 μmol·L-1褪黑素对水稻芽鲜重无明显影响,1000 μmol·L-1褪黑素会导致水稻芽鲜重下降7.0%。

|
| 图 4 褪黑素(MT)对Cd胁迫下水稻幼芽根鲜重、芽鲜重的影响 Figure 4 Effects of exogenous melatonin on root and shoot fresh weights of rice under Cd stresses |
外源添加褪黑素对Cd胁迫下水稻幼芽MDA含量的影响见图 5。Cd胁迫下,MDA含量随着Cd胁迫浓度的增加而上升,在10、100 μmol·L-1 Cd处理后,相对于对照组MDA分别增加了40.1%和66.8%。添加褪黑素可显著降低Cd胁迫下水稻幼芽的MDA含量。Cd浓度为10 μmol·L-1时,添加10 μmol·L-1褪黑素使MDA含量从对照处理的358.0 nmol·g-1 FW下降至312.0 nmol·g-1 FW,当褪黑素浓度提高到100、1000 μmol·L-1时,MDA含量有所上升,但依然显著低于没有添加褪黑素的对照组;当Cd浓度提高到100 μmol·L-1时,添加100 μmol·L-1褪黑素对MDA含量影响最大,从对照处理的424.3 nmol·g-1 FW降至356.0 nmol·g-1 FW,降低幅度为16.1%。
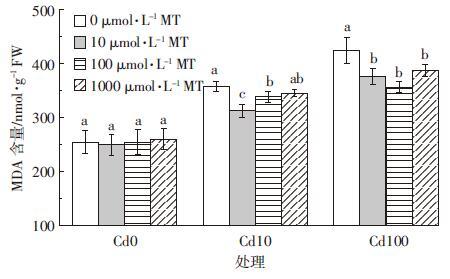
|
| 图 5 褪黑素(MT)对Cd胁迫下水稻幼芽MDA含量的影响 Figure 5 Effects of exogenous melatonin on MDA content of rice shoots under Cd stresses |
图 6为添加外源褪黑素对Cd胁迫下水稻幼芽POD活性的影响。外源褪黑素添加能显著提高Cd胁迫下水稻幼芽的POD活性。Cd胁迫浓度为10 μmol·L-1时,添加10、100、1000 μmol·L-1褪黑素相比对照组使水稻幼芽POD活性分别提高21.5%、31.3%和42.2%;当Cd浓度为100 μmol·L-1时,添加10、100、1000 μmol·L-1褪黑素相比对照组POD活性分别提高21.3%、40.6%和45.5%。外源褪黑素添加也可以显著提高Cd胁迫下水稻幼芽的CAT、SOD活性(图 7和图 8),其变化趋势与POD类似。当Cd浓度为10 μmol·L-1时,添加10、100、1000 μmol·L-1褪黑素使水稻幼芽CAT活性分别比对照处理提高62.2%、75.7%和74.8%,SOD活性分别提高16.7%、46.9%和54.2%;当Cd胁迫浓度上升至100 μmol·L-1时,10、100、1000 μmol·L-1褪黑素添加使水稻幼芽CAT活性分别比对照处理提高77.8%、143.1%和145.8%,SOD活性分别提高24.2%、32.2%和28.7%。
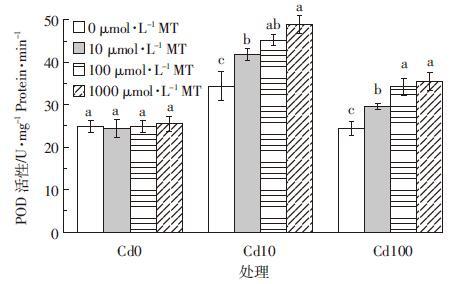
|
| 图 6 褪黑素(MT)对Cd胁迫下水稻幼芽POD酶活性的影响 Figure 6 Effects of exogenous melatonin on POD activity of rice shoots under Cd stresses |

|
| 图 7 褪黑素(MT)对Cd胁迫下水稻幼芽SOD酶活性的影响 Figure 7 Effects of exogenous melatonin on SOD activity of rice shoots under Cd stresses |
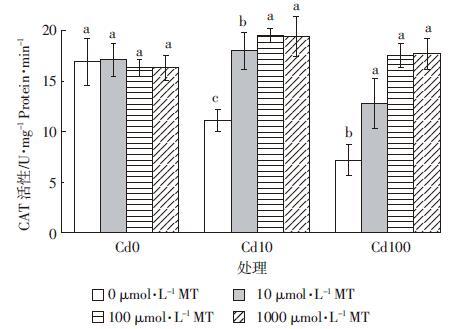
|
| 图 8 褪黑素(MT)对Cd胁迫下水稻幼芽CAT酶活性的影响 Figure 8 Effects of exogenous melatonin on CAT activity of rice shoots under Cd stresses |
图 9为添加外源褪黑素对Cd胁迫下水稻根系活力的影响。10 μmol·L-1 Cd胁迫对水稻幼芽根系活力无明显影响,100 μmol·L-1 Cd能明显降低水稻根系活力,与对照组相比下降了33.1%,添加外源褪黑素能显著提高根系活力。当Cd胁迫浓度为10 μmol·L-1时,添加10、100 μmol·L-1外源褪黑素对根系活力影响不大,而褪黑素浓度为1000 μmol·L-1时却显著地抑制水稻的根系活力;当Cd胁迫浓度提升至100 μmol·L-1时,10、100 μmol·L-1褪黑素均能显著提高水稻根系活力,增幅分别为14.0%和15.2%。
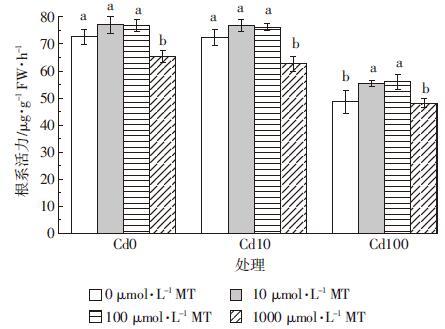
|
| 图 9 褪黑素(MT)对Cd胁迫下水稻根系活力的影响 Figure 9 Effects of exogenous melatonin on rice root activity under Cd stresses |
表 1为添加外源褪黑素对Cd胁迫下水稻根系形态相关参数的影响。在Cd胁迫下,水稻根系总长度、表面积、根体积均有明显的下降趋势,与对照处理相比,10 μmol·L-1 Cd胁迫下分别下降了28.4%、40.0%和50.0%,100 μmol·L-1 Cd胁迫下分别下降了59.1%、60.9%和65.0%。总根尖数在10 μmol·L-1 Cd胁迫下与对照组相比无明显差异,而在100 μmol·L-1 Cd胁迫下,与对照组相比平均值下降了34.9%,效果显著。在Cd胁迫下,根系直径、根分支数与对照组相比没有显著差异。外源褪黑素处理能显著地提高Cd胁迫下水稻的总根长、根表面积和根体积。在10 μmol·L-1 Cd胁迫下,添加10 μmol·L-1褪黑素使水稻总根长、根表面积和根体积分别比对照处理提高84.5%、104.1%和129.9%;而Cd浓度为100 μmol·L-1时,添加100 μmol·L-1褪黑素可分别提高水稻总根长、根表面积和根体积133.7%、100.0%和85.7%。添加褪黑素对Cd胁迫下水稻根系直径也有影响。在10、100 μmol·L-1 Cd浓度胁迫下,添加10 μmol·L-1褪黑素导致水稻根系直径分别比对照处理显著降低11.0%和9.9%。当Cd胁迫浓度为100 μmol·L-1时,添加外源褪黑素对水稻根尖数有一定影响,与未添加褪黑素的对照处理相比,10、100 μmol·L-1褪黑素使水稻根尖数分别比对照处理提高73.7%和93.4%。添加褪黑素对Cd胁迫下水稻分叉数影响不显著。

|
Cd胁迫对植物生长发育有明显的抑制和毒害作用,例如它对水稻的毒害作用主要表现为抑制水稻萌发、生长、细胞分裂,影响水稻的光合作用和呼吸作用,产生氧化胁迫,对细胞结构和亚细胞结构造成损伤[19]。本研究发现Cd胁迫可明显抑制水稻种子的萌发,种子发芽率和发芽势明显下降,水稻幼芽和幼根生长明显受到抑制,添加合适的外源褪黑素则有效缓解了Cd胁迫对水稻种子萌发的影响。这与Tan等[20]报道的有关褪黑素促进Cu胁迫下豌豆种子萌发的结果一致。
Cd胁迫可诱导植物产生包括过氧化氢(H2O2)、超氧自由基(O2-·)、羟基(OH-)等活性氧物质,这些活性氧物质可破坏植物的膜系统,加剧膜脂过氧化程度,影响植物的光合作用等正常生理功能,进而影响诸如脂质、核酸、蛋白质等生物大分子的代谢过程[21-22]。MDA是植物膜脂过氧化评价的重要指标。一般认为,Cd胁迫产生的自由基会损害水稻细胞内的膜系统,导致水稻体内MDA含量增加。本研究也发现Cd胁迫导致水稻幼芽MDA含量显著提高,但是外源褪黑素的添加能显著降低水稻幼芽的MDA含量,说明褪黑素可有效缓解水稻体内的过氧化胁迫。Cd胁迫对植物体内抗氧化酶活性也有明显影响,研究表明Cd胁迫导致的植物抗氧化酶活性变化随着植物基因型的不同而不同[23]。本研究中,在10 μmol·L-1 Cd浓度胁迫下水稻幼芽的POD、SOD活性比没有Cd胁迫时有所提高,但是水稻幼芽CAT活性却随着Cd胁迫浓度的增加而显著降低。外源添加10~1000 μmol·L-1褪黑素均能显著提高Cd胁迫下水稻幼芽的POD、SOD和CAT的活性,而且褪黑素浓度越高这种作用越明显(图 6、图 7、图 8)。POD和CAT可将植物细胞中的H2O2迅速分解为H2O和O2,从而清除过氧化体中产生的H2O2,它们在抑制植物膜脂过氧化方面发挥着重要的作用。SOD是植物体内发现的唯一专职清除O2-·的抗氧化酶,是清除活性氧自由基的关键酶,能把O2-·还原成H2O2,还能将O2-·氧化为O2[24]。褪黑素施用显著提高水稻体内POD、SOD和CAT的活性,从而提高植物清除H2O2、O2-·等活性氧物质的能力。这可能是褪黑素缓解Cd胁迫对水稻毒害的主要机制之一。另外,褪黑素是目前已知的抗氧化作用最强的内源性自由基清除剂[25]。Pieri等[26]发现褪黑素与维生素E、维生素C、还原性谷胱甘肽相比,是更为有效的亲脂性氧化剂,而且褪黑素抗氧化过程的中间产物N1-乙酰基-N2-甲酰基-5-甲氧基犬尿胺(AFMK)和N1-乙酰基-5-甲氧基犬尿胺(AMK)本身也是有效的自由基清除剂,会增加其对自由基的清除能力。植物体内SOD/POD、SOD/CAT比值的平衡也会影响植物的膜脂过氧化状况。Shah等[27]研究发现,SOD的过量表达会加速O2-·转化为H2O2和O2,如果清除H2O2的酶活性无法同等程度地提高,则剩余的H2O2会同O2-·相结合生成氧化性更强的·OH,进而加剧植物的氧化损伤。Kanazawa等[28]也报道SOD/POD、SOD/CAT比值的提升会进一步增加植物体的氧化胁迫。本研究发现,尽管添加褪黑素对水稻幼芽SOD/POD比值影响不大,但是却显著降低Cd胁迫下水稻幼芽SOD/CAT比值,这可能也是褪黑素缓解水稻氧化胁迫、降低Cd毒害的机制之一。
根系作为水稻重要的吸收和代谢器官,其生长、形态对植物营养吸收有重要的作用。根长、根表面积、根体积、根直径、根尖数和根分叉数是评价植物根系生长发育、养分吸收、与环境介质互动的重要指标。Cd胁迫对水稻根系生长发育有重要影响,通常认为Cd对水稻的毒害首先反应在根系上。根系活力主要反映植物根氧化、还原和合成的能力,是间接衡量根系功能的重要指标。本研究发现,添加10、100 μmol·L-1褪黑素对Cd胁迫下水稻根系活力有明显的促进作用(图 9),同时褪黑素可促进水稻总根长、根直径、根表面积、根体积的增长,说明褪黑素能提高水稻根系的新陈代谢速度,从而有利于水稻根系发育和植株生长。Sarropoulou等[29]研究证实施用0~10 μmol·L-1褪黑素可促进樱桃根系再生,提高樱桃根生物量、脯氨酸含量和总糖含量等。褪黑素的添加对渗透胁迫下导致植物侧根数目的减少有缓解作用[30]。
近年来,科学工作者在提高植物抗逆方面进行了多方面的探索,主要通过矿质元素、植物生长调节物质来降低重金属对植物体的毒害。植物生长调节物质(如水杨酸、谷胱甘肽等)对水稻Cd胁迫均有较为显著的缓解作用,相较于其他抗氧化剂(如维生素E、谷胱甘肽),褪黑素的抗氧化能力更强,同时褪黑素的加入还可以提高植物体内其他抗氧化剂(如抗坏血酸和谷胱甘肽)的含量[31]。由于褪黑素具有亲水和亲脂的双重性质,能够自由进出细胞,也使其在重金属胁迫情况下能迅速转移至反应位置。另外,褪黑素容易获得,规模化使用时成本不高。这些优势使褪黑素在植物抗逆,特别是在抗重金属胁迫方面具有潜在的应用前景。
对植物而言,由于浓度不同,褪黑素对逆境胁迫可能具有缓解作用,也可能加剧植物体的受毒程度。本试验中不同施用浓度的褪黑素对植物抗Cd胁迫作用影响较大,如10、100、1000 μmol·L-1褪黑素对重金属Cd导致的氧化胁迫均表现出明显的缓解作用,均能提高抗氧化酶活性,降低脂质过氧化。10、100 μmol·L-1褪黑素对Cd胁迫下水稻种子萌发及水稻根系生长有显著的促进作用,而1000 μmol·L-1褪黑素对水稻种子萌发及水稻根系生长则无明显影响或呈负面影响。这可能是因为褪黑素具有较强的活性氧清除作用,而高浓度褪黑素对活性氧的过多清除反过来却阻碍了植物体内的信号传递,延迟了植物体对Cd胁迫做出的反应。因此,在实际应用过程中还需要根据具体作物种类及不同逆境条件,对外源褪黑素的施用浓度作出相应的选择。
4 小结(1) 添加外源褪黑素可促进Cd胁迫下水稻的种子萌发,提高种子的发芽率和发芽势,提高水稻根系活力,促进水稻根系和幼芽的生长,但是褪黑素浓度过高(1000 μmol·L-1)却不利于水稻种子萌发、根系和幼芽的生长。
(2) 添加褪黑素可显著降低Cd胁迫下水稻幼芽的MDA含量,显著提高POD、SOD和CAT的活性,说明褪黑素添加可有效地抑制Cd胁迫对水稻的膜脂过氧化,缓解Cd对水稻的毒害作用。
| [1] | 陈怀满. 环境土壤学[M]. 北京: 科学出版社, 2005 CHEN Huai-man. Environment pedology[M]. Beijing: Science press, 2005 . |
| [2] | 环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL].[2015-11-10]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm. Ministry of Environmental Protection, Minnistry of Land and Resources. National survey of soil pollution[EB/OL]. [2015-11-10]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm. |
| [3] | 黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32 (3) : 409–417 . HUANG Yi-zong, HAO Xiao-wei, LEI Ming, et al. The remediation technology and remediation practice of heavy metals-contaminated soil[J]. Journal of Agro-Environment Science, 2013, 32 (3) :409–417 . |
| [4] | 文晓慧. 重金属胁迫对植物的毒害作用[J]. 农业灾害研究, 2012, 2 (11) : 20–21 . WEN Xiao-hui. Toxic effect of heavy metal stress on plant[J]. Journal of Agricultural Catastrophology, 2012, 2 (11) :20–21 . |
| [5] | 何俊瑜, 任艳芳, 朱诚, 等. 镉胁迫对不同水稻品种种子萌发、幼苗生长和淀粉酶活性的影响[J]. 中国水稻科学, 2008, 22 (4) : 399–404 . HE Jun-yu, REN Yan-fang, ZHU Cheng, et al. Effects of cadmium stress on seed germination, seedling growth, and amylase activities in rice[J]. Chinese Journal Rice Science, 2008, 22 (4) :399–404 . |
| [6] | Lerner A B, Case J, Takahashi Y. Isolation of melatonin, the pineal gland factor that lightens melanocytes[J]. Journal of the American Chemical Society, 1958, 80 (10) :2587 . |
| [7] | Flora S J S, Rupal S, Megha M. Chemistry and pharmacological properties of some natural and synthetic antioxidants for heavy metal toxicity[J]. Current Medicinal Chemistry, 2013, 20 (36) :4540–4574 . |
| [8] | Dubbels R, Reiter R J, Klenke E, et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research, 1995, 18 (1) :28–31 . |
| [9] | Afreen F, Zobayed S M A, Kozai T. Melatonin in Glycyrrhiza uralensis:Response of plant roots to spectral quality of light and UV-B radiation[J]. Journal of Pineal Research, 2006, 41 (2) :108–115 . |
| [10] | Tiryaki I, Keles H. Reversal of the inhibitory effect of light and high temperature on germination of Phacelia tanacetifolia seeds by melatonin[J]. Journal of Pineal Research, 2012, 52 (3) :332–339 . |
| [11] | Zuo B X, Zheng X D, He P L, et al. Overexpression of MzASMT improves melatonin production and enhances drought tolerance in transgenic Arabidopsis thaliana plants[J]. Journal of Pineal Research, 2014, 57 (4) :408–417 . |
| [12] | Posmyk M M, Kuran H, Marciniak K, et al. Presowing seed treatment with melatonin protects red cabbage seedlings against toxic copper ion concentrations[J]. Journal of Pineal Research, 2008, 45 (1) :24–31 . |
| [13] | Lee H Y, Byeon Y, Back K. Melatonin as a signal molecule triggering defense responses against pathogenattack in Arabidopsis and tobacco[J]. Journal of Pineal Research, 2014, 57 (3) :262–268 . |
| [14] | Turk H, Erdal S. Melatonin alleviates cold-induced oxidative damage in maize seedlings by up-regulating mineral elements and enhancing antioxidant activity[J]. Journal of Plant Nutrition and Soil Science, 2015, 178 (3) :433–439 . |
| [15] | Tal O, Haim A, Harel O, et al. Melatonin as an antioxidant and its semi-lunar rhythm in green macroalga Ulva sp[J]. Journal of Experimental Botany, 2011, 62 (6) :1903–1910 . |
| [16] | Zhang H J, Zhang N, Yang R C, et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA4 interaction in cucumber(Cucumis sativus L. )[J]. Journal of Pineal Research, 2014, 57 (3) :269–279 . |
| [17] | 张巍巍, 郑飞翔, 王效科, 等. 臭氧对水稻根系活力、可溶性蛋白含量与抗氧化系统的影响[J]. 植物生态学报, 2009, 33 (3) : 425–432 . ZHANG Wei-wei, ZHENG Fei-xiang, WANG Xiao-ke, et al. Effects of ozone on root activity, soluble protein content and antioxidant system in Oryza sativa roots[J]. Chinese Journal of Plant Ecology, 2009, 33 (3) :425–432 . |
| [18] | 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006 WANG Xue-kui. Experimental principle and technology of plant physiology and biochemistry[M]. Beijing: Higher Education Press, 2006 . |
| [19] | 游来勇, 王昌全, 罗娟, 等. Cd胁迫对水稻生长及内源激素含量的影响[J]. 生态环境学报, 2015, 24 (5) : 860–865 . YOU Lai-yong, WANG Chang-quan, LUO Juan, et al. Effect of Cd stress on growth and content of endogenous hormones in rice[J]. Ecology and Environmental Sciences, 2015, 24 (5) :860–865 . |
| [20] | Tan D X, Manchester L C, Helton P, et al. Phytoremediative capacity of plants enriched with melatonin[J]. Plant Signaling & Behavior, 2007, 2 (6) :514–516 . |
| [21] | Frank T, Kee L W. Cadmium and cellular signaling cascades:Interactions between cell death and survival pathways[J]. Archives of Toxicology, 2013, 87 (10) :1743–1786 . |
| [22] | Schutzendubel A, Polle A. Plant responses to abiotic stresses:Heavy metal-induced oxidative stress and protection by mycorrhization[J]. Journal of Experimental Botany, 2002, 53 (372) :1351–1365 . |
| [23] | 史静, 潘根兴, 夏运生, 等. 镉胁迫对两品种水稻生长及抗氧化酶系统的影响[J]. 生态环境学报, 2013, 22 (5) : 832–837 . SHI Jing, PAN Gen-xing, XIA Yun-sheng, et al. Effects of Cd on different rice growth and antioxidant enzyme system[J]. Ecology and Environmental Sciences, 2013, 22 (5) :832–837 . |
| [24] | 黄益宗, 隋立华. 臭氧污染胁迫下植物的抗氧化系统调节机制[J]. 生态毒理学报, 2013, 8 (4) : 456–464 . HUANG Yi-zong, SUI Li-hua. Antioxidant mechanism of plants under ozone stress[J]. Asian Journal of Ecotoxicology, 2013, 8 (4) :456–464 . |
| [25] | Reiter R J, Tan D X. Melatonin:An antioxidant in edible plants[J]. Annals of the New York Academy of Sciences, 2002, 957 :341–344 . |
| [26] | Pieri C, Marra M, Moroni F. Melatonin:A peroxyl radical scavenger more effective than vitamin E[J]. Life Science, 1994, 55 (15) :271–276 . |
| [27] | Shah K, Kumar R G, Verma S, et al. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science, 2001, 161 (1) :1135–1144 . |
| [28] | Kanazawa S, Sano S, Koshiba T, et al. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence:Comparison with those during dark-induced senescence[J]. Physiologia Plantarum, 2000, 109 (2) :211–216 . |
| [29] | Sarropoulou V, Dimassi-Theriou K, Therios I, et al. Melatonin enhances root regeneration, photosynthetic pigments, biomass, total carbohydrates and proline content in the cherry rootstock PHL-C(Prunus avium×Prunus cerasus)[J]. Plant Physiology and Biochemistry, 2012, 61 :162–168 . |
| [30] | 张娜. 褪黑素处理对渗透胁迫下黄瓜种子萌发及幼苗生长的影响及其分子机制[D]. 北京:中国农业大学, 2014. ZHANG Na. Regulation of melatonin and seeding growth under osmotic stress in cucumber[D]. Beijing:China Agricultural University, 2014. |
| [31] | Wang P, Yin L H, Liang D, et al. Delayed senescence of apple leaves by exogenous melatonin treatment:Toward regulating the ascorbate-glutathione cycle[J]. Journal of Pineal Research, 2012, 53 (1) :11–20 . |
 2016, Vol. 35
2016, Vol. 35