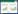文章信息
- 魏丽琼, 呼世斌, 王娇娇, 柴琴琴, 刘晋波, 王梦柯, 史超
- WEI Li-qiong, HU Shi-bin, WANG Jiao-jiao, CHAI Qin-qin, LIU Jin-bo, WANG Meng-ke, SHI Chao
- 甜菜-牧草体系对土壤中4种邻苯二甲酸酯的修复研究
- Phytoremediation of 4 phthalic acid esters in contaminated soil by beet-grass system
- 农业环境科学学报, 2016, 35(6): 1097-1102
- Journal of Agro-Environment Science, 2016, 35(6): 1097-1102
- http://dx.doi.org/10.11654/jaes.2016.06.011
文章历史
- 收稿日期: 2015-11-23
随着人们对化学物品的依赖程度越来越高,环境中的有机物污染情况也越来越严重。据联合国环境规划署(UNEP)1990年的报告指出,每年大约有3亿~4亿t有机物进入环境,而其中的大部分都进入了土壤环境,土壤成为了有机污染物的最大受体[1]。邻苯二甲酸酯(又名酞酸酯,简称PAEs)是一类化学添加剂,被广泛用作塑料增塑剂,用以增加塑料的可塑性和柔软度[2-4]。由于PAEs与塑料基质之间没有形成化学键,而是以氢键与范德华力联结,彼此保留各自相对独立的化学性质[5],随着时间的推移,PAEs会向周围空气环境中释放与转移,或者接触到合适的有机溶剂也会溶解出来,进入各类环境介质。土壤中PAEs污染来源十分广泛,如农膜残留、污泥施用、农药和肥料使用、生活垃圾和污水灌溉等均能引起土壤PAEs污染[6-8]。PAEs易与土壤有机质结合,不仅会直接影响土壤质量和生产功能,更严重的是PAEs 通过食物链富集,对人体健康造成威胁[9]。PAEs在人体和动物体内发挥着类似雌性激素的作用,可干扰内分泌,还具有致癌、致畸、致突变作用。因此对PAEs污染土壤的治理很有必要。
目前,对土壤中有机污染物的修复方法有物理修复、化学修复、电化学修复、生物修复等,生物修复技术因具备投资成本低、无二次污染、兼具保护生态和美化环境的功能等优点,且在修复土壤中重金属与有机物上已取得可观成果,更是备受重视[10-11]。土壤植物修复是指利用植物忍耐和超量积累某种或某些化学元素的特性,或利用植物及其根际微生物体系将污染物降解、转化为无毒或低毒物质的方法。黑麦草、苜蓿和苏丹草是3种牧草,多作为土壤中有机污染物的修复植物,甜菜作为经济作物,具有发达的块状根,根系分泌物含量丰富,可影响土壤碳、氮代谢和酶活性[12],甜菜/牧草间作修复土壤中PAEs的研究至今还未见报道。本研究利用甜菜和3种牧草(黑麦草、苜蓿、苏丹草)单作与间作,比较了不同种植模式对土壤中4种PAEs的修复效果,以及不同种植模式下不同植物对4种污染物的吸收与富集,并分析了不同种植模式下土壤中过氧化氢酶和磷酸酶的变化,拟筛选出修复效果较好的植物和种植模式,为土壤中PAEs的污染修复提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 供试土壤供试土壤由土壤和污泥堆肥而成的有机肥混合而成。土壤采自陕西杨凌示范区穆家寨农田表层土壤(0~20 cm),类型为褐土类。有机肥取自西安高陵某污泥堆肥厂。采回后的土壤与有机肥自然风干,过5 mm筛后备用,以确保土壤的质地适合植物生长。有机肥的加入是为了提高土壤肥力,使植物能更好地生长,没有外加4种PAEs污染物。供试土壤的基本理化性质:全氮10.5 g·kg-1,全磷0.16 g·kg-1,全钾1.26 g·kg-1,有机质7.24 g·kg-1,pH7.12;土壤中4种PAEs的初始浓度:邻苯二甲酸二乙酯(DEP)2.081 mg·kg-1、邻苯二甲酸二丁酯(DBP)5.893 mg·kg-1、邻苯二甲酸丁基苄基酯(BBP)1.295 mg·kg-1、邻苯二甲酸(2-乙基己基)二酯(DEHP)8.487 mg·kg-1。
1.1.2 供试植物试验选择了甜菜、黑麦草、苏丹草和苜蓿作为供试植物。
1.1.3 试剂与仪器仪器:KQ-300DE医用数控超声波清洗器,LABOROTA 4000旋转蒸发仪,高效液相色谱仪(920-LC),带二极管阵列(PDA)检测器(HPLC,美国 varian 公司),弗罗里硅土固相萃取柱。试验过程避免使用任何塑料制品,所有玻璃仪器使用前用超纯水、丙酮多次清洗,置于马弗炉中450 ℃烘烤2~4 h。
邻苯二甲酸酯标准溶液:DEP、DBP、BBP、DEHP浓度均为2000 μg·mL-1,购自美国Sigma-Alorich公司。丙酮、正己烷、二氯甲烷、乙腈均为色谱纯(国药化学试剂有限公司)。
1.2 试验方法与设计本试验在西北农林科技大学智能玻璃温室内进行,为期90 d。植物种子购自网上,种植之前先用生根剂浸泡1~2 d。试验用盆:木板自制试验用盆,高×宽×长=60 cm×30 cm×30 cm。土壤和有机肥以质量比9∶1混合均匀,放置一周后再开始种植植物。
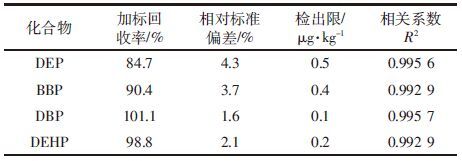
植物种植方式为甜菜(T)、黑麦草(H)、苜蓿(M)和苏丹草(S)分别单作,苜蓿/甜菜(MT)、苏丹草/甜菜(ST)、黑麦草/甜菜(HT)间作,每组设3个平行。种植15 d后,当所有种子均发芽后进行间苗,筛选长势良好的植株,间作处理每盆甜菜2株、牧草7株,单作处理每盆甜菜4株、牧草14株。同时设计无植物种植的作为空白对照(CK)。植物种植以后,根据缺水情况不定期浇水,通风,保持光照和湿度,保证植物正常生长。
1.3 样品采集90d后收获植物,测定株高。然后将植株分地上、地下部分收获并用去离子水冲洗干净。将所有植物样品装入信封中,在 65 ℃下烘至恒重,测定干物质质量。烘干的植物样用玛瑙研钵磨细,过60目筛,放于冰箱(4 ℃)中备用。采集土样,自然风干,研磨后过100目筛,放在密封玻璃瓶中保存。
1.4 测定方法供试土壤的基本理化性质采用常规分析方法测定[13]。
土样中邻苯二甲酸酯测定方法:称取土样 10.00 g(或1.00 g植物样品),加入三角瓶中,用30 mL二氯甲烷-丙酮(1∶1,V/V)混合溶液分两次(每次15 mL)超声提取样品,每次萃取15 min,合并提取液,用旋转蒸发仪在40 ℃浓缩近干,用正己烷定容至2.0 mL。
提取液净化:取 Florisil小柱(500 mg,6 mL,玻璃小柱),用5 mL丙酮和5 mL二氯甲烷活化后,加入样品浓缩液,用15 mL 二氯甲烷-丙酮(9∶1,V/V)混合液进行洗脱,收集洗脱液,于40 ℃下旋转蒸发近干,用正己烷定容至2.0 mL,换成甲醇相,氮吹至1 mL定容,备用。
色谱条件:
反相分析柱:Pursuit XRs C18 不锈钢柱(50 mm×2.0 mm ×2.8 μm);流动相A 为水,B为乙腈;梯度洗脱程序:0~5 min,30%A,70%B;5~6 min,70%B升到100%B;6~12 min,100%B;流速 0.2 mL·min-1,柱温35 ℃,紫外波长225 nm,进样量 2 μL。
土壤中过氧化氢酶与磷酸酶的测定方法参照文献[14]。
1.5 质量控制和质量保证实验过程中,每组实验做3个平行,同时进行一个全程序空白,以监测实验过程中所用仪器、试剂的清洁程度及人为干扰的影响因素。实验对PAEs测定过程中的提取条件(如萃取剂、萃取剂体积和比例、超声时间、层析柱类别等)进行了优化选择,优化后测定方法的回收率、相对标准偏差和检出限如表 1所示。
4种PAEs单一去除率的计算为:
R=(Cac-Cat)/Cac×100%
总PAEs的去除率为4种PAEs的单一相对去除率之和,4种PAEs的单一相对去除率的计算为:
r=R×(Cac/Ctc)×100%
式中:R为单一PAEs的去除率;r为单一PAEs的相对去除率;Cat为土壤中残留的单一PAEs的浓度,mg·kg-1;Cac为土壤中单一PAEs的初始浓度,mg·kg-1;Ctc为土壤中总PAEs的初始浓度,mg·kg-1。
4种PAEs生物富集系数的计算为:
BCF=Cp/Ct×100%
式中:Cp为植物体内的单一PAEs的浓度,mg·kg-1;Ct为土壤中单一PAEs的初始浓度,mg·kg-1。
所有数据都通过Microsoft Excel 2003 和SPSS 软件处理。
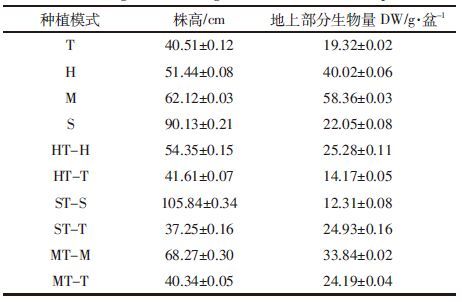
2 结果与讨论 2.1 土壤中4种PAEs的浓度和去除率与初始浓度相比,不同试验种植模式对土壤中4种目标污染物都有一定程度上的去除,不同的种植模式之间存在着差异(图 1)。与空白对照相比(表 2),种植植物的修复效率明显较高,说明了植物修复的可行性。
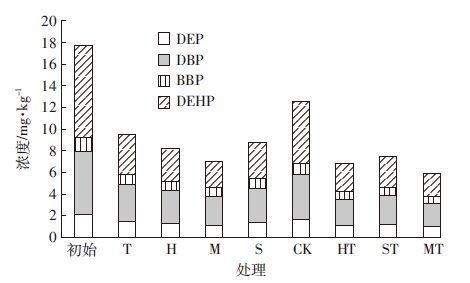
|
| 图 1 土壤中PAEs的初始浓度与修复后浓度对比 Figure 1 Concentrations of 4 PAEs compounds in soil under different treatments |
 |
单作中,苜蓿单作对4种PAEs的去除效果最好,对DEHP的去除率最高,可达71.69%,4种PAEs的总去除率达到60%以上,其他不同处理的总去除率也达到了46%以上;间作中,苜蓿/甜菜间作对4种PAEs的去除效果最好,总去除率高达66.48%;不同处理间去除效率表现为苜蓿/甜菜(66.48%)>黑麦草/甜菜(61.45%)>苜蓿(60.44%)>苏丹草/甜菜(57.72%)>黑麦草(53.63%)>苏丹草(50.55%)>甜菜(46.08%)。其中,甜菜的去除率最低,因为甜菜根部为块根状,比表面积较小,与污染物接触面积小,从而影响了其对污染物的吸收效果。苜蓿/甜菜间作以及苜蓿单作在该研究中都能较好地去除土壤中的PAEs,表明苜蓿在植物修复中的作用极大。苜蓿是豆科植物,可以形成固氮根瘤菌共生关系,通过增加根际氮供应以促进植物生长并加速微生物增殖;其次,植物的地上部生物量使它们对总PAEs有更高的去除效率(图 1和表 3);最后,PAEs化合物可以更容易地被豆科植物通过它们根部脂质转移蛋白的手段吸收,如苜蓿亲脂性。Ma等[15]研究了单作和间作紫花苜蓿、黑麦草和高羊茅草对土壤中6种PAEs的植物修复,PAEs总量的80%被去除,3种植物间作和苜蓿单作对土壤中PAEs的去除效果最好。与单作相比,间作的去除效果较好。以往的研究也表明,不同的修复植物物种的间作与单作相比,间作在去除有机污染物(如多环芳烃)方面有明显的优势[16],间作增强了植物根际微生物的交互作用,促进了植物生长(表 3),提高植物对污染物的提取以及促进了植物对有机污染物的降解。Ma等[17]在中国西部电子垃圾废弃地区单作和间作紫花苜蓿、海州香薷、景天属植物,比较它们对受污染土壤的修复能力,结果表明:间作增强土壤中PAEs的去除效果,增加土壤微生物量和微生物功能多样性,苜蓿的嫩枝和根比其他两种植物吸收更多目标污染物。
单一污染物的去除率表现出了很大的差异(图 2),4种污染物在不同种植模式下的去除率由高到低为DEHP>DBP>DEP>BBP,其中DEHP 去除率最高,单一去除率最高可达75.19%,BBP去除率最低,两者的去除率之差都在20%以上,最大相差32.85%;其次,DBP 的去除率较高,单一去除率最高可达63.00%左右。DEHP和DBP是污染土壤中PAEs的主要组成部分(图 1),分别占PAEs总量的47.81%和33.20%。苜蓿单作和间作对DBP和DEHP的去除率差别不大,黑麦草和苏丹草的间作与单作对DBP的去除有较大差异。
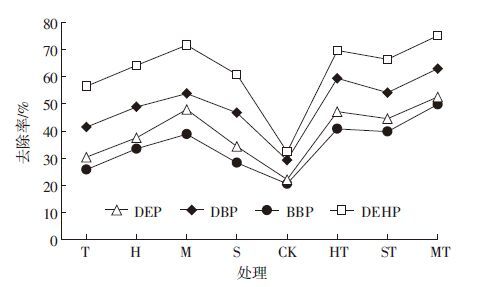
|
| 图 2 土壤中PAEs的去除率 Figure 2 Percentages of 4 PAEs compounds removed from tested soil under different treatments |
4种目标污染物在不同植物茎叶中的总浓度有极大的不同,从0.35 mg·kg-1到0.66 mg·kg-1(图 3)。与间作相比,单作的植物茎叶中污染物的浓度较高,而从土壤中污染物的去除率比较来看,间作的去除率高于单作,说明植物吸收只是去除土壤中污染物的途径之一,间作植物污染物含量低,再利用的可能性也较大。单作的苜蓿茎叶中积累了最高的目标污染物,间作的苜蓿与其他间作植物相比也表现出了最高的积累量,说明无论是间作还是单作,苜蓿更适合用于土壤中PAEs的植物修复,影响修复能力的最主要因素可能是它地上部分生物量(表 3)。苜蓿强大的根系,大的叶面积,高根部脂肪量,尤其是根瘤菌,对修复有较大贡献。从单一污染物来说,植物茎叶中DBP和DEHP的浓度较高,其中单作中DBP的浓度最高,其次是DEHP,而对于间作来说,DEHP的浓度略高于DBP。
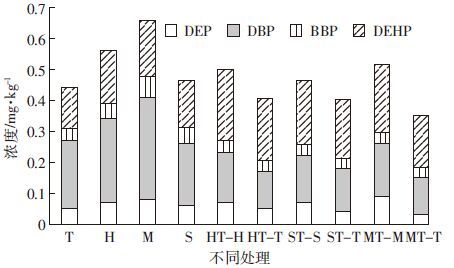
|
| 图 3 不同处理的植物茎叶中PAEs的浓度 Figure 3 Concentrations of 4 PAEs compounds in plant shoots under different treatments |
比较不同植物茎叶中污染物的生物富集系数,表明直接吸收和新陈代谢可能是土壤中PAEs修复降解的主要机制。所有植物样品中,苜蓿单作茎叶的生物富集系数最大(图 4),苜蓿大的茎叶可能增加了它吸收PAEs到地上部分的能力;间作与单作相比,单作中植物的生物富集系数高于间作,说明植物间作套种减少了植物对有机污染物的吸收,从而降低了植物体内污染物的危害。不同种植模式下DEHP的生物富集系数都明显较低,且单作低于间作;DBP和BBP的生物富集系数较高,在单作中表现明显,可能与污染物烷基链长有关,DBP和BBP相较DEHP的烷基链较短,短链PAEs易于发生转移,从植物根部转移至茎叶,而长链的DEHP不易发生转移,容易在根部积累。
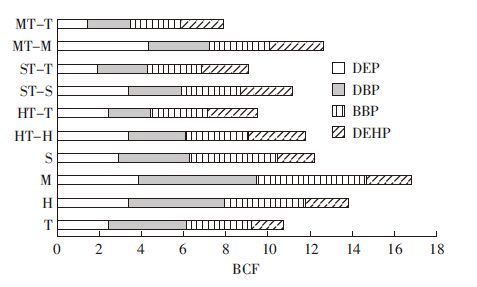
|
| 图 4 植物茎叶中污染物的生物富集系数 Figure 4 BCFs of 4 PAEs compounds in plant shoots under different treatments |
土壤酶活性不仅易受土壤环境中的物理、化学及生物因素的影响,而且也能反映出土壤微生物的总体活性,因此常被作为指示土壤污染的重要生物活性物质之一[18]。在植物修复过程中,酶对土壤污染物的修复作用有明显优势。其主要机理是通过微生物酶的作用将土壤中的有机污染物分解转化成为简单的无机物,以达到净化土壤的目的。同样,植物的存在促进了生物化学反应中酶的能力。土壤酶类参与土壤中大部分复杂的生物化学过程,起到高效催化作用。
甜菜根际可以分泌磷酸酶,磷酸酶将生长环境中的有机磷分解为无机磷后被植物吸收利用[19]。过氧化氢酶是在生物呼吸和有机物的生物化学氧化反应过程中形成的,对土壤有机质分解和转化起着重要作用,同时它能促进H2O2分解,有利于防止H2O2对生物体的毒害作用。因此通过探讨不同种植模式的土壤中过氧化氢酶和磷酸酶的活性,可以比较全面地了解PAEs对土壤酶活性的影响及过氧化氢酶在PAEs降解过程中所起的作用。
如图 5所示,土壤中磷酸酶的活性相差不大,其中黑麦草单作和苜蓿/甜菜间作的磷酸酶活性较高,种植甜菜对土壤磷酸酶的影响相差不大,可能是由于该浓度的土壤污染物抑制了甜菜分泌磷酸酶;苜蓿/甜菜间作土壤中过氧化氢酶的活性最高,可能是两种植物在土壤生化过程中共同作用,改善了根际生态环境和土壤质量,提高了根际微生物群落的新陈代谢活动,使植物根系和微生物分泌释放了更多的过氧化氢酶,从而促进PAEs的降解。与空白对照相比,种植植物的土壤磷酸酶和过氧化氢酶都明显较高,说明种植植物促进了土壤中酶的活性。
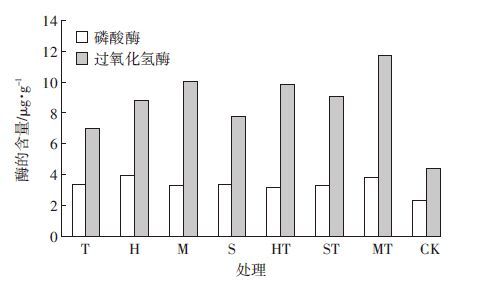
|
| 图 5 土壤中磷酸酶和过氧化氢酶的活性 Figure 5 Activities of phosphatase and catalase in soil under different treatments |
(1) 与空白对照相比,种植植物对土壤中PAEs的修复效果更好;苜蓿单作与间作均取得了较好的修复效果;间作与单作相比,间作的修复效果较好。
(2) 就单一污染物来说,DBP和DEHP是污染土壤的主要组成部分,在土壤中的去除率也较高,且其中DEHP为最高;植物茎叶中DBP和DEHP的浓度较高,其中单作中DBP的浓度最高,其次是DEHP,而对于间作来说,DEHP的浓度略高于DBP。
(3) DEHP的生物富集系数明显较低,且单作低于间作;DBP和BBP的生物富集系数较高,在单作中表现明显。
(4) 各处理间磷酸酶的活性相差不大,苜蓿/甜菜间作土壤中过氧化氢酶的活性最高。与空白对照相比,种植植物的土壤磷酸酶和过氧化氢酶都明显较高。
| [1] | 彭胜巍, 周启星. 持久性有机污染土壤的植物修复及其机理研究进展[J]. 生态学杂志, 2008, 27 (3) : 469–475 . PENG Sheng-wei, ZHOU Qi-xing. Research advances in phytoremediation and its mechanisms of POPs-contaminated soils[J]. Chinese Journal of Ecology, 2008, 27 (3) :469–475 . |
| [2] | 俞晓雪. 增塑剂市场分析[J]. 精细石油化工进展, 2002, 3 (7) : 24–27 . YU Xiao-xue. Plasticizer market analysis[J]. Advances in Fine Petrochemicals, 2002, 3 (7) :24–27 . |
| [3] | 陶刚, 梁诚. 国内外增塑剂市场分析与发展趋势[J]. 塑料科技, 2008, 36 (6) : 78–81 . TAO Gang, LIANG Cheng. Analysis on development tendency of domestic and globalplasticizer market[J]. Plastics Science and Technology, 2008, 36 (6) :78–81 . |
| [4] | 王盛才, 胡华勇, 罗岳平, 等. GC-MS测定土壤中酞酸酯类化合物[J]. 中国环境监测, 2007, 23 (4) : 23–25 . WANG Sheng-cai, HU Hua-yong, LUO Yue-ping, et al. GC-MS determination of phthalates in soil samples[J]. Environmental Monitoring in China, 2007, 23 (4) :23–25 . |
| [5] | Klamsmeier R E. Microbial biodeterioration[M]. London: Academic Press, 1981 : 431 -474. |
| [6] | 何丽芝, 陆扣萍, 秦华, 等. 我国设施菜地邻苯二甲酸酯污染现状及防治研究进展[J]. 安徽农业科学, 2012, 40 (28) : 13973–13975 . HE Li-zhi, LU Kou-ping, QIN Hua, et al. Research progress in the phthalate acid esters(PAEs) pollution and remediation in the soil of vegetable greenhouses in China[J]. Journal of Anhui Agri Sci, 2012, 40 (28) :13973–13975 . |
| [7] | 王凯荣, 崔明明, 史衍玺. 农业土壤中邻苯二甲酸酯污染研究进展[J]. 应用生态学报, 2013, 24 (9) : 2699–2708 . WANG Kai-rong, CUI Ming-ming, SHI Yan-xi. Phthalic acid esters(PAEs) pollution in farmland soils:A review[J]. Chinese Journal of Applied Ecology, 2013, 24 (9) :2699–2708 . |
| [8] | 黄慧娟, 蔡全英, 吕辉雄, 等. 土壤-蔬菜系统中邻苯二甲酸酯的研究进展[J]. 广东农业科学, 2011 (9) : 50–53 . HUANG Hui-juan, CAI Quan-ying, LÜ Hui-xiong, et al. Progresses on phthalic acid esters in the soil-vegetable system[J]. Guangdong Agricultural Sciences, 2011 (9) :50–53 . |
| [9] | Zeng F, Cui K Y, Xie Z Y, et al. Phthalate esters(PAEs):Emerging organic contaminants in agricultural soils in peri-urban areas around Guangzhou, China[J]. China Environmental Pollution, 2008, 156 (2) :425–434 . |
| [10] | 徐铁兵, 梁静, 孙玉艳. 几种典型的土壤污染修复技术综述[J]. 价值工程, 2013 : 313–314 . XU Tie-bing, LIANG Jing, SUN Yu-yan. Overview on several typical soil pollution remediation technologies[J]. Value Engineering, 2013 :313–314 . |
| [11] | 何章莉, 潘伟斌. 受污染土壤环境的植物修复技术[J]. 广东工业大学学报, 2004, 21 (1) : 56–62 . HE Zhang-li, PAN Wei-bin. Phytoremediation of contaminated soil environment[J]. Journal of Guangdong University of Technology, 2004, 21 (1) :56–62 . |
| [12] | 耿贵. 作物根系分泌物对土壤碳、氮含量、微生物数量和酶活性的影响[D]. 沈阳:沈阳农业大学, 2011. GENG Gui. The influence of soil carbon, nitrogen content, microorganism quantity and enzyme activity by crop root secretion[D]. Shenyang:Shenyang Agricultural University, 2011. |
| [13] | 鲍士旦. 土壤农化分析[M].三版. 北京: 中国农业出版社, 2008 BAO Shi-dan. Soil agricultural chemistry analysis[M].3 edition. Beijing: China Agriculture Press, 2008 . |
| [14] | 周礼恺, 张志明. 土壤酶活性的测定方法[J]. 土壤通报, 1980 (5) : 37–38 . ZHOU Li-kai, ZHANG Zhi-ming. The determination methods of soil enzyme activity[J]. Chinese Journal of Soil Science, 1980 (5) :37–38 . |
| [15] | Ma T T, Teng Y, Luo Y M, et al. Legume-grass intercropping phytoremediation of phthalic acid esters in soil near an electronic waste recycling site:A field study[J]. International Journal of Phytoremediation, 2013, 15 (2) :154–167 . |
| [16] | Maila M P, Randima P, Cloete T E. Multispecies and monoculture rhizoremediation of polycyclic aromatic hydrocarbons(PAHs) from the soil[J]. Int J Phytorem, 2005, 7 (2) :87–98 . |
| [17] | Ma T T, Luo Y M, Christie P, et al. Removal of phthalic esters from contaminated soil using different cropping systems:A field study[J]. European Journal of Soil Biology, 2012, 50 :76–82 . |
| [18] | Wang Y, Shi J, Wang H, et al. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter[J]. Ecotoxicol Environ Saf, 2007, 67 (1) :75–81 . |
| [19] | 周建朝, 韩晓日. 甜菜根际磷酸酶分泌特性的研究[J]. 中国糖料, 2003 (3) : 6–11 . ZHOU Jian-zhao, HAN Xiao-ri. The properties of phosphatase excretion in rhizosphere of sugar beet[J]. Sugar Crops of China, 2003 (3) :6–11 . |
 2016, Vol. 35
2016, Vol. 35