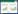文章信息
- 施翠娥, 艾弗逊, 汪承润, 颜守保, 车运城
- SHI Cui-e, AI Fu-xun, WANG Cheng-run, YAN Shou-bao, CHE Yun-cheng
- 大气CO2和O3升高对菜地土壤酶活性和微生物量的影响
- Effects of elevated atmospheric CO2 and O3 on soil enzyme activities and microbial biomass
- 农业环境科学学报, 2016, 35(6): 1103-1109
- Journal of Agro-Environment Science, 2016, 35(6): 1103-1109
- http://dx.doi.org/10.11654/jaes.2016.06.012
文章历史
- 收稿日期: 2016-03-28
2. 南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023
2. State Key Laboratory of Pollution Control and Resources Reuse, School of Environment, Nanjing University, Nanjing 210023, China
近年来,大气对流层CO2、O3浓度升高与全球性气候变化已经引起全社会的广泛关注[1]。日益增加的研究结果表明,大气CO2浓度升高主要通过改变植物根系分泌物和土壤微生物群落的组成和数量、土壤中碳氮的流动与分配,以及可溶性碳水化合物库的大小等途径间接地改变土壤理化特性,从而潜在地影响着土壤微生物生态系统的变化[2-3]。人们通常采用FACE(Free-air CO2 enrichment)或OTC(Open top chamber)系统探讨大气CO2浓度升高条件下土壤-植物系统的变化[4-6]。土壤酶参与土壤中的物质循环、能量流动以及有机污染物的降解,其活性变化可反映出土壤中各种生物化学过程的强度和方向。因此,土壤酶已经用于评价大气CO2等污染条件下土壤微生态环境的变化[7]。就目前研究的土壤酶类而言,认为其活性被诱导而升高者居多,但也有相反的报道[8-9]。由于供试土壤的特性、供试植物种类和CO2增加方式等的不同,导致大气CO2浓度升高对土壤微生物的区系、群落结构、土壤呼吸、微生物量以及土壤酶活性影响的研究尚未得出一致的结论。
O3是另一种温室气体,也是光化学烟雾的主要成分。臭氧浓度升高会对植物产生负面影响。O3通过气孔进入植物组织,降低气孔导度、抑制光合作用和养分的吸收、降低植物生物量和作物产量等[10-12]。O3胁迫下,植物根系分泌物的改变还可能改变土壤的理化性质,降低土壤微生物量碳、氮,从而潜在地改变根际的微生物群落、营养状态、土壤酶活性和酚类物质含量[13-16]。人们通常采用OTC系统探究大气O3浓度升高对植物和土壤微生物系统的影响[13, 17]。研究发现,O3升高对陆生生态系统地下部分的作用效应比地上部分出现得早,而且还表现出积累效应[1, 9]。据报道,O3浓度升高能够诱导土壤微生物功能多样性、生物量和酶活性的改变[2, 18-19],但相关研究还相当薄弱。
目前,多数研究是模拟单一CO2或O3升高对生态系统安全性的影响和评估,而对二者复合条件下的研究则有待加强。然而,国内外关于大气CO2和O3升高条件下土壤酶活性影响的研究鲜见报道。本文在OTC平台下构建微宇宙土壤-青菜盆栽模拟系统,探讨[CO2]、[O3]和[CO2+O3]升高条件下土壤蛋白酶、多酚氧化酶、酸性磷酸酶、脲酶和蔗糖酶活性以及微生物生物量的变化,以期获得未来大气CO2或/和O3升高对菜地土壤微生态环境的影响。
1 材料与方法 1.1 试验平台与处理方式试验平台位于南京大学仙林校区(118°57′36.15″E,31°7′23.99″N),平台包括4个气室:一个气室通正常大气;一个气室控制CO2浓度比正常大气高200 nL·L-1;一个气室控制O3浓度比正常大气高50 nL·L-1;一个气室控制CO2和O3浓度复合升高。气室为八边形,直径2 m,高2.8 m。CO2由杜瓦罐(Q/JB-THB002,北京天海工业有限公司)提供,CO2气体购自南京天泽气体有限公司,纯度99.9%,O3由臭氧发生器(NPF10/W,山东绿邦)产生。CO2或O3(通过分压阀和流量计控制气体量)与正常大气混合后通过轴流风机(SFG-2,上海佳豹)通入气室底部,气体再通过气室底部和腔体中间不锈钢板上的小孔(直径0.5 cm)进入气室腔体,气体再通过气室顶部的开口进入外部大气,气体的更换频率为保证气室腔体中气体每分钟更换3~4次。CO2浓度用CO2检测仪(Li-7000,Li-Cor,USA)监测,O3浓度用O3检测仪(Model 205,2B Co.,USA)监测。气室24 h通入CO2,气室通入O3的时间为早上9:00至下午5:00(雨天除外)。
2014年6月将土壤分装入花盆(10 kg·盆-1),施加复合肥(2 g·盆-1,N∶P∶K =1∶1∶1),翻耕、混匀,然后播撒10颗青菜种子(上海四季青)。将上述土壤的花盆转移至OTC的4个气室里,即[Amb]、[CO2]、[O3]、[CO2+O3],分别表示正常大气、高CO2、高O3、CO2和O3混合升高。青菜发芽后再生长一个星期就开始间苗,每个花盆保留3棵大小基本一致的青菜苗,定期补充等量去离子水。间苗30 d后采集土壤样品,用于下述指标的检测与分析。
1.2 土壤理化性质的测定土壤理化性质的测定参照鲍士旦等[20]方法进行。采用烘干法测定土壤含水量;应用便携式pH计测定土壤pH值;应用钼锑抗比色法测定土壤全磷;应用原子吸收光谱法测定钾(K);应用多元素N/C分析仪(EA 3000 Series,Italy)测定总碳(TC)和总氮(TN);应用流动注射分析仪(FIAStar 5000,FOSS)测定铵态氮NH4+-N(AN)、硝态氮NO3-N(NN)和速效P(AP);采用TOC分析仪(Multi C/N 3100,Jena)测定土壤可溶性碳(DOC)和可溶性氮(DON)[21]。
1.3 土壤微生物量碳(MBC)和微生物量氮(MBN)的测定采用氯仿熏蒸-K2SO4浸提法测定土壤MBC和MBN[22]。应用TOC分析仪测定浸提液中有机碳及全N含量(Multi C/N 3100,Jena)。MBC和MBN的计算方法如下:MBC=EC/0.45,MBN=EN/0.45,EC、EN分别为熏蒸和未熏蒸土样浸提液的有机碳或全氮的差值[23],0.45为氯仿熏蒸后提取生物量的比例系数[24]。微生物碳氮比用MBC/MBN表示。
1.4 土壤酶活性的测定土壤酶活性按照关松荫的方法[25],土壤蛋白酶(PRA)活性采用茚三酮比色法测定,以24 h后1 g土生成1 mg NH2-N定义为1 mg NH2-N·g-1·24 h-1。蔗糖酶(SA)采用3,5-二硝基水杨酸比色法测定,以24 h后1 g土壤生成1 mg葡萄糖定义为1 mg glucose·g-1·24 h-1。脲酶(UA)活性采用苯酚钠-次氯酸钠比色法测定:以1 g土壤37 ℃恒温培养24 h生成1 μg NH3-N定义为1 μg NH3-N·g-1·24 h-1。多酚氧化酶(POA)活性采用紫色没食子素比色法进行测定,把1 g土壤在2 h内生成1 mg紫色没食子素定义为1 mg PG·g-1·2 h-1。土壤酸性磷酸酶(APA)和中性磷酸酶(NPA)活性均采用磷酸苯二钠法进行测定,将100 g土壤于37 ℃恒温培养2 h生成1 mg P2O5定义为1 mg P2O5·100 g-1·2 h-1。
1.5 数据处理应用SPSS 18. 0软件对数据进行统计分析(Duncan检验,P<0.05),应用Origin 软件作图。
2 结果与分析 2.1 大气CO2、O3升高对土壤理化性质的影响由表 1可见,随着OTC中CO2或/和O3的升高,土壤中NN、TP、TK和TC的含量呈现[CO2]>[amb]>[CO2+O3]>[O3]的变化趋势。就NN而言,[CO2]暴露组显著高于其他处理组(P<0.05),[O3]暴露组显著低于[CO2]和[amb]处理组(P<0.05),而[CO2+O3]则缓解了[O3]对土壤NN的抑制作用(P>0.05)。与[amb]比较,[CO2]提高了TP或TK的含量(P>0.05),[O3]则诱导了TP或TK显著性降低(P<0.05),而[CO2+O3]又缓解了[O3]对TP或TK的抑制作用(P>0.05)。同时发现,各暴露组之间未见TC含量的显著性变化(P<0.05)。

|
土壤中AN、DON、TN和DOC含量的大小依次为:[CO2]>[CO2+O3]>[amb]>[O3]。与[amb]比较,[CO2]和[CO2+O3]诱导了AN升高(P>0.05),而[O3]则导致AN下降,并显著低于其他三种处理组(P<0.05)。DON和TN含量与AN的变化趋势相似,但各处理组中未见显著性变化(P>0.05)。同时发现,四种处理组之间DOC含量变化显著(P<0.05)。在上述实验条件下,SWC和AP含量的变化为:[CO2]>[CO2+O3]>[O3]>[amb],而pH值的大小则随着[O3]>[CO2+O3]>[amb]>[CO2]的变化而趋于下降,且各处理组之间变化不显著(P>0.05)。
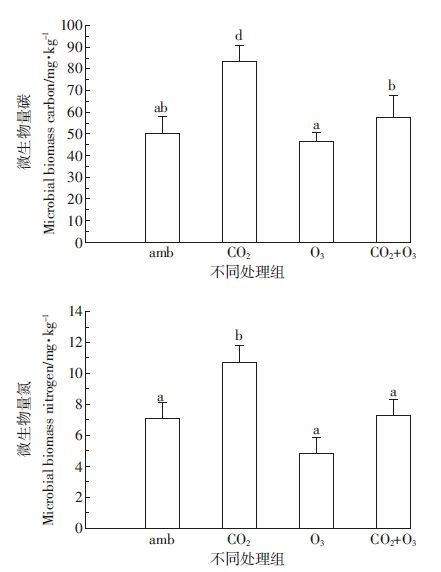
2.2 大气CO2、O3升高对土壤微生物量的影响如图 1所示,土壤微生物量碳(MBC)和微生物量氮(MBN)含量的变化表现为:[CO2]>[CO2+O3]>[amb]>[O3]。与[amb]比较,通入CO2诱导了MBC和MBN含量显著性升高(P<0.05),而其他处理组未见显著性变化。微生物量碳氮比(MBC/MBN)显示出[O3]>[CO2+O3]>[CO2]>[amb]的变化。与[amb]比较,只有[O3]诱导了MBC/MBN显著性升高(P<0.05)(图 2)。
|
| 图 1 大气CO2或/和O3升高对土壤微生物量碳(MBC)和微生物量氮(MBN)的影响 Figure 1 Effect of elevated atmospheric CO2 and/or O3 on contents of microbial biomass carbon(MBC) and nitrogen(MBN) |
|
| 图 2 大气CO2或/和O3升高对土壤MBC/MBN比值的影响 Figure 2 Effect of elevated atmospheric CO2 and/or O3 on ratio of MBC/MBN in the soils |
如图 3所示,大气CO2或/和O3升高条件下土壤蛋白酶(PRA)和蔗糖酶(SA)的活性变化为[CO2]>[CO2+O3]>[amb]>[O3],与其土壤中MBC和MBN的变化一致。与[amb]比较,只有通入O3诱导了PRA显著性下降(P<0.05),只有通入CO2诱导了SA显著性升高(P<0.05)。

|
| 图 3 大气CO2或/和O3升高对土壤蛋白酶(PRA)和蔗糖酶(SA)活性的影响 Figure 3 Effect of elevated atmospheric CO2 and/or O3 on activities of protease(PRA) and sucrase(SA) |
如图 4所示,土壤脲酶(UA)和多酚氧化酶(POA)活性的变化为[CO2]>[CO2+O3]>[amb]>[O3],与其土壤中PRA和SA酶活性的变化一致,但各处理组的UA或POA之间差异不显著(P>0.05)。

|
| 图 4 大气CO2或/和O3升高对土壤的脲酶(UA)和多酚氧化酶(POA)活性的影响 Figure 4 Effect of elevated atmospheric CO2 and/or O3 on activities of urease(UA) and phenol oxidases(POA) in the soils |
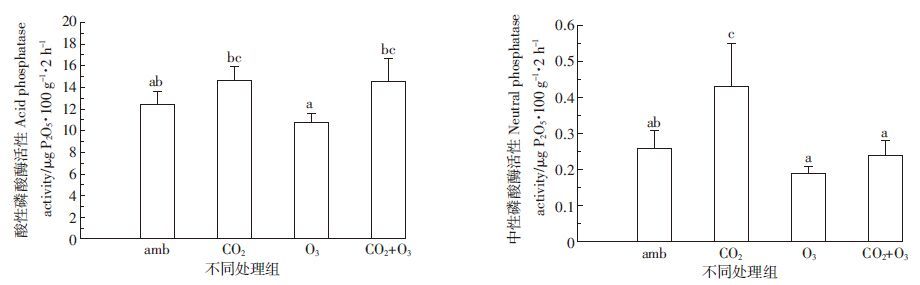
大气CO2或/和O3升高条件下土壤酸性磷酸酶(APA)活性呈现[CO2]>[CO2+O3]>[amb]>[O3]的递减趋势,与该土壤中PRA和SA酶活性的变化一致。同时,中性磷酸酶(NPA)活性显示[CO2]>[amb]>[CO2+O3]>[O3],且通入CO2诱导了NPA显著性升高(P<0.05),而通入O3则降低了NPA酶活性(P>0.05)(图 5)。
|
| 图 5 CO2或/和O3升高对土壤的酸性磷酸酶(APA)和中性磷酸酶(NPA)活性的影响 Figure 5 Effect of elevated atmospheric CO2 and/or O3 on activities of acid phosphatase(APA) and neutral phosphatase(NPA) in the soils |
本实验利用OTC平台构建土壤-青菜盆栽模拟系统,研究了CO2或/和O3升高后土壤理化性质和土壤酶活性的变化。结果表明,[CO2]升高诱导了土壤NN、AN、TN、TP、TK、TC、DOC、DON、MBC、MBN等理化指标不同程度的增长,呈现[CO2]>[amb]的变化趋势。同时发现,NPA、PRA、SA、UA、POA、APA等土壤酶活性也显示相似的变化(表 1,图 1、图 3、图 5)。由此推测,[CO2]的升高对上述土壤理化指标和土壤酶活性产生了促进作用。有研究报道,大气CO2浓度升高能够促进植物的光合作用,提高根系的生物量和分泌物,并改变根系输入到土壤中的物质成分[2-3]。大气CO2升高还能够通过植物的代谢作用提高土壤总有机碳含量和根际碳的可利用性,导致土壤微生物量C、N和微生物活性的升高[4-5]。土壤微生物量的改变进而诱导了PRA、UA、POA、APA等土壤酶活性的变化[4, 26]。因此,本实验中[CO2]的升高很可能通过促进青菜的光合作用及其根系分泌物的合成与输出,不同程度提高了土壤TN、TP、TK、TC、DOC、DON、MBC和MBN等理化指标,进而诱导了NPA、PRA、SA、UA、POA和APA等土壤酶活性的升高(表 1,图 1、图 3、图 5)。
同时还发现,[O3]的升高降低了上述土壤理化指标和酶活性,呈现[O3]<[amb]的递减趋势。同时,[O3]升高还导致微生物MBC/MBN比值的升高(图 2)。有研究报道,大气O3浓度升高能够关闭叶片的气孔,限制CO2进入叶片组织,从而降低了光合速率和植物体内碳水化合物的含量[27]。O3浓度升高能够减少根系的分泌物,改变分泌物的类型[10, 28];还能够降低土壤微生物量C的代谢和N的含量,提高MBC/MBN比值[29],从而干扰了土壤养分、根际微生态环境和土壤酶活性[16, 18, 30-31],进而从本质上影响土壤微生物的群落组成及其功能多样性[32]。据此推测,[O3]升高很可能通过抑制青菜的光合作用,减少并改变了青菜根系的分泌物,在一定程度上改变了土壤C、N的代谢,导致NN、AN、TN、TP、TK、TC、DOC、DON、MBC、MBN等理化指标的异常变化,因而不同程度地抑制了NPA、PRA、SA、UA、POA、APA等土壤酶的活性(表 1,图 1、图 3、图 5)。同时这些结果还能反映土壤微生物量和土壤酶活性的变化,能够评价大气CO2或/和O3升高对菜地土壤微生态环境的影响。
研究结果还表明,[CO2+O3]复合条件下,土壤TN、TP、TK、TC、DOC、DON、MBC和MBN等理化指标,以及NPA、PRA、SA、UA、POA、APA等土壤酶活性大小呈现[CO2+O3]>[O3]的变化(表 1,图 1、图 3、图 5)。[CO2]可能消减了[O3]对青菜叶片组织的伤害以及对青菜叶片组织光合作用等生理生化过程的干扰,从而间接地诱导了TN、TP等土壤理化指标以及NPA、PRA等酶活性不同程度的升高。相关机理有待进一步探讨。
4 结论[CO2]升高诱导了土壤NN、AN、TP、TC、DOC、DON、MBC、MBN等理化指标以及NPA、PRA、SA、UA、POA和APA等土壤酶活性不同程度的升高,呈现[CO2]>[amb]的变化趋势。[O3]升高降低了上述土壤理化指标和酶活性([O3]<[amb]),却提高了土壤微生物MBC/MBN的比值。而[CO2+O3]升高在一定程度上则消减了[O3]对土壤微生物量和酶活性的抑制作用,也缓释了[CO2]升高对土壤微生物量和酶活性的刺激效应。
| [1] | Wang Y, Song Q, Frei M, et al. Effects of elevated ozone, carbon dioxide, and the combination of both on the grain quality of Chinese hybrid rice[J]. Environmental Pollution, 2014, 189 :9–17 . |
| [2] | Xu M, He Z, Deng Y, et al. Elevated CO2 influences microbial carbon and nitrogen cycling[J]. BMC Microbiology, 2013, 13 (1) :1–11 . |
| [3] | Sulman B N, Phillips R P, Oishi A C, et al. Microbe-driven turnover offsets mineral-mediated storage of soil carbon under elevated CO2[J]. Nature Climate Change, 2014, 4 (12) :1099–1102 . |
| [4] | 任欣伟, 唐景毅, 柳静臣, 等. 不同氮水平下CO2升高及增温对幼苗土壤酶活性的影响[J]. 北京林业大学学报, 2014, 36 (5) : 44–53 . REN Xin-wei, TANG Jing-yi, LIU Jing-chen, et al. Effects of elevated CO2 and temperature on soil enzymes of seedlings under different nitrogen concentrations[J]. Journal of Beijing Forestry University, 2014, 36 (5) :44–53 . |
| [5] | 田然, 周辉, 黄娟, 等. 大气CO2浓度升高条件下土壤镉污染对土壤酶及微生物群落多样性的影响[J]. 南京大学学报(自然科学版), 2011, 47 (6) : 712–717 . TIAN Ran, ZHOU Hui, HUANG Juan, et al. Effect of elevated atmospheric CO2 concentration on the soil enzymes and microbial communities under stress of Cd pollution[J]. Journal of Nanjing University(Natural Sciences), 2011, 47 (6) :712–717 . |
| [6] | 赖上坤, 周三妮, 顾伟锋, 等. 二氧化碳、施氮量和移栽密度对汕优63产量形成的影响:FACE研究[J]. 农业环境科学学报, 2014, 33 (5) : 836–843 . LAI Shang-kun, ZHOU San-ni, GU Wei-feng, et al. Effects of CO2 concentration, nitrogen supply and transplanting density on yield formation of hybrid rice shanyou 63:A FACE study[J]. Journal of Agro-Environment Science, 2014, 33 (5) :836–843 . |
| [7] | Li X, Han S, Guo Z, et al. Changes in soil microbial biomass carbon and enzyme activities under elevated CO2 affect fine root decomposition processes in a Mongolian oak ecosystem[J]. Soil Biology and Biochemistry, 2010, 42 (7) :1101–1107 . |
| [8] | Manna S, Singh N, Singh V P. Effect of elevated CO2 on degradation of azoxystrobin and soil microbial activity in rice soil[J]. Environmental Monitoring and Assessment, 2012, 185 (4) :2951–2960 . |
| [9] | Formánek P, Rejšek K, Vranová V. Effect of elevated CO2, O3, and UV radiation on soils[J]. The Scientific World Journal, 2014, 2014 :1–8 . |
| [10] | Maria D Q, Marcus S, Seraina B, et al. Ozone visible symptoms and reduced root biomass in the subalpine species Pinus uncinata after two years of free-air ozone fumigation[J]. Environmental Pollution, 2012, 169 :250–257 . |
| [11] | Zhang W W, Niu J F, Wang X K, et al. Effects of ozone exposure on growth and photosynthesis of the seedlings of Liriodendron chinense(Hemsl. )Sarg, a native tree species of subtropical China[J]. Photosynthetica, 2011, 49 (1) :29–36 . |
| [12] | Wang Q, He M, Wang Y. Influence of combined pollution of antimony and arsenic on culturable soil microbial populations and enzyme activities[J]. Ecotoxicology, 2011, 20 (1) :9–19 . |
| [13] | 伍文, 黄益宗, 李明顺, 等. O3浓度升高对麦田土壤氨氧化细菌、氨氧化古菌和硝化细菌数量的影响[J]. 农业环境科学学报, 2012, 31 (3) : 491–497 . WU Wen, HUANG Yi-zong, LI Ming-shun, et al. Effects of elevated ozone on quantity of ammonium-oxidizing bacteria, ammonia-oxidizing achaea and nitrobacteria in wheat field soil[J]. Journal of Agro-Environment Science, 2012, 31 (3) :491–497 . |
| [14] | 陈展, 王效科, 尚鹤. 13CO2示踪臭氧胁迫对水稻土壤微生物的影响[J]. 环境科学, 2014, 35 (10) : 3911–3917 . CHEN Zhan, WANG Xiao-ke, SHANG He. Ozone effects on soil microbial community of rice investigated by 13C isotope labeling[J]. Environmental Science, 2014, 35 (10) :3911–3917 . |
| [15] | Haesler F, Hagn A, Engel M, et al. Impact of elevated atmospheric O3 on the actinobacterial community structure and function in the rhizosphere of European beech(Fagus sylvatica L.)[J]. Frontiers in Microbiology, 2014, 5 :1–12 . |
| [16] | Johnson R M, Pregitzer K S. Concentration of sugars, phenolic acids, and amino acids in forest soils exposed to elevated atmospheric CO2 and O3[J]. Soil Biology and Biochemistry, 2007, 39 (12) :3159–3166 . |
| [17] | 张咸臣, 张海进, 尹微琴, 等. 大气O3浓度升高对麦季土壤和植株氮磷钾的影响[J]. 生态学杂志, 2011, 30 (8) : 1637–1641 . ZHANG Xian-chen, ZHANG Hai-jin, YIN Wei-qin, et al. Effects of elevated atmospheric O3 on N, P, and K concentrations in soil and wheat plant during wheat growth season[J]. Chinese Journal of Ecology, 2011, 30 (8) :1637–1641 . |
| [18] | 黄益宗, 王斐, 钟敏, 等. O3浓度升高对麦田土壤碳、氮含量和酶活性的影响[J]. 生态毒理学报, 2013, 8 (6) : 871–878 . HUANG Yi-zong, WANG Fei, ZHONG Min, et al. Effects of elevated ozone on carbon, nitrogen content and soil enzymes activities in a winter wheat field[J]. Asian Journal of Ecotoxicology, 2013, 8 (6) :871–878 . |
| [19] | 吴芳芳, 郑有飞, 吴荣军, 等. O3浓度升高和太阳辐射减弱对小麦根际土壤微生物功能多样性的影响[J]. 生态学报, 2015, 35 (12) : 3949–3958 . WU Fang-fang, ZHENG You-fei, WU Rong-jun, et al. Effects of ozone fumigation and depressed solar irradiance on soil microbial functional diversity in winter wheat rhizosphere[J]. Acta Ecologica Sinica, 2015, 35 (12) :3949–3958 . |
| [20] | 鲍士旦. 土壤农化分析[M]. 北京市: 中国农业出版社, 2000 BAO Shi-dan. Soil agrochemical analysis[M]. Beijing: Chinese Agricultural Press, 2000 . |
| [21] | 王蕾蕾, 尹维彬, 岳妍, 等. 松材线虫危害后马尾松林土壤氮素的矿化特性[J]. 东北林业大学学报, 2012, 40 (7) : 116–120 . WANG Lei-lei, YIN Wei-bin, YUE Yan, et al. Soil nitrogen mineralization in Pinus massoniana stands after disturbance by pine wilt disease[J]. Journal of Northeast Forestry University, 2012, 40 (7) :116–120 . |
| [22] | 施翠娥, 高扬, 王玉龙, 等. 松材线虫对马尾松林土壤微生物生物量及酶活性的影响[J]. 生态学杂志, 2015, 34 (4) : 1046–1051 . SHI Cui-e, GAO Yang, WANG Yu-long, et al. Soil microbial biomass and enzyme activities in Pinus massoniana forest infected by pine wood nematode[J]. Chinese Journal of Ecology, 2015, 34 (4) :1046–1051 . |
| [23] | 刘纯, 刘延坤, 金光泽. 小兴安岭6种森林类型土壤微生物量的季节变化特征[J]. 生态学报, 2014, 34 (2) : 1–2 . LIU Chun, LIU Yan-kun, JIN Guang-ze. Seasonal dynamics of soil microbial biomass in six forest types in Xiaoxing'an Mountains, China[J]. Acta Ecologica Sinica, 2014, 34 (2) :1–2 . |
| [24] | Iqbal J, Hu R G, Feng M L, et al. Microbial biomass, and dissolved organic carbon and nitrogen strongly affect soil respiration in different land uses:A case study at Three Gorges Reservoir Area, South China[J]. Agriculture, Ecosystems & Environment, 2010, 137 (3/4) :294–307 . |
| [25] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986 : 274 -300. GUAN Song-yin. Soil enzyme and study method[M]. Beijing: Agricultural Press, 1986 : 274 -300. |
| [26] | Larson J L, Zak D R, Sinsabaugh R L. Extracellular enzyme activity beneath temperate trees growing under elevated carbon dioxide and ozone[J]. Soil Science Society of America, 2002, 66 (6) :1848–1856 . |
| [27] | Chen X, Liu J, Deng Q, et al. Effects of elevated CO2 and nitrogen addition on soil organic carbon fractions in a subtropical forest[J]. Plant and Soil, 2012, 357 :25–34 . |
| [28] | 胡正华, 李岑子, 陈书涛, 等. 臭氧浓度升高对土壤-冬小麦系统CO2排放的影响[J]. 环境科学, 2011, 32 (1) : 46–50 . HU Zheng-hua, LI Cen-zi, CHEN Shu-tao, et al. Effects of elevated ozone concentration on CO2 emission from soil-winter wheat system[J]. Chinese Journal of Environmental Science, 2011, 32 (1) :46–50 . |
| [29] | 李硕, 郑有飞, 吴荣军, 等. 臭氧污染胁迫下植物营养生长及防护研究[J]. 中国农业科技导报, 2014, 16 (1) : 117–124 . LI Shuo, ZHENG You-fei, WU Rong-jun, et al. Research progress on plant vegetative growth and protection under ozone pollution stress[J]. Journal of Agricultural Science and Technology, 2014, 16 (1) :117–124 . |
| [30] | Cheng L, Booker F L, Burkey K O, et al. Soil microbial responses to elevated CO2 and O3 in a nitrogen-aggrading agroecosystem[J]. PLOS ONE, 2011, 6 (6) :e21377 . |
| [31] | 许亮, 郑有飞, 吴荣军, 等. 近地层高臭氧浓度对作物地上和地下部分影响的研究进展[J]. 作物杂志, 2013 (5) : 18–24 . XU Liang, ZHENG You-fei, WU Rong-jun, et al. A review on impacts of elevated near-earth storey ozone[J]. Crops, 2013 (5) :18–24 . |
| [32] | 胡君利, 林先贵, 朱建国. 土壤微生物对大气对流层臭氧浓度升高的响应[J]. 土壤, 2008, 40 (6) : 857–862 . HU Jun-li, LIN Xian-gui, ZHU Jian-guo. A review:Soil microbial responses to elevated tropospheric O3 concentration[J]. Soils, 2008, 40 (6) :857–862 . |
 2016, Vol. 35
2016, Vol. 35