文章信息
- 梁丽琛, 刘维涛, 张雪, 陈晨, 霍晓慧, 李松
- LIANG Li-chen, LIU Wei-tao, ZHANG Xue, CHEN Chen, HUO Xiao-hui, LI Song
- 盐土植物提取修复重金属污染盐土研究进展
- Research progress in phytoextraction of heavy metal contaminated saline soil
- 农业环境科学学报, 2016, 35(7): 1233-1241
- Journal of Agro-Environment Science, 2016, 35(7): 1233-1241
- http://dx.doi.org/10.11654/jaes.2016.07.002
文章历史
- 收稿日期: 2016-02-03
盐土是指含有大量可溶性盐类而使大多数植物不能生长的土壤,其含盐量一般达0.6%~1.0%或更高[1]。土壤盐渍化是一个世界性的问题,其形成与土壤母质、质地和地形有关,干旱、不合理的耕作和灌溉以及设施栽培等因素导致土壤次生盐渍化的加剧[2]。据估计,世界范围内约20%的农田土壤受到盐渍化的影响[3]。近年来,随着城市化进程的加快、工业的发展和农用化学品的过量使用,农田土壤重金属污染日益严重,导致干旱和半干旱地区的农田土壤受到盐渍化和重金属污染的“双重”影响[4]。盐土重金属污染不仅在一定程度上降低了农作物产量和品质,还可通过食物链对动物和人体健康造成潜在威胁[2]。
与一般土壤的重金属污染相比,盐土重金属污染的显著特点在于:一方面,盐土中的盐分在一定程度上提高了重金属的迁移性和生物有效性,其可能机理在于盐分中的阴离子可与重金属离子发生络合作用,盐分中的阳离子可与重金属离子竞争吸附,促使重金属离子从土壤固相中解吸[5]。Acosta 等[6]研究证实,外源添加CaCl2 和NaCl 可活化土壤中的Cd 和Pb,而添加MgCl2对Cd 和Cu 的活化作用显著。另一方面,盐土重金属污染使得植物面临着重金属和盐分的“双重”胁迫,绝大多数已发现的重金属超富集植物为甜土植物(Glycophyte),其在盐土环境中难以正常生长,无法用于修复盐土重金属污染[7]。近年来,利用耐盐碱的盐土植物(Halophyte)修复盐土重金属污染的研究逐渐引起人们的关注,盐土植物也被认为是可替代甜土植物修复盐土重金属污染的理想选择[4, 8]。
盐土植物约占全球植物种群的1%,通常是指在含盐(NaCl含量为200mmol·L-1或更高)环境中能够正常生长和繁殖的植物类群[9]。据不完全统计,中国<有430种盐土植物,分属66科、198属,其中46.8%的盐土植物属于藜科(Chenopodiaceae)、禾本科(Poaceae)、菊科(Asteraceae)和豆科(Fabaceae)[10]。利用盐土植物提取修复盐土重金属污染的研究已有较多报道[3],然而,这一研究领Ⅱ的综述还鲜有报道。因此,本文综述了盐土植物对盐和重金属耐性、盐土植物提取修复盐土重金属污染及其影响因素的最新研究进展,并对盐土植物提取修复的可行性、修复效率、局限性及挑战等进行了讨论及展望,以期推动盐土植物修复重金属污染研究的发展。
1 盐土植物对盐和重金属胁迫的耐性 1.1 盐土植物对盐胁迫的耐性盐胁迫主要表现为离子胁迫和渗透胁迫以及次生胁迫(氧化反应),其直接影响植物的基本代谢和生理功能,严重时可导致植株死亡[11]。植物对盐胁迫均有一定的耐性,但存在品种差异。通常情况下,25 mmol·L-1 的NaCl 对甜土植物已具有生理学毒性,而盐土植物却可耐受500~1000 mmol·L-1 的NaCl 胁迫[12]。
盐土植物对盐胁迫的主要响应机制包括抗氧化防御系统的抵御、盐离子的渗透调节/吸收和区室化分布、盐离子由根部向地上部的转运、应激感应和信号传递相关基因表达和代谢等,由此调节渗透物质和转运蛋白等达到胞内离子的内稳态平衡,起到解毒作用[13-14]。Canalejo 等[13]最新研究发现,盐土植物密花米草(Spartina densiflora)受到盐胁迫,总抗坏血酸(AA)、过氧化氢酶(CAT)和抗坏血酸过氧化氢酶(APX)活性水平增加,其耐盐性与密花米草的特殊抗氧化响应机制有关。植物可通过细胞内感应Na+机制,间接地调节K+的流向和气孔密度,降低植物蒸腾作用,从而减少水分亏损并抑制Na+从根部向地上部的转运[11],有效地应激盐胁迫。盐土植物体内的Na+转运蛋白对于植物耐受盐胁迫具有重要作用,植物质膜中SOS1蛋白或液泡膜NHX1蛋白可调节Na+/H+交换量,质膜蛋白PutAKT1 与KPutB1 协同作用调节K+和Na+含量[15],从而使得细胞质中K+和Na+的输出通量得以控制,达到内稳态平衡[16]。
1.2 盐土植物对重金属胁迫的耐性盐土植物的耐盐机制有助于其对重金属的耐性,例如盐土植物在抵御盐胁迫时合成渗透保护剂脯氨酸(Proline),提高了植物对重金属的耐性[3],而且盐土植物通常具有的较高活性的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD),可最大限度地降低重金属毒害产生的活性氧自由基(ROS)对其类脂膜的伤害[17-18]。盐土植物在细胞或亚细胞水平上的耐金属机制在于其将绝大部分重金属束缚于细胞壁和细胞膜,从而降低细胞质中的重金属浓度[8]。Sousa等[19]研究发现,海马齿苋(Halimione portulacoides)可耐受高水平重金属胁迫,原因在于其将绝大部分重金属截留于细胞壁,限制Cd 进入关键细胞器。其次,金属硫蛋白(MTs)和植物螯合肽(PCs)在盐土植物对重金属解毒中起着重要作用[20]。海榄雌(Avicennia germinans)对Cd 和Cu 的高耐性主要表现为其在受胁迫的几小时内即可诱导AvPCS 编码基因的超表达,尽管这一过程短暂,却足以在长期暴露时触发有效的保护机制[21]。当受到Zn、Cu 和Pb 的胁迫时,木榄(Avicennia marina)的解毒机制在于其体内2 型金属硫蛋白(MT2)基因编码的明细上调[22]。此外,一些盐土植物还可通过植物分泌(Phyto-excretion)机制解毒,即利用其特有的盐腺分泌排出有毒重金属[23-24]。
2 盐土植物提取修复植物提取修复(Phytoextraction)是指利用富集植物将土壤中污染物富集和转运到易收割的地上部(某些情况下亦包括根部),通过连续种植和收割富集植物,使得土壤中污染物浓度降低至环境可接受水平[25]。植物提取修复被认为是最为有效的植物修复技术之一[26]。一般而言,植物提取修复土壤重金属过程包括植物根系对土壤中重金属的吸收,根部积累的重金属向地上部的转运,重金属在地上部的积累以及富含重金属的地上部收割与妥善处置等(图 1)[27]。
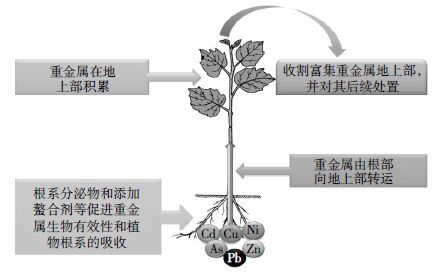
|
| 图 1 植物提取修复土壤重金属过程示意图 Figure 1 Schematic diagram showingphytoextraction of heavymetals from soils |
目前,植物提取修复技术主要采用两种策略:一是自然植物提取修复(Natural phytoextraction),多采用超富集植物进行长期修复,尽管超富集植物的重金属富集能力强,但其生物量通常较小;二是螯合诱导植物提取修复(Chelate-induced phytoextraction),通常采用螯合剂诱导大生物量富集植物修复重金属污染,这些富集植物虽有一定重金属富集能力,但未达到超富集植物标准[28]。
2.1 自然植物提取修复滨藜属(Atriplex)盐土植物生物量巨大且根系深,对环境胁迫具有较强的抗性。据Lutts等[29]报道,滨藜(Atriplex halimus)生物量大(5 t·hm-2·a-1)且对重金属耐性强,地上部Cd 和Zn 的平均浓度分别高达830、440 mg·kg-1,适用于提取修复重金属污染的土壤。此外,滨藜对Cd的吸收随着土壤盐度(NaCl浓度分别为0%、0.5%、3%)的增加而增加,尽管其地上部的Cd 浓度不高,但滨藜生物量高、生长快速以及根系深等特点使其在提取修复盐土Cd 污染上极具潜力[30]。
大米草属(Spartina)盐土植物多为多年生草本植物,常用于水土流失治理与植物修复[24]。Redondo-Gómez等[31]研究证实阿根廷米草(S. argentinensis)是一种铬(Cr)超富集植物,其地上部对Cr 的转运系数和富集系数均大于1.0,可用于提取修复Cr 污染土壤。Salla等[32]研究认为可利用互花米草(S. alterniflora)根部提取修复土壤重金属污染。Nalla 等[33]随后开展了连续两季种植互花米草提取修复重金属污染的研究,结果发现,第二季中互花米草吸收和富集土壤重金属的能力强于第一季,互花米草地上部对Pb、Cr、Cu、Fe 和Zn 的提取量分别为36.4、10.1、29.3、908.7、62 mg·m-2·a-1。据Best 等[34]估算,盐土植物S. foliosa 地上部对汞(Hg)和甲基汞(MeHg)的提取量分别为305、5720μg·m-2·a-1。
值得关注的是,一些研究发现,盐土植物具有超富集重金属的潜力。据报道,芦竹(Arundo donax)为锡(Se)超富集植物,可通过植物提取和植物挥发修复土壤Se 污染[35]。As(Ⅲ)和As(Ⅴ)在芦竹体内的分布规律均为根部<茎部<叶部,芦竹吸收的As 有7.2%~22%可通过植物挥发作用排出体外[36]。de la Rosa 等[37]研究证实钾猪毛菜(Salsola kali)为Cd 超富集植物,其茎部和叶部Cd 含量分别高达2075、2016 mg·kg-1。而Santos 等[38]研究表明,短尖灯芯草(Juncus acutus)为Zn 超富集植物,可用于提取修复土壤Zn 污染。
此外,Alyazouri 等[39]研究表明,马齿苋(Portulacaoleracea)可用于提取修复土壤Cr 污染,其地上部Cr浓度可达1400 mg·kg-1,体内超过95%的Cr(Ⅵ)被还原为低毒的Cr(Ⅲ)。Ghnaya 等[40]研究证实,海马齿(Sesuvium portulacastrum)可用于提取修复盐土Cd 污染,海马齿地上部As和Pb的浓度分别可达155、3400mg·kg-1,可用于提取修复土壤As和Pb污染[41-42]。陈雷等[43]发现,碱蓬(Suaeda salsa)地上部的Cd 富集系数为0.9~19.9,地上部吸收的Cd 累积量是根部的8.1~73.6 倍,存在一定的修复Cd 污染盐土潜力。
2.2 螯合诱导植物提取修复螯合诱导植物提取修复技术主要通过外源添加螯合剂,使得土壤固相束缚的重金属重新释放进入土壤溶液,从而提高了植物对重金属的富集效率。植物提取修复常用螯合剂主要包括氨基多羧酸类螯合剂(APCAs)和低分子量有机酸类螯合剂(LMWOAs)[44]。Zaier 等[45]研究发现,添加EDTA 可有效提高海马齿对Pb 的植物提取修复效率,海马齿地上部Pb 含量从未添加EDTA 时的1390 mg·kg-1 提高至3772 mg·kg-1,Pb 从根部向地上部的转运能力显著提高。Ben Rejeb等[7]研究表明,单一Cd 或添加NaCl 处理下,Cd 主要积累在钾猪毛菜根部,而添加EDTA 可使钾猪毛菜地上部的Cd 含量增加两倍,表明可利用EDTA 诱导钾猪毛菜提取修复盐土Cd 污染。Bareen和Tahira[46]研究证实,添加低剂量EDTA 可有效促进碱蓬属盐土植物Suaeda fruticosa 修复土壤Cr 污染,但添加高剂量EDTA 可能存在土壤Cr 渗滤的风险。Mnasri 等[47]认为,施用柠檬酸可有效促进海马齿对Cd 和Ni 的吸收及其向地上部的转运,而Duarte 等[48]研究却发现,柠檬酸促进了Cd 在海马齿苋体内的积累与转运,但限制了海马齿苋对Ni 的吸收与转运。
2.3 植物提取修复的影响因素植物提取修复过程主要涉及土壤中重金属的活化、根部对重金属的吸收以及重金属由根部向地上部转移等,植物提取修复效率的影响因素主要包括:植物种类、外界环境条件、根际圈、污染物生物有效性、污染物化学特性和环境介质特性等(图 2)。

|
| 图 2 植物提取修复的主要影响因素 Figure 2 Main factors affecting phytoextraction efficiency |
植物品种选择是影响植物提取修复效果的关键因素之一。其中,超富集植物对重金属的吸收量是非富集植物的50~500 倍,目前已发现的超富集植物约400 种,主要分布于菊科(Asteraceae)、十字花科(Brassicaceae)、石竹科(Caryophyllaceae)、豆科(Fabaceae)、大风子科(Flacourtaceae)、唇形科(Lami原aceae)、禾本科(Poaceae)、堇菜科(Violaceae)和大戟科(Euphorbiaceae)[49]。大米草属盐土植物,在植物修复盐土重金属污染上表现出较高潜力,据Redondo-Gómez[24]报道,互花米草(S. alterniflora)可用于植物提取修复,而密花米草(S. densiflora)和S. maritima既可用于植物提取修复,也可用于植物稳定修复盐土重金属污染。Almeida 等[50]研究了不同盐土植物对重金属的吸收和分配特征,发现芦苇(Phragmites australis)将吸收的重金属主要积累在地上部,可用于植物提取修复;而Triglochin striata则将大量的重金属积累在地下部,适于植物稳定修复。值得关注的是,植物对重金属的吸收和富集不仅存在显著的品种差异,还存在显著的基因型差异[51]。因此,今后应开展植物提取修复的盐土植物品种和基因型的筛选和鉴定研究,这些筛选到的植物品种或基因型应同时具有重金属富集能力和耐性较强、生长快速和生物量大等特征。
2.3.2 外界环境条件外界环境条件如温度、湿度、降水、光照和CO2浓度等均可在不同程度上影响植物的生长及其对土壤重金属的吸收。随着外界温度的升高,分子的移动速率和植物自身的酶活性增加,在适宜的温度范围内促进了植物的生长及其对重金属的吸收和富集;光照不仅可影响植物光合作用,还对植物的新陈代谢和酶活性有重要影响,从而对植物吸收和富集重金属产生影响[52]。Li 等[53]研究发现,CO2浓度的升高增加土壤溶液中可溶性有机碳(DOC)和有机酸含量,降低土壤pH值,提高Cd 和Zn 在超富集植物东南景天(Sedum al fredii)根际圈的活性,促进了根系的生长以及Cd 在东南景天体内的积累。
2.3.3 根际圈根际圈是受植物根系影响的根-土界面的一个微区,也是植物-土壤-微生物交互作用的场所,根际圈的pH 值、氧浓度和渗透和氧化还原势等均与植物种类和根系的性质有关[54]。植物根系分泌的低分子量有机酸可降低根际土壤pH 值,从而使得根际土壤中重金属的生物有效性增加,促进了植物对重金属的吸收[55]。Mucha等[56]研究表明,盐土植物Juncus maritimus根系分泌物能够与重金属络合从而增加其生物有效性。此外,根际微生物可活化土壤重金属,促进植物对重金属的吸收。Whiting 等[57]研究发现,根际微生物增加了土壤中水溶态Zn 含量,外源添加根际微生物,超富集植物天蓝遏蓝菜(Thlaspi caerulescens)中Zn的积累量增加了4 倍。da Silva 等[58]研究证实,根际圈接种土著微生物(Cd-RAMC)后,芦苇茎部的Cd 浓度提高至原来的7 倍,显著增强了芦苇提取修复Cd效率。
2.3.4 重金属生物有效性土壤重金属的生物有效性是指土壤重金属在生物体内吸收、积累或毒性程度[59]。重金属的生物有效性主要取决于重金属在环境介质中的存留时间、与其他污染物的交互作用以及环境介质性质[8]。盐土中重金属的生物有效性主要受盐度、氧化还原电位、土壤湿度和pH 等因素控制[60]。一般而言,土壤重金属生物有效性随pH 值的降低而增加,其原因在于酸性条件促进了重金属离子由土壤固相解吸进入土壤溶液[61]。氧化还原电位(Eh)可改变重金属的氧化状态,影响重金属在土壤中的吸附/解吸、土壤微生物的活性和土壤pH值,从而影响重金属的生物有效性。阳离子交换量(CEC)通常与土壤重金属的生物有效性呈负相关,随着阳离子交换量的增加,土壤对于重金属阳离子的吸附稳定能力提高,从而使其生物有效性降低,但其具体影响与重金属种类有关[62]。土壤有机质可与重金属形成络合物从而影响重金属在土壤中的迁移性和生物有效性。有研究表明,加入有机质使得土壤中MgCl2提取态Cd 含量增加,Fe-Mn 氧化物结合态Cd 含量降低,黑麦草(Lolium multörum L.)的生物量无显著影响,但其Cd 含量随着有机质添加量的增加而降低[63]。重金属与土壤溶液阴离子的络合作用对土壤重金属的化学行为和生物有效性具有重要影响,如土壤溶液中Cl-浓度的增加,提高了Cd 的生物有效性及其在植物中的积累[64]。此外,植物的种植、外源添加螯合剂和接种微生物均可改变盐土中重金属的生物有效性[8]。
2.3.5 重金属化学特性土壤中重金属阳离子与有机质的亲和力的一般顺序为Cu2+ >Cd2+>Fe2+>Pb2+>Ni2+>Mn2+>Co2+>Mn2+>Zn2+[65]。植物对重金属的吸收和分配因重金属化学特性的不同而差异显著[66]。盐土植物Juncus maritimus 主要将Cd和Cu积累在地上部,而将Cr和Pb 积累在根部[50]。pH 对植物吸收重金属的影响与重金属元素化学特性有关。Li 等[67]研究发现,降低土壤pH值,增加了植物对Zn、Mn 和Co 的吸收,但却降低了植物对Ni 的吸收;而增加pH 值,则降低了植物对Zn、Mn 和Co 的吸收,提高了其对Ni 的吸收。此外,重金属在土壤环境中的迁移性和毒性还与其在土壤中的化学价态相关,如土壤中Cr(Ⅵ)的毒性和迁移性强于Cr(Ⅲ),而As(Ⅲ)毒性强于As(Ⅴ)[68]。
2.3.6 环境介质特性土壤重金属的生物有效性很大程度上取决于土壤质地,重金属生物有效性在不同土壤中的大小顺序为壤土和砂土 >粘壤土>细纹理粘土[65]。一般而言,较高的土壤湿度有利于植物对重金属的吸收和积累。Angel 等[69]研究了土壤湿度对超富集植物吸收重金属的影响,结果表明,较高的土壤湿度条件下,超富集植物生物量普遍大于较低土壤湿度的生物量,有利于植物修复重金属污染。此外,如上所述,土壤的pH、CEC、Eh、有机质含量以及外源添加螯合剂等对重金属的迁移性和生物有效性有重要影响,均可影响植物对重金属的吸收和积累效率。因此,可采用农艺措施或施用螯合剂等手段改变土壤中重金属的生物有效性,从而达到保障食品安全或修复土壤之目的[70]。
3 讨论与展望 3.1 盐土植物提取修复可行性探讨资源丰富的盐土植物为植物修复盐土重金属污染提供了可能[71]。据报道,全球约有1560 种盐土植物,分属117 科、550 属[10]。盐土植物被认为是修复盐土重金属污染的理想植物选择[4],盐土植物提取修复土壤重金属污染的可行性和优势在于:①对于某些盐土植物,如Tamarix smyrnensis,盐分可以促进重金属从其根部转运到地上部[72];②盐分可以活化土壤重金属,提高其生物有效性,从而促进盐土植物对重金属的吸收[6];③盐土植物从盐土提取重金属的同时,也可以吸收土壤中的盐分,从而达到“边修复重金属,边改良盐碱”之目的,一举两得[8, 73]。
3.2 盐土植物与甜土植物修复效率比较盐土植物与甜土植物修复效率比较研究表明,盐土植物提取修复土壤重金属污染具有一定的优势。Ghnaya 等[74]研究表明,海马齿地上部的Cd 浓度可达350mg·kg-1,干物质产量可达17t·hm-2·a-1,估算可提取Cd5950g·hm-2·a-1,天蓝遏蓝菜(Thlaspi caerulescens)接近4160~8320 g·hm-2·a-1,远远高于芥菜(Brassicajuncea)的60~80g·hm-2·a-1和烟草(Nicotinana tabacum)的500 g·hm-2·a-1)。Zaier等[42]研究了海马齿和芥菜对Pb 的提取修复能力,结果证实海马齿对Pb 的耐性强于芥菜,海马齿地上部Pb 的浓度(3400 mg·kg-1)远高于芥菜地上部Pb 浓度(2200 mg·kg-1),表明海马齿提取修复Pb 的能力强于芥菜。Lokhande 等[41]研究认为,海马齿的As 提取量为2635 g·hm-2·a-1,超过著名的As超富集植物蜈蚣草(525~1470 g·hm-2·a-1)。据Taamalli 等[75]最新报道,盐土植物滨海卡克勒(Cakilemaritima)对Cd 的耐性强于芥菜,其地上部Cd 含量(1365 mg·kg-1)远高于芥菜地上部Cd 含量(548 mg·kg-1),且其转运系数均高于芥菜,表明滨海卡克勒是一种具有较高应用前景的提取修复植物。
3.3 盐土植物提取修复的局限性与挑战尽管盐土植物修复具有原位、绿色和成本低廉等优点,并且近年来在修复盐土重金属污染上也已取得较大进展,但由于其本身也存在一定的局限性,在实际应用中面临着一定的挑战,择要列举如下:
(1) 盐土植物适用于修复低到中等程度的重金属污染,而难以实际应用于修复重金属污染严重的土壤;此外,盐土植物仅能修复植物根系所生长范围的表层土壤,通常不超过50 cm,对于根系之外的土壤则修复效果甚微[76]。
(2) 盐土重金属污染的复杂性为盐土植物提取修复提供了机遇与挑战。一方面,盐土中所含的NaCl 在一定程度上提高了重金属的生物有效性,利于盐土植物对重金属的吸收和积累[30],但NaCl 对重金属生物有效性的提高却因重金属种类的不同而不同[6];另一方面,重金属的生物有效性增加的同时也相应增加了其对盐土植物的毒理效应,过高的NaCl 含量可导致植物生长不良、生物量降低甚至死亡,从而降低其修复效率。盐土植物对盐胁迫的耐性范围一般在500~1000 mmol·L-1,当盐土含盐量超过其自身的耐受范围时,盐土植物理论上无法再用于修复盐土重金属污染。此外,也有研究发现NaCl 的存在有可能降低盐土植物对Cd 的吸收[73],从而限制盐土植物提取修复的效率。因此,今后仍需重点开展不同程度的盐胁迫对盐土植物修复效率的研究。
(3) 盐土植物对重金属的吸收和富集通常具有特定性或专一性,很难同时修复多种重金属或重金属与有机物的复合污染。这也是今后盐土植物提取修复研究中亟需解决的关键问题之一[20]。
(4) 盐土植物修复盐土重金属污染在很大程度上受季节性限制,无法保障一年四季均能生长和修复盐土重金属污染。此外,盐土中的重金属存在老化的现象,在一定程度上降低了植物提取修复的效率[26]。
3.4 展望合适的修复植物筛选是植物提取修复成功的关键之一。笔者认为,用于植物提取修复的理想盐土植物应同时具有以下特征:淤具有较强的盐和重金属耐性,可在重金属污染盐土中正常生长;于地上部具有较强的重金属富集能力,并且重金属由根部向地上部的转运能力较强;盂植物生长快速、地上部生物量大,且具有较深和巨大的根系统;榆地上部利于收割和后续处理。
重金属在土壤中的生物有效性是影响盐土植物提取修复效率的重要因素。外源添加螯合剂EDTA 虽可提高重金属的生物有效性,但易导致重金属渗滤和污染地下水。因此,今后应研发可生物降解的螯合剂,既促进植物提取修复效率,又具有较低的环境风险。为提高盐土植物提取修复效率,今后还需开展生物强化植物修复技术,包括微生物强化、动物强化以及转基因强化植物修复技术的研究。
尽管盐土植物对重金属的耐性和富集机理已有初步研究,但其具体机理仍不甚清楚,今后亟需重点开展基因组学、蛋白组学和重金属代谢途径等领域的研究。最后,盐土植物提取修复盐土重金属污染必然会产生大量富含有毒重金属的生物质,如何安全地处理和处置这些生物质也是今后亟需解决的重要科学问题之一。
| [1] | 张璐, 孙向阳, 尚成海, 等. 天津滨海地区盐碱地改良现状及展望[J]. 中国农学通报 , 2010, 26 (18) : 180–185. ZHANG Lu, SUN Xiang-yang, SHANG Cheng-hai, et al. Review and prospect of improvement present situation on coastal saline-alkali area in Tianjin[J]. Chinese Agricultural Science Bulletin , 2010, 26 (18) : 180–185. |
| [2] | 邓绍云, 邱清华. 中国盐碱土壤修复研究综述[J]. 北方园艺 , 2011 (22) : 171–174. DENG Shao-yun, QIU Qing-hua. Synthetic study on restoration to alka li-saline soil in China[J]. Northern Horticulture , 2011 (22) : 171–174. |
| [3] | Van Oosten M J, Maggio A. Functional biology of halophytes in the phy toremediation of heavy metal contaminated soils[J]. Environmental and Experimental Botany , 2015, 111 : 135–146. |
| [4] | Wang H L, Tian C Y, Jiang L, et al. Remediation of heavy metals con taminated saline soils:A halophyte choice?[J]. Environmental Science & Technology , 2013, 48 (1) : 21–22. |
| [5] | Paalman M A A, Weijden C H, Loch J P G. Sorption of cadmium on sus pended matter under estuarine conditions; competition and complexation with major sea-water ions[J]. Water Air and Soil Pollution , 1994, 73 (1) : 49–60. |
| [6] | Acosta J A, Jansen B, Kalbitz K, et al. Salinity increases mobility of heavy metals in soils[J]. Chemosphere , 2011, 85 (8) : 1318–1324. |
| [7] | Ben Rejeb K, Ghnaya T, Zaier H, et al. Evaluation of the Cd2+ phytoex traction potential in the xerohalophyte Salsola kali L[J]. Ecological Engineering , 2013, 60 : 309–315. |
| [8] | Anjum N A, Ahmad I, Válega M, et al. Salt marsh halophyte services to metal metalloid remediation:Assessment of the processes and underlying mechanisms[J]. Critical Reviews in Environmental Science and Tech nology , 2014, 44 (18) : 2038–2106. |
| [9] | Flowers T J, Colmer T D. Salinity tolerance in halophytes[J]. New Phytol ogist , 2008, 179 (4) : 945–963. |
| [10] | Zhao K, Fan H, Ungar I A. Survey of halophyte species in China[J]. Pl ant Science , 2002, 163 (3) : 491–498. |
| [11] | Hasegawa P M, Bressan R A, Zhu J-K, et al. Plant cellular and molec ular responses to high salinity[J]. Annual Review of Plant Physiology and Plant Molecular Biology , 2000, 51 (1) : 463–499. |
| [12] | Flowers T J, Galal H K, Bromham L. Evolution of halophytes:Multiple origins of salt tolerance in land plants[J]. Functional Plant Biology , 2010, 37 (7) : 604–612. |
| [13] | Canalejo A, Martínez-Domínguez D, Córdoba F, et al. Salt tolerance is related to a specific antioxidant response in the halophyte cordgrass, Spartina densiflora[J]. Estuarine, Coastal and Shelf Science , 2014, 146 : 68–75. |
| [14] | Hasegawa P M. Sodium (Na+)homeostasis and salt tolerance of plants[J]. Environmental and Experimental Botany , 2013, 92 : 19–31. |
| [15] | Ardie S, Nishiuchi S, Liu S, et al. Ectopic expression of the K+channel β subunits from Puccinellia tenuiflora(KPutB1) and rice(KOB1) alters K+homeostasis of yeast and Arabidopsis[J]. Molecular Biotech nology , 2011, 48 (1) : 76–86. |
| [16] | Kronzucker H J, Britto D T. Sodium transport in plants:A critical re view[J]. New Phytologist , 2011, 189 (1) : 54–81. |
| [17] | Sharma A, Gontia I, Agarwal P K, et al. Accumulation of heavy metals and its biochemical responses in Salicornia brachiata, an extreme halo phyte[J]. Marine Biology Research , 2010, 6 (5) : 511–518. |
| [18] | Domínguez M D, García C F, Raya C A, et al. Physiologia Plantarum, 2010, 139(3):289-302[J]. Physiologia Plantarum , 2010, 139 (3) : 289–302. |
| [19] | Sousa A I, Caøador I, LillebøA I, et al. Heavy metal accumulation in Halimione portulacoides:Intra-and extra-cellular metal binding sites[J]. Chemosphere , 2008, 70 (5) : 850–857. |
| [20] | Lutts S, Lefèvre I. How can we take advantage of halophyte properties to cope with heavy metal toxicity in salt-affected areas?[J]. Annals of Botany , 2015, 115 (3) : 509–528. |
| [21] | Gonzalez-Mendoza D, Moreno A Q, Zapata-Perez O. Coordinated re sponses of phytochelatin synthase and metallothionein genes in black mangrove, Avicennia germinans, exposed to cadmium and copper[J]. Aquatic Toxicology , 2007, 83 (4) : 306–314. |
| [22] | Huang G Y, Wang Y S. Expression and characterization analysis of type 2 metallothionein from grey mangrove species (Avicennia marina) in response to metal stress[J]. Aquatic Toxicology , 2010, 99 (1) : 86–92. |
| [23] | Kadukova J, Manousaki E, Kalogerakis N. Pb and Cd accumulation and phyto-excretion by salt cedar(Tamarix smyrnensis bunge)[J]. Interna tional Journal of Phytoremediation , 2008, 10 (1) : 31–46. |
| [24] | Redondo-Gómez S. Bioaccumulation of heavy metals in Spartina[J]. Fu nctional Plant Biology , 2013, 40 (9) : 913–921. |
| [25] | Salt D E, Blaylock M, Kumar N P B A, et al. Phytoremediation:A novel strategy for the removal of toxic metals from the environment using plants[J]. Nature Biotechnology , 1995, 13 (5) : 468–474. |
| [26] | Liu W T, Zhou Q X, Zhang Z N, et al. Evaluation of cadmium phytore mediation potential in Chinese cabbage cultivars[J]. Journal of Agricul tural and Food Chemistry , 2011, 59 (15) : 8324–8330. |
| [27] | 刘维涛, 倪均成, 周启星, 等. 重金属富集植物生物质的处置技术研究进展[J]. 农业环境科学学报 , 2014, 33 (1) : 15–27. LIU Wei-tao, NI Jun-cheng, ZHOU Qi-xing, et al. Research progress of disposal technology for heavy metal-enriched plant biomass[J]. Jour nal of Agro-Environment Science , 2014, 33 (1) : 15–27. |
| [28] | Garbisu C, Alkorta I. Phytoextraction:A cost-effective plant-based technology for the removal of metals from the environment[J]. Bioresource Te chnology , 2001, 77 (3) : 229–236. |
| [29] | Lutts S, Lefèvre I, Delpérée C, et al. Heavy metal accumulation by the halophyte species Mediterranean saltbush[J]. Journal of Environmental Quality , 2004, 33 (4) : 1271–1279. |
| [30] | Manousaki E, Kalogerakis N. Phytoextraction of Pb and Cd by the Mediterranean saltbush(Atriplex halimus L[J]. Environmental Science and Pollution Research , 2009, 16 (7) : 844–854. |
| [31] | Redondo-Gómez S, Mateos-Naranjo E, Vecino-Bueno I, et al. Accu mulation and tolerance characteristics of chromium in a cordgrass Crhyperaccumulator, Spartina argentinensis[J]. Journal of Hazardous ma terials , 2011, 185 (2/3) : 862–869. |
| [32] | Salla V, Hardaway C J, Sneddon J. Preliminary investigation of Spartina alterniflora for phytoextraction of selected heavy metals in soils from Southwest Louisiana[J]. Microchemical Journal , 2011, 97 (2) : 207–212. |
| [33] | Nalla S, Hardaway C J, Sneddon J. Phytoextraction of selected metals by the first and second growth seasons of Spartina alterniflora[J]. Instru mentation Science & Technology , 2012, 40 (1) : 17–28. |
| [34] | Best E H, Hintelmann H, Dimock B, et al. Natural cycles and transfer of mercury through Pacific coastal marsh vegetation dominated by Spartina foliosa and Salicornia virginica[J]. Estuaries and Coasts , 2008, 31 (6) : 1072–1088. |
| [35] | El-Ramady H, Abdalla N, Alshaal T, et al. Giant reed for selenium phytoremediation under changing climate[J]. Environmental Chemistry Letters , 2015, 13 (4) : 359–380. |
| [36] | Mirza N, Pervez A, Mahmood Q, et al. Ecological restoration of arsenic contaminated soil by Arundo donax L[J]. Ecological Engineering , 2011, 37 (12) : 1949–1956. |
| [37] | de la Rosa G, Peralta-Videa J R, Montes M, et al. Cadmium uptake and translocation in tumbleweed(Salsola kali), a potential Cd-hyperaccu mulator desert plant species:ICP/OES and XAS studies[J]. Chemosphere , 2004, 55 (9) : 1159–1168. |
| [38] | Santos D, Duarte B, Caøador I. Unveiling Zn hyperaccumulation in Juncus acutus:Implications on the electronic energy fluxes and on ox idative stress with emphasis on non-functional Zn-chlorophylls[J]. Jo urnal of Photochemistry and Photobiology B:Biology , 2014, 140 : 228–239. |
| [39] | Alyazouri A H, Jewsbury R A, Tayim H A, et al. Phytoextraction of Cr (Ⅵ) from soil using Portulaca oleracea[J]. Toxicological & Environ mental Chemistry , 2013, 95 (8) : 1338–1347. |
| [40] | Ghnaya T, Slama I, Messedi D, et al. Cd-induced growth reduction in the halophyte Sesuvium portulacastrum is significantly improved by NaCl[J]. Journal of Plant Research , 2007, 120 (2) : 309–316. |
| [41] | Lokhande V H, Srivastava S, Patade V Y, et al. Investigation of arsenic accumulation and tolerance potential of Sesuvium portulacastrum(L[J]. Chemosphere , 2011, 82 (4) : 529–534. |
| [42] | Zaier H, Ghnaya T, Lakhdar A, et al. Comparative study of Pb-phy toextraction potential in Sesuvium portulacastrum and Brassica juncea:Tolerance and accumulation[J]. Journal of Hazardous materials , 2010, 183 (1-3) : 609–615. |
| [43] | 陈雷, 杨亚洲, 郑青松, 等. 盐生植物碱蓬修复镉污染盐土的研究[J]. 草业学报 , 2014, 23 (2) : 171–179. CHEN Lei, YANG Ya-zhou, ZHENG Qing-song, et al. Phytoremedia tion of Cd polluted saline soils by the halophyte Suaeda salsa[J]. Acta Pr at ac ulturae Sinica , 2014, 23 (2) : 171–179. |
| [44] | 胡亚虎, 魏树和, 周启星, 等. 螯合剂在重金属污染土壤植物修复中的应用研究进展[J]. 农业环境科学学报 , 2010, 29 (11) : 2055–2063. HU Ya-hu, WEI Shu-he, ZHOU Qi-xing, et al. Application of chelator in phytoremediation of heavy metals contaminated soils:A review[J]. Jo urnal of Agro-Environment Science , 2010, 29 (11) : 2055–2063. |
| [45] | Zaier H, Ghnaya T, Ghabriche R, et al. EDTA-enhanced phytoremedi ation of lead-contaminated soil by the halophyte Sesuvium portulacas trum[J]. Environmental Science and Pollution Research , 2014, 21 (12) : 7607–7615. |
| [46] | Bareen F-e, Tahira S A. Metal accumulation potential of wild plants in tannery effluent contaminated soil of Kasur, Pakistan:Field trials for toxic metal cleanup using Suaeda fruticosa[J]. Journal of Hazardous ma terials , 2011, 186 (1) : 443–450. |
| [47] | Mnasri M, Ghabriche R, Fourati E, et al. Cd and Ni transport and accu mulation in the halophyte Sesuvium portulacastrum:Implication of or ganic acids in these processes[J]. Frontiers in Plant Science , 2015, 6 : 1–9. |
| [48] | Duarte B, Delgado M, Cacador I. The role of citric acid in cadmium and nickel uptake and translocation, in Halimione portulacoides[J]. Chemo sphere , 2007, 69 (5) : 836–840. |
| [49] | Mahar A, Wang P, Ali A, et al. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils:A review[J]. Eco toxicology and Environmental Safety , 2016, 126 : 111–121. |
| [50] | Almeida C M R, Mucha A P, Teresa Vasconcelos M. Role of different salt marsh plants on metal retention in an urban estuary (Lima estuary, NW Portugal)[J]. Estuarine, Coastal and Shelf Science , 2011, 91 (2) : 243–249. |
| [51] | Liu W, Liang L, Zhang X, et al. Cultivar variations in cadmium and lead accumulation and distribution among 30 wheat (Triticum aestivum L[J]. Environmental Science and Pollution Research , 2015, 22 (11) : 8432–8441. |
| [52] | 郝玉娇, 朱启红. 植物富集重金属的影响因素研究[J]. 重庆文理学院学报(自然科学版) , 2010, 29 (4) : 45–47. HAO Yu-jiao, ZHU Qi-hong. Study of influnce factors of plants en riching heavy metals[J]. Journal of Chongqing University of Arts and Science(Natural Science Edition) , 2010, 29 (4) : 45–47. |
| [53] | Li T, Di Z, Han X, et al. Elevated CO2 improves root growth and cadmi um accumulation in the hyperaccumulator Sedum alfredii[J]. Plant and Soil , 2012, 354 (1) : 325–334. |
| [54] | 张雪, 刘维涛, 梁丽琛, 等. 多氯联苯(PCBs)污染土壤的生物修复[J]. 农业环境科学学报 , 2016, 35 (1) : 1–11. ZHANG Xue, LIU Wei-tao, LIANG Li-chen, et al. Bioremediation of soils polluted by polychlorinated biphenyls (PCBs)[J]. Journal of AgroEnvironment Science , 2016, 35 (1) : 1–11. |
| [55] | Li T, Di Z, Islam E, et al. Rhizosphere characteristics of zinc hyperac cumulator Sedum alfredii involved in zinc accumulation[J]. Journal of Hazardous Materials , 2011, 185 (2/3) : 818–823. |
| [56] | Mucha A P, Almeida C M R, Bordalo A A, et al. Exudation of organic acids by a marsh plant and implications on trace metal availability in the rhizosphere of estuarine sediments[J]. Estuarine, Coastal and Shelf Science , 2005, 65 (1/2) : 191–198. |
| [57] | Whiting S N, de Souza M P, Terry N. Rhizosphere bacteria mobilize Zn for hyperaccumulation by Thlaspi caerulescens[J]. Environmental Sci ence & Technology , 2001, 35 (15) : 3144–3150. |
| [58] | da Silva M N, Mucha A P, Rocha A C, et al. A strategy to potentiate Cd phytoremediation by saltmarsh plants:Autochthonous bioaugmenta tion[J]. Journal of Environmental Management , 2014, 134 : 136–144. |
| [59] | 钟晓兰, 周生路, 李江涛, 等. 长江三角洲地区土壤重金属生物有效性的研究:以江苏昆山市为例[J]. 土壤学报 , 2008, 45 (2) : 240–248. ZHONG Xiao-lan, ZHOU Sheng-lu, LI Jiang-tao, et al. Bioavailability of soil heavy metals in the Yangtze River Delta:A case study of Kun shan City in Jiangsu Province[J]. ACTA Pedologica Sinica , 2008, 45 (2) : 240–248. |
| [60] | Conesa H M, Maria-Cervantes A, Alvarez-Rogel J, et al. Influence of soil properties on trace element availability and plant accumulation in a Mediterranean salt marsh polluted by mining wastes:Implications for phytomanagement[J]. Science of the Total Environment , 2011, 409 (20) : 4470–4479. |
| [61] | Hattori H, Kuniyasu K, Chiba K, et al. Effect of chloride application and low soil pH on cadmium uptake from soil by plants[J]. Soil Science and Plant Nutrition , 2006, 52 (1) : 89–94. |
| [62] | 利锋, 张学先, 戴睿志. 重金属有效态与土壤环境质量标准制订[J]. 广东微量元素科学 , 2008, 15 (1) : 7–10. LI Feng, ZHANG Xue-xian, DAI Rui-zhi. The bioavailability of heavy metal and environmental quality standard for soil[J]. Guangdong Weiliang Yuansu Kexue , 2008, 15 (1) : 7–10. |
| [63] | He Q B, Singh B R. Effect of organic matter on the distribution, ex tractability and uptake of cadmium in soils[J]. Journal of Soil Science , 1993, 44 (4) : 641–650. |
| [64] | Weggler K, McLaughlin M J, Graham R D. Effect of chloride in soil so lution on the plant availability of biosolid-borne cadmium[J]. Journal of Environment Quality , 2004, 33 (2) : 496–504. |
| [65] | Sheoran V, Sheoran A S, Poonia P. Factors affecting phytoextraction:A review[J]. Pedosphere , 2016, 26 (2) : 148–166. |
| [66] | Nagajyoti P C, Lee K D, Sreekanth T V M. Heavy metals, occurrence and toxicity for plants:A review[J]. Environmental Chemistry Letters , 2010, 8 (3) : 199–216. |
| [67] | Li Y M, Chaney R L, Brewer E P, et al. Phytoextraction of nickel and cobalt by hyperaccumulator Alyssum species grown on nickel-contaminatedsoils[J]. Environmental Science & Technology , 2003, 37 (7) : 1463–1468. |
| [68] | 周启星, 宋玉芳. 污染土壤修复理与方法[M]. 北京: 科学出版社, 2004 . ZHOU Qi-xing, SONG Yu-fang. Remediation of contaminated soils:Principles and methods[M]. Beijing: Science Press, 2004 . |
| [69] | Angle J S, Baker A J M, Whiting S N, et al. Soil moisture effects on uptake of metals by Thlaspi, Alyssum, and Berkheya[J]. Plant and Soil , 2003, 256 (2) : 325–332. |
| [70] | 刘维涛, 周启星. 不同土壤改良剂及其组合对降低大白菜镉和铅含量的作用[J]. 环境科学学报 , 2010, 30 (9) : 1846–1853. LIU Wei-tao, ZHOU Qi-xing. Effectiveness of different soil ameliorants in reducing concentrations of Cd and Pb in Chinese cabbage[J]. Acta Scientiae Circumstantiae , 2010, 30 (9) : 1846–1853. |
| [71] | Manousaki E, Kalogerakis N. Halophytes present new opportunities inphytoremediation of heavy metals and saline soils[J]. Industrial & Engineering Chemistry Research , 2011, 50 (2) : 656–660. |
| [72] | Manousaki E, Kadukova J, Papadantonakis N, et al. Phytoextractionand phytoexcretion of Cd by the leaves of Tamarix smyrnensis growingon contaminated non-salineand salinesoils[J]. Environmental Research , 2008, 106 : 326–332. |
| [73] | Mei X, Li S, Li Q, et al. Sodium chloride salinity reduces Cd uptake byedible amaranth(Amaranthus mangostanus L[J]. Ecotoxicology and Environmental Safety , 2014, 105 : 59–64. |
| [74] | Ghnaya T, Nouairi I, Slama I, et al. Cadmium effects on growth andmineral nutrition of two halophytes:Sesuvium portulacastrum andMesembryanthemum crystallinum[J]. Journal of Plant Physiology , 2005, 162 (10) : 1133–1140. |
| [75] | Taamalli M, Ghabriche R, Amari T, et al. Comparative study of Cd tolerance and accumulation potential between Cakile maritima L[J]. Ecological Engineering , 2014, 71 : 623–627. |
| [76] | Vangronsveld J, Herzig R, Weyens N, et al. Phytoremediation of contaminated soils and groundwater:Lessons from the field[J]. Environmental Science and Pollution Research , 2009, 16 (7) : 765–794. |
 2016, Vol. 35
2016, Vol. 35




