文章信息
- 陈海刚, 孙立伟, 张林宝, 张喆, 胡莹, 蔡文贵, 贾晓平
- CHEN Hai-gang, SUN Li-wei, ZHANG Lin-bao, ZHANG Zhe, HU Ying, CAI Wen-gui, JIA Xiao-ping
- 六溴环十二烷短期暴露对红鳍笛鲷幼鱼甲状腺激素T3和T4含量的影响
- Effects of short-term exposure to hexabromocyclododecane (HBCD)on T3 and T4 of liver and brain in juvenile crimson snapper (Lutjanus erythopterus)
- 农业环境科学学报, 2016, 35(7): 1257-1263
- Journal of Agro-Environment Science, 2016, 35(7): 1257-1263
- http://dx.doi.org/10.11654/jaes.2016.07.005
文章历史
- 收稿日期: 2016-01-26
2. 浙江工业大学海洋学院, 杭州 310032
2. Ocean College, Zhejiang University of Technology, Hangzhou 310032, China
自从20 世纪60 年代开始生产以来,六溴环十二烷(HBCD)已经成为目前使用最为广泛的脂环族溴化添加剂[1]。HBCD 在建筑行业使用最为广泛,主要用于含量小于3%的挤压或发泡聚苯乙烯泡沫材料中,其次在家具装饰、汽车内饰和电子设备等方面都有广泛的应用[1]。2001 年HBCD 全球产量已达16 700 t,仅次于四溴双酚A( >130 000 t)和十溴二苯醚(56 000 t)的生产量[2],目前全球HBCD 年均消耗量估计已超过22 000 t[3]。
当前,几乎在所有的环境介质中都已经检测到HBCD的存在,相当多城市中心或已知工业源头的河流沉积物中以及海洋沉积物中HBCD浓度已经远远高出十溴二苯醚[4-5]。淡水和海水生物体内HBCD 浓度也都有所检出,生活在工厂废水排放口下游鱼体内HBCD 的浓度超过10 mg·kg-1 [6]。食物链的研究也表明,HBCD 可被无脊椎动物从沉积物中富集,并通过高营养级生物如鱼类、鸟类和海豹捕食而被进一步生物放大[4, 6]。de Wit 等的研究还表明[7],HBCD 具有长距离空气传输的能力,北冰洋格陵兰岛和斯瓦尔巴特群岛北极熊体内检出HBCD 存在也证实了这一点。
HBCD 对生物体表现出较低的急性和慢性毒性,然而其亚致死毒性效应并不能被排除。研究表明,HBCD 对生物解毒酶[8]、内分泌[9]、神经功能[10]和生长发育[10]等方面均有影响。此外现有的毒理学研究结果表明,由于具有和多溴联苯醚(PBDEs)类似的结构,HBCD 一个重要的毒性效应为甲状腺激素干扰效应。目前HBCD 对大鼠[11]、鱼类[11]及人体[12]甲状腺激素影响方面的研究均有报道,但主要选择血清甲状腺激素水平作为重要判断指标。如虹鳟鱼口服HBCD 后,血清中游离甲状腺素(FT4)含量降低而游离甲状腺原氨酸(FT3)含量增加[11],进一步研究还表明HBCD 可能通过影响生物转化酶的表达而影响甲状腺的活性[1]。鱼类甲状腺轴由下丘脑、垂体、甲状腺组成,下丘脑通过分泌促甲状腺激素释放激素、甲状腺滤泡合成并释放甲状腺激素(主要为T4),并运输至肝脏等外周组织中[13-14]。因此鱼类除血液外的其他重要靶器官如肝、脑和鳃组织对污染物胁迫的响应也值得进一步关注[15],但当前HBCD 对鱼类肝、脑等组织甲状腺激素水平影响方面的研究还未见报道。
红鳍笛鲷是我国热带亚热带地区大规模养殖的重要经济鱼类,本研究以红鳍笛鲷幼鱼为受试生物,研究了HBCD 溶液短期暴露对红鳍笛鲷肝、脑组织中甲状腺激素T3 和T4 的影响,研究结果对进一步了解HBCD 的甲状腺激素干扰效应,对认识HBCD 对水生生物的环境暴露风险和保护渔业资源具有重要的参考意义。
1 材料与方法 1.1 仪器与试剂X-mark 酶标仪(美国Bio-RAD 公司);5415 型台式离心机(德国Eppendorf 公司)。
六溴环十二烷(hexabromocyclododecane,HBCD),纯度97%(Sigma 公司)。鱼三碘甲腺原氨酸(T3)ELISA 试剂盒和鱼四碘甲腺原氨酸(T4)ELISA 试剂盒,购于上海继锦化学科技有限公司。实验过程中所用其余试剂均为市售分析纯药品。
1.2 实验材料红鳍笛鲷幼鱼,体长26.13~34.20 mm,体质量1.35~1.87 g,购自海南陵水县新村镇附近育苗场。养殖容器为500 L圆形玻璃钢材质育苗桶,暂养7 d后,选取活泼健康幼鱼进行实验。海水取自育苗场附近,经沉淀池沉淀和砂滤后待用。实验期间海水pH值为7.6~7.8,盐度为35~37,温度为25.7~27.3 ℃。每天定时投喂饲料,待进食5 min 后吸出底部食物残渣,实验过程中昼夜曝氧。
1.3 实验方法 1.3.1 浓度设置称取适量HBCD,用无水乙醇溶解,配制成1 g·L-1的HBCD-乙醇储备液,于4 ℃避光保存,实验时根据需要将储备液进行稀释。参照急性毒性预实验结果,设置低、中、高3 个HBCD 暴露组(8.6、43.0、215μg·L-1),同时以乙醇溶液(V乙醇:V 水=0.05%)作为对照组进行96 h半静水暴露实验。实验容器为100 L正方形玻璃缸,每个容器加入暴露溶液60 L,投放健康幼鱼20 尾。分别在实验进行的24 h、48 h和96 h进行取样测试。
1.3.2 组织样品前处理每组各取5 尾鱼,洁净海水冲洗后置于冰盘内,快速解剖并取其脑组织,0.86%预冷生理盐水淋洗并用滤纸擦干后,按1/10~1/5 的比例(组织质量g/缓冲液体积mL)用预冷的生理盐水匀浆,3000 r·min-1 离心10 min 后,立即取上清液进行相关指标的测定。
1.3.3 测定指标及方法利用双抗体一步夹心法酶联免疫吸附试验(ELISA)测定T3 和T4 水平,具体参照ELISA 试剂盒使用说明书提供的操作方法。
1.3.4 数据分析采用软件SPSS18.0 对实验结果进行one-wayANOVA 方差分析,方差齐时直接采用LSD 分析,不齐时采用Tamhanes's T2 分析。统计结果用平均值±标准偏差(Mean±SD)表示,P <0.05 认为具有显著相关性,P <0.01 认为具有极显著相关性。
2 结果与分析 2.1 HBCD 对红鳍笛鲷肝脏T3 和T4 的影响不同浓度组HBCD 溶液暴露对红鳍笛鲷肝脏组织T3 和T4 含量的影响见图 1。
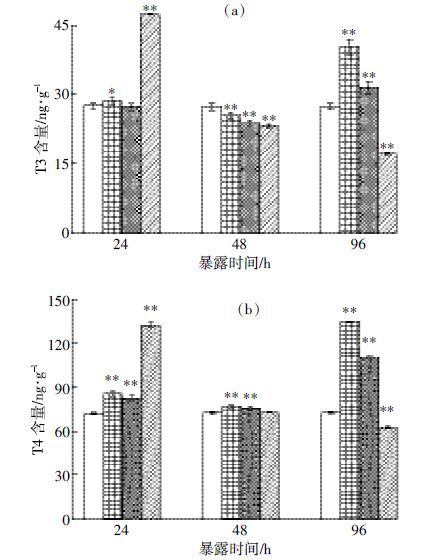
|
| 图 1 HBCD 短期暴露下红鳍笛鲷肝脏组织T3 和T4 的含量 Figure 1 T3 and T4 in liver tissues of Lutjanus erythopterus after short-term exposure to HBCD *、**分别表示P <0.05、P <0.01。下同 *P <0.05 and **P <0.01 indicate significant differences between exposure groups and control group。The same below |
从图 1(a)可以看出,暴露24 h时低暴露组肝脏T3 含量显著增加(P <0.05),高暴露组肝脏T3 含量极显著增加(P <0.01),而中暴露组肝脏T3 含量与对照组比较无显著性差异(P>0.05),表明HBCD 对红鳍笛鲷肝甲状腺素T3 水平具有诱导作用;随HBCD 暴露时间的延长,48 h时各暴露组肝脏T3 含量均极显著降低(P <0.01),且浓度越高降低越明显,呈明显的剂量-效应关系;暴露96 h 时,各暴露组对T3 含量的影响出现差异:低、中暴露组HBCD 暴露下肝脏T3 含量极显著增加(P <0.01),而高暴露组肝脏T3 含量仍极显著(P <0.01)低于对照组。不同暴露组HBCD 溶液暴露对红鳍笛鲷肝脏组织T4 含量的影响如图 1(b)所示,从中可以发现HBCD 对红鳍笛鲷肝甲状腺素T4 有明显的诱导作用。暴露24 h时低、中和高暴露组肝脏组织T4 含量均极显著高于对照组(P <0.01);随暴露时间延长,低、中暴露组T4 含量仍极显著高于对照组(P <0.01),而高暴露组T4 含量恢复至对照组水平;暴露96 h时低、中暴露组肝脏组织T4 含量继续增加,并极显著高于对照组(P <0.01),而高暴露组肝脏T4 含量极显著下降(P <0.01)。
2.2 HBCD 对红鳍笛鲷脑T3 和T4 的影响HBCD 暴露对红鳍笛鲷脑组织甲状腺素T3 和T4 含量的影响如图 2 所示。
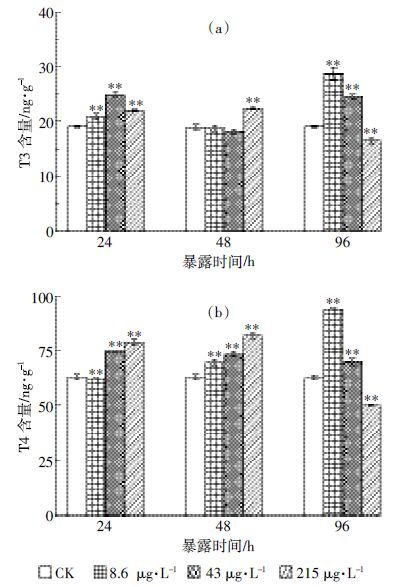
|
| 图 2 HBCD 短期暴露下红鳍笛鲷脑组织T3 和T4 的含量 Figure 2 T3 and T4 in brain tissues of Lutjanus erythopterus after short-term exposure to HBCD |
从图 2(a)可见,HBCD 对红鳍笛鲷脑组织T3 含量有明显的诱导作用:暴露24 h后,低、中和高暴露组脑组织中T3 均被极显著性诱导(P <0.01),中暴露组T3 含量诱导率最高,为30.5%;随暴露时间延长,48 h时低、中暴露组脑组织T3 含量均恢复至对照组水平,而高暴露组T3 含量则极显著性增加(P <0.01);暴露96 h时不同暴露组HBCD 对脑组织T3 的干扰作用出现差异,低、中暴露组T3 水平被极显著诱导(P <0.01),而高暴露组T3 水平被极显著抑制(P <0.01)。HBCD 对脑组织中T4 含量的影响结果如图 2(b)所示。与脑组织中T3 含量的变化规律相似,整个暴露阶段低、中暴露组脑组织中T4 含量均极显著高于对照组(P <0.01),高浓度T4 含量呈先升后降的变化规律:24 h和48 h被极显著诱导(P <0.01),96 h被极显著抑制(P <0.01)。
2.3 HBCD 对红鳍笛鲷肝脏和脑T3/T4 比值的影响图 3 为不同浓度组HBCD 溶液暴露对红鳍笛鲷肝脏和脑组织T3/T4 比值的影响。
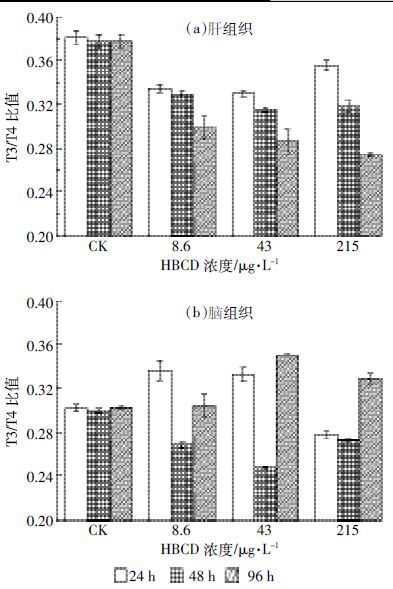
|
| 图 3 HBCD 短期暴露对红鳍笛鲷T3/T4 比值的影响 Figure 3 Ratios of T3 and T4 in Lutjanus erythopterus after shortterm exposure to HBCD |
从图 3(a)可以看出,整个暴露阶段肝组织T3/T4比值均极显著低于对照组(P <0.01),且呈明显的时间-效应和剂量-效应关系。从剂量效应看,不同暴露时间下HBCD 对红鳍笛鲷肝脏组织T3/T4 比值的影响呈3 种变化类型:暴露24 h时肝组织T3/T4 比值随浓度增加而明显升高;暴露48 h时肝组织T3/T4比值先降低,并随浓度增加而趋于平衡;暴露48 h时肝组织T3/T4 比值随浓度增加而明显降低。从时间效应看,不同暴露组肝组织T3/T4 比值随暴露时间延长均明显降低。图 3(b)显示不同浓度组HBCD 暴露后脑组织T3/T4 比值的变化具有较大差异:暴露24 h时低、中暴露组脑组织T3/T4 比值高于对照组,随暴露浓度增加高暴露组脑组织T3/T4 比值降低;暴露48 h时各暴露组脑组织T3/T4 比值均高于对照组,随浓度增加呈先升后降的变化趋势;暴露96 h各暴露组脑组织T3/T4 比值均低于对照组,随浓度增加呈先降后升的变化趋势。
3 讨论在生物体内,甲状腺激素(Thyroid hormones,THs)保持在一个合理的水平是其正常调节生物体诸多生理过程的基础,尤其是对机体的早期正常发育起着至关重要的作用[16]。研究表明,PBDEs、PCBs、TBBPA、HBCD 和甲基汞等很多环境污染物均能影响甲状腺激素在体内的转运过程,如导致生物体的甲状腺滤泡上皮细胞增生、甲状腺激素循环水平改变和甲状腺功能减弱等毒性效应[17-19]。本研究中,与对照组比较,经HBCD 溶液短期暴露后,8.6 μg·L-1 和43 μg·L-1浓度组肝脏和脑组织中T3 和T4 均出现了升高趋势,215μg·L-1浓度组暴露96 h时肝、脑组织中T3 和T4 含量均极显著降低(P <0.01),表明短期暴露下低浓度HBCD 暴露对发育期的红鳍笛鲷幼鱼甲状腺素具有诱导作用,而高浓度水平的HBCD 胁迫对甲状腺素T3 和T4 均产生明显干扰。Palace 等[20]研究了HBCD异构体对彩虹鳟鱼甲状腺素的干扰作用,结果发现幼鱼暴露于HBCD 的3 种异构体56 d后,血清中FT4含量降低,FT3 含量上升。在冀秀玲等[19]的实验中,新生3 d大鼠暴露于HBCD 21 d后,与对照组相比,暴露组大鼠出现了血清中TT4 下降,TT3、FT3、TSH 升高的趋势。比较上述研究结果均可以直观地反映出HBCD 对大鼠和鱼类甲状腺素的干扰效应,同样的结果在人体血清中也得到了进一步证实。李鹏等[12]研究了生产源区人血清中HBCD 水平与甲状腺激素相关性,结果表明生产源区人群血清甲状腺5 项指标异常率均显著高于未检出HBCD 的血清样本,从而认为人群暴露HBCD 会显著增加甲状腺指标异常的发生率。
本研究结果显示,短期暴露下鱼类肝和脑T3、T4含量均呈升高的变化,与其他研究结果在变化规律方面存在一些差异。一般情况下,经HBCD 暴露后,生物体内玉型脱碘酶(D1)诱导甲状腺激素T4 向T3 转化,导致机体内T4 含量降低而T3 含量升高[19]。但本研究中肝脑组织中T3、T4 含量均升高,其原因可能主要在于生物体组织差异和代谢过程的复杂性,同时本实验的暴露时间也短于大部分研究。甲状腺激素的代谢主要是由玉型脱碘酶(D1)和域型脱碘酶(D2)完成,它们不仅参与甲状腺激素的合成与活化,而且对甲状腺功能具有重要的调节作用[19, 21]。脱碘酶主要分布于肝脏和脑组织[21-22],肝脏是甲状腺激素代谢的重要器官和循环T3 的主要来源[21],本研究也发现,整个暴露阶段肝组织T3/T4 比值均极显著低于对照组,表明HBCD 胁迫可能抑制了肝脏D1 酶的活性,从而抑制了甲状腺激素T4 向T3 转化,导致T3/T4 比值下降。类似的结果在刘园园等[23]的研究中也得到了证实,他们观察到HBCD 暴露42 d后大鼠肝脏和脑组织中D1、D2 活性及基因表达水平均呈下降趋势,认为HBCD 能通过改变甲状腺激素代谢酶的活性及mRNA 表达水平影响机体甲状腺激素的内稳态平衡。另外在本研究中,脑组织中T3/T4 比值的变化随暴露时间和浓度有较大差异,则可能与脑内T3 水平由脑D2 活力和血清T4 水平共同决定的相关机制有关[24]。研究中常用血清中TT4 和TT3 水平来检测污染物对生物是否产生甲状腺激素干扰效应,但通常情况下血液中约85%以上的T3 是由T4 在外周组织如肝、肾和骨骼肌等的脱碘酶作用下转变而来[25],因此肝脏和脑对血液中甲状腺素的水平和代谢具有重要影响。这也进一步揭示了HBCD 暴露下,鱼类和大鼠血清呈FT4 含量降低、FT3 含量上升而肝脑组织则呈现不同变化规律的代谢过程,进一步表明了机体甲状腺素代谢过程的复杂性。
作为一种新型的持久性有机污染物[26],HBCD 的健康风险研究尚处于起步阶段,相关毒理学资料仍待完备。Kuiper等[27]认为HBCD 暴露对实验雌鼠甲状腺产生影响的最低基准剂量(以体重计)为1.6 mg·kg-1,总甲状腺激素减少的标准剂量为55.5 mg·kg-1。然而环境中HBCD 通常是与其替代物多溴联苯醚共存,形成复合污染体系,其对小鼠和鱼类的甲状腺激素方面的影响存在明显的不确定性。如刘园园等[23]研究发现,单独HBCD 或DE-71 暴露的文献上往往分别显示协同作用和甲状腺激素水平下降,而HBCD/DE-71复合后甲状腺激素水平反而上升,显示出2 种物质复合暴露产生的毒性不同于任何一种单一物质的暴露结果。另外,从研究文献来看,当前研究对象主要集中在哺乳动物和两栖动物,研究内容主要关注于生物体血清甲状腺激素水平,而污染物干扰鱼类尤其是其他外周组织如肝脏、肾脏和脑甲状腺激素的研究还较为缺乏。Tagawad 等[28]分别以淡水、海水和洄游性鱼卵为实验材料,结果发现在鱼卵孵化的不同阶段26 种鱼卵的T3 和T4 水平呈明显下降的变化规律。这也进一步说明了在缺乏足够的血液样本时,采用生物体的其他组织材料研究激素水平变化的变化规律是可行的。从本研究结果来看,红鳍笛鲷肝脏和脑组织甲状腺素对HBCD 胁迫具有足够的灵敏度,且结合相关的研究文献在一定程度上可以为血清中甲状腺素的变化规律提供有力证据。经济合作与发展组织(OECD)也提出有必要利用鱼类进行甲状腺激素干扰物的筛选和检测[29],因此利用鱼类不同组织的甲状腺激素干扰效应来指示某些典型污染物的毒性效应和机制应该受到高度关注。这对于水环境中甲状腺激素干扰物(TDCs)的筛选和生态风险评价均具有重要的意义。
4 结论(1) HBCD 短期胁迫可干扰红鳍笛鲷肝、脑组织甲状腺的相关机能,其中低、中暴露组以诱导作用为主,而高暴露组则先诱导后抑制。
(2) 与对照组比较,随暴露浓度增加肝T3/T4 比值显著降低,而脑T3/T4 比值呈先升后降的变化规律,表明肝甲状腺素对HBCD 胁迫的反应更敏感,同时也验证了鱼脑对甲状腺的调控影响,但其相关机理有待进一步研究。
(3) 红鳍笛鲷幼鱼肝、脑组织T3 和T4 对HBCD胁迫具有足够的灵敏度,表明利用血液外的其他组织指示和筛选环境中的甲状腺激素干扰物(TDCs)是可行的。
| [1] | Marvin C H, Tomy G T, Armitage J M, et al. Hexabromocyclododecane:current understanding of chemistry, environmental fate and toxicology and implications for global management[J]. Environmental Science & Te chnology , 2011, 45 (20) : 8613–8623. |
| [2] | Covaci A, Gerecke A C, Law R J, et al. Hexabromocyclododecanes (HBCDs)in the environment and humans:A review[J]. Environmental Science & Technology , 2006, 40 (12) : 3679–3688. |
| [3] | Sellström U, Bignert A, Kierkegaard A, et al. Temporal trend studies on tetra-and pentabrominated diphenyl ethers and hexabromocyclodode cane in guillemot egg from the Baltic Sea[J]. Environmental Science & Te chnology , 2003, 37 (24) : 5496–5501. |
| [4] | Leonards P, Vethaak D, Brandsma S, et al. Biotransformation of poly brominated diphenyl ethers and hexabromocyclododecane in two Dutch food chains[C]. Canada, 2004. |
| [5] | Marvin C H, Tomy G T, Alaee M, et al. Distribution of hexabromocy clododecane in Detroit River suspended sediments[J]. Chemosphere , 2006, 64 (2) : 268–275. |
| [6] | Morris S, Allchin C R, Zegers B N, et al. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs[J]. Environmental Science & Technology , 2004, 38 (21) : 5497–5504. |
| [7] | de Wit C, Alaee M, Muir D. Brominated flame retardants in the Arctican overview of spatial and temporal trends[J]. Organohalogen Com pounds , 2004, 66 : 3764–3769. |
| [8] | Ronisz D, Finne E F, Karlsson H, et al. Sublethal effects of the flame re tardants hexabromocyclododecane(HBCDD)and tetrabromobisphenol A (TBBPA)in juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquatic To xicology , 2001, 69 : 229–245. |
| [9] | Legler J, Brouwer A. Are brominated flame retardants endocrine disrup tors?[J]. Environment International , 2003, 29 (6) : 879–885. |
| [10] | Eriksson P, Johansson N, Viberg H, et al. Comparative developmental neurotoxicity of flame-retardants, polybrominated flame-retardants and organophosphorous compounds, in mice[J]. Organohalogen Com pounds , 2004, 66 : 3163–3165. |
| [11] | Palace V P, Pleskach K, Halldorson T, et al. Biotransformation enzymes and thyroid axis disruption in juvenile rainbow trout(Oncorhynchus mykiss)exposed to hexabromocyclododecane diastereoisomers[J]. En vironmental Science & Technology , 2008, 42 (6) : 1967–1972. |
| [12] | 李鹏, 杨从巧, 金军, 等. 生产源区人血清中六溴环十二烷水平与甲状腺激素相关性研究[J]. 环境科学 , 2014, 35 (10) : 3970–3976. LI Peng, YANG Cong-qiao, JIN Jun, et al. Correlations between HBCD and thyroid hormone concentrations in human serum from production source area[J]. Environmental Science , 2014, 35 (10) : 3970–3976. |
| [13] | 张晓娜, 田华, 汝少国. 鱼类甲状腺轴对胚胎发育, 仔鱼变态及性别分化的调控作用研究进展[J]. 中国海洋大学学报:自然科学版 , 2012, 42 : 94–101. ZHANG Xiao-na, TIAN Hua, RU Shao-guo. Advances in piscine thy roidal axis and its regulatory effects on embryogenesis, metamorphosis and sex differentiation[J]. Periodical of Ocean University of China (Nat ural Science) , 2012, 42 : 94–101. |
| [14] | 曲宪成, 杨艳红, 刘颖, 等. 外源性雌二醇对异育银鲫脑垂体-甲状腺轴的影响[J]. 南方水产科学 , 2007, 3 (1) : 31–36. QU Xian-cheng, YANG Yan-hong, LIU Ying, et al. Effects of exogenous estradiol -17β on pituitary-thyroid axis of Carassius auratus[J]. South China Fisheries Science , 2007, 3 (1) : 31–36. |
| [15] | 王贺威, 张喆, 马胜伟, 等. 全氟辛烷磺酸钾对真鲷谷胱甘肽质量分数和谷胱甘肽转硫酶活性的影响[J]. 南方水产科学 , 2012, 8 (4) : 23–28. WANG He-wei, ZHANG Zhe, MA Sheng-wei, et al. Effect of perfluo rooctane sulfonate potassium on glutathione content and glutathione Stransferase activity of red sea bream[J]. South China Fisheries Science , 2012, 8 (4) : 23–28. |
| [16] | Power D M, Llewellyn L, Faustino M, et al. Thyroid hormones in growth and development of fish[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology , 2001, 130 (4) : 447–459. |
| [17] | Ema M, Fujii S, Hirata-Koizumi M, et al. Two-generation reproductive toxicity study of the flame retardant hexabromocyclododecane in rats[J]. Reproductive Toxicology , 2008, 25 (3) : 335–351. |
| [18] | Bleau H, Daniel C, Chevalier G, et al. Effects of acute exposure to mercury chloride and methylmercury on plasma cortisol, T3, T4, glucose and liver glycogen in rainbow trout (Oncorhynchus mykiss)[J]. Aquatic To xicology , 1996, 34 (3) : 221–235. |
| [19] | 冀秀玲, 刘洋, 刘芳, 等. 六溴环十二烷转甲状腺素蛋白结合活性及其发育期暴露的甲状腺激素干扰效应研究[J]. 环境科学 , 2010, 31 (9) : 2191–2195. JI Xiu-ling, LIU Yang, LIU Fang, et al. Transthyretin-binding activity of hexabromocyclododecanes(HBCDs)and its thyroid hormone dis rupting effects after developmental exposure[J]. Chinese Journal of En vironmental Science , 2010, 31 (9) : 2191–2195. |
| [20] | Palace V P, Pleskach K, Halldorson T, et al. Biotransformation enzymes and thyroid axis disruption in juvenile rainbow trout(Oncorhynchus mykiss)exposed to hexabromocyclododecane diastereoisomers[J]. En vironmental Science & Technology , 2008, 42 (6) : 1967–1972. |
| [21] | 杨雪锋, 孙秀发, 侯晓晖, 等. 硒对高碘小鼠肝脏两种含硒酶的影响[J]. 营养学报 , 2005, 27 (4) : 300–302. YANG Xue-feng, SUN Xiu-fa, HOU Xiao-hui, et al. Influence of sele nium supplementation on the hepatic seleno enzymes in mice fed with high iodine diet[J]. Acta Nutrimenta Sinica , 2005, 27 (4) : 300–302. |
| [22] | 孟列素, 谭武红, 苏敏, 等. MSeC对鸡胚肝脏和脑组织中谷胱甘肽过氧化物酶和脱碘酶活性的影响[J]. 中国地方病学杂志 , 2005, 24 (4) : 382–385. MENG Lie-su, TAN Wu-hong, SU Min, et al. Effects of Se-methylse lenocysteine on glutathione peroxidase and iodothyronine deiodinase activity in chicken embryonic brain and liver[J]. Chinese Journal ofEndemiology , 2005, 24 (4) : 382–385. |
| [23] | 刘园园, 冀秀玲, 沈群辉, 等. 六溴环十二烷及其复合污染脑发育期暴露对大鼠甲状腺激素代谢过程的影响[J]. 生态环境学报 , 2012, 21 (9) : 1614–1619. LIU Yuan-yuan, JI Xiu-ling, SHEN Qun-hui, et al. Disrupting Effects of Hexabromocyclododecane(HBCD)and its complex compounds on rat thyroid hormone metabolism after developmental exposure[J]. Ecol ogy and Environment Sciences , 2012, 21 (9) : 1614–1619. |
| [24] | Hall J A, Bianco A C. Triumphs of the thyroid despite lesser conversion[J]. Endocrinology , 2009, 150 (6) : 2502–2504. |
| [25] | Beckett G J, Arthur J R. Selenium and endocrine systems[J]. Journal of Endocrinology , 2005, 184 (3) : 455–465. |
| [26] | Arnot J, Mccarty L, Armitage J, et al. An evaluation of hexabromocy clododecane (HBCD)for Persistent Organic Pollutant (POP)properties and the potential for adverse effects in the environment[R]. Submitted to European Brominated Flame Retardant Industry Panel(EBFRIP), 2009. |
| [27] | Kuiper R V, Canton R F, Leonards P, et al. Long-term exposure of European flounder (Platichthys flesus)to the flame-retardants tetrabro mobisphenol A (TBBPA)and hexabromocyclododecane (HBCD)[J]. E cotoxicology and Environmental Safety , 2007, 67 (3) : 349–360. |
| [28] | Tarawa M, Tanaka M, Matsumoto S, et al. Thyroid hormones in eggs of various freshwater, marine and diadromous teleosts and their changes during egg development[J]. Fish Physiology and Biochemistry , 1990, 8 (6) : 515–520. |
| [29] | Blanton M L, Specker J L. The hypothalamic-pituitary-thyroid(HPT) axis in fish and its role in fish development and reproduction[J]. Criti cal Reviews in Toxicology , 2007, 37 (1/2) : 97–115. |
 2016, Vol. 35
2016, Vol. 35




