文章信息
- 李嘉, 张瑞杰, 王润梅, 张华, 姜德娟, 邹涛, 唐建辉, 吕剑
- LI Jia, ZHANG Rui-jie, WANG Run-mei, ZHANG Hua, JIANG De-juan, ZOU Tao, TANG Jian-hui, LÜ Jian
- 小清河流域抗生素污染分布特征与生态风险评估
- Distribution characteristics and ecological risk assessment of antibiotic pollution in Xiaoqing River watershed
- 农业环境科学学报, 2016, 35(7): 1384-1391
- Journal of Agro-Environment Science, 2016, 35(7): 1384-1391
- http://dx.doi.org/10.11654/jaes.2016.07.022
文章历史
- 收稿日期: 2015-12-16
2. 中国科学院大学, 北京 100049 ;
3. 广西大学海洋学院, 南宁 530004
2. University of Chinese Academy of Sciences, Beijing 100049, China ;
3. College of Oceanology, Guangxi University, Nanning 530004, China
抗生素可用于治疗各种非病毒感染所引起的疾病,同时还具有调节生物体生长代谢的功能。因此,它们被广泛用于人类疾病治疗和养殖业[1]。我国抗生素滥用现象严重,仅2013 年,我国抗生素使用总量就高达16.2 万t,其中人用和兽用抗生素的比重基本各占50%[2]。由于抗生素进入生物体后,不能被完全代谢, 有25%~75%的抗生素是以母体或其代谢产物的形式被排出体外[3],所以每年实际有大量抗生素通过生活污水和养殖废水进入环境地表水中。虽然抗生素不属于持久性有机污染物,但由于被大量使用并不断进入地表水,导致其形成“假持久”现象[4],对人类健康和生态系统构成严重威胁。另外,抗生素会影响微生物种群数量及水生生物的环境行为,引发次级效应,破坏自然生态平衡。
小清河起源于济南市泉群,流经济南、淄博、滨州、东营、潍坊,于寿光羊角沟流入渤海的莱州湾,是一条典型的陆源入海河流。主要的土地利用类型包括耕地、居民区、森林、草地和水域等。流域内人口密度为699人·km-2,大于山东省平均人口密度(599人·km-2)。 小清河流域受生活污水污染影响严重,生活污水年排放量3 亿t[5]。流域内畜禽养殖业发达,90%以上为规模化养殖[6],单位耕地面积(公顷)内养猪3.22 头、牛1.17头、禽类110 只。《山东省海洋功能区划》规定[7], 小清河河口及其周边海域属于水产养殖、增殖区,下游水产养殖密集,仅羊口镇就有4000 hm2虾池。小清河流域分布着众多的抗生素潜在污染源,使其容易成为抗生素重污染区。与此同时,小清河作为莱州湾的主要污染负荷来源,由其输入的抗生素也对莱州湾近岸海域生态健康具有重大影响。张瑞杰等[8]调查了莱州湾入海河流中抗生素的污染情况,结果表明小清河口喹诺酮抗生素质量浓度较高,但对流域内抗生素的空间分布尚未有调查。
为了研究抗生素通过陆源河流进入海洋的迁移过程及其分布规律,了解抗生素污染对流域及近岸水生环境的影响,本研究以整个小清河流域作为研究区,选取常用的四类抗生素(大环内酯类、喹诺酮类、磺胺类和磺胺增效类)作为目标污染物,探究小清河流域中的污染及空间分布特征,对其来源进行简要分类和初步探讨,通过风险商值(RQs)来评估其生态风险,从而为该流域抗生素污染治理提供有效的指导意见。
1 材料与方法 1.1 化学试剂和标准品磺胺增效类的甲氧苄啶(TMP),磺胺类的磺胺醋酰(SAAM)、磺胺嘧啶(SDZ)、磺胺甲恶唑(SMX)、磺胺噻唑(STZ)、磺胺间二甲氧嘧啶(SDM),喹诺酮类的恩诺沙星(ENRO)、氧氟沙星(OFL)、诺氟沙星(NOR)、 环丙沙星(CIP)、依诺沙星(ENO),大环内酯类的红霉素(ETM)、阿奇霉素(AZM)、克拉霉素(CTM)、罗红霉素(RTM)均购自美国Sigma-Aldrich 公司。回收率指示剂13C3-咖啡因溶液购自美国剑桥同位素实验室。 甲醇、乙腈和甲酸为色谱纯,硫酸为分析纯,其他试剂均为优级纯。实验用水为Milli-Q(Millipore,Bedford, MA,USA)超纯水。
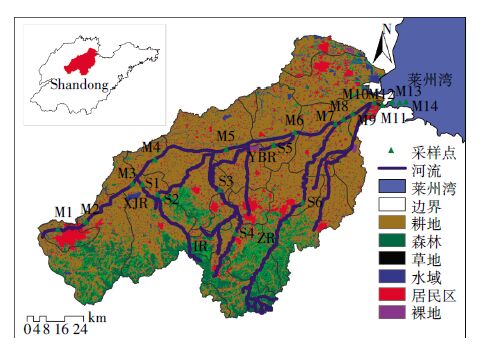
1.2 样品采集2013 年7 月,用不锈钢采水器在小清河干流采集表层水样品14 个(M1~M14),在其主要支流漯河、 孝妇河、淄河等河流采集表层水样品6 个(S1~S6),20 个样品均为瞬时采样(图 1)。2.5 L样品被保存在棕色玻璃瓶中,运回实验室后,48 h内完成样品前处理。
|
| 图 1 小清河流域采样点及土地利用类型 Figure 1 Map of Xiaoqing River watershed showing sampling sites and land use types |
用量筒量取>1.5 L 表层水样品,经0.45 μm 混合纤维酯微孔滤膜过滤后,用3 mol·L-1 的硫酸溶液调节样品pH=3.0。准确量取1.5 L酸化后的水样,加入0.2 g Na2EDTA 络合剂和100 ng 回收率指示物13C3- 咖啡因,摇匀。采用固相微萃取装置(SPE)将水样以低于5 mL·min-1的流速通过Oasis HLB 小柱(Waters, 6mL,500 mg)。HLB 小柱使用前用6 mL甲醇和6 mL 超纯水(pH=3.0)分3 次进行活化。萃取结束后,将HLB 小柱真空干燥30 min,然后用6 mL 甲醇分3 次进行洗脱,洗脱流速低于3 mL·min-1。收集洗脱液至玻璃离心管中,利用氮吹仪将洗脱液吹扫至近干,用甲醇:水(60:40)溶液定容至1 mL,经0.2 μm 滤膜过滤后转移至1.5 mL 棕色进样小瓶,利用高效液相色谱-三重四极杆质谱(Thermo Scientific Ultimate 3000, USA)联用仪进行测定。样品经Hypersil Gold-C18 (1.9 μm,2.1 mm×100 mm)色谱柱分离,柱温25 益;流动相A 为5 mmol·L-1乙酸铵和0.1%甲酸溶液,流动相B 为甲醇,采用梯度洗脱;离子源为ESI,在正离子模式下,采用选择反应监控模式(SRM)进行检测分析。大环内酯类、磺胺类及磺胺增效类抗生素一起检测,喹诺酮类抗生素单独检测。
1.4 方法回收率与质量控制目标抗生素通过外标法定量。在优化条件下,抗生素的回收率为68%~82%。以信噪比逸3 时抗生素的浓度值作为仪器检出限,结合样品回收率及浓缩系数,15种抗生素的方法检出限范围为0.24~0.71ng·L-1。
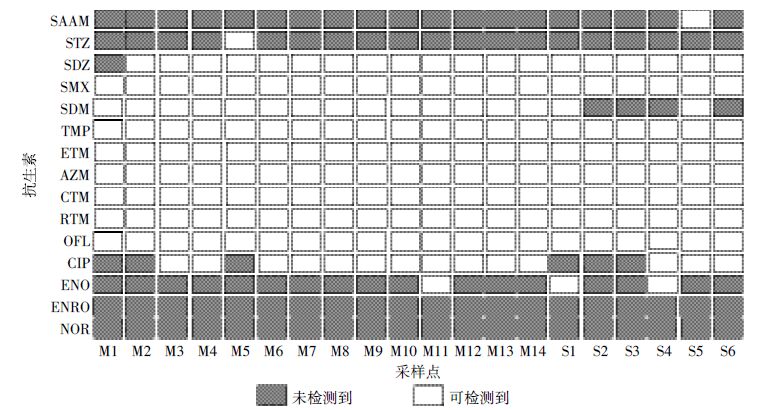
2 结果与讨论 2.1 小清河流域地表水中抗生素污染特征由图 2 可见,小清河流域20 个地表水中共可检测到13 种抗生素。其中,TMP 和4 种大环内酯类抗生素的检出率为100%;5 种磺胺类抗生素中,除了SAAM 和STZ 的检出率较低(5%)外,其余3 种的检出率均大于80%;相对而言,氟喹诺酮类抗生素的检出率较低,仅OFL和CIP的检出率大于50%,而ENRO 和NOR 未检测到。不同种类抗生素检出率的差异可能是由其使用方式和环境行为引起的。大环内酯类抗生素被广泛用于人类疾病治疗[9];磺胺类抗生素是常用的兽药,通常与TMP 一起使用来增强药效,此外, 磺胺类抗生素在自然水体中水溶性好,且不容易发生吸附或降解反应[10]。这些条件都可能导致大环内酯类、磺胺类和磺胺增效类抗生素在地表水中的检出率较高。我国政府规定水产养殖禁止使用STZ[11], 使用量减少可能导致其在地表水中检出率较低。氟喹诺酮类抗生素易发生光降解[12],容易被沉积物吸附[13];此外,ENRO 属于兽用专用药,NOR 被禁止未成年人使用,使其用量受限。这都可能导致某些氟喹诺酮类抗生素在自然水体中含量较少,不容易被检测到。
|
| 图 2 15 种抗生素的检出率结果 Figure 2 Percentages of detected antibiotics |
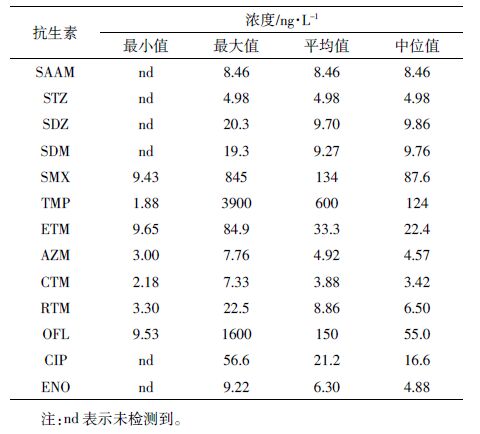
表 1 列出了可检测到的13 种抗生素的质量浓度,TMP和OFL的最高浓度达到了μg·L-1的级别,其余的11 种抗生素的浓度峰值均处于ng·L-1 的级别。 从浓度平均值来看,TMP 的含量最高,为600 ng·L-1; 5种磺胺类抗生素中,SMX的含量最高,为134 ng·L-1, 其余4 种的平均浓度均低于10 ng·L-1。原因可能是SMX 价格相对较低[15],在小清河流域内SMX 的用量较大,导致其在地表水中残留量高。虽然4 种大环内酯类抗生素的检出率为100%,但除了ETM 的含量较高(33.3 ng·L-1)外,其余3 种的平均浓度均较低;4 种大环内酯类抗生素平均含量大小为ETM>RTM> AZM>CTM,与国内其他地表水中大环内酯类抗生素的浓度分布规律一致[11]。氟喹诺酮类抗生素中OFL的含量最高,为150 ng·L-1,其次是CIP(21.2 ng·L-1), ENO 的平均浓度仅为6.30 ng·L-1。
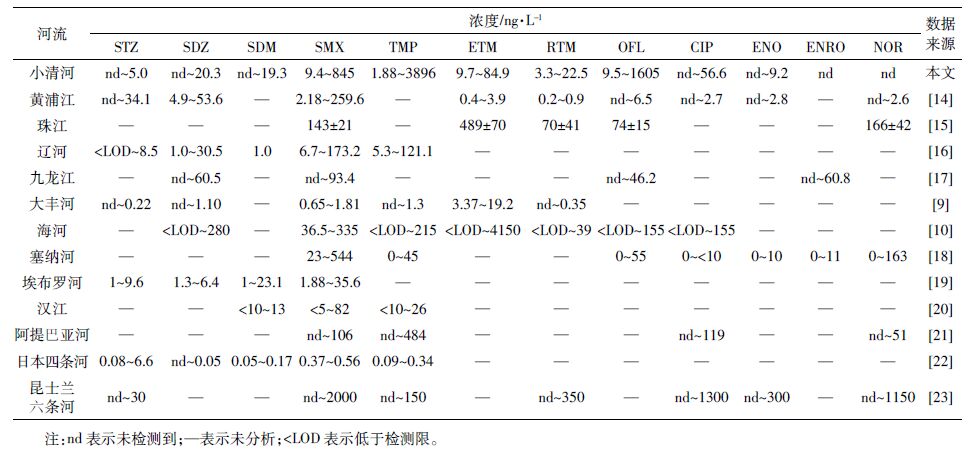
与国内外地表水中抗生素浓度相比(表 2),小清河流域TMP 和OFL 的污染严重,其最大浓度要远高于国内外河流,其余几种抗生素的浓度范围与国内外河流处于同一数量级。总体而言,小清河流域抗生素的浓度处于中等水平,大多数抗生素的最高浓度比国内河流低,比大多数国外的河流高。
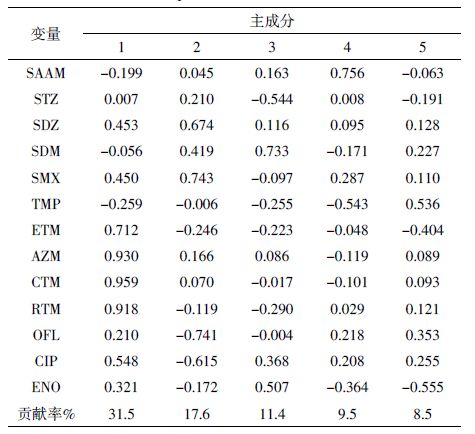
图 3 列出13 种抗生素浓度的空间分布情况及各类抗生素总浓度的变化趋势。如图 3a 所示,大环内酯类抗生素在流域上游浓度较高,从上游至下游,其浓度呈现出逐渐减小的趋势。生活污水中通常可检测到较高浓度的人用抗生素,而生活污水主要来自居民区,尤其是人口密集区,因此人口密集区下游往往是人用抗生素重灾区。M2 位于济南市槐荫区出口,S4 位于淄博市淄川区出口,S6 位于淄博市临淄市下游(图 1),在这3 个站位都检测到高浓度的大环内酯类抗生素。M1 位于人口密集区上游,通过对比发现, M2 站位的大环内酯类抗生素的浓度明显高于M1。另外,主成分分析(PCA)结果表明,4 种大环内酯类抗生素属于同一组分(表 3),说明它们来自同一污染源。我国政策规定,水产养殖禁用ETM,CTM 只能用于人类疾病治疗[11]。以上的分析显示小清河流域内大环内酯类抗生素主要来自生活污染源。

|
| 图 3 小清河流域抗生素含量分布 Figure 3 Distribution of antibiotic concentrations in Xiaoqing River watershed |
氟喹诺酮类抗生素是一种人兽共用药,其浓度分布从上游到下游呈现出先减少后增加的趋势,但上游浓度明显高于下游(图 3b )。与大环内酯类抗生素分布规律相似,浓度较高的几个站位也是M2、S4 和S6, M1 站位的浓度也非常低,说明研究区内氟喹诺酮类抗生素的主要来源也是生活污染源。下游河口区域浓度升高,可能跟水产养殖有关。根据以前的调查,莱州湾养殖区附近海域喹诺酮类抗生素污染严重[8];另外, 随着盐度增加,水中溶解性有机碳(DOC)浓度降低[24]。 作为一种吸附能力很强的物质,DOC 的减少可能导致抗生素吸附量减小,从而使水体中溶解态的抗生素增多。
小清河流域内磺胺类抗生素的浓度分布较为平均(图 3c )。下游区域检测到较高浓度的SMX,可能跟水产养殖和集约化畜禽养殖有关。梁惜梅等[25]研究发现水产养殖废水是珠江口抗生素污染的主要来源, 何秀婷等[26]在广州海水养殖区的7 个沉积物样品中均检测到磺胺类抗生素残留,说明养殖废水对于周围水域磺胺类抗生素污染的贡献较大。S3 可能位于点源污染附近,导致该站SMX 的浓度很高。位于S3 下游的M5 站位,可能受其排入的影响,致使其SMX 的浓度升高。S5 位于博兴县湖滨镇畜牧兽医站下游不远处,我们在该站位检测到4 种磺胺类抗生素,印证了磺胺类抗生素主要来自于动物医疗。
TMP 通常与SMX、SDZ 等磺胺类抗生素配合使用来增强药效。因此,其在空间上的分布规律应与磺胺类抗生素相一致。图 3d 显示,高浓度的TMP主要集中在靠近河口的下游区域,而流域上游和支流区域内TMP 的浓度较低,说明下游水产养殖对TMP 的污染有重要贡献。另外,TMP在自然水体中很稳定[27-28], 易使其浓度通常维持在较高水平。在人口密集的M2、 S4 和S6 站位,TMP 的浓度相对较低,说明研究区生活污染并不是TMP的主要来源。
总体上,4 类抗生素在地域空间上表现出不同的分布特征。其原因除了跟抗生素用量和使用方式有关外,土地类型、径流量等环境因素也会影响抗生素在环境中的迁移。据Dutta等[29]报道,含有抗生素的地表水流经河岸植被区时,其浓度会降低。Vaicunas等[30] 在美国特拉华州的研究表明,磺胺类和四环素类抗生素与土地利用类型有较弱的相关性。而本文的数据显示,在居民区下游可检测到较高浓度的大环内酯类和氟喹诺酮类抗生素,间接地反映出土地利用类型对地表水抗生素污染的影响。
2.3 小清河流域地表水中抗生素的生态风险评估通过计算风险商值(RQs)来评估研究区内地表水中抗生素潜在生态风险的大小。根据欧洲技术指导文件中有关风险评估的介绍[31],采用以下公式进行计算RQs:
式中:MEC(Measured Environmental Concentration)为实测环境浓度,ng·L-1;PNEC(Predicted No Effect Con原centration)为预测无效应浓度,ng·L-1。
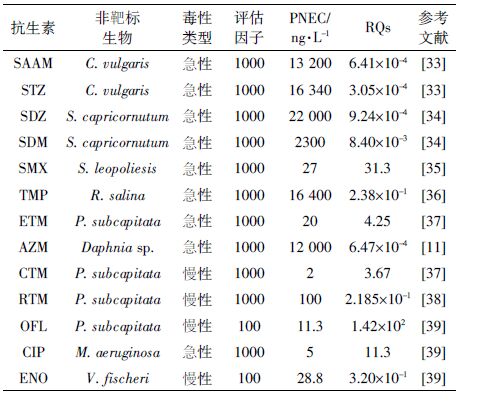
PNEC 值通过查阅文献获得,或者通过收集急性或慢性毒理学实验数据与评估因子计算得来。本次调查基于“最坏情况”打算,采用抗生素的最大实测浓度来计算其相应的RQ 值。以最保守的方式评估13 种抗生素的环境生态风险(表 4)。
为了更好地区分地表水中抗生素的生态风险大小,RQ 值被划分为4 个等级:RQs<0.01 为无风险,0.01<RQs<0.1 为低风险;0.1<RQs<1 为中等风险;1< RQs 为高风险[32]。13 种抗生素的RQ 值如表 4 所示, 其中处于高风险等级、中等风险等级、无风险等级的抗生素比例分别是38.5%、23.1%、38.5%。OFL、SMX、 CIP、ETM 和CTM 5种抗生素处于高风险等级,说明它们对研究区地表水中相应的敏感性生物构成严重威胁。ENO、TMP和RTM 处于中等风险等级,SAAM、 STZ、SDM、SDZ 和AZM 对于研究区内水生生物的生态威胁不显著。
3 结论(1)小清河流域地表水中有13 种抗生素:大环内脂类和磺胺增效药甲氧苄啶的检出率为100%;5 种磺胺类抗生素中除了不常用的磺胺醋酰和磺胺噻唑外,其余几种的检出率都大于80%;喹诺酮类抗生素的检出率相对较低。研究区内大多数抗生素的浓度峰值均处于ng·L-1 级别,TMP 和OFL 的最高浓度达到μng·L-1级别。与国内外河流相比,小清河及其主要支流中大多数抗生素的浓度处于中等水平。
(2)空间分布上,大环内酯类和喹诺酮类抗生素在人口密集区浓度较高,说明这两类抗生素与生活污染源紧密相关;磺胺类和磺胺增效类抗生素的高浓度主要集中在下游区域,可能跟密集的畜禽和水产养殖有关。
(3)根据生态风险评估,小清河流域地表水中5 种抗生素具有高风险性,3 种抗生素处于中等风险等级。这些抗生素对水体中敏感性水生生物具有较高的毒性风险。因此,小清河流域地表水中抗生素污染问题应引起关注。
| [1] | Moreno-Bondi M C, Marazuela M D, Herranz S, et al. An overview of sample preparation procedures for LC-MS multiclass antibiotic determi nation in environmental and food samples[J]. Analytical and Bioanalyti cal Chemistry , 2009, 395 (4) : 921–946. |
| [2] | Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of an tibiotics emission and fate in the River Basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environ mental Science & Technology , 2015, 49 (11) : 6772–6782. |
| [3] | Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary an tibiotics (VAs)in the environment[J]. Chemosphere , 2006, 65 (5) : 725–759. |
| [4] | 周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J]. 生态毒理学报 , 2007, 2 (3) : 243–251. ZHOU Qi-xing, LUO Yi, WANG Mei-e. Environmental residues and ecotoxicity of antibiotics and their resistance gene pollution:A review[J]. Asian Journal of Ecotoxicology , 2007, 2 (3) : 243–251. |
| [5] | 马吉刚, 郭红欣, 梅泽本, 等. 山东小清河水质污染原因及治理对策分析[J]. 中国农村水利水电 , 2003 (8) : 53–54. MA Ji-gang, GUO Hong-xin, MEI Ze-ben, et al. Analysis of causes and countermeasures of water pollution of the Xiaoqing River in Shandong[J]. China Rural Water and Hydropower , 2003 (8) : 53–54. |
| [6] | 王立刚, 李虎, 王迎春, 等. 小清河流域畜禽养殖结构变化及其粪便氮素污染负荷特征分析[J]. 农业环境科学学报 , 2011, 30 (5) : 986–992. WANG Li-gang, LI Hu, WANG Ying-chun, et al. Changes in livestock operation systems and their contributions to manure nitrogen pollution loading in Xiaoqinghe Watershed, China[J]. Journal of Agro-Environment Science , 2011, 30 (5) : 986–992. |
| [7] | 山东省海洋功能区划编制组. 山东省海洋功能区划[M]. 北京: 海洋出版社, 2004 : 11 . Editorial Group for Marine Functional Zoning of Shandong Province. Marine functional zoning of Shandong Province[M]. Beijing: China O cean Press, 2004 : 11 . |
| [8] | 张瑞杰, 张干, 郑芊, 等. 喹诺酮类抗生素在莱州湾及主要入海河流中的含量和分布特征[J]. 海洋环境科学 , 2012, 31 (1) : 53–57. ZHANG Rui-jie, ZHANG Gan, ZHENG Qian, et al. Concentrations and spatial distributions of selected quinolones antibiotics in Laizhou Bay and main rivers flowing into the bay[J]. Marine Environmental Science , 2012, 31 (1) : 53–57. |
| [9] | Zheng Q, Zhang R, Wang Y, et al. Occurrence and distribution of antibi otics in the Beibu Gulf, China:Impacts of river discharge and aquacul ture activities[J]. Marine Environmental Research , 2012, 78 : 26–33. |
| [10] | Luo Y, Xu L, Rysz M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J]. Environmental Science & Technology , 2011, 45 (5) : 1827–1833. |
| [11] | Xue B M, Zhang R J, Wang Y H, et al. Antibiotic contamination in a typical developing city in South China:Occurrence and ecological risks in the Yongjiang River impacted by tributary discharge and anthro pogenic activities[J]. Ecotoxicology and Environmental Safety , 2013, 92 : 229–236. |
| [12] | Jiao S, Zheng S, Yin D, et al. Aqueous photolysis of tetracycline and toxicity of photolytic products to luminescent bacteria[J]. Chemosphere , 2008, 73 (3) : 377–382. |
| [13] | Zhang J Q, Dong Y H. Effect of low-molecular-weight organic acids on the adsorption of norfloxacin in typical variable charge soils of China[J]. Jo urnal of Hazardous Materials , 2008, 151 (2/3) : 833–839. |
| [14] | Jiang L, Hu X L, Yin D Q, et al. Occurrence, distribution and seasonal variation of antibiotics in the Huangpu River, Shanghai, China[J]. Chemosphere , 2011, 82 (6) : 822–828. |
| [15] | Xu W, Zhang G, Li X, et al. Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta (PRD), South China[J]. Water Research , 2007, 41 (19) : 4526–4534. |
| [16] | Jia A, Hu J Y, Wu X Q, et al. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River Basin, North China[J]. Environmental Toxicology and Chem istry , 2011, 30 (6) : 1252–1260. |
| [17] | Zheng S, Qiu X, Chen B, et al. Antibiotics pollution in Jiulong River estuary:Source, distribution and bacterial resistance[J]. Chemosphere , 2011, 84 (11) : 1677–1685. |
| [18] | Tamtam F, Mercier F, Le Bot B, et al. Occurrence and fate of antibi otics in the Seine River in various hydrological conditions[J]. Science of the Total Environment , 2008, 393 (1) : 84–95. |
| [19] | Jesus Garcia-Galan M, Silvia Diaz-Cruz M, Barcelo D. Occurrence of sulfonamide residues along the Ebro River Basin removal in wastewater treatment plants and environmental impact assessment[J]. Environment In ternational , 2011, 37 (2) : 462–473. |
| [20] | Choi K, Kim Y, Park J, et al. Seasonal variations of several pharmaceu tical residues in surface water and sewage treatment plants of Han River, Korea[J]. Science of the Total Environment , 2008, 405 (1-3) : 120–128. |
| [21] | Locatelli M A F, Sodre F F, Jardim W F. Determination of antibiotics in Brazilian surface waters using liquid chromatography-electrospray tandem mass spectrometry[J]. Archives of Environmental Contamina tion and Toxicology , 2011, 60 (3) : 385–393. |
| [22] | Shimizu A, Takada H, Koike T, et al. Ubiquitous occurrence of sulfon amides in tropical Asian waters[J]. Science of the Total Environment , 2013, 452C (108) : 115. |
| [23] | Watkinson A J, Murby E J, Kolpin D W, et al. The occurrence of antibi otics in an urban watershed:From wastewater to drinking water[J]. Sci ence of the Total Environment , 2009, 407 (8) : 2711–2723. |
| [24] | Yan C, Yang Y, Zhou J, et al. Selected emerging organic contaminants in the Yangtze Estuary, China:A comprehensive treatment of their as sociation with aquatic colloids[J]. Journal of Hazardous Materials , 2015, 283 : 14–23. |
| [25] | 梁惜梅, 施震, 黄小平. 珠江口典型水产养殖区抗生素的污染特征[J]. 生态环境学报 , 2013, 22 (2) : 304–310. LIANG Xi-mei, SHI Zhen, HUANG Xiao-ping. Occurrence of antibi otics in typical aquaculture of the Pearl River Estuary[J]. Ecology and Environmental Sciences , 2013, 22 (2) : 304–310. |
| [26] | 何秀婷, 王奇, 聂湘平, 等. 广东典型海水养殖区沉积物及鱼体中磺胺类药物的残留及其对人体的健康风险评价[J]. 环境科学 , 2014, 35 (7) : 2728–2735. HE Xiu-ting, WANG Qi, NIE Xiang-ping, et al. Residues and health risk assessment of sulfonamides in sediment and fish from typical ma rine aquaculture regions of Guangdong Province, China[J]. Environ mental Science , 2014, 35 (7) : 2728–2735. |
| [27] | Alexy R, Kumpel T, Kummerer K. Assessment of degradation of 18 an tibiotics in the Closed Bottle Test[J]. Chemosphere , 2004, 57 (6) : 505–512. |
| [28] | 巫杨, MikeW, RaiK, 等. 水体中磺胺甲恶唑和甲氧苄氨嘧啶的自然光降解[J]. 环境化学 , 2013, 32 (6) : 1081–1087. WU Yang, Mike W, Rai K, et al. Natural sunlight photodegradation of sulfamethazole and trimethoprimin aquatic environment[J]. Environ mental Chemistry , 2013, 32 (6) : 1081–1087. |
| [29] | Dutta S K, Inamdar S P, Tso J, et al. Concentrations of free and conju gated estrogens at different landscape positions in an agricultural wa tershed receiving poultry litter[J]. Water Air and Soil Pollution , 2012, 223 (5) : 2821–2836. |
| [30] | Vaicunas R, Inamdar S, Dutta S, et al. Statewide survey of hormones and antibiotics in surface waters of delaware[J]. Journal of the Ameri can Water Resources Association , 2013, 49 (2) : 463–474. |
| [31] | Sassman S A, Lee L S. Sorption of three tetracyclines by several soils:Assessing the role of pH and cation exchange[J]. Environmental Sci ence & Technology , 2005, 39 (19) : 7452–7459. |
| [32] | Hernando M D, Mezcua M, Fernandez-Alba A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J]. Talanta , 2006, 69 (2) : 334–342. |
| [33] | Baran W, Sochacka J, Wardas W. Toxicity and biodegradability of sul fo namides and products of their photocatalytic degradation in aqueous solutions[J]. Chemosphere , 2006, 65 (8) : 1295–1299. |
| [34] | Eguchi K, Nagase H, Ozawa M, et al. Evaluation of antimicrobial agents fo r veterinary use in the ecotoxicity test using microalgae[J]. Chemo sphere , 2004, 57 (11) : 1733–1738. |
| [35] | Ferrari B, Mons R, Vollat B, et al. Environmental risk assessment of six human pharmaceuticals:Are the current environmental risk assessment procedures sufficient for the protection of the aquatic environment?[J]. Environmental Toxicology and Chemistry , 2004, 23 (5) : 1344–1354. |
| [36] | Lutzhoft H C H, Halling-Sorensen B, Jorgensen S E. Algal toxicity of antibacterial agents applied in Danish fish farming[J]. Archives of En vironmental Contamination and Toxicology , 1999, 36 (1) : 1–6. |
| [37] | Isidori M, Lavorgna M, Nardelli A, et al. Toxic and genotoxic evalua tion of six antibiotics on non-target organisms[J]. Science of the Total Environment , 2005, 346 (1-3) : 87–98. |
| [38] | Yang L H, Ying G G, Su H C, et al. Growth-inhibiting effects of 12 an tibacterial agents and their mixtures on the freshwater microalga Pseu dokirchneriella subcapitata[J]. Environmental Toxicology and Chem istry , 2008, 27 (5) : 1201–1208. |
| [39] | Backhaus T, Scholze M, Grimme L H. The single substance and mix ture toxicity of quinolones to the bioluminescent bacterium Vibrio fis cheri[J]. Aquatic Toxicology , 2000, 49 (1/2) : 49–61. |
 2016, Vol. 35
2016, Vol. 35