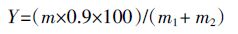文章信息
- 赵晶, 张福蓉, 陈明, 徐晨, 权春善, 范圣第
- ZHAO Jing, ZHANG Fu-rong, CHEN Ming, XU Chen, QUAN Chun-shan, FAN Sheng-di
- NaOH预处理对玉米秸秆纤维结构特性和酶解效率的影响
- Effect of NaOH pretreatments on cellulosic structure and enzymatic hydrolysis of corn stover
- 农业环境科学学报, 2016, 35(7): 1407-1412
- Journal of Agro-Environment Science, 2016, 35(7): 1407-1412
- http://dx.doi.org/10.11654/jaes.2016.07.025
文章历史
- 收稿日期: 2015-12-14
2. 大连工业大学生物工程学院, 辽宁 大连 116034
2. School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China
化石燃料资源日℃枯竭引发能源短缺,温室气体排放导致环境问题加剧,开发利用清洁可再生能源受到广泛关注[1]。乙醇、丁醇等生物质能源被认为是传统化石燃料的最佳替代品[2-3]。目前乙醇等生物质能源的生产主要以粮食淀粉为原料,存在生产成本高、原料供应有限等问题[4-5]。玉米秸秆在我国是一类量大而集中的木质纤维废弃物,年产量高达2.5亿t,目前因缺乏对其有效利用, 而多采用直接烧掉或弃置于农田的处理方式,既浪费资源又污染环境。利用玉米秸秆为原料替代粮食来生产生物质能源或化学品,不仅能够实现资源的有效利用,还可以解决环境问题,具有巨大的产业化潜力。
玉米秸秆富含纤维素、半纤维素和木质素,采用酶解技术将纤维素和半纤维素降解成可发酵性糖,可用于发酵制备生物燃料和化学品[6]。木质纤维原料中木质素和半纤维素对纤维素的包裹作用以及纤维素的高结晶度,阻碍了纤维素酶的可及性,因此在酶解前采取适宜的预处理,是提高纤维原料酶解效率的关键[7-8]。目前对玉米秸秆常用的预处理方法包括蒸汽爆破、酸法预处理、碱法预处理等,其中碱法预处理工艺相对简单,能够有效脱除木质素,预处理效果显著,应用较为广泛[9-11]。Chen 等[12]比较了用稀酸、石灰、氨水/ 稀酸、稀碱4 种不同化学试剂对玉米秸秆进行预处理,结果表明稀碱预处理对于纤维残渣酶解效率的提高最为有效;He 等[13]对玉米秸秆采用NaOH 溶液润涨联合湿法球磨的预处理技术,发现能够有效脱除木质素,提高酶解得率;周殿芳等[14]采用NaOH 溶液中加入双氧水对玉米秸秆进行浸泡处理,以木质素脱除率为衡量指标优化了预处理条件;姚晓琰等[15]利用稀NaOH溶液处理玉米秸秆,以去除木质素、减少半纤维素和纤维素的损失为目的,对其处理条件进行优化,进一步研究发现尿素与NaOH的混合溶液对木质素去除效果更显著;郑明霞等[16]比较了NaOH和Ca(OH)2 常温下堆沤处理对玉米秸秆中纤维素结构的影响,结果表明NaOH 预处理表现出更好的纤维素润涨能力和反应性。上述玉米秸秆的碱法预处理多集中于工艺条件的优化,从纤维微观结构变化的角度来探究碱法预处理改善玉米秸秆酶解效率的机制则鲜有报道。
本研究对玉米秸秆在不同温度下进行NaOH 预处理,比较了预处理前后玉米秸秆的成分、纤维结构和酶解得率的变化,分析纤维结构特性的变化对酶解效率的影响,旨在初步揭示碱处理技术对玉米秸秆预处理的内在机制,以期为玉米秸秆的高效资源化利用提供理论依据。
1 材料和方法 1.1 材料原料:实验所用玉米秸秆样品采自辽宁省大连市郊区,自然风干后粉碎,过40 目筛,备用。
试剂:Cellic CTec2 复合纤维素酶购自Novozymes 公司,该酶制剂中含有纤维素酶、纤维二糖酶、木聚糖酶等酶活力。
主要仪器:日本Shimadzu IRPrestige-21 傅里叶变换红外光谱仪;日本Shimadzu XRD-6000 X射线衍射仪;日本Hitachi S-4800 扫描电子显微镜;美国GE Ultrospec 4300 pro 紫外可见分光光度计;天津泰斯特仪器有限公司FZ102 微型植物试样粉碎机;太仓市科教器材厂HZ-8802S 水浴恒温振荡器。
1.2 玉米秸秆的NaOH 预处理称取一定量粉碎后的玉米秸秆,按1:8 的固液比(W/V)加入质量浓度为2%(W/V)的NaOH 溶液,搅拌均匀,分别在60、80、105℃下处理1 h,反应结束后抽滤,残渣水洗至中性,取样测含水量及进行主要成分(纤维素、半纤维素和木质素)分析。
1.3 扫描电镜分析将NaOH 预处理前后的玉米秸秆样品分别烘干、 粉碎、过筛,用导电双面胶带固定在样品台上,采用Hitachi S-4800 扫描电子显微镜进行分析,观察玉米秸秆内部纤维素束的微观结构形态变化。
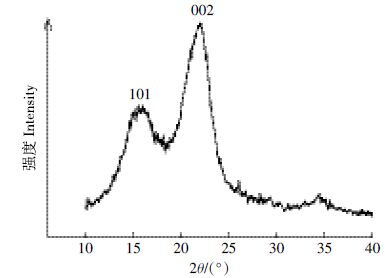
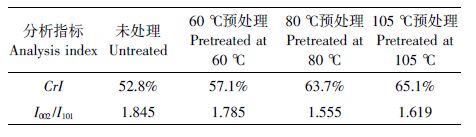
1.4 X射线衍射光谱分析NaOH 预处理前后的玉米秸秆样品烘干、粉碎, 过200 目筛,采用Shimadzu XRD-6000 X射线衍射仪对样品进行分析,操作条件为:Cu 靶,电压40 kV,电流30 mA,扫描范围10°~50°,扫描速度6°·min-1。利用MID Jade 5.0 软件,使用分峰拟合法分析并计算纤维素的结晶度(CrI)和结晶峰I002/I101比例(图 1)[17]。
|
| 图 1 纤维素的X 射线衍射图谱 Figure 1 X-ray diffraction pattern of cellulose |
NaOH 预处理前后的玉米秸秆样品烘干、粉碎后取少量,加入约为样品质量100 倍的KBr 于玛瑙研钵,混合研磨后压片,采用Shimadzu IRPrestige-21 傅里叶变换红外光谱仪进行分析。
1.6 玉米秸秆的酶水解酶水解在250mL三角瓶中进行,以NaOH预处理前后的玉米秸秆为底物,底物浓度为80 g·L-1,用0.05 mol·L-1柠檬酸缓冲液调节pH值为4.8,按20 FPU·g-1 底物的用量加入CellicCTec2复合纤维素酶,反应混合物总体积为100 mL,在50℃条件下振荡水解,水浴恒温振荡器转速为120 r·min-1,定时取样,离心,测定上清液中还原糖含量。酶解得率(Y)按下式计算:
式中:m 为上清液中还原糖总量,g;m1为底物中纤维素质量,g;m2为底物中半纤维素质量,g。
1.7 分析方法 1.7.1 纤维原料成分分析玉米秸秆原料及NaOH 预处理后纤维残渣中纤维素、半纤维素和木质素等成分含量按文献[18]所述方法进行分析。
1.7.2 酶活力测定滤纸酶活力(Filter paper activity,FPA)和纤维二糖酶活力(Cellbiase,CB)按照IUPAC 推荐的国际标准方法测定[19]。一个滤纸酶活力国际单位(FPU)等于酶促反应中每分钟生成1 μmol 葡萄糖(以还原糖计, DNS 法测定)的酶量;一个纤维二糖酶活力国际单位(CBU)等于标准反应条件下每分钟生成2 μmol 葡萄糖(葡萄糖试剂盒测定)的酶量。
1.7.3 总还原糖的测定采用DNS(3,5-二硝基水杨酸)法测定[19]。
2 结果与讨论 2.1 NaOH预处理前后玉米秸秆成分分析NaOH 预处理前后玉米秸秆的成分分析如表 1 所示。可以看出,玉米秸秆经不同温度碱液预处理后, 纤维素、半纤维素和木质素的含量发生了明显变化, 随着NaOH 预处理温度的升高,木质素得以有效脱除,纤维素和半纤维素比例增加。前人研究发现,纤维原料中的木质素对纤维素酶与底物的接触形成立体阻碍,同时还能够非特异性吸附纤维素酶,是阻碍纤维原料酶解过程进行的重要因素[20]。表 1 显示,玉米秸秆经105℃碱液预处理后,木质素百分含量由19.3%降低至5.9%,碱法预处理有利于改善玉米秸秆的酶水解。105℃预处理前后,纤维素百分含量由38.7%升高至66.2%,半纤维素百分含量由21.7%升高至25.1%。纤维素百分含量升高了1.7 倍,而半纤维素百分含量仅升高1.2 倍,表明在碱处理过程中半纤维素有部分损失。
|
NaOH预处理前后玉米秸秆样品的扫描电镜图像如图 2所示。可以看出,未处理的玉米秸秆样品微观上呈纤维束状结构,放大观察可以看出其表面粗糙,表明附着在纤维细胞上的非纤维杂质较多,可能包括粘结物(木质素、半纤维素、胶类物质)、蜡质层、灰分、有机溶剂抽提物、薄壁细胞等;经60℃NaOH 处理的玉米秸秆扫描电镜图像显示,样品表面的粗糙程度有所改善,这是由于纤维细胞表面杂质部分溶解于碱液并被除去所致;随着碱处理温度升高至80℃,纤维细胞表面杂质在碱液中的溶解性增强,呈现出一定的流动状态,较多的非纤维杂质被除去,部分杂质返吸附在纤维细胞表面,形成纤维表面的沉淀物;经105℃NaOH处理后,纤维细胞表面较为光滑,纹孔较为均匀地暴露在细胞表面。可以推断,随着预处理条件愈加剧烈,碱水解的润胀作用对原料形态产生破坏力亦愈大,纤维胞间层的非纤维杂质基本被除去,纤维束状结构变得更为疏松,更有利于预处理后的纤维原料进行酶水解。然而,纹孔的暴露会使得纤维细胞中的半纤维素通过纹孔流失,从而降低玉米秸秆向可发酵糖转化的利用效率。陈尚钘等[21]利用扫描电镜观察了蒸汽爆破预处理前后玉米秸秆的纤维结构,发现爆破处理后的纤维呈现分丝和细纤维化现象;Zhao 等[22]对NaOH/尿素低温预处理前后的云杉木屑进行扫描电镜观察,同样发现预处理后的云杉木屑纤维束结构变得松散。可见,不同的预处理方法对木质纤维原料的纤维束结构产生的破坏作用程度不等。

|
| 图 2 NaOH预处理前后玉米秸秆电镜扫描图 Figure 2 Scanning electron micrographs of raw and NaOHpretreated corn stover samples A:未处理;B:60℃NaOH预处理;C:80℃NaOH预处理; D:105℃NaOH预处理。下同 |
纤维素是由D-吡喃葡萄糖以β-1,4 糖苷键连接而成的高聚物,根据其分子结构排列是否紧密和规则,将纤维素分为结晶区和无定形区,纤维素的结晶度是指结晶区占纤维素整体的百分比,反映了纤维素聚集时形成结晶的程度[17]。
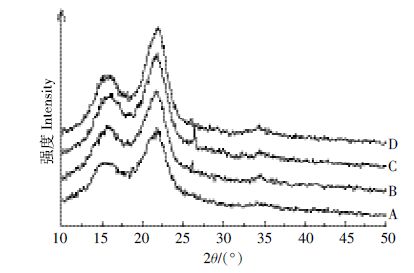
不同温度NaOH 预处理前后,玉米秸秆经X 射线衍射图谱基本相似(图 3)。根据分峰拟合法分析, 未处理玉米秸秆纤维素的结晶度为52.8%,经过NaOH 预处理后纤维素的结晶度均有所升高,且随着预处理温度的升高,纤维素的结晶度逐渐增大(表 2)。 这是因为高温NaOH 溶液处理脱除了原料中的木质素和部分半纤维素,同时纤维素的无定形区受到碱液的润胀作用被破坏,使得结晶区的比例增加所致。预处理温度由80℃升至105℃,结晶度的增加放缓。由表 2 可知,对于未处理的玉米秸秆原料,纤维素结晶区002 和101 晶面衍射峰强度比例(I002/I101)为1.845, 随着预处理温度的升高,该比例逐渐降低,但105℃ 预处理与80℃预处理的物料相比,I002/I101 比值略有回升,可见不同温度碱预处理使得纤维素结晶结构发生了一定变化。Victor 等[23]对松果进行碱法预处理,预处理前后样品的X 射线衍射图谱与本文图 3 所示形状基本一致,但预处理前后样品的结晶度和I002/I101具体数值并未给出;郑明霞等[16]对玉米秸秆采用NaOH 常温下堆沤处理,提取预处理前后样品中的纤维素进行X 射线衍射分析,利用Segal 公式计算纤维素结晶度,计算方法与本文采用的分峰拟合法不同,但同样发现经过碱处理后纤维素的结晶度有所升高。
|
| 图 3 NaOH 预处理前后玉米秸秆X 射线衍射图谱 Figure 3 X-ray diffraction spectra of raw and NaOH-pretreated corn stover samples |
|
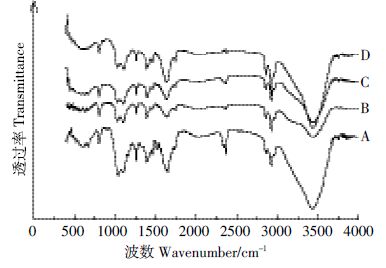
采用傅里叶变换红外光谱对NaOH 预处理前后玉米秸秆进行分析,结果见图 4。对于木质纤维原料,波数3420 cm-1为纤维素分子内形成氢键的羟基伸缩振动,1431、1164 cm-1为纤维素的特征峰,1736 cm-1为半纤维素的特征峰,1600、1510 cm-1 为木质素的特征峰[16, 21]。由图 4 可知,NaOH预处理前后玉米秸秆的红外图谱形状较为相似,差别主要在于某些特征峰吸收强度的变化。与未处理样品相比,60℃碱液预处理后,3420 cm-1处吸收峰强度明显减弱,表明碱处理导致纤维素分子内形成的氢键部分断裂,使得纤维素内聚力减小,纤维素发生润胀和溶解,改善了预处理后原料的酶水解性能,然而,随着预处理温度升高,3420 cm-1处吸收峰强度逐渐回升,表明纤维素分子内氢键重新形成,纤维素的润胀程度逐渐降低,可能由于纤维素结晶度的增加所致;1431、1164 cm-1 处吸收峰在不同温度NaOH预处理前后变化不大,表明纤维素结构经碱处理后差异不大。与未处理样品的红外光谱相比,玉米秸秆经NaOH预处理后1736 cm-1处半纤维素特征吸收峰强度有所减弱,但特征峰仍明显存在,可见半纤维素在碱处理过程中虽有损失,但仍然得到一定程度保留;NaOH 预处理后1600、1510 cm-1 处木质素的特征峰基本消失,说明经过碱处理后玉米秸秆中的木质素结构受到较大破坏,得以有效脱除。陈尚钘等[21] 对蒸汽爆破预处理前后玉米秸秆进行红外光谱分析, 发现蒸汽爆破处理后半纤维素的特征峰基本消失,而木质素的特征峰变化并不明显,说明半纤维素易受到蒸汽爆破处理的破坏而发生降解,而木质素受到的破坏程度较小,红外光谱图分析表明,蒸汽爆破处理和碱法预处理对玉米秸秆的作用机理存在较大差异。
|
| 图 4 NaOH 预处理前后玉米秸秆的红外光谱图 Figure 4 Infrared spectra of raw and N |
以NaOH 预处理前后的玉米秸秆为底物,加入纤维素酶进行酶水解,底物酶解得率随时间变化的趋势如图 5 所示。可以看出,未预处理玉米秸秆的酶解得率较低,60 h 酶解得率仅为11.1%,而NaOH 预处理后玉米秸秆的酶解得率显著增加,经60、80℃和105 ℃NaOH 预处理后玉米秸秆60 h的酶解得率分别为67.1%、71.4%和64.4%。预处理前后玉米秸秆纤维结构表征阐述了酶解得率变化的机制:未预处理玉米秸秆具有致密复杂的稳定结构,阻碍了纤维素酶与底物的接触,因此酶解效率很低;碱处理能够有效脱除原料中的木质素,解除其对纤维素酶的空间位阻作用, 引起纤维原料润胀,纤维束结构变得松散,增加了纤维素酶与底物的接触面积,从而提高了酶解效率。预处理温度中以80℃NaOH 预处理酶解得率最高,105 ℃预处理酶解得率最低,可能是因为预处理温度过高导致纤维素结晶度升高,不利于纤维素酶与底物的接触;同时,高温处理使纤维表面纹孔充分暴露,使原料中半纤维素损失较高,从而降低了酶水解液中戊糖含量,导致酶解得率偏低。姚晓琰[15]和Nlewem[24]等的研究均发现,纤维原料碱法预处理过程中反应强度的增加能够提高木质素的脱除率,同时也造成更多的纤维素和半纤维素损失,导致总糖得率下降。可见对玉米秸秆的碱法预处理并非反应条件越剧烈预处理效果越好,碱处理过程适度降低反应强度,有利于己糖戊糖同步获取,提高酶解效率。

|
| 图 5 NaOH 预处理前后玉米秸秆酶水解的时间进程 Figure 5 Time course of enzymatic hydrolysis of raw and NaOH-pretreated corn stover samples |
(1)稀碱预处理技术能够充分改变玉米秸秆化学组成和结构特性。玉米秸秆经稀碱预处理后,木质素和非纤维杂质被有效脱除,纤维素和半纤维素的比例增加;纤维素结晶度增加,纤维原料润胀,纤维束状结构疏松。
(2)经稀NaOH溶液80℃预处理1h后,玉米秸秆60h的酶解得率达到71.4%,较未处理原料提高了5.4倍,碱预处理温度进一步升高,酶解得率反而降低。80℃ 为玉米秸秆NaOH预处理的适宜温度。
| [1] | 张裕卿, 付二红, 梁江华. 超声波对木质纤维素糖化过程影响的研究[J]. 中国生物工程杂志 , 2007, 27 (9) : 81–84. ZHANG Yu-qing, FU Er-hong, LIANG Jiang-hua. Study on the sac charification processes of lignocellulose brought about by ultrasonic wave[J]. China Biotechnology , 2007, 27 (9) : 81–84. |
| [2] | Bali G, Meng X, Deneff J I, et al. The effect of alkaline pretreatment methods on cellulose structure and accessibility[J]. Chem Sus Chem , 2015, 8 (2) : 275–279. |
| [3] | Green E M. Fermentative production of butanol:The industrial perspec tive[J]. Current Opinion in Biotechnology , 2011, 22 (3) : 337–343. |
| [4] | Sun Y, Cheng J. Hydrolysis of lignocellulosic materials for ethanol pro duction:A review[J]. Bioresource Technology , 2002, 83 (1) : 1–11. |
| [5] | 王爱杰, 曹广丽, 徐诚蛟, 等. 木质纤维素生物转化产氢技术现状与发展趋势[J]. 生物工程学报 , 2010, 26 (7) : 931–941. WANG Ai-jie, CAO Guang-li, XU Cheng-jiao, et al. Process and tech nology development on hydrogen production through bioconversion of lignocellulosic biomass[J]. Chinese Journal of Biotechnology , 2010, 26 (7) : 931–941. |
| [6] | Alvira P, Tomás-PejóE, Ballesteros M, et al. Pretreatment technologies fo r an efficient bioethanol production process based on enzymatic hy drolysis:A review[J]. Bioresource Technology , 2010, 101 (13) : 4851–4861. |
| [7] | Kumar P, Barrett D M, Delwiche M J, et al. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. In dustrial & Engineering Chemistry Research , 2009, 48 (8) : 3713–3729. |
| [8] | Kim J S, Lee Y Y, Kim T H. A review on alkaline pretreatment technolo gy for bioconversion of lignocellulosic biomass[J]. Bioresource Technol ogy , 2016, 199 : 42–48. |
| [9] | Kim S, Holtzapple M T. Delignification kinetics of corn stover in lime pretreatment[J]. Bioresource Technology , 2006, 97 (5) : 778–785. |
| [10] | Chen Y, Stevens M A, Zhu Y, et al. Understanding of alkaline pretreat ment parameters for corn stover enzymatic saccharification[J]. Biotech nology for Biofuels , 2013, 6 (1) : 8. |
| [11] | Li Q, Gao Y, Wang H, et al. Comparison of different alkali-based pre treatments of corn stover for improving enzymatic saccharification[J]. Bioresource Technology , 2012, 125C : 193–199. |
| [12] | Chen M, Zhao J, Xia L. Comparison of four different chemical pretreat ments of corn stover for enhancing enzymatic digestibility[J]. Biomass an d Bioenergy , 2009, 33 (10) : 1381–1385. |
| [13] | He X, Miao Y, Jiang X, et al. Enhancing the enzymatic hydrolysis of corn stover by an integrated wet-milling and alkali pretreatment[J]. Applied Biochemistry and Biotechnology , 2010, 160 (8) : 2449–2457. |
| [14] | 周殿芳, 马玉龙, 谢丽, 等. 碱和双氧水预处理玉米秸秆的试验研究[J]. 可再生能源 , 2011, 29 (1) : 19–22. ZHOU Dian-fang, MA Yu-long, XIE Li, et al. Experimental study on pretreatment of maize stalk cellulose with H2O2 and alkaline[J]. Re newable Energy Resource , 2011, 29 (1) : 19–22. |
| [15] | č晓琰, 王润娟, 吕学斌, 等. 碱液预处理玉米秸秆的条件优化及添加剂的选择[J]. 环境工程学报 , 2014, 8 (7) : 3011–3017. YAO Xiao-yan, WANG Run-juan, LÜ Xue-bin, et al. Optimization of pretreatment conditions for corn straw with alkali liquor and selection of additives[J]. Chinese Journal of Environmental Engineering , 2014, 8 (7) : 3011–3017. |
| [16] | 郑明霞, 李来庆, 郑明月, 等. 碱处理对玉米秸秆纤维素结构的影响[J]. 环境科学与技术 , 2012, 35 (6) : 27–31. ZHENG Ming-xia, LI Lai-qing, ZHENG Ming-yue, et al. Effect of al kali pretreatment on cellulosic structural changes of corn stover[J]. En vironmental Science & Technology , 2012, 35 (6) : 27–31. |
| [17] | Park S, Baker J O, Himmel M E, et al. Cellulose crystallinity index:Measurement techniques and their impact on interpreting cellulase per fo rmance[J]. Biotechnology for Biofuels , 2010, 3 (员) : 10. |
| [18] | 刘书钗. 制浆造纸分析与检测[M]. 北京: 化学工业出版社, 2004 : 17 -31. LIU Shu-chai. Analysis and detection of pulp and paper[M]. Beijing: Chemical Industry Press, 2004 : 17 -31. |
| [19] | Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry , 1987, 59 (2) : 257–268. |
| [20] | Zhu L, O忆Dwyer J P, Chang V S, et al. Structural features affecting biomass enzymatic digestibility[J]. Bioresource Technology , 2008, 99 (9) : 3817–3828. |
| [21] | 陈尚钘, 勇强, 徐勇, 等. 蒸汽爆破预处理对玉米秸秆化学组成及纤维结构特性的影响[J]. 林产化学与工业 , 2009, 29 (Suppl 1) : 33–38. CHEN Shang-xing, YONG Qiang, XU Yong, et al. Effect of stream-ex plosion pretreatment on chemical components and cellulosic structure of corn stalk[J]. Chemistry and Industry of Forest Products , 2009, 29 (Suppl 1) : 33–38. |
| [22] | Zhao Y, Wang Y, Zhu J Y, et al. Enhanced enzymatic hydrolysis of spruce by alkaline pretreatment at low temperature[J]. Biotechnology & Bioengineering , 2008, 99 (6) : 1320–1328. |
| [23] | Victor A, Pulidindi I N, Gedanken A. Assessment of holocellulose for the production of bioethanol by conserving Pinus radiata cones as re newable feedstock[J]. Journal of Environmental Management , 2015, 162 : 215–220. |
| [24] | Nlewem K C, Thrash Jr M E. Comparison of different pretreatment methods based on residual lignin effect on the enzymatic hydrolysis of switchgrass[J]. Bioresource Technology , 2010, 101 (14) : 5426–5430. |
 2016, Vol. 35
2016, Vol. 35