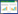文章信息
- 李堃, 余海英, 黄富, 陈光登, 张路
- LI Kun, YU Hai-ying, HUANG Fu, CHEN Guang-deng, ZHANG Lu
- 镉低积累水稻亲本及其杂交组合镉积累特征分析
- Characteristics of cadmium accumulation in low cadmium-accumulating rice parent and its hybrids
- 农业环境科学学报, 2016, 35(8): 1444-1450
- Journal of Agro-Environment Science, 2016, 35(8): 1444-1450
- http://dx.doi.org/10.11654/jaes.2016-0137
文章历史
- 收稿日期: 2016-01-26
2. 四川农业大学农学院, 成都 611130
2. College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China
水稻是我国主要粮食作物,目前镉(Cd)已成为我国危害严重的农田污染源,稻田Cd 污染使水稻生长发育受阻,导致产量、品质降低,稻米Cd 含量大幅增加,并通过食物链对人体构成直接威胁[1-2]。Liu 等[3]研究发现,当大田Cd 浓度为10.30 mg·kg-1时,32 份水稻品种中有近50%的糙米Cd 含量超过食品安全国家标准限值。降低水稻籽粒Cd含量已成为保障粮食安全的重要课题。研究表明,由于基因型差异所导致的水稻籽粒Cd 含量在品种间的差异可达显著水平,利用品种间差异进行水稻籽粒Cd 安全品种的选育是可行的。Liu 等[4]研究发现,不同水稻品种籽粒Cd含量相差10 倍以上。刘建国等[5]指出,在污染地区通过品种选择可将稻米中Cd 含量降低90%。同时,Cd在水稻体内的积累分配也存在明显的品种间差异。郑陶等[6]研究表明,相同Cd 处理下水稻Cd 高积累品种对Cd 的转运能力显著高于普通品种。籽粒中Cd 含量及Cd 在地上部的分配比率与Cd 从地上部向籽粒的迁移率显著相关,糙米中Cd含量表现为杂交籼稻>常规籼稻>常规粳稻[7-8]。对Cd 的亚细胞分布研究表明,Cd 低积累品种可溶部分中Cd 的分布显著低于Cd高积累品种[9]。目前,水稻Cd 低积累材料的筛选及其耐Cd 机理的研究已普遍展开,而对于Cd 低积累材料的遗传特性及其杂交后代对Cd 的积累转运特征还鲜见报道。
糙米中Cd 含量存在杂种负优势,且在世代间遗传传递率较强[10],表明利用Cd 低积累种质资源进行杂交育种是改良水稻籽粒Cd 含量的有效途径。赵步洪等[11]指出,杂交稻组合Cd 吸收量的大小与其亲本的吸收量密切相关,在安全品种的选育中父本的选择尤为重要。本文以籽粒Cd 低积累水稻作为父本,与不育系材料创制不同杂交组合,通过分析水稻亲本及其杂交组合Cd 积累分配特征,探讨Cd 胁迫下Cd 低积累水稻亲本的遗传特性,为培育籽粒Cd 安全的杂交水稻品种,进一步发掘与籽粒Cd 含量相关的基因提供材料及理论基础。
1 材料与方法 1.1 供试材料供试材料为前期筛选获得的Cd 低积累水稻亲本雅恢2816(播抽期108 d,抗稻瘟病,文中表示为A)及其4 个杂交组合泸98A/雅恢2816、5406A/雅恢2816、C268A/雅恢2816、蓉18A/雅恢2816(文中分别表示为B、C、D、E),由四川农业大学农学院提供。供试土壤为灰色冲积物发育的潮土,采自四川省都江堰市蒲阳镇双柏村,其基本理化性质为:pH 6.40、有机质15.98 g·kg-1、全氮0.92 g·kg-1、碱解氮127.65 mg·kg-1、有效磷8.64 mg·kg-1、速效钾47 mg·kg-1。土壤全Cd含量0.31 mg·kg-1。供试肥料为尿素(N 46%)、磷酸二氢钾(P2O5 52%,K2O 34%)、氯化钾(K2O 63%),均为分析纯。
1.2 试验设计与处理分别设置4 个Cd 处理水平:0 mg·kg-1(CK)、1mg·kg-1(Cd1)、2 mg·kg-1(Cd2)、4 mg·kg-1(Cd4)。氮(N)、磷(P2O5)、钾(K2O)肥用量分别为150、100、105mg·kg-1,每个处理重复3 次,共60 盆,完全随机排列。采用土培盆栽,供试土壤经风干磨碎过10 目筛,每盆(12 L)装土10 kg。将相应量的CdCl2·2.5H2O(分析纯试剂)配成溶液,与土壤混合均匀,陈化30 d待用,平衡后测定Cd1、Cd2 和Cd4 条件下土壤Cd 有效量分别为0.55、1.02、2.10 mg·kg-1。旱地育秧,三叶期选取长势一致的秧苗进行移栽,于移栽前1 d将氮、磷、钾肥施入土壤,按照常规管理,做好病虫害防治工作和长势记录。试验于2014 年5 月至10月在四川农业大学有防雨设施的网室中进行。
成熟期采样,每桶2 株混合样为1 次重复,共3个重复。将所采样品先用自来水冲洗干净,根部在20mmol·L-1 Na2-EDTA 溶液中浸泡15 min,再用去离子水洗净,最后用吸水纸擦干。将样品分为根、茎、叶、枝梗、谷壳、糙米,105℃下杀青30 min 后,75℃烘干至恒重,称重后粉碎备用。
1.3 测定项目及方法土壤理化性质采用常规分析方法;水稻产量采用万深SC-G 自动种子考种分析及千粒重仪测定;土壤Cd 全量采用HNO3-HClO4-HF(体积比,5颐1颐1)消化;有效态Cd 含量采用DTPA 提取;植株Cd 含量采用HNO3-HClO4(体积比,5颐1)消化,利用原子吸收分光光度计测定,其中谷壳及糙米Cd 含量采用石墨炉分析[12]。以国家标准物质GBW10044 GSB-22 为内标控制分析质量。
1.4 数据处理与分析转移系数=茎叶(或穗)Cd 含量/根系(或茎叶)Cd含量;滞留率(%)=(地下部Cd 含量-地上部Cd 含量)/地下部Cd 含量×100%;超亲优势(%)=(F1-高亲值)/高亲值×100%[13-14]。
统计分析采用DPS(11.0),多重比较选择LSD法;图表制作采用Origin 8.0 和Excel 2013。
2 结果与分析 2.1 Cd处理对水稻生物量的影响不同浓度Cd 处理下,杂交组合各器官生物量均显著高于亲本,根、茎、叶、穗生物量分别较亲本增加了102.47%~199.42%、8.06%~37.05%、30.84%~51.41%和9.63%~139.44%(表 1)。4 个杂交后代中,根、茎、叶生物量在组合间差异不显著,穗部生物量则表现为杂交组合C 显著高于其他组合。可见,亲本及杂交组合在中、低浓度Cd 处理下能够正常生长,且杂交组合生物量优于亲本。
 |
不同浓度Cd处理下,亲本及杂交组合各器官Cd含量分配顺序均为根>茎、叶>>穗,且随处理浓度提高而显著增加(表 2)。杂交后代茎部Cd 含量在不同Cd 处理和不同组合间均无显著差异,而根系、叶片、穗部Cd 含量与亲本相比变异较大,且杂交组合间差异显著。Cd 胁迫下,杂交组合根系Cd 含量为13.66~36.90 mg·kg-1(CV=27.97%),以组合C 的增加量最为显著,为亲本的1.08~1.11 倍,其他组合的1.06~1.22倍,而组合D 显著降低,仅为亲本的73.69%~79.77%,其他组合的74.04%~93.37%。叶片Cd 含量(CV=9.52%)则与根系相反,表现为组合D 最高而组合C最低。穗部Cd含量(CV=29.04%)以组合C、D 在中、低浓度Cd 处理下降幅最为明显,分别较亲本降低了33.33%~37.50%和6.25%~12.50%,且仅为其他杂交组合的45.45%~69.57%和68.18%~91.30%。这表明,以籽粒Cd 低积累水稻为父本创制的不同杂交组各器官Cd 含量变异较大,杂交增强了组合C 根系对Cd 的吸收能力,而使组合D 根系吸收Cd 的能力减弱。
 |
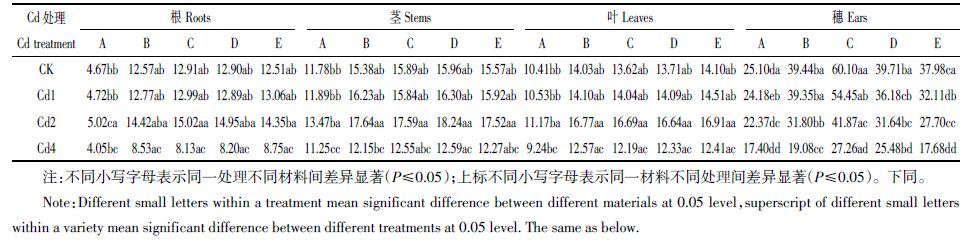
不同浓度Cd 处理下,亲本材料各器官Cd 积累量分配比例为茎>根>叶>穗,而杂交组合为根>茎>叶>穗,均以穗部Cd 积累量的分配比例最低(图 1)。与亲本相比,各杂交组合根系Cd 积累量的分配比例均上升,积累量达亲本的1.49~3.24 倍,以组合C 最大,组合D 最小;茎、叶Cd 积累量的分配比例则降低至亲本的72.06%~91.08%,在组合间表现为D 最大而C 最小。杂交后,根系Cd 积累量增加,地上部分配比例减少,穗部Cd 积累量亦随之降低。
|
| 图 1 Cd 在水稻材料各器官中的分配比例 Figure 1 Proportion of Cd in different tissues of rice |
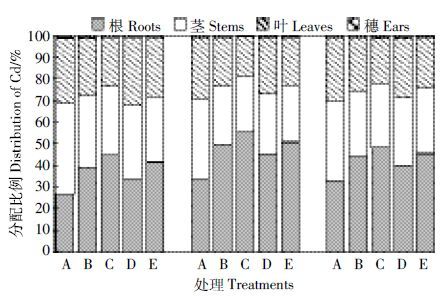
转移系数是水稻植株各组织Cd 含量的比值,用于表征Cd在水稻植株中的迁移特征。由表 3分析可知,随Cd处理浓度的增加,Cd 由根到茎叶的转移系数均有所降低,且杂交组合的降幅更大,以组合C 最低,仅为亲本的87.39%~93.20%;由茎叶到穗的转移系数仅组合C 在中、低浓度Cd 处理下,以及组合D在低浓度Cd 处理下有所降低,为亲本及其他组合的50%。滞留率则与此相反,仅组合C 高于亲本,而组合D 降幅最大。这表明亲本及杂交组合在较低浓度时将Cd 由根系向地上部转运的效率更高,而在高浓度下可将更多的Cd 固持于根系。杂交后组合C 对Cd 的转运能力降低,可将更多的Cd 富集在根部,限制其向地上部的转运;而组合D 将Cd 由根系转运并固定于茎叶中的能力增强,限制Cd 向穗部转移。
 |
在相同浓度Cd 处理下,亲本及杂交组合穗部各部位Cd 含量随Cd 处理浓度的提高而显著增加,表现为枝梗>谷壳>糙米(表 4)。杂交后各组合糙米Cd含量均小于国际食品法典委员会的限量标准0.4 mg·kg-1,以组合C、D 在中、低浓度Cd 处理下的降幅最大,仅为亲本的57.14%~86.36%,且小于食品安全国家标准(GB 2762—2012)0.2 mg·kg-1。
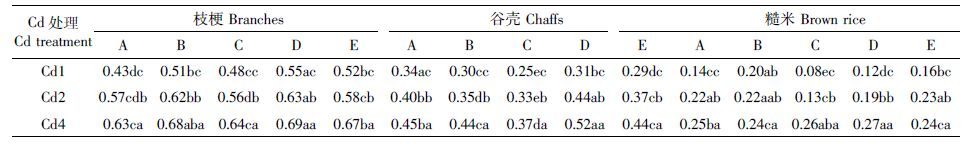 |
Cd 胁迫条件下,亲本及其杂交组合的产量均较对照显著降低,但组合间变化趋势不一致(图 2)。CK条件下,各杂交组合的产量均显著高于亲本,增幅达7.04%~29.86%;Cd 处理条件下,除组合E 较亲本有显著降低外,其余各组合与亲本相比均显著增加。其中,中、低浓度Cd 处理对组合C 和组合D 的产量均无显著影响。这表明,Cd 胁迫使水稻亲本及杂交组合产量显著降低,但胁迫条件下杂交稻在产量上更具优势。
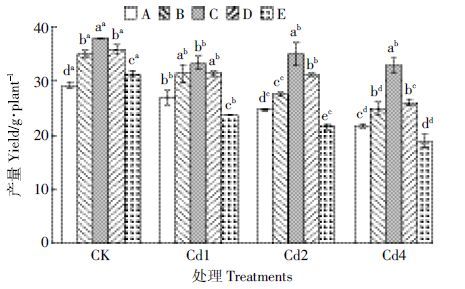
|
| 图 2 Cd处理对水稻产量的影响 Figure 2 Effects of different Cd treatments on rice yields 图中不同小写字母表示同一处理不同材料间差异显著(P≤0.05); 上标不同小写字母表示同一材料不同处理间差异显著(P≤0.05)。下同 |
Cd 胁迫下杂交组合生物量、产量、糙米Cd 含量均表现出不同程度的杂种优势(表 5)。在不同浓度Cd 处理下杂交组合的生物量均显著高于亲本,杂种优势达21.86%~89.63%。就产量而言,除组合E外,其余杂交组合的杂种优势均为正值,平均杂种优势可达38.81%,以组合C 表现最好。当Cd处理浓度为1 mg·kg-1和2 mg·kg-1 时,杂交组合间糙米Cd 含量差异较大,杂种优势变幅达-42.86%~42.86%,其中组合C 和组合D 糙米中Cd 含量具有较大的杂种负优势。可见,Cd 胁迫下杂交组合生物量与产量杂种优势普遍存在,且在中、低浓度Cd 处理条件下组合C 和组合D糙米中Cd含量杂种负优势最为明显。
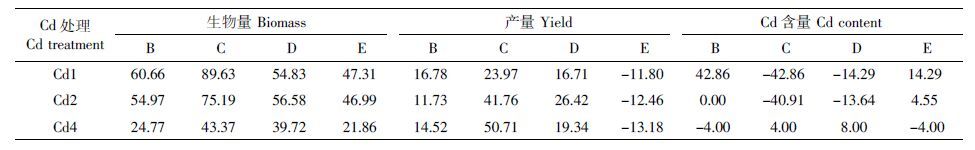 |
Cd 安全种质的筛选是提高水稻Cd 安全性的有效途径,水稻亲本作为育种的基本材料,其Cd 耐性和Cd 吸收、积累能力为Cd 安全品种的培育提供了±据。课题组前期在Cd 处理下对146份水稻亲本材料进行了耐性探讨以及吸收差异评价,筛选到耐性较强的Cd 低积累恢复系亲本雅恢2816[15]。本研究在前人基础上以雅恢2816为亲本配制4 个杂交组合。对亲本材料雅恢2816 成熟期籽粒Cd 含量分析发现,在轻度(全Cd为1 mg·kg-1)、中度(全Cd为2 mg·kg-1)和重度(全Cd 为4 mg·kg-1)污染土壤上,水稻亲本雅恢2816 糙米Cd 含量均低于国际食品法典委员会限量标准(0.4 mg·kg-1),且在Cd 处理浓度为1 mg·kg-1时,低于我国食品安全标准最大限量(0.2 mg·kg-1)[16],具有籽粒Cd 低积累的特点,因而在Cd 安全材料的育种上具有一定应用价值。在4 个杂交组合中,5406A/雅恢2816 和C268A/雅恢2816 的糙米Cd 含量在Cd 处理浓度为1 mg·kg-1和2 mg·kg-1时与亲本相比显著降低,分别为0.08、0.13 mg·kg-1和0.12、0.19mg·kg-1,均达到食品安全国家标准(<0.2 mg·kg-1)。因此,5406A/雅恢2816 和C268A/雅恢2816 在中、轻度Cd污染农田的安全生产中具有一定应用前景。
杂种优势是生物界的普遍现象,对优势组合的选育具有重要意义[17]。在本研究中,杂交组合生物量在不同浓度Cd 处理下始终优于亲本,且在Cd 处理浓度为1 mg·kg-1时生长未受影响,在Cd 处理浓度为2mg·kg-1 时生物量显著增加,单株生物量最高可达97.32 g。张路等[18]指出,Cd 安全材料生物量随Cd 处理浓度增加显著降低,在Cd 处理浓度为1 mg·kg-1时为38.28 g·株-1,可见本研究中杂交组合生物量更具优势。杂交组合生物量的优势也促进了其产量的提升,除组合E 外,其余杂交组合在Cd 胁迫下的单株产量均显著高于亲本。亲本Cd 积累特征直接影响杂交组合Cd 吸收量,选择籽粒低积累亲本有利于减少组合品种Cd含量[19]。本研究中,糙米Cd 含量的杂种优势在组合间差异较大,组合5406A/雅恢2816 和C268A/雅恢2816 糙米的Cd 含量显著低于亲本,具有较大的杂种负优势。基于品种间的差异,众多学者利用不同的作图群体定位到了一些影响水稻Cd 积累能力的QTL,但因材料与部位不同差异较大[20-21]。Yao 等[22]研究表明,杂交稻籽粒Cd 积累量主要由基因的加性效应引起。但也有研究指出,杂种的性状由双亲共同决定,基因表达的差异是表型多样性的重要来源,优势杂种基因的平均表达量高于无优势的杂种,认为杂种优势与基因的非加性表达有关[23-24]。可见,分子水平上基因表达模式的差异与杂种后代的表型性状密切相关,后期可通过联合QTL 作图等手段对杂种后代基因差异表达模式深入研究,揭示杂种优势形成的分子基础。
本研究中,亲本及杂交组合各部位Cd 含量均表现为根系最高而穗部最低,且杂交组合根系Cd 积累量分配比例高于亲本。He 等研究表明,水稻籽粒Cd含量主要受根系吸收以及由木质部与韧皮部向地上部转运的影响[25]。细胞壁作为重金属进入植物的第一道屏障,能够固定进入植株的Cd 降低其活性,Cd 超富集植物东南景天根部吸收的Cd 有61.13%~63.14%分布于细胞壁中,蓖麻根系对Cd 的积累能力显著高于其他部位,细胞中的Cd 主要分布于可溶部分,细胞壁次之[26-28]。对水稻的研究也有相似的结果,Cd 的亚细胞分布表现为可溶部分>细胞壁>细胞器[29]。这可能由于不同植物对Cd 的解毒机制存在差异所导致。在本研究中,杂交后组合5406A/雅恢2816 根系对Cd的吸收能力增强,但Cd 由根系向地上部的转移系数降低,从而降低了Cd 对地上部的毒害,液泡的区隔化作用可能是导致其耐性较强的原因。对于C268A/雅恢2816 而言,杂交后根系对Cd 的吸收能力减弱,其穗部Cd 含量较低的原因可能在于根系对Cd 的限制吸收作用。对水稻Cd 胁迫应答分子机制的报道指出,细胞壁的吸附、液泡的隔离以及转运蛋白运输对限制Cd2+的吸收和向地上部的转移有积极作用。定位于水稻根系液泡膜上的基因OsHMA3 以及其同源基因OsHMA2 可通过将Cd2+从细胞质转运并隔离于液泡,以及参与Cd 向木质部的装载并由地下部向地上部的转运控制籽粒Cd含量[30-31]。Shimpei等[32]证实,低亲和性阳离子转运蛋白OsLCT1 在Cd2+的运输过程中能够减少Cd 由韧皮部向籽粒的转运。因此,对现有材料进行与籽粒Cd 低积累相关分子机制的研究,进一步发掘与Cd 含量相关的基因并了解其功能对遗传改良和选育低Cd 品种具有重要意义。
4 结论在Cd 处理浓度为1 mg·kg-1和2 mg·kg-1的条件下,杂交组合正常生长且生物量超亲优势显著。水稻亲本及杂交组合均呈现穗部最低的Cd 积累特征,杂交后组合5406A/雅恢2816 根系对Cd 的滞留作用增强,而组合C268A/雅恢2816 根系对Cd 的吸收减弱,穗部Cd 含量显著低于亲本。当Cd处理浓度为1 mg·kg-1 和2 mg·kg-1 时,杂交组合5406A/雅恢2816 和C268A/雅恢2816 糙米中Cd 含量达到食品安全国家标准(<0.2 mg·kg-1),在中、轻度Cd 污染农田的安全生产上具有较好的应用价值。
| [1] | 唐非, 雷鸣, 唐贞, 等. 不同水稻品种对镉的积累及其动态分布[J]. 农业环境科学学报 , 2013, 32 (6) : 1092–1098. TANG Fei, LEI Ming, TANG Zhen, et al. Accumulation characteristic and dynamic distribution of Cd in different genotypes of rice(Oryza sativa L.)[J]. Journal of Agro-Environment Science , 2013, 32 (6) : 1092–1098. |
| [2] | Chaney R L, Reeves P G, Ryan J A, et al. An improved understanding of soil Cd risk to humans and low cost methods to phytoextract Cd from contaminated soils to prevent soil Cd risks[J]. Biometals , 2004, 17 : 549–553. DOI:10.1023/B:BIOM.0000045737.85738.cf |
| [3] | Liu J G, Qian M, Cai G L, et al. Uptake and translocation of Cd in different rice cultivars and the relation with Cd accumulation in rice grain[J]. Journal of Hazardous Materials , 2007, 143 (Suppl 1/2) : 443–447. |
| [4] | Bing L, Xun W, Qi X, et al. Identification of rice cultivars with low brown rice mixed cadmium and lead contents and their interactions with the micronutrients iron, zinc, nickel and manganese[J]. Journal of Environmental Sciences , 2012, 24 (10) : 1790–1798. DOI:10.1016/S1001-0742(11)60972-8 |
| [5] | 刘建国, 李坤权, 张祖建. 水稻不同品种对铅吸收、分配的差异及机理[J]. 应用生态学报 , 2004, 15 (2) : 291–294. LIU Jian-guo, LI Kun-quan, ZHANG Zu-jian. Difference of lead uptake and distribution in rice cultivars and its mechanism[J]. Chinese Journal of Applied Ecology , 2004, 15 (2) : 291–294. |
| [6] | 郑陶, 李廷轩, 张锡洲, 等. 水稻Cd高积累品种对Cd的富集特性[J]. 中国农业科学 , 2013, 46 (7) : 1492–1500. ZHENG Tao, LI Ting-xuan, ZHANG Xi-zhou, et al. Accumulation characteristics of cadmium-accumulated rice cultivars with high cadmium accumulation[J]. Scientia Agricultura Sinica , 2013, 46 (7) : 1492–1500. |
| [7] | 李军, 梁吉哲, 刘侯俊, 等. Cd对不同品种水稻微量元素累积特性及其相关性的影响[J]. 农业环境科学学报 , 2012, 31 (3) : 441–447. LI Jun, LIANG Ji-zhe, LIU Hou-jun, et al. Influence of Cd on microelements accumulation and their correlation in different rice cultivars of Northeastern China[J]. Journal of Agro-Environment Science , 2012, 31 (3) : 441–447. |
| [8] | Liu J G, Liang J S, Li K Q, et al. Correlations between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress[J]. Chemosphere , 2003, 52 (9) : 1467–1473. DOI:10.1016/S0045-6535(03)00484-3 |
| [9] | Wu F B, Dong J, Qian Q Q, et al. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J]. Chemosphere , 2005, 60 (10) : 1437–1446. DOI:10.1016/j.chemosphere.2005.01.071 |
| [10] | 曹应江, 游书梅, 蒋开锋, 等. 籼型三系杂交稻稻米中重金属镉含量的杂种负优势效应及配合力、遗传力分析[J]. 中国生态农业学报 , 2011, 19 (3) : 668–671. DOI:10.3724/SP.J.1011..2011.00668 CAO Ying-jiang, YOU Shu-mei, JIANG Kai-feng, et al. Analysis of heterosis, combining ability and heritability of cadmium content in brown rice of tri-line indica hybrid rice[J]. Chinese Journal of Eco-Agriculture , 2011, 19 (3) : 668–671. DOI:10.3724/SP.J.1011..2011.00668 |
| [11] | 赵步洪, 张洪熙, 奚岭林, 等. 杂交水稻不同器官镉浓度与累积量[J]. 中国水稻科学 , 2006, 20 (3) : 306–312. ZHAO Bu-hong, ZHANG Hong-xi, XI Ling-lin, et al. Concentrations and accumulation of cadmium in different organs of hybrid rice[J]. Chin J Rice Sci , 2006, 20 (3) : 306–312. |
| [12] | McGrath S P, Lombi E, Gray C W, et al. Field evaluation of Cd and Zn phytoextraction potential by the hyperaccumulators Thlaspicaerulescens and Arabidopsis halleri[J]. Environmental Pollution , 2006, 141 : 115–125. DOI:10.1016/j.envpol.2005.08.022 |
| [13] | 程龙玲, 周守标, 吴晓艳, 等. 弯囊苔草对Cd胁迫的响应及其Cd富集能力的研究[J]. 中国草地学报 , 2012, 34 (2) : 16–22. CHENG Long-ling, ZHOU Shou-biao, WU Xiao-yan, et al. Studies on responses of carex dispalata to Cd stress and its accumulation ability[J]. Chinese Journal of Grassland , 2012, 34 (2) : 16–22. |
| [14] | 桑世飞, 王会, 梅德胜, 等. 利用全基因组SNP芯片分析油菜遗传距离与杂种优势的关系[J]. 中国农业科学 , 2015, 48 (12) : 2469–3478. SANG Shi-fei, WANG Hui, MEI De-sheng, et al. Correlation analysis between heterosis and genetic distance evaluated by genome-wide SNP chip in brassica napus[J]. Scientia Agricultura Sinica , 2015, 48 (12) : 2469–3478. |
| [15] | 张锡洲, 张洪江, 李廷轩, 等. 水稻镉耐性差异及镉低积累种质资源的筛选[J]. 中国生态农业学报 , 2013, 21 (11) : 1434–1440. DOI:10.3724/SP.J.1011.2013.01434 ZHANG Xi-zhou, ZHANG Hong-jiang, LI Ting-xuan, et al. Differences in Cd-tolerance of rice and screening for Cd low-accumulation rice germplasm resources[J]. Chinese Journal of Eco-Agriculture , 2013, 21 (11) : 1434–1440. DOI:10.3724/SP.J.1011.2013.01434 |
| [16] | Ministry of Health of PRC. GB 2762-2012 National food safety standard:Limits of contaminants in food[S]. Beijing:China Standards Press, 2012. |
| [17] | 张涛, 倪先林, 蒋开锋, 等. 水稻功能基因标记遗传距离与杂种优势的相关性研究[J]. 中国水稻科学 , 2009, 23 (6) : 567–572. ZHANG Tao, NI Xian-lin, JIANG Kai-feng, et al. Correlation between genetic distance based on molecular markers of functional genes and heterosis in rice[J]. Chin J Rice Sci , 2009, 23 (6) : 567–572. |
| [18] | 张路, 张锡洲, 李廷轩, 等. Cd胁迫对水稻亲本材料Cd吸收分配的影响[J]. 农业环境科学学报 , 2014, 33 (12) : 2288–2295. ZHANG Lu, ZHANG Xi-zhou, LI Ting-xuan, et al. Effects of cadmium stress on uptake and distribution of cadmium in different rice varieties[J]. Journal of Agro-Environment Science , 2014, 33 (12) : 2288–2295. |
| [19] | 张路, 张锡洲, 李廷轩, 等. 水稻镉安全亲本材料对镉的吸收分配特性[J]. 中国农业科学 , 2015, 48 (1) : 174–184. ZHANG Lu, ZHANG Xi-zhou, LI Ting-xuan, et al. Cd uptake and distribution characteristics of Cd pollution-safe rice materials[J]. Scientia Agricultura Sinica , 2015, 48 (1) : 174–184. |
| [20] | Satoru I, Noriharu A, Masahiro Y. Chromosomal regions with quantitative trait loci controlling cadmium concentration in brown rice(Oryza sativa)[J]. New Phytologist , 2005, 168 (2) : 345–350. DOI:10.1111/j.1469-8137.2005.01516.x |
| [21] | Xue D, Chen M, Zhang G. Mapping of QTLs associated with cadmium tolerance and accumulation during seedling stage in rice(Oryza sativa L.)[J]. Euphytica , 2009, 165 (3) : 587–596. DOI:10.1007/s10681-008-9785-3 |
| [22] | Yao W Y, Sun L, Zhou H, et al. Additive, dominant parental effects control the inheritance of grain cadmium accumulation in hybrid rice[J]. Molecular Breeding , 2015, 35 (1) . |
| [23] | Auger D L, Gray A D, Ream T S, et al. Nonadditive gene expression in diploid and triploid hybrids of maize[J]. Genetics , 2005, 169 (1) : 389–397. |
| [24] | Ju C L, Zhang F, Gao Y F, et al. Cloning, chromosome mapping and expression analysis of an R2R3-MYB gene under-expressed in maize hybrid[J]. Molecular Biology Reports , 2006, 33 (2) : 103–110. DOI:10.1007/s11033-006-0016-5 |
| [25] | He J Y, Zhu C, Ren Y F, et al. Genotypic variation in grain cadmium concentration of lowland rice[J]. Journal of Plant Nutrition & Soil Science , 2006, 169 (5) : 711–716. |
| [26] | 于辉, 杨中艺, 杨知建, 等. 不同类型镉积累水稻细胞镉化学形态及亚细胞和分子分布[J]. 应用生态学报 , 2008, 19 (10) : 2221–2226. YU Hui, YANG Zhong-yi, YANG Zhi-jian, et al. Chemical forms and subcellular and molecular distribution of Cd in two Cd-accumulation rice genotypes[J]. Chinese Journal of Applied Ecology , 2008, 19 (10) : 2221–2226. |
| [27] | Ni T H, Zhang W Y. Subcellular distribution of cadmium in mining e-cotype Sedum alfredii[J]. Acta Botanica Sinica , 2003, 45 (8) : 925–928. |
| [28] | 陈亚慧, 刘晓宇, 王明新, 等. 蓖麻对镉的耐性、积累及与镉亚细胞分布的关系[J]. 环境科学学报 , 2014, 34 (9) : 2440–2446. CHEN Ya-hui, LIU Xiao-yu, WANG Ming-xin, et al. Cadmium tolerance, accumulation and relationship with Cd subcellular distribution in Ricinus communis L.[J]. Acta Scientiae Circumstantiae , 2014, 34 (9) : 2440–2446. |
| [29] | He J Y, Zhu C, Ren Y F, et al. Uptake, subcellular distribution, and chemical forms of cadmium in wide-type and mutant rice[J]. Pedosphere , 2008, 18 (3) : 371–377. DOI:10.1016/S1002-0160(08)60027-2 |
| [30] | Tezuka K, Miyadate H, Katou K, et al. A single recessive gene controls cadmium translocation in the cadmium hyperaccumulating rice cultivar Cho-Ko-Koku[J]. Theoretical & Applied Genetics , 2010, 120 (6) : 1175–1182. |
| [31] | Satohnagasawa N, Mori M, Nakazawa N, et al. Mutations in rice(Oryza sativa) heavy metal ATPase 2(OsHMA2) restrict the translocation of zinc and cadmium[J]. Plant & Cell Physiology , 2012, 53 (1) : 213–224. |
| [32] | Shimpei U, Takehiro K, Takuya S, et al. Low-affinity cation transporter(OsLCT1) regulates cadmium transport into rice grains[J]. Proceedings of the National Academy of Sciences of the United States of America , 2011, 108 (52) : 20959–20964. DOI:10.1073/pnas.1116531109 |
 2016, Vol. 35
2016, Vol. 35