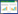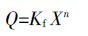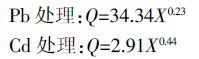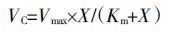文章信息
- 罗洁文, 黄玫英, 殷丹阳, 吴鹏飞, 蔡丽平, 周垂帆
- LUO Jie-wen, HUANG Mei-ying, YIN Dan-yang, WU Peng-fei, CAI Li-ping, ZHOU Chui-fan
- 类芦对铅镉的吸收动力特性及亚细胞分布规律研究
- Uptake kinetic characteristics and subcellular distribution of Pb2+ and Cd2+ in Neyraudia reynaudiana
- 农业环境科学学报, 2016, 35(8): 1451-1457
- Journal of Agro-Environment Science, 2016, 35(8): 1451-1457
- http://dx.doi.org/10.11654/jaes.2016-0202
文章历史
- 收稿日期: 2016-02-19
2. 海峡两岸红壤区水土保持协同创新中心, 福州 350002
2. Co-innovation Center for Soil and Water Conservation in Red Soil Region of the Cross-straits, Fuzhou 350002, China
重金属污染日趋严重,重金属污染的治理逐渐引起了人们的重视。其中,Pb、Cd 是植物体内的非必需元素,这两种重金属毒性极强,Pb 或Cd 胁迫至一定的浓度则可以使植物出现中毒症状,如叶片失绿、生长迟缓、光合作用被抑制、扰乱植物对矿质营养元素的吸收等[1-2]。植物的防御主要通过外排作用避免重金属进入细胞,或是通过细胞壁对重金属进行沉淀、区隔化,同时通过一些配位基团、有机酸、氨基酸以及植物螯合物与重金属作用,在其进入细胞前减轻其毒害,不同的植物对Pb、Cd 的响应过程和耐性机制不同[3-4]。植物修复是近年来新兴的绿色修复技术,其中一些生物量大、生长速度快、对污染物吸收能力较强但还达不到超富集植物标准的耐性植物受到了广泛的关注。
类芦(Neyraudia reynaudiana)是中国南方优良的水土保持防风固土的绿化植物,不仅可在重金属矿废弃地上较好生长,且保持有较高的生物量,在重金属废弃地的恶劣环境下表现出较强的适应性,其耐干旱、贫瘠、酸、重金属等,根系发达(可长达300 cm),茎分蘖力强,生长快,生物量大(高可达300 cm 左右,直径约1 cm),能适应各种恶劣的环境,这些特性使类芦成为能在铅锌矿上生长的几种植物之一[5]。矿山废弃地研究[6]发现其地上部分Pb 含量最高可达773mg·kg-1,接近Pb 超积累植物的临界含量标准(1000mg·kg-1),且其生物富集系数0.19~1.69,从转运系数来看,类芦的转运系数为3.1~21.2。除此之外,研究[7]发现在添加EDTA 螯合剂的情况下,类芦地上部分对Pb 的富集量可高达11 008 mg·kg-1,是对照的16.5倍。正是类芦具备的这些特点,使其成为适合南方Pb、Cd重金属污染的修复植物。近年来,国内外学者对类芦开展的研究大多集中在水土流失治理、根系固土作用以及其对干旱和养分胁迫的响应等方面[8-9]。但有关类芦对重金属耐性的机理并不清楚,这成为限制类芦在重金属污染修复应用的主要技术瓶颈。鉴于此,本文选取南方水土保持先锋植物类芦为试验材料,采用营养液培养的方法,研究不同Pb、Cd 处理浓度、处理时间下类芦对Pb、Cd 的吸收动力学特性,并对Pb、Cd 在各亚细胞组分的分布进行分析。本研究旨在探明类芦对Pb、Cd 的吸收动力学规律,揭示Pb、Cd 在类芦细胞内的分布格局,为阐明类芦对Pb、Cd污染的耐性和富集机理研究提供基础数据。
1 材料与方法 1.1 试验材料类芦种子于2015年4 月购自云南省昆明市某种子公司。同年8 月底种植于福建农林大学温室大棚,10 月底在水培实验前,选择生长均一的类芦幼株转移到培养箱中,移植在泡沫板上并放置于500 mL 超纯水中培养3~4 d,然后±次用1/2 和完全Hoagland培养液在塑料盆中培养3~4 d。培养期间昼/夜温度为25℃/22℃,光照时间16 h。
1.2 试验方法 1.2.1 Pb2+、Cd2+吸收浓度动力学取成长到一定程度大小一致的类芦苗,±次用自来水和去离子水冲洗干净,用含2 mmol·L-1 Mes-Tris和0.5 mmol·L-1 CaCl2的预处理液(用HCl和NaOH调节pH 值为5.8)预培养12 h后,放入含有不同浓度Pb2+/Cd2+[以Pb(NO3) 2/CdCl2的形式加入]的2 mmol·L-1Mes-Tris、0.5 mmol·L-1 CaCl2(pH5.5)吸收液中培养48h,浓度分别为0.5、1、5、10、25、50、100、200 μmol·L-1(为避免产生磷酸铅沉淀,营养液中KH2PO4的浓度设置为0.25 mmol·L-1),每个处理设置3 次重复,每个处理重复4 棵类芦。类芦苗处理48 h后取出,±次用自来水和去离子水冲洗根部,放入含有2 mmol·L-1Mes-Tris 和5 mmol·L-1 CaCl2(pH5.5)的洗脱液中冰水浴30 min。洗脱后的根用去离子水冲洗干净,吸水纸擦干,分为根部和地上部分,置于烘箱105℃杀青30min,然后75℃烘干72 h,称重,测定Pb2+/Cd2+含量。选取Pb2+/Cd2+的浓度分别为0、5、25、200 μmol·L-1 处理的鲜样作亚细胞组分分析,每个处理3 次重复。
1.2.2 Pb2+、Cd2+吸收时间动力学基于预试验的结果,在Pb2+/Cd2+浓度为25 μmol·L-1时能够正常生长,选取Pb2+/Cd2+浓度为25 μmol·L-1进行时间动力学试验。将类芦预培养12 h后,置于Pb2+/Cd2+浓度为25 μmol·L-1的吸收液中(含有2 mmol·L-1 Mes-Tris、0.5 mmol·L-1 CaCl2,pH5.5)培养3、6、12、24、48 h;试验设置4 次重复,每个处理重复6 棵类芦。吸收培养后,洗脱,洗净,擦干,烘干,称重,测定Pb2+/Cd2+含量;并取鲜样作亚细胞组分分析,每个处理3次重复。
1.3 样品Pb2+、Cd2+总含量的测定把地上部分和地下部分烘干至恒量,将干燥的类芦根或类芦叶子粉碎后准确称取0.2 g(精确到0.000 1)于50 mL三角瓶中,加混酸(HNO3:HClO4=5:1)10 mL,在电炉上加热至冒白烟,用1%的稀硝酸定容至25mL容量瓶中,然后用原子吸收法测定Pb2+/Cd2+含量。
1.4 样品亚细胞组分Pb2+、Cd2+含量的测定采用差速离心法分离不同的细胞组分,参考周小勇等[10]的方法,具体步骤为:准确称取鲜样0.2 g,加入20 mL 提取液[0.25 mol·L-1 蔗糖+50 mmol·L-1 Tris-HCl缓冲液(pH7.5)+1 mmol·L-1二硫赤鲜糖醇],液氮研磨匀浆,匀浆液在冷冻离心机300 r·min-1 下离心1min,沉淀为细胞壁组分(F1);上清液在2000 r·min-1下离心15 min,沉淀为细胞核和叶绿体组分(F2);上清液在10 000 r·min-1下离心20 min,沉淀为线粒体组分(F3);上清液为含核糖体的可溶组分(F4),全部操作在4℃下进行。各组分采用1.3 节中的方法进行消解,定容至10 mL 后测定Pb、Cd含量。
1.5 数据处理数据为3次重复样品测定结果的平均值(含标准差)。运用Excel 2007 和SPSS 18 进行数据统计分析,采用单因素方差分析(One-way ANOVA)和多重比较,用SNK 法对处理间数据进行差异显著性分析,以P<0.05表示处理间差异显著,并用Origin 9.2 作图。
2 结果与分析 2.1 类芦对Pb2+、Cd2+的吸收浓度动力学在Pb、Cd 处理下,随着重金属浓度的增加,类芦叶片和根对Pb、Cd 的吸收都呈明显的增长趋势。但是类芦对Pb、Cd 的吸收在200 μmol·L-1下,经过48 h的处理后仍未达到饱和。类芦对Pb2+、Cd2+吸收动力学曲线呈线性、非饱和曲线,用Freundlich 方程对类芦叶片吸收Pb、Cd 曲线进行拟合,修改后的方程为[11]:
式中:Q 为吸收量,mg·kg-1;X 为溶液中Pb2+、Cd2+的浓度,μmol·L-1;Kf为与吸收量有关的常数;n 为吸收曲线斜率。Kf和n 都由实验测定分析得出。
由图 1 可知,类芦叶片吸收Pb2+、Cd2+可以采用Freundlich方程拟合,相关系数高。拟合得到的方程为:

|
| 图 1 类芦叶片对Pb2+、Cd2+的吸收速率与溶液浓度的关系 Figure 1 Concentration-dependent Pb2+,Cd2+ influx kinetics in leaves of Neyraudia reynaudiana |
拟合方程在坐标上的截距为Kf 值,对于重金属的吸收情况而言,类芦吸收Pb 的Kf值大于Cd 的Kf值,说明类芦在重金属吸收中具有选择性,相同浓度胁迫下,类芦能更多地富集重金属Pb。另外,n为曲线的斜率,在48 h的胁迫时间内,类芦吸收Cd 的n 值大于Pb 的n 值,说明类芦吸收Cd 的速率增长得更快。
类芦根系对Pb2+、Cd2+的吸收曲线(其中,Pb 只对浓度0~100 μmol·L-1 进行拟合)可利用Michaelis-Menten方程进行拟合[12]:
式中:VC 是吸收速率,mol·g-1·h-1;X 是溶液中Pb2+、Cd2+的浓度,μmol·L-1;Vmax 是最大吸收速率,mol·g-1·h-1;Km 是方程的速率常数,μmol·L-1,Km 值代表了根系对离子的亲和力,该值越小,亲和力越高。根吸收力α=Vmax/Km,表示根系对离子的实际吸收能力,α值越大,表明根系对离子的吸收能力越强。
根据方程的拟合效果(图 2)及参数(表 1),相关系数R2>0.95,说明该方程能很好地拟合吸收曲线。类芦根系对Pb2+、Cd2+的亲和值Km相近,而最大吸收速率Vmax有较大的差异,类芦吸收Cd 的α值明显高于Pb 的α值,说明类芦根系对Cd 吸收能力更强。但是此吸收规律仅对于Pb 浓度为0~100 μmol·L-1 而言,当Pb 浓度达到200 μmol·L-1,根系大量富集Pb,其含量达到4 687.86 mg·kg-1,说明类芦对Pb 有较高的耐受和富集能力。

|
| 图 2 类芦根系对Pb2+、Cd2+的吸收速率与溶液浓度的关系 Figure 2 Concentration-dependent Pb2+,Cd2+ influx kinetics in roots of Neyraudia reynaudiana |
吸收液中Pb2+、Cd2+浓度为25 μmol·L-1 时,类芦对Pb2+、Cd2+的积累量都随时间的增加而增加,并且都能用修改的Freundlich方程进行拟合,相关系数R2>0.95,拟合性好,见图 3。

|
| 图 3 类芦对Pb2+、Cd2+的吸收速率与时间的关系 Figure 3 Time-dependent Pb2+,Cd2+ influx kinetics in roots and leaves of Neyraudia reynaudiana |
由图 3可知,在吸收时间动力学试验中(3~48 h),类芦对Pb2+、Cd2+的吸收量基本保持平稳增长,根部随时间增长大量富集Pb、Cd,处理48 h后,根部吸收的Pb、Cd 分别是叶片的3.2 倍和13.72 倍。而由表 2 可知,类芦吸收Pb 的Kf 值大于Cd 的Kf 值,说明在3~48 h内,类芦能更多地富集重金属Pb。但是在曲线斜率n 上,类芦吸收Cd 的n 值均大于Pb 的n 值,说明相对而言,类芦吸收Cd 的速率增长得更快、更明显。
通过差速离心分离法,将类芦叶片和根细胞分别分离出四部分,并对Pb2+、Cd2+在类芦体内的分布进行测定,结果显示,没有Pb、Cd 胁迫时,植物体内只有少量的Cd 分布于细胞壁(可能是培育的土壤受到了轻微Cd 污染),并且没有检测出Pb。从总量来说,根中的重金属含量基本高于叶片中的含量,Pb 在植物体内的含量高于Cd的含量,在不同Pb2+、Cd2+浓度胁迫时(表 3),Pb、Cd 在细胞壁组分(F1)和含核糖的可溶组分(F4)的分布最高,占61.98%~100%,其次为细胞核和叶绿体组分(F2),仅有少量分布在线粒体组分(F3),这说明细胞壁和含核糖体可溶组分是Pb、Cd在类芦体内的主要分布位点,只有少量分布于细胞核和叶绿体以及线粒体等细胞器中,说明Pb、Cd 的胁迫使细胞壁对重金属的滞留作用显著增强。同是类芦叶片,Cd 主要分布在F1 中,在低浓度胁迫时,该组分中的Cd 含量达到74.76%,但随着Cd 浓度的增加,部分金属转移到F4 中,而Pb 在类芦体内的比例并没有明显的变化。根系状况与叶片有所不同,高浓度Pb 胁迫下,Pb 在细胞壁中大量富集,Pb 浓度为200 μmol·L-1时,在此组分的含量达到最高,为1 096.49 mg·kg-1,所占比例为90.43%,同时减少了Pb 在其他组分中的分配比例,说明细胞壁为促进植物进行正常生理活动发挥了作用。而Cd在类芦根部的分布,随着Cd浓度的增加,其在F1 组分中的比例下降,在200 μmol·L-1时降至44.63%,而F4的比例上升,说明部分Cd 从F1 组分转移到F4组分中。
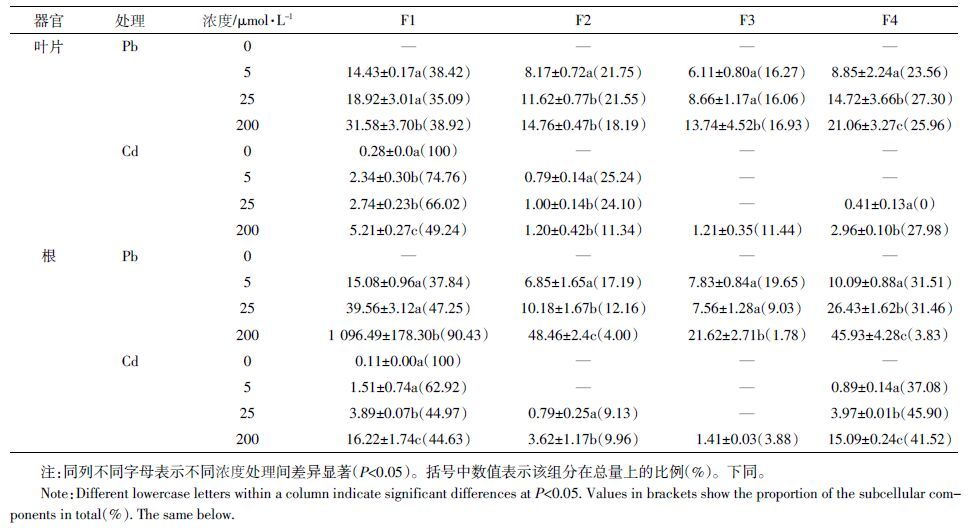 |
在Pb、Cd 不同时间处理下(表 4),类芦吸收Pb的总量仍高于吸收Cd 的量,植物体内F1 与F4 组分中Pb、Cd的含量随着时间的增长而增加,Pb、Cd 在这两个组分中所占比例最高,占总量的59.88%~100%。在48 h处理时间内,Cd 在F2、F3 组分含量极低,仪器未能检测出其含量,而Pb 在F2 和F3 中的含量在类芦不同部位变化趋势不一。同在类芦叶片,从Pb、Cd 含量所占的百分比来看,Pb 在F1 组分中的比例下降而F4 组分比例增加,而Cd 则相反,随着处理时间的增加,F1 组分中从100%降至80.56%,F4 组分从0%增加至19.44%。Cd 在根系中的分布比例状况与叶片中的相似,且含量与时间有显著的关系(P<0.05),而Pb 在根F1 组分中的比例随时间的增长先升后降,F4 的比例呈上升趋势,F2、F3 组分所占比例呈下降趋势。上述结果表明,随着胁迫时间的增加,类芦根细胞壁能将大部分Pb、Cd 吸附在细胞壁上,并且类芦对Pb、Cd 的吸收具有一定的动态变化。
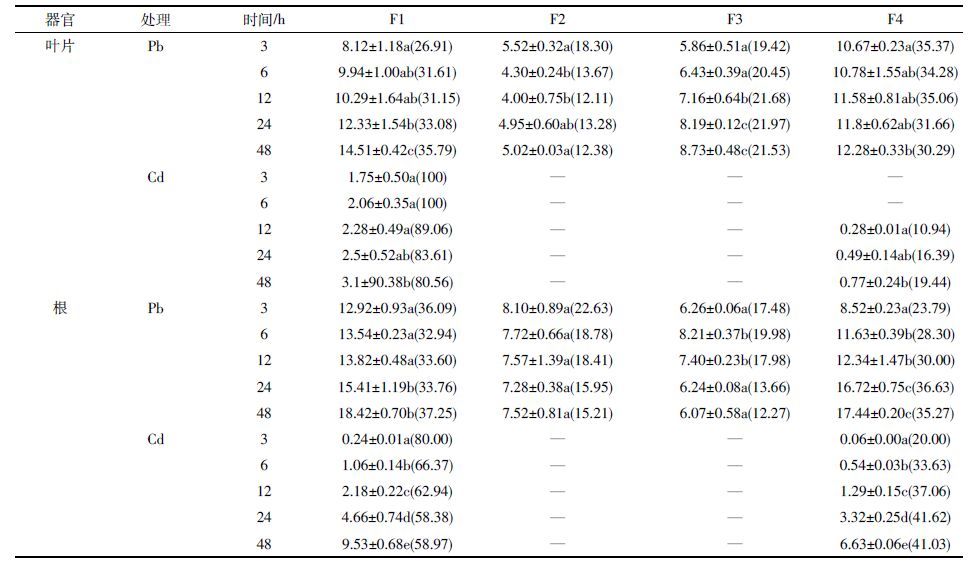 |
一般而言,植物通过根际吸收重金属元素,并将其输送和富集到地上部分,在本研究中,类芦体内重金属含量与浓度和时间有显著的相关性,类芦根系吸收溶液中的重金属,并转移到叶片中。经过分析后发现,可利用Freundlich 方程和Michaelis-Menten 方程对吸收量和吸收速率进行拟合。从拟合方程对比来看,类芦对Pb 有更强的敏感性,吸附量更高,但对Cd的吸收速率更为显著,类芦吸收Cd 有一定的潜力。类芦根中可以积累较大量的Pb2+、Cd2+,并且这两种重金属浓度在根中均高于叶片中的浓度,这跟以往关于植物吸收重金属的研究一致[13],可能是重金属从根到地上部分远距离转运而导致的。当溶液中重金属浓度达到200 μmol·L-1 时,Cd 在类芦叶片中的含量为31.10 mg·kg-1,根中含量达到465.43 mg·kg-1,约为叶片含量的15 倍;而Pb在类芦体内的分布差异更为显著,其在叶片中含量为118.65 mg·kg-1 时,在根中大量富集,达到4 687.87 mg·kg-1,是叶片中含量的39.5倍。由此可见,水培条件下根系是类芦主要富集Pb、Cd 的部分,而类芦对Pb2+具有较高的选择性,其中可能是有一些通道对Pb有特定的吸附能力,还有待进一步的研究。
3.2 类芦对Pb2+、Cd2+的耐性机制植物根系吸收离子主要是通过细胞外空间(质外体)或经由胞质(通过共质体),在本试验中,细胞壁结合部分(质外体途径)会干扰Pb2+、Cd2+流进细胞质的量,原则上,细胞壁吸附的重金属不能被认为是真正的吸收,因此,利用洗脱液去除细胞壁松散的Pb2+、Cd2+后再作进一步分析[12]。细胞壁是重金属离子进入植物体的第一道屏障,它与重金属的结合作用是植物耐重金属的原因之一,大量有害重金属沉积在植物细胞壁,能阻止重金属对细胞内溶物的伤害。由于重金属离子被固定在细胞壁上,不能进入细胞质影响细胞内的代谢活动,使植物对重金属表现出耐性[3, 14]。有学者分别对矿山生态型的东南景天和少根紫萍进行研究,同样发现重金属镉或铀都主要分布在细胞壁上[15-16]。在本试验中,洗脱后类芦根细胞壁仍有较高的量,说明类芦根细胞壁对Pb2+、Cd2+的吸附能力较强,同时,进入植物叶片和根部的Pb、Cd 主要分布在细胞壁上且一直保持较高的比例,仅有少量分布在细胞核和线粒体等组分,可能是因为根细胞壁中固定了大量Pb、Cd,减少了重金属的流通量,减弱了Pb、Cd向地上部分迁移的能力。这些说明了可能是由于凯氏带的存在,离子在进入中柱之前,必须首先进入共质体,而凯氏带则能有效减少重金属离子进入的量[17]。
Pb、Cd 进入细胞内会进一步分布到各种细胞器中,在本试验中,F4 组分在总量中占有相当的比重,F4 组分为含核糖的可溶性组分,主要由液泡和细胞质两部分组成。随着Pb、Cd浓度的增加和处理时间的延长,细胞壁沉淀达到饱和及细胞质膜断裂后,多余的Pb、Cd便进入原生质体内,进入原生质中的重金属可通过向液泡输送来降低其在原生质体中的浓度,使植物表现出耐性。液泡是植物细胞代谢副产品及废物囤积场所,其含有的多种蛋白质、有机酸、有机碱等物质都能与重金属结合,使重金属离子在细胞内被区隔化,从而明显降低了细胞质中游离重金属离子的浓度[18]。因此,类芦在受到重金属胁迫时,部分Pb、Cd 向可溶组分转移,可能是类芦通过改变Pb、Cd 在亚细胞组分中的分布以增强植物对重金属的耐受性。
类芦具有的对Pb、Cd 富集能力、耐受性及生物量大等特点,或能使其成为植物修复的潜能植物。而目前,在植物修复方面,超积累植物与非超积累植物最大的区别在于其向地上部转运重金属的能力,对生物量大而富集量一般的耐性植物而言,EDTA、DTPA、有机肥等螯合剂,尤其是胡敏酸等天然螯合剂得到了广泛的使用,这些螯合剂能促使植物将大量的重金属转运至地上部分[19]。但是何种螯合剂能促进类芦对重金属的吸收,螯合剂在类芦体内的螯合机制,以及是否对环境有潜在的风险等仍需进一步的讨论和深入的研究。
4 结论(1)类芦对Pb、Cd吸收随着浓度和时间的增加而增加,吸收的Pb、Cd 主要分布在植物的根部,在相同浓度和时间处理下,类芦体内的Pb 明显比Cd 含量高,但是对Cd 的吸收有一定的潜力。类芦对Pb、Cd的吸收规律能够利用Freundlich 方程和Michaelis-Menten方程进行拟合。
(2)细胞壁是Pb、Cd 在类芦细胞内主要的分布位点,尤其是Pb 在植物根中最高能达到90.43%,其次是可溶组分,细胞核、叶绿体组分和线粒体组分含量较低。重金属在类芦体内的动态分布使得类芦对Pb、Cd有一定的耐性,维持了植物自身的稳态。
| [1] | Xu S S, Lin S Z, Lai Z X. Cadmium impairs iron homeostasis in Arabidopsis thaliana by increasing the polysaccharide contents and the iron-binding capacity of root cell walls[J]. Plant and Soil , 2015, 392 (1) : 71–85. |
| [2] | Lamhamdi M, Galiou O E, Bakrim A, et al. Effect of lead stress on mineral content and growth of wheat(Triticum aestivum) and spinach(Spinacia oleracea) seedlings[J]. Saudi Journal of Biological Sciences , 2013, 20 (1) : 29–36. DOI:10.1016/j.sjbs.2012.09.001 |
| [3] | 黄化刚, 李廷轩, 杨肖娥, 等. 植物对Pb胁迫的耐性及其解毒机制研究进展[J]. 应用生态学报 , 2009, 20 (3) : 696–704. HUANG Hua-gang, LI Ting-xuan, YANG Xiao-e, et al. Research advances in plant lead tolerance and detoxification mechanism[J]. Journal of Applied Ecology , 2009, 20 (3) : 696–704. |
| [4] | 荆红梅, 郑海雷, 赵中秋, 等. 植物对镉胁迫响应的研究进展[J]. 生态学报 , 2001, 21 (12) : 2125–2130. JING Hong-mei, ZHENG Hai-lei, ZHAO Zhong-qiu, et al. Progresses of plants response to cadmium[J]. Acta Ecologica Sinica , 2001, 21 (12) : 2125–2130. |
| [5] | 王友生, 侯晓龙, 吴鹏飞, 等. 长汀稀土矿废弃地土壤重金属污染特征及其评价[J]. 安全与环境学报 , 2014, 14 (4) : 259–262. WANG You-sheng, HOU Xiao-long, WU Peng-fei, et al. Characteristics and evaluation of heavy metal pollution in the waste land of Changting rare earth mine[J]. Journal of Safety and Environment , 2014, 14 (4) : 259–262. |
| [6] | 戴文娇, 宁平, 刘晓海, 等. 类芦对铅的耐性及富集能力探讨[J]. 环境工程学报 , 2008, 2 (7) : 1004–1008. DAI Wen-jiao, NING Ping, LIU Xiao-hai, et al. Tolerance and accumulation of Neyraudia reynaudiana for Pb[J]. Chinese Journal of Environmental Engineering , 2008, 2 (7) : 1004–1008. |
| [7] | 戴文娇. 类芦对铅的耐性及吸收富集研究[D]. 昆明:昆明理工大学, 2008. DAI Wen-jiao. Lead tolerance and accumulation in Neyraudia reynaudiana(Kunth) Keng[D]. Kunming:Kunming University of Science and Technology, 2008. |
| [8] | 蔡丽平, 吴鹏飞, 侯晓龙, 等. 类芦根系对不同强度干旱胁迫的形态学响应[J]. 中国农学通报 , 2012, 28 (28) : 44–48. CAI Li-ping, WU Peng-fei, HOU Xiao-long, et al. Morphological response to different drought stress in the roots of Neyraudia reynaudiana[J]. Chinese Agricultural Science Bulletin , 2012, 28 (28) : 44–48. |
| [9] | 袁中友, 郭彦彪, 李强, 等. 有机无机肥配施对生态重建先锋植物类芦生长的影响[J]. 水土保持学报 , 2014, 25 (5) : 302–308. YUAN Zhong-you, GUO Yan-biao, LI Qiang, et al. Effects of organic-inorganic fertilizer application on pioneer plant Neyraudia reynaudiana on ecological restoration[J]. Journal of Soil and Water Convervation , 2014, 25 (5) : 302–308. |
| [10] | 周小勇, 仇荣亮, 胡鹏杰, 等. 镉和铅对长柔毛委陵菜体内锌的亚细胞分布和化学形态的影响[J]. 环境科学 , 2008, 29 (7) : 2028–2036. ZHOU Xiao-yong, QIU Rong-liang, HU Peng-jie, et al. Effects of cadmium and lead on subcellular distribution and chemical form of zinc in potentilla griffithii var. velutina[J]. Environmental Science , 2008, 29 (7) : 2028–2036. |
| [11] | 安增莉, 侯艳伟, 蔡超水, 等. 水稻秸秆生物炭对Pb(Ⅱ)的吸附特性[J]. 环境化学 , 2011, 30 (11) : 1851–1857. AN Zeng-li, HOU Yan-wei, CAI Chao-shui, et al. Adsorption characteristics of Pb(Ⅱ) from rice straw biological carbon[J]. Environmental Chemistry , 2011, 30 (11) : 1851–1857. |
| [12] | 陈彩虹, 刘治昆, 陈光才, 等. 苏柳172和垂柳对Cu2+的吸收特性及有机酸影响[J]. 生态学报 , 2011, 31 (18) : 5255–5263. CHEN Cai-hong, LIU Zhi-kun, CHEN Guang-cai, et al. Uptake kinetic characteristics of Cu2+ by Salix jiangsuensis CL J-172 and Salix babylonica Linn and the influence of organic acids[J]. Acta Ecologica Sinica , 2011, 31 (18) : 5255–5263. |
| [13] | Zhao L, Li T, Yu H, et al. Changes in chemical forms, subcellular distribution, and thiol compounds involved in Pb accumulation and detoxification in Athyrium wardii(Hook[J]. Environmental Science and Pollution Research , 2015, 22 (16) : 12676–12688. DOI:10.1007/s11356-015-4464-0 |
| [14] | Meyer C L, Juraniec M, Huguet S, et al. Intraspecific variability of cadmium tolerance and accumulation, and cadmium-induced cell wall modifications in the metal hyperaccumulator Arabidopsis halleri[J]. Journal of Experimental Botany , 2015, 66 (11) : 3215–3227. DOI:10.1093/jxb/erv144 |
| [15] | Nie X, Dong F, Liu N, et al. Subcellular distribution of uranium in the roots of Spirodela punctata and surface interactions[J]. Applied Surface Science , 2015, 347 (30) : 122–130. |
| [16] | Ni T H, Wei Y Z. Subcellular distribution of cadmium in mining ecotype Sedum alfredii[J]. Journal of Integrative Plant Biology , 2003, 45 (8) : 925–928. |
| [17] | 泰兹. 植物生理学[M].五版. 北京: 科学出版社, 2009 . Taiz L. Plant physiology[M].Fifth edition. Beijing: Science Press, 2009 . |
| [18] | 徐君, 贾荣, 施国新, 等. 镉在水花生叶片中的亚细胞分布及其毒理学[J]. 应用生态学报 , 2012, 23 (4) : 1070–1076. XU Jun, JIA Rong, SHI Guo-xin, et al. Subcellular distribution and phytotoxicity of cadmium in Alternanthera philoxeroides leaves[J]. Journal of Applied Ecology , 2012, 23 (4) : 1070–1076. |
| [19] | 刘婷婷, 彭程, 王梦, 等. 海州香薷根细胞壁对铜的吸附固定机制研究[J]. 环境科学学报 , 2014, 34 (2) : 514–523. LIU Ting-ting, PENG Cheng, WANG Meng, et al. Mechanism of fixation and adsorption of copper on root cell wall of Elsholtzias plendens[J]. Acta Scientiae Circumstantiae , 2014, 34 (2) : 514–523. |
 2016, Vol. 35
2016, Vol. 35