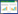文章信息
- 李广科, 陈俊艳, 付小娟
- LI Guang-ke, CHEN Jun-yan, FU Xiao-juan
- 垃圾渗滤液暴露对拟南芥的毒效应研究
- Phytotoxicity of landfill leachate to Arabidopsis thaliana
- 农业环境科学学报, 2016, 35(8): 1458-1464
- Journal of Agro-Environment Science, 2016, 35(8): 1458-1464
- http://dx.doi.org/10.11654/jaes.2016-0119
文章历史
- 收稿日期: 2016-01-25
垃圾渗滤液是生活垃圾在填埋后经过堆积、压实及降解等一系列物理化学和生物反应过程产生的一种高浓度有机废水,其组成复杂,水质水量变化大,含有多种有机污染物、重金属等物质。垃圾渗滤液很容易渗入土壤甚至地下水中,造成土壤及水体污染,并通过食物链富集在人体中,给人体健康带来巨大危害。近年来,研究者关注于渗滤液对生物胁迫的影响研究,多利用高等植物生长发育、抗氧化酶系统、遗传系统等指标反映渗滤液的毒性效应。Klauck R C等发现[1],不同浓度垃圾渗滤液会对洋葱根系生长、根尖有丝分裂指数及染色体畸变率产生影响,他们还发现[2]油麦菜和芸芥的生长指标(萌发率和根长)与垃圾渗滤液的来源有关,相比于生物处理后的垃圾渗滤液,生物处理前的渗滤液更易抑制其生长。Guerrero-Rodríguez D 等[3]采用温室试验测定了豆科植物对两种不同垃圾渗滤液的毒性响应,发现不同来源、不同浓度的渗滤液会对菜豆的产量造成不同程度的抑制效应。桑楠等[4]的研究表明,不同浓度的渗滤液会影响玉米幼苗的生理生化及氧化损伤,从而造成玉米抗氧化酶系统的变化。这些研究大多集中于一些禾草类材料[5]及农田作物[6-8]等的早期毒性研究,而关于植物整个生命期对渗滤液复合污染物综合毒性的应答机制研究还不多见。
拟南芥是国际上第一种完成全基因测序的高等模式植物[9],生命周期很短,培养方法成熟,是明确高等植物整个生命阶段对垃圾渗滤液复合污染应答反应机理的理想材料。本研究通过分析北方冬季某一垃圾填埋场内垃圾渗滤液对拟南芥的影响,分别讨论了拟南芥不同生长发育阶段对垃圾渗滤液胁迫的应答机制,为拟南芥有效、敏感地监测渗滤液的毒性提供理论±据。
1 材料与方法 1.1 供试渗滤液及供试作物供试渗滤液采自山西省太原市侯村垃圾卫生填埋场。该垃圾填埋场属于北方高原山谷型垃圾填埋场,2007 年投入使用,占地面积约59 hm2,填埋区容积约为1200 万m3,废物主要来源于城市生活垃圾。渗滤液样品采集于2014年11 月,具有北方冬季城市生活垃圾的代表性,其基本理化性质如下:pH 7.96,电导率157 mS·cm-1,色度256 倍,CODCr 2340 mg·L-1,氨氮958 mg·L-1,Ni 0.071 6 mg·L-1,Zn 0.020 3 mg·L-1,Cu 0.005 7 mg·L-1,Fe 0.533 3 mg·L-1,Mn 0.005 9 mg·L-1,Pb 0.027 5 mg·L-1。供试作物为Colunbia 生态型(Col-0)拟南芥(购自中国农业科学院)。
1.2 试验设计采用室内盆栽实验,所有种子均需要预处理。选取均匀饱满的拟南芥种子,用1%次氯酸钠(NaClO V/V,内含0.01%Triton-100)将其消毒并用蒸馏水洗三次后浸泡,于4℃下春化2~3 d后进行各阶段的渗滤液暴露实验。培养条件均为:白天22±1℃,晚上18±1℃,光照/黑暗时间为14 h/10 h,光照强度大于3000lx,相对湿度在70%左右。
为研究拟南芥对渗滤液污染的耐受性及生理响应机制,本实验针对拟南芥不同生长阶段设置不同体积浓度的渗滤液水平。每个处理至少3 个重复。实验期间,对所有供试植株进行统一灌溉,并进行除草、防虫和防病管理。
1.3 测定指标及方法 1.3.1 早期相关指标的测定于2015 年4月中旬取消毒后的拟南芥种子于铺有滤纸的直径为120 mm的培养皿内,用不同体积浓度(0%、0.1%、1%、10%)的垃圾渗滤液进行染毒,暴露期间注意更换培养液,每次3~5 mL。以种子破白后根长约0.03 mm 为萌发标准,每隔24 h 记录一次种子萌发数,并用光学显微镜在15×40 倍镜下测量幼苗的根长和芽长。实验设3 个平行,每组30粒种子。
1.3.2 成熟期相关指标的测定于2015 年5 月中旬取4 周龄的拟南芥植株,播种于每小格(上口长、宽均为4.5 cm,下口长、宽均为3cm,高为4 cm 的育苗盘,底部开有直径为1 cm 的出水孔),每小格种5 株拟南芥。用德国进口播种育苗泥炭土进行培养,连续灌溉不同体积浓度(1%、5%、10%、20%、40%、80%)的垃圾渗滤液,分别在第7 d和14 d取样测定株高、单株叶片数、叶片鲜重,并采集拟南芥的新鲜叶片以测定其生理生化指标。叶绿素测定采用丙酮-乙醇混合提取,分光光度法[10];丙二醛(MDA)采用硫代巴比妥酸(TBA)加热比色法[11];超氧化物歧化酶(SOD)活性采用硝基四氮唑蓝(NBT)还原法[12];过氧化氢酶(CAT)活性采用紫外分光光度法[13];过氧化物酶(POD)活性采用愈创木酚法[11, 14]。
1.3.3 晚期生长发育指标的测定于2015 年5月中旬取4周龄的拟南芥植株于上述苗盘中,用不同体积浓度(1%、5%、10%、20%)的垃圾渗滤液连续灌溉14 d,然后进行恢复培养,直到拟南芥产种,水力负荷固定为1.5 mm·d-1。从第一株拟南芥抽薹开始,每隔5 d统计所有植株的抽薹总数,并从中随机挑选30 株,统计拟南芥的角果数。实验设3个平行,以平均值为最终值。
1.4 数据分析实验至少重复三次,结果以平均值±标准差表示。用Origin 7.0 软件进行单因素方差分析及统计学多重比较。当P<0.05 时,认为差异显著;当P<0.01 时,认为差异极显著。
2 实验结果与分析 2.1 早期生长发育的影响渗滤液早期暴露会影响拟南芥的萌发、根长及芽长,并随处理浓度和暴露时间而变化。由图 1a 可知,0.1%渗滤液暴露24 h拟南芥萌发率升高,与对照组相比呈现显著性差异(P<0.05),为对照组的256%。而10%渗滤液暴露48 h、72 h和168 h则与对照组相比出现显著性抑制效应(P<0.05)。

|
| 图 1 垃圾渗滤液对拟南芥萌发率、根长及芽长的影响 Figure 1 Effects of landfill leachate on germination,root length and shoot growth of Arabidopsis seedlings 不同处理组和对照组之间比较:*P<0.05,**P<0.01。下同 |
随着暴露时间的延长,拟南芥根的生长速度逐渐缓慢,并表现出与萌发率相同的变化趋势(图 1b)。0.1%渗滤液暴露24 h根长与对照组相比显著性增加(P<0.01),为对照组的324%。随渗滤液浓度的增加,根系生长开始受到抑制,在48 h 10%渗滤液暴露后呈现显著性差异(P<0.01),为对照组的36%。图 1c所示是渗滤液暴露后拟南芥幼苗芽长的情况,结果表明低浓度渗滤液(0.1%、1%)促进芽的生长,而高浓度渗滤液(10%)暴露48 h 抑制其生长,随暴露时间的延长,与对照组相比没有表现出显著性差异。可以看出,在同一浓度渗滤液水平下,拟南芥幼苗的根系比芽更为敏感。
2.2 成熟期的影响渗滤液暴露会影响成熟期拟南芥的生长与发育(叶片数、株高、叶片鲜重、叶绿素)。图 2a表明在低浓度(1%、5%)渗滤液水平下,拟南芥的叶片数基本保持不变,随着渗滤液浓度的增加,与对照组相比呈现显著性差异(P<0.05,P<0.01)。此外,暴露时间也会对拟南芥叶片数造成影响,暴露时间越长,抑制效应越显著。图 2b 表明,1%和5%渗滤液处理后,拟南芥株高没有发生统计学变化。10%处理组,暴露7 d株高显著增加(P<0.05),至14 d则表现为显著的抑制效应(P<0.01)。对于20%和40%处理组,与对照组相比,暴露7 d无显著性变化,14 d则出现显著性抑制效应(P<0.01)。对于80%处理组,暴露7 d 即出现显著性抑制作用。
|
| 图 2 垃圾渗滤液暴露7d 和14d 对拟南芥叶片数、株高、叶片鲜重及叶绿素的影响 Figure 2 Effects of landfill leachate on leaf number(a),plant height(b),fresh leaf weight(c),chlorophyll content(d) in 7- and 14-day-exposed Arabidopsis 相应浓度下时间之间比较:# P<0.05,## P<0.01。下同 |
图 2c 为拟南芥叶片的鲜重变化情况。低浓度(1%、5%)渗滤液并未显著性影响鲜重,随着浓度的升高(10%、20%、40%、80%),与对照组相比表现出显著的抑制效应(P<0.01)。渗滤液暴露7 d,除80%处理组外,其余处理组均可促进叶绿素的合成并表现出统计学差异(P<0.01),分别达到对照组的115%、136%、151%、125%和123%。暴露14 d,渗滤液处理组的叶绿素含量与对照组相比表现为抑制效应(P<0.05、P<0.01;图 2d)。以上结果均表明,渗滤液暴露浓度和暴露时间均会影响成熟期拟南芥的生长发育。
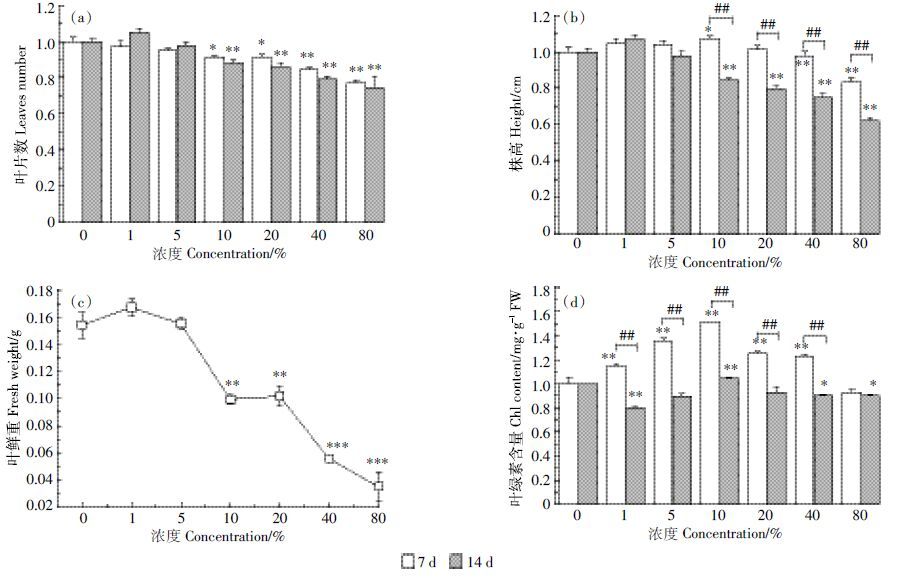
此外,渗滤液暴露会对成熟期拟南芥造成氧化损伤。从图 3可以看出,渗滤液暴露不同时间对拟南芥MDA、SOD、CAT、POD 造成不同程度的影响。渗滤液暴露7 d时,1%、5%、10%处理组MDA 含量与对照组相比无统计学差异,但随浓度的上升(20%、40%),MDA 含量显著增加(P<0.01)。至14 d,MDA 含量并未随渗滤液浓度上升而发生统计学变化(图 3a)。图 3b表明,处理组SOD 活性(除5%处理组)在渗滤液暴露7d时均显著性被抑制(P<0.01),5%、10%、20%处理组均在14 d 观察到统计学差异(P<0.01)。另一方面,渗滤液浓度和暴露时间对CAT活性影响不大,所有处理组均未表现出统计学差异(图 3c)。而POD活性随渗滤液浓度的增加而逐渐升高(除5%处理组外),总体上呈浓度±赖性增加趋势(P<0.01),在40%处理组达到最高水平,暴露7 d和14 d时分别为对照组的311.3%和290.2%。
|
| 图 3 垃圾渗滤液暴露7 d和14 d对拟南芥脂质过氧化水平(MDA含量)、蛋白质羰基含量(SOD,CAT,POD)的影响 Figure 3 Effects of landfill leachate on lipid peroxidation levels(MDA content)and protein carbonyl content(including:SOD,CAT,and POD)in 7- and 14-day-exposed Arabidopsis |
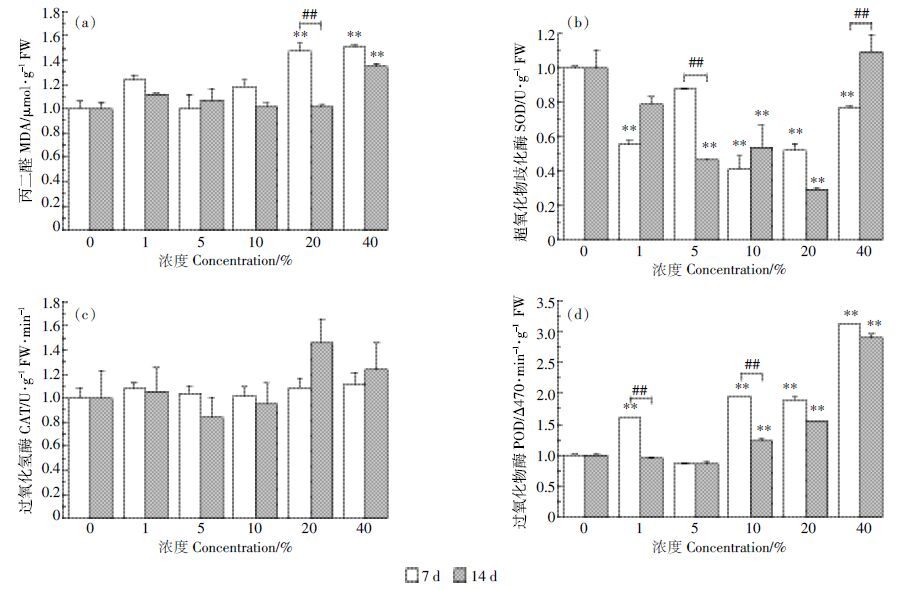
渗滤液暴露对拟南芥晚期的抽薹率(图 4a)和角果数(图 4b)也会造成影响。正常情况下,拟南芥在7周左右开始抽薹,其果实呈豆荚形。本研究中各实验组基本在7 周时抽薹,由图 4 可知,拟南芥的抽薹率和角果数随暴露浓度和生长时间的变化趋势相同。结果表明:低浓度渗滤液(1%)暴露会增加抽薹率和角果数;而高浓度渗滤液(10%、20%)会造成植物损伤,降低抽薹率和角果数。此外,随着时间的延续,1%处理组表现出较高的抽薹率和角果数,在抽薹5 d时抽薹率和角果数均显著高于对照组,15 d时角果数为对照组的128%;而20%处理组抽薹率极显著低于对照组,开花结果延迟,角果数量显著低于对照,15 d时抽薹率和角果数分别为对照的45%和43%。
|
| 图 4 垃圾渗滤液对拟南芥晚期抽薹率和角果数的影响 Figure 4 Effects of landfill leachate on bolting rates and pod number of Arabidopsis at later stage |
垃圾渗滤液含有多种无机、自然和外源性化合物等,其混合物会影响植物的生长[15]。我们的研究结果表明,渗滤液浓度和暴露时间会对拟南芥不同时期的生长发育造成影响。另外,低浓度渗滤液可促进其生长,高浓度渗滤液对其产生抑制效应,且暴露浓度越大抑制效应越明显。目前的研究可反映植被系统对渗滤液的响应特征,为渗滤液的植物监测提供理论±据。
渗滤液暴露浓度和暴露时间会影响植被系统的生长发育。一方面,渗滤液中含有植物所需要的营养元素(氮、磷等),因此低浓度、短时间的暴露会促进植物早期幼苗的生长发育[6-7, 16],可将其考虑作为一种“液体肥料”应用于农业方面;另一方面,渗滤液本身是一种成分复杂的有机废水,随渗滤液暴露浓度的增加,污染成分超标,必然会对植被系统造成损伤,抑制其生长。我们的研究结果表明,拟南芥可以轻微缓解低浓度渗滤液的压力,但随暴露浓度的增加其防御能力就会降低,从而抑制拟南芥种子萌发、幼苗根芽的生长。有研究表明,渗滤液所含微量污染物进入植物根尖分生区干扰了细胞的正常生理代谢,同时渗滤液胁迫后细胞内核的结构也会发生改变[17]。拟南芥根尖细胞中的核在渗滤液胁迫下处于固缩状态,影响了细胞分裂、细胞周期,还会影响基因转录、降低相关酶的合成或活性,从而造成细胞代谢紊乱,进一步影响种子的萌发代谢过程及根芽的生长。此外,由于根部是吸收营养元素的主要器官,也是富集污染物的首要部位,对于外界污染物的压力,根部比其他部位有更明显的响应。这也进一步揭示了渗滤液对拟南芥根系生长的抑制作用比芽更敏感。
渗滤液暴露还会影响成熟期拟南芥相关生理生化响应及氧化损伤效应。植物叶片中污染成分的积累±赖于蒸腾作用,高浓度渗滤液暴露抑制新叶的生长、光合作用、新陈代谢等一系列生理活动。随渗滤液暴露浓度持续升高,拟南芥叶片数、株高和叶片鲜重的抑制作用逐渐显著。另外,叶绿素的合成需要多种物质的参与,氮、磷、钾、锰等营养元素起主要作用[18]。有研究报道,渗滤液盐度的增加会破坏植物中的色素,导致叶绿素含量降低[19]。重金属离子的富集,也会影响叶绿素合成酶的通路,进而改变酶的结构以及酶的活性和合成[20-21]。渗滤液中含有丰富的有机质和氮、磷、钾、锰等营养元素,在短时间(7 d)暴露后会促进植物的生长。随着暴露时间的延长(14 d),渗滤液中盐分和多种重金属离子等会在植物细胞中富集,降低多种酶的活性,进而抑制叶绿素的合成。
据报道,活性氧(ROS)作为一种正常氧代谢的副产物,在调节细胞信号和稳态中发挥重要作用。植物在外界压力的胁迫下,ROS 水平将显著升高[22],造成细胞结构的损害。MDA 是膜脂过氧化的最终分解产物,能直接反映出植物细胞膜受到损伤的程度。MDA含量越高,植物细胞膜脂过氧化程度越高,细胞膜受到的伤害越严重[23]。研究发现,渗滤液连续暴露后的成熟期拟南芥叶片中丙二醛含量显著升高,并且呈现出对暴露浓度和时间的双重±赖效应。由于高浓度、长时间的暴露,使大量的可溶性盐富集在植物体内,暴露时间越长富集的污染物浓度也越高,相应的毒害作用也就越加显著。植物在渗滤液胁迫下,会发生膜脂过氧化,为缓解和防御膜脂过氧化,植物体内的抗氧化酶系统被启动,以清除活性氧,保持体内环境平衡。SOD 用于清除生物体内O2-·,但同时会产生H2O2,而CAT和POD 主要酶促H2O2的分解,从而减少有害物质对细胞的氧化损伤[24]。本研究中,低浓度、短时间的渗滤液暴露,SOD 和CAT 的活性没有显著性变化,而诱导的POD活性清除过量的ROS,因此没有观察到氧化损伤效应。对于高浓度和长时间的渗滤液暴露,CAT活性不变,而POD 活性升高同时抑制了SOD活性。渗滤液中含有的多种金属离子,刺激了植物机体内的抗氧化酶系统,诱使SOD 活性增大,清除多余的氧自由基,但过多的氧自由基又反过来抑制SOD的活性。在SOD 清除多余的氧自由基的同时,也使植物体内富集了大量的过氧化氢,诱使CAT 活性升高,机体为了维持自由基产生和清除的平衡,抵制植物机体的氧化损伤,在复合污染物的胁迫过程中POD 被激活的程度最大,且持续时间最长。
拟南芥在经过特殊处理(如辐射处理、化学处理和转基因)后,其基因很容易发生突变[25]。通过诱导突变处理,在一定程度上影响了拟南芥的生长、开花和果实的发育[26-27]。本研究中,抽薹率和角果数随暴露浓度的变化情况表明高浓度渗滤液中含有的多种金属离子和高分子有机化合物在拟南芥体内积累,可能引发基因突变,导致其不育,一方面抑制了拟南芥的抽薹率,另一方面使抽薹后的拟南芥植株花药不能开裂,花粉败育,最终可能导致基因的突变,严重影响拟南芥的繁殖。
4 结论目前的研究结果表明:垃圾渗滤液作为一种复合污染物,会影响拟南芥生长早期、成熟期、晚期各个阶段的生理生化及氧化损伤。渗滤液对早期阶段幼苗的萌发、根长、芽长以及晚期阶段的抽薹率和角果数均表现为:低浓度的渗滤液促进其生长,而高浓度渗滤液产生抑制效应。在成熟期,渗滤液影响拟南芥的叶片数目、株高、叶片鲜重及叶绿素含量;同时渗滤液以浓度±赖性方式诱导升高了叶片组织中的脂质过氧化水平,从而损伤其抗氧化防御系统。综上所述,垃圾渗滤液的毒性效应随暴露浓度和处理时间的变化而改变,进而影响拟南芥整个生命期的生长发育状态。
| [1] | Klauck R C, Rodrigues M A S, Silva L B. Toxicological evaluation of landfill leachate using plant(Allium cepa) and fish(Leporinus obtusidens) bioassays[J]. Waste Management & Research , 2013, 31 (11) : 1148. |
| [2] | Klauck R C, Rodrigues M A S, Silva L B. Evaluation of phytotoxicity of municipal landfill leachate before and after biological treatment[J]. Brazilian Journal of Biology , 2015, 75 (2) : 57–62. DOI:10.1590/1519-6984.1813 |
| [3] | Guerrero-Rodríguez D, Sánchez-Yáñez J M, Buenrostro-Delgado O, et al. Phytotoxic effect of landfill leachate with different pollution indexes on Common Bean[J]. Water, Air, & Soil Pollution , 2014, 225 (6) : 2002. |
| [4] | Sang N, Han M, Li G K, et al. Landfill leachate affects metabolic responses of Zea mays L. seedlings[J]. Waste Management , 2010, 30 (5) : 856–862. DOI:10.1016/j.wasman.2010.01.023 |
| [5] | Farzinebrahimi R, Taha R M, Rashid K A, et al. Effect of landfill leachate on Brassica chinensis dry matter weight and iron concentration[J]. International Journal of Environmental Science and Development , 2013, 4 (5) : 591–595. |
| [6] | Mojiri A, Aziz H A. Impacts of municipal waste leachate on accumulation of heavy metals in soil and barley(Hordeum vulgare L.)[J]. Retrieved March , 2012 : 1–7. |
| [7] | Sang N, Li G K, Xin X Y. Municipal landfill leachate induces cytogenetic damage in root tips of Hordeum vulgare[J]. Ecotoxicology and environmental safety , 2006, 63 (3) : 469–473. DOI:10.1016/j.ecoenv.2005.02.009 |
| [8] | Li G K, Yun Y. Effect of landfill leachate on cell cycle, micronucleus, and sister chromatid exchange in Triticum aestivum[J]. Journal of hazardous materials , 2008, 155 (1/2) : 10–16. |
| [9] | Ó'MaoiléidighD S, GracietE, WellmerF. Gene networks controlling Arabidopsis thaliana flower development[J]. New Phytologist , 2014, 201 (1) : 16–30. |
| [10] | 李得孝, 郭月霞, 员海燕, 等. 玉米叶绿素含量测定方法研究[J]. 中国农学通报 , 2005, 2 (6) : 153–155. LI De-xiao, GUO Yue-xia, YUAN Hai-yan, et al. Determine methods of chlorophyll from maize[J]. Chinese Agricultural Science Bulletin , 2005, 2 (6) : 153–155. |
| [11] | 熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003 : 72 -73. XIONG Qing-e. The experimental tutotial of plant physiology[M]. Chengdu: Sichuan Science and Technology Press, 2003 : 72 -73. |
| [12] | 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006 : 211 . GAO Jun-feng. Plant physiology experimental guidance[M]. Beijing: Higher Education Press, 2006 : 211 . |
| [13] | 赵世杰, 刘华山, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科技出版社, 2002 : 214 -219. ZHAO Shi-jie, LIU Hua-shan, DONG Xin-chun. The guidance of plant physiology[M]. Beijing: The Agricultural Science and Technology Press of China, 2002 : 214 -219. |
| [14] | 李合生, 孙群, 赵世杰. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000 : 164 -165. LI He-sheng, SUN Qun, ZHAO Shi-jie. Experimental principles and techniques of plant physiology and biochemistry[M]. Beijing: Higher Education Press, 2000 : 164 -165. |
| [15] | Zhang Q Q, Tiana B H, Zhanga X, et al. Investigation on characteristics of leachate and concentrated leachate in three landfill leachate treatment plants[J]. Waste Management , 2013, 33 (11) : 2277–2286. DOI:10.1016/j.wasman.2013.07.021 |
| [16] | Li G K, Yun Y, Sang N. Effect of landfill leachate on cell cycle, micronucleus, and sister chromatid exchange in Triticum aestivum[J]. Journal of Hazardous Materials , 2008, 155 (1-2) : 10–16. DOI:10.1016/j.jhazmat.2007.10.106 |
| [17] | 王忠. 植物生理学[M]. 北京: 中国农业出版社, 2000 . WANG Zhong. Plant physiology[M]. Beijing: China Agriculture Press, 2000 . |
| [18] | Hou X J, Hou H J M. Roles of manganese in photosystem Ⅱ dynamics to irradiations and temperatures[J]. Frontiers in Biology , 2013, 8 (3) : 312–322. DOI:10.1007/s11515-012-1214-2 |
| [19] | Muhammad S, Ashraf M, Akram N A, et al. Salt-induced modulation in growth, photosynthetic capacity, proline content and ion accumulation in sunflower(Helianthus annuus L.)[J]. Acta Physiologiae Plantarum , 2011, 33 (4) : 1113–1122. DOI:10.1007/s11738-010-0639-y |
| [20] | Lu X W, Yu L, Song X L, et al. Effect of heavy metal Cr on chlorophyll synthesis in wheat[J]. Agriculture and Technology , 2007, 27 (4) : 60–63. |
| [21] | 张露洁, 兰利琼, 卿人伟, 等. 几种重金属离子对组培值叶薯蓣叶绿素含量的影响[J]. 四川大学学报(自然科学版) , 2006, 43 (1) : 200–205. ZHANG Lu-jie, LAN Li-qiong, QING Ren-wei, et al. Study on the impact of a several heavy metals ion to the chlorophyll content of tissue cultured Dioscorea zingiberensis[J]. Journal of Sichuan University(Natural Science Edition) , 2006, 43 (1) : 200–205. |
| [22] | Shinde A, Jayashree G, Pankaja N. Effect of free radicals & antioxidants on oxidative stress:A review[J]. Journal of Dental and Allied Sciences , 2012, 1 (2) : 63–66. DOI:10.4103/2277-4696.159144 |
| [23] | 朱涵毅, 陈益军, 劳佳丽, 等. 外源NO对镉胁迫下水稻幼苗抗氧化系统和微量元素积累的影响[J]. 生态学报 , 2013, 33 (2) : 603–609. DOI:10.5846/stxb ZHU Han-yi, CHEN Yi-jun, LAO Jia-li, et al. The effect of exogenous nitric oxide on activities of antioxidant enzymes microelements accumulation of two rice genotypes under cadmium stress[J]. Acta Ecologica Sinica , 2013, 33 (2) : 603–609. DOI:10.5846/stxb |
| [24] | 陈世军, 张明生, 韦美玉. SNP处理的辣椒幼苗对Cd2+胁迫的生理响应[J]. 植物生理学通讯 , 2009, 45 (3) : 229–232. CHEN Shi-jun, ZHANG Ming-sheng, WEI Mei-yu. Physiological response of Capsicum frutescens L.var.longum bailey seedling with SNP to Cd2+ stress[J]. Plant Physiology Communications , 2009, 45 (3) : 229–232. |
| [25] | Cao Y Z. Model organisms Series-Arabidopsis//genetic analysis of Arabidopsis and Arabidopsis Genome[M]. Beijing: Higher Education Press, 2004 : 32 -66. |
| [26] | Zhou Y P, Chen Q H, Luo T W, et al. Identification of a novel male sterile mutant of Arabidopsis[J]. Journal of Hubei Institute for Nationalities(Natural Science Edition) , 2008, 26 (3) : 256–260. |
| [27] | Tian C E, Zhou Y P, Liu S Z, et al. Isolation of a mutant of Fer1 gene, acting synergistically with arf8 gene to control development of anther and filament in Arabidopsis[J]. Journal of Integrative Plant Biology , 2005, 47 (3) : 327–333. DOI:10.1111/jipb.2005.47.issue-3 |
 2016, Vol. 35
2016, Vol. 35