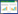文章信息
- 侯时季, 李涛, 蔺阁, 陈保冬
- HOU Shi-ji, LI Tao, LIN Ge, CHEN Bao-dong
- 施用沼液和接种丛枝菌根真菌对甘草生长及重金属累积的影响
- Effects of biogas slurry and AM fungi on growth and heavy metal accumulation of licorice plants
- 农业环境科学学报, 2016, 35(8): 1465-1472
- Journal of Agro-Environment Science, 2016, 35(8): 1465-1472
- http://dx.doi.org/10.11654/jaes.2016-0117
文章历史
- 收稿日期: 2016-01-24
甘草(Glycyrrhiza uralensis Fisch)为豆科(Legu原minosae)甘草属多年生草本植物,是一种重要的补益中草药,同时也是制药业以及食品保健业的重要原材料[1]。甘草适应性强,具有耐旱、抗寒和耐盐碱等优良特性,因此是干旱和半干旱地区重要的植物资源,可作为地方经济作物或用于生态恢复[2]。近几年来,随着对甘草需求量的增多,野生甘草面临着过度采撷和资源耗竭的威胁,甘草的人工种植日益受到重视并得到发展。然而,如何提高人工种植甘草的产量并保障产品品质等诸多问题仍有待解决[3]。常规施肥能显著提高甘草产量,但会增加人工种植成本,而且可能造成土壤板结[4]。沼液作为厌氧发酵的副产物,含有植物生长所需的多种养分,而且成本十分低廉。诸多试验表明,沼液作为肥料施于土壤,可提高土壤中有机质和矿质养分含量,从而促进农作物增产[5-8]。不过,也有研究报道指出,因为厌氧发酵原料来源较为复杂,沼液中可能含有一定量的重金属等有毒有害物质,在施用过程中有二次污染风险,进而可能引起农产品质量安全问题[9-11]。
丛枝菌根(Arbuscular mycorrhiza,AM)真菌是广泛存在于陆地生态系统中的一类土壤真菌,能与绝大多数陆地高等植物形成互惠共生体系[12]。AM 根外菌丝网络加强了土壤植物系统中的物质循环、能量流动和信息传递,对于维持土壤生态系统稳定具有不可替代的重要作用[12]。大量研究表明,AM 共生体系能有效促进宿主植物对矿质养分(尤其是磷)的吸收与利用,因而对宿主植物具有重要促生作用[13-15]。此外,AM 真菌还能通过不同途径影响植物对重金属的吸收和累积,减轻重金属对植物的毒害[16]。在重金属污染土壤中,AM 共生体系能够对宿主植物产生保护效应,这对于降低重金属污染风险及修复污染土壤均具有重要意义[17]。
已有研究表明,接种AM真菌能够促进甘草生长[18]。然而,施用沼液结合接种AM 真菌能否协同促进甘草生长并有效控制重金属污染风险,尚未见报道。基于此,本研究通过室内盆栽试验考察不同沼液添加水平及接种AM 真菌对甘草生长以及土壤理化性质的影响,以期为建立高产优质高效的甘草人工种植体系提供技术支撑。
1 材料与方法 1.1 试验材料供试植物:乌拉尔甘草(Glycyrrhiza uralensis Fisch)种子从新疆康隆农业科技发展有限公司购得。
菌剂:AM 真菌(Rhizophagus intraradices Błaszk.,Wubet,Renker,and Buscot BGC AH01)原始菌剂由北京市农林科学院植物营养与资源研究所提供。试验用菌剂通过盆栽苜蓿扩繁获得,接种剂为含有菌根真菌孢子、宿主植物根段以及培养基质的混合物,每克菌剂大约含有80个孢子。
培养基质:供试土壤取自内蒙古多伦(42°02'N,116°17'E),其基本理化性质如下:pH 7.02(土水比,1:2.5),有机质含量1.78%,最大田间持水量24.24%,速效磷6.73 mg·kg-1,总氮0.85 g·kg-1。测定方法参考鲍士旦(2000)。土壤过2 mm 筛后,送至中国农业科学院原子能所辐照中心进行辐照灭菌(60Co,γ射线25kGy)。培养基质为土壤和石英砂(过2 mm筛)按质量比1:1 混合而成。除非特别注明,文中“土壤”即指此混合培养基质。
沼液来源:沼液是由内蒙古自治区鄂尔多斯市东胜区工业和生活垃圾分选出的有机物料经过厌氧发酵过滤后得到的液体。沼液pH 7.6,有机质含量0.46%,总磷25.9 mg·L-1,总氮1146 mg·L-1,铬185.8mg·L-1,铜276.8 mg·L-1,铅313.0 mg·L-1,锌62.1 mg·L-1,镉0.036 mg·L-1,砷0.023 mg·L-1。沼液过滤后经高压蒸汽灭菌(121℃,30 min)待用。
1.2 试验设计 1.2.1 接种处理和沼液处理以容积700 mL 的PVC 管(口径7 cm,高19 cm)为培养容器。接种处理每盆加入800 g 土壤和20 g接种剂,而非接种处理每盆加入800 g 土壤和20 g灭菌处理后的接种剂,并添加15 mL 菌种滤液,以保证除AM 真菌之外接种和不接种处理有基本一致的微生物群落。
甘草种子经催芽处理,每盆播种3 颗种子,出苗后2周每盆间留一株幼苗。自出苗后第25 d开始,每10 d按不同沼液稀释比添加一次沼液,每次添加10mL,在植物收获前总共添加5 次,最后一次于收获前10 d添加。试验设置5 个沼液浓度梯度,沼液稀释比(沼液/去离子水体积比)分别为10/0、9/1、5/5、1/9、0/10。参照农田灌溉水质标准GB 5084—1992,沼液稀释比(沼液/去离子水体积比)为10/0、9/1、5/5 时,该沼液中铬、铜和铅含量超标,因此本试验考虑将这三种重金属的含量作为评判土壤污染及植物重金属毒害的分析指标。在每个沼液浓度下设接种菌根真菌(Mycorrhiza)和不接种对照(Control)处理。总共10 个处理,每个处理重复4 次。试验过程中所有盆钵完全随机排列且每周定期重排。
1.2.2 试验管理试验在人工气候室中进行。试验期间室内昼夜温度为25℃/20℃,每天光照时间16 h,光强约700μmol·m-2·s-1,相对湿度60%。每日称重浇水保持土壤15%的含水量(大约田间持水量的60%)。
1.3 测定指标及方法植物生长75 d后,分别收获地上部和根系,并取土样。植物样品用去离子水清洗干净,取新鲜根系(0.5 g)用作菌根侵染强度测定,另取新鲜叶片(0.5 g)用作叶片叶绿素含量测定,其余植物样品于105℃杀青30 min,然后于70℃烘干48 h至恒重后称取干重。叶片叶绿素含量采用比色法测定。植物磷和重金属(Cr、Cu、Pb)浓度的测定采用微波消解进行样品前处理,ICP-MS(7500a Agilent Technologies,Palo Alto,CA,USA)进行样品分析,同时采用国家一级标准物质灌木枝叶(GBW07603)进行分析质控。甘草根系菌根侵染状况采用Trypan blue 染色-镜检法[19]观测,用方格交叉法计算菌根侵染率[20]。
土壤有机质含量采用重铬酸钾氧化法测定。土壤全磷和重金属(Cr、Cu、Pb)含量采用微波消解进行样品前处理,ICP-MS 进行样品分析,同时采用中国地质科学院地球物理化学勘探研究所的土壤标准样品(GBW07406)进行分析质控。
1.4 数据分析采用SPSS(SPSS18.0forWindows,SPSSInc,Chicago,USA)和Microsoft Excel®对试验数据进行统计分析和作图。采用双因素方差分析检验接种处理、沼液处理及二者交互作用的显著性。当交互作用显著时,采用最小显著性差异法(LSD)将全部处理统一进行多重比较。当接种处理与沼液处理交互作用不显著时,则将试验数据按试验因素分组进行多重比较。
2 结果与分析 2.1 菌根侵染情况试验条件下,AM 真菌对甘草根系形成良好侵染,接种处理菌根侵染率在25.0%~48.4%之间,而对照处理未观测到菌根侵染迹象(表 1)。添加沼液处理显著降低了菌根侵染率,菌根侵染率总体上随沼液浓度的升高而降低。未添加沼液处理(0/10)菌根侵染率最高,约为沼液原液处理(10/0)的2 倍。
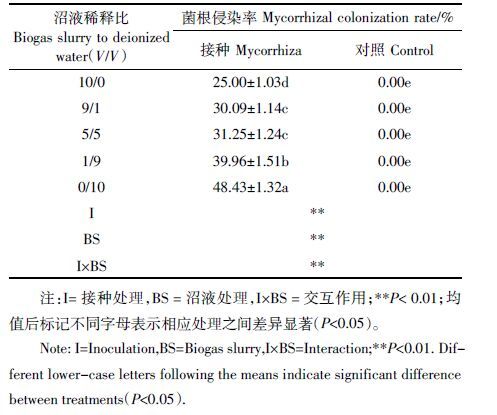 |
总体上,接种处理显著提高了甘草生物量、磷浓度及叶片叶绿素含量(图 1)。相同沼液处理下,接种处理植物地上部干重、根系干重、地上部磷浓度、根系磷浓度及叶片叶绿素含量与对照相比分别提高264%~330%、39%~256%、22%~128%、127%~156%和98%~127%。沼液处理显著提高了根系磷浓度和叶片叶绿素含量,沼液稀释比10/0 和9/1处理下根系磷浓度和叶片叶绿素含量显著高于其他沼液添加水平。接种处理和添加沼液对根系生物量、地上部磷浓度和叶片叶绿素含量存在显著交互作用(表 2)。沼液稀释比10/0和9/1 处理下,接种处理根系生物量及地上部磷浓度显著高于其他处理,而沼液稀释比10/0 处理下接种处理的叶绿素含量显著高于其他处理。总体上在高浓度沼液处理下,接种处理和对照处理之间的差异相比低浓度沼液处理下的差异更为显著。
|
| 图 1 不同处理下甘草植株生物量(A)、磷浓度(B)及叶片叶绿素含量(C) Figure 1 Plant dry weights(A),P concentrations(B)and leaf chlorophyll content(C)of licorice plants under different experimental treatments 柱形上方不同字母表示处理之间差异显著(P<0.05)。当接种处理与沼液处理交互作用显著时,所有处理统一进行多重比较,以不同小写 字母(a, b, c…)标示处理之间的差异显著性。当交互作用不显著时,以小写字母(a, b, c…)和(a´, b´, c´…)分别标示接种和对照处理下 不同沼液处理之间的差异显著性;以# 标示相同沼液处理下接种和对照处理之间的差异显著性 |
 |
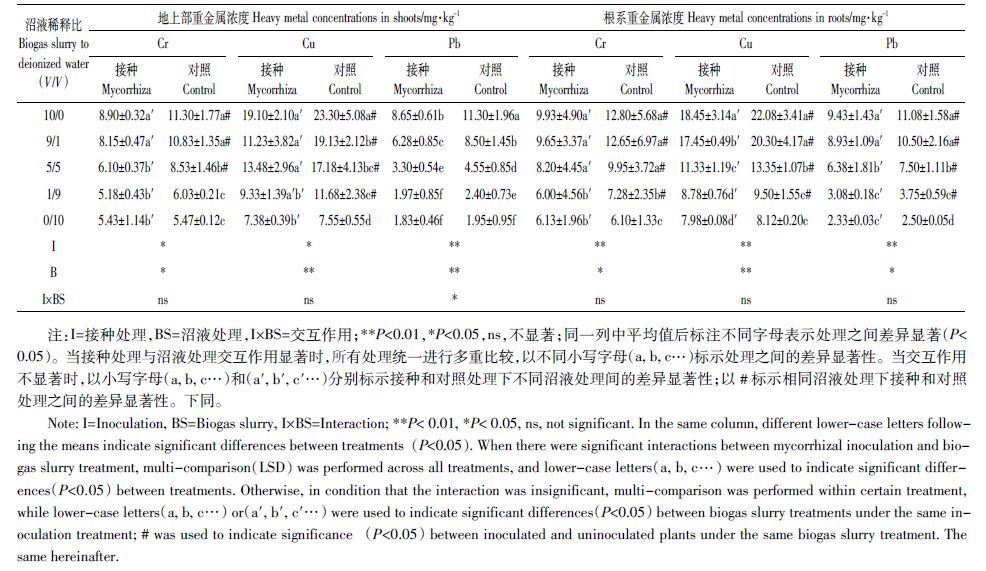
总体上甘草植株中3 种重金属浓度随沼液浓度升高而升高,添加沼液处理使地上部Cr、Cu和Pb 浓度分别提高了10%~107%、55%~209%和23%~480%,使根系Cr、Cu 和Pb 浓度分别提高了19%~110%、17%~172%和50%~343%(表 3)。与此相对照,接种处理显著降低了植株中3 种重金属的浓度,地上部Cr、Cu 和Pb 浓度分别降低了27%~40%、22%~70%和22%~38%,根系Cr、Cu 和Pb 浓度分别降低了21%~31%、8%~20%和18%~22%(表 3)。
 |
添加沼液处理显著提高了土壤有机质和全磷含量,增加幅度分别为5%~21%和5%~28%(表 4)。接种处理只在沼液稀释比9/1、5/5 和1/9 水平下显著提高了土壤有机质含量。
添加沼液显著提高了土壤中重金属浓度,使土壤Cr、Cu 和Pb 浓度分别提高了1%~11%、1%~14%和2%~15%(表 5)。接种处理对土壤重金属含量无明显影响。
 |
试验结果显示,施用沼液显著抑制了AM 真菌对甘草的侵染(表 1)。这可能是由于沼液中富含养分物质抑制了菌根共生体的发育,也可能是沼液中所含的重金属等毒性物质对菌根共生体系的建成和发育产生了直接抑制作用。很多研究表明,土壤养分(尤其是磷)含量对AM 真菌生长和菌根共生体发育具有显著影响[21-22]。另一方面,重金属的植物毒性和对AM真菌的直接生理毒害,也会抑制菌根侵染[23-24]。尽管如此,本试验中添加沼液并未完全抑制AM 真菌侵染,甚至在施用最高浓度沼液情况下,菌根侵染率仍维持在25%左右,表明AM 真菌具有较强的耐逆能力。
总体上,AM 共生体系对甘草表现出显著促生作用,接种处理大幅度地提高了植物生物量(图 1A),与之前很多有关AM 真菌促进宿主植物生长的研究结果一致[25-26]。多数研究表明,AM 真菌对植物的促生作用与其改善植物磷营养状况密不可分[27]。AM 根外菌丝可直接从土壤中吸收无机磷,同时菌根分泌物(如磷酸酶和有机酸等)也能矿化有机磷,因而能够帮助宿主植物获取生长所需的磷素[27-28]。接种处理显著提高了甘草地上部和根系磷浓度(图 1B),也很好地解释了菌根对植物的促生作用。另一方面,光合作用是植物成长过程中的基础代谢过程,植物光合作用强弱与叶片叶绿素含量直接相关。众多研究发现,菌根共生体系能通过提高叶片叶绿素含量来增强植物光合作用[29-32]。本试验中接种处理显著提高了叶片叶绿素含量(图 1C),显然对植物生长也起到促进作用。
尽管在沼液稀释比10/0 和9/1 处理下甘草根系磷浓度显著升高(图 1B),但单独施用沼液并未显著促进甘草生长(图 1A)。这可能是由于沼液中所含重金属对甘草生长产生抑制作用,一定程度上抵消了改善磷营养的积极作用。此外,沼液中养分形态多为有机组分不易为植物利用(植物主要吸收无机养分),而只有在菌根真菌的帮助下才能有效活化利用这部分养分。不过,适量施用沼液促进植物生长的潜力仍是不容忽视的,特别是本试验中添加沼液和接种AM 真菌对根系生物量、根系磷浓度以及叶片叶绿素含量表现出显著交互作用,在高浓度沼液处理下,AM 真菌的促生作用更为显著(图 1),表明沼液和AM 真菌能够协同促进甘草生长。大量研究表明,由于AM 真菌对植物的促生作用主要与促进植物磷吸收有关,当培养基质中磷含量增加但植物利用效率较低的情况下,AM 真菌可通过对磷的特殊活化吸收及转运机制[27],有效改善植物磷营养,最终促进宿主植物生长。
作为一种药用植物,甘草主要用于医药及食品行业,因此甘草植株重金属含量和甘草相关产品的安全性密切相关。本试验表明,尽管沼液能提升土壤肥力并促进甘草生长,但因其含有一定量的重金属而为甘草生产埋下安全隐患[9, 11, 33],尤为重要的则是防患于未然。尽管本试验所用沼液具有污染土壤的风险,但按一定配比稀释后施用,土壤重金属浓度均在国家土壤质量标准GB 15618—2008安全范围内。然而,需要注意的是由于土壤重金属污染具有累积效应,而本试验仅向土壤中添加了5次沼液,若增加添加次数则有可能超出土壤安全阈值。后续工作还需要明确在保障土壤安全前提下允许的沼液添加量。
本试验中甘草植株Cr、Cu、Pb 浓度均随沼液浓度的升高而升高,且在沼液稀释比9/1 处理下,未接种甘草地上部Cr、根系Cu 和Pb 分别超出《中国药典》甘草重金属含量安全标准(2015 年版)8%、3%和5%;在沼液稀释比10/0 处理下,未接种甘草地上部Cr、Cu、Pb 和根系Cu、Pb 分别超出安全标准13%、33%、13%、21%和11%。与此相对照,接种AM 真菌使甘草地上部和根系Cr、Cu、Pb 大幅度下降(表 3),并且接种处理下植株Cr、Cu 和Pb 浓度均在安全范围以内。众多研究发现,AM 能影响土壤中重金属的生物有效性,并通过不同途径影响植物对重金属的吸收和累积[17]。菌根能够通过菌丝体的吸附固持作用,强化根系对重金属的屏障效应,降低植物体内重金属浓度[34-35]。尽管也有一些研究表明,在特定条件下菌根共生体系可能促进植物对重金属的吸收并提高植物体内重金属浓度[36-37],但本试验证实AM 能有效降低甘草重金属浓度,从而消除或降低施用沼液可能带来的重金属污染风险。因此,施用沼液和接种AM 真菌相结合在很大程度上有利于建立经济安全高效的甘草人工种植体系。
4 结论沼液和AM 真菌联合应用能够协同促进甘草生长,同时保障甘草重金属含量在安全范围内。本研究为构建高产优质高效的甘草种植体系提供了一种可能的技术途径。考虑到本试验周期较短(76 d),而甘草是多年生植物,仍有必要开展长期试验及更接近自然情形的田间试验,系统研究沼液和AM 真菌应用于甘草种植和生产体系的综合效益。
| [1] | 张利. 甘草的药理作用及现代研究进展[J]. 中医临床研究 , 2014, 10 : 147–148. ZHANG Li. A review on pharmacological effects of licorice[J]. Clinical Journal of Chinese Medicine , 2014, 10 : 147–148. |
| [2] | 李昂, 张鸣, 蔺海明, 等. 西北风蚀区种植甘草对地表微环境和土壤物理性状的影响[J]. 干旱区资源与环境 , 2014 (10) : 128–132. LI Ang, ZHANG Ming, LIN Hai-ming, et al. Effects of Glycyrrhiza uralensis vegetation on the ground surface microenvironment and soil physical properties in wind erosion region in Northwest China[J]. Journal of Arid Land Resources and Environment , 2014 (10) : 128–132. |
| [3] | 王晓桃, 韩强. 优质甘草人工栽培技术[J]. 防护林科技 , 2012 (6) : 113–114. WANG Xiao-tao, HAN Qiang. Artificial cultivation technique of high quality Glycyrrhiza uralensis[J]. Protection Forest Science and Technology , 2012 (6) : 113–114. |
| [4] | 李海华, 青梅, 于娟, 等. 甘草的研究进展[J]. 内蒙古医科大学学报 , 2015 (2) : 199–204. LI Hai-hua, QING Mei, YU Juan, et al. Research progression of Glycyrrhiza uralensis[J]. Journal of Inner Mongolia Medical University , 2015 (2) : 199–204. |
| [5] | 奚辉, 薛智勇, 陈喜靖, 等. 沼液不同灌溉量对茭白产量、品质及土壤肥力的影响[J]. 浙江农业学报 , 2013 (6) : 1337–1341. XI Hui, XUE Zhi-yong, CHEN Xi-jing, et al. Effect of different biogas slurry irrigation amounts on the yield and quality of Zizania caduci-flora and soil fertility[J]. Acta Agriculturae Zhejiangensis , 2013 (6) : 1337–1341. |
| [6] | 李胜利, 夏亚真, 刘金, 等. 沼液与钾钙耦合对黄瓜叶绿素荧光参数、产量及品质的影响[J]. 河南农业科学 , 2013 (11) : 106–110. LI Sheng-li, XIA Ya-zhen, LIU Jin, et al. Effects of coupling of biogas slurry, potash and calcium fertilizer on chlorophyll fluorescence parameters, yield and quality of cucumber[J]. Journal of Henan Agricultural Sciences , 2013 (11) : 106–110. |
| [7] | 伍钧, 王静雯, 张璘玮, 等. 沼液对玉米产量及品质的影响[J]. 核农学报 , 2014 (5) : 905–911. WU Jun, WANG Jing-wen, ZHANG Lin-wei, et al. Effects of biogas slurry on yield and quality of maize[J]. Journal of Nuclear Agricultural Sciences , 2014 (5) : 905–911. |
| [8] | 胡福初, 何凡, 范鸿雁, 等. 沼液对荔枝果园土壤肥效及果实产量与品质的影响[J]. 广东农业科学 , 2014 (1) : 42–45. HU Fu-chu, HE Fan, FAN Hong-yan, et al. Effects of biogas slurry on the soil fertility, fruit yield and quality in litchi orchard[J]. Guangdong Agricultural Sciences , 2014 (1) : 42–45. |
| [9] | Bian B, Lv L, Yang D, et al. Migration of heavy metals in vegetable farmlands amended with biogas slurry in the Taihu Basin, China[J]. Ecological Engineering , 2014, 71 : 380–383. DOI:10.1016/j.ecoleng.2014.07.026 |
| [10] | Bian B, Wu H S, Lv L, et al. Health risk assessment of metals in food crops and related soils amended with biogas slurry in Taihu Basin:Perspective from field experiment[J]. Environmental Science and Pollution Research International , 2015, 22 (18) : 14358–14366. DOI:10.1007/s11356-015-4853-4 |
| [11] | Bian B, Wu H S, Zhou L J. Contamination and risk assessment of heavy metals in soils irrigated with biogas slurry:A case study of Taihu basin[J]. Environmental Monitoring and Assessment , 2015, 187 (4) : 1–15. |
| [12] | Smith S E, Read D. Mycorrhizal symbiosis[M]. San Diego: Academic Press, 2008 : 148 -158. |
| [13] | Schnepf A, Jones D, Roose T. Modelling nutrient uptake by indicidual hyphae of arbuscular mycorrhizal fungi:Temporal and spatial scales for an experimental design[J]. Bulletin of Mathematical Biology , 2011, 73 (9) : 2175–2200. DOI:10.1007/s11538-010-9617-1 |
| [14] | Balzergue C, Puech-Pagès V, Bécard G, et al. The regulation of arbuscular mycorrhizal symbiosis by phosphate in pea involves early and systemic signalling events[J]. Journal of Experimental Botany , 2011, 62 (3) : 1049–1060. DOI:10.1093/jxb/erq335 |
| [15] | WEI Li-li, LU Chang-yi, DING Jing, et al. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system[J]. Acta Ecologica Sinica , 2016 . DOI:10.5846/STXB201412042407 |
| [16] | Wu S L, Zhang X, Chen B D, et al. Chromium immobilization by extraradical mycelium of arbuscular mycorrhiza contributes to plant chromium tolerance[J]. Environmental and Experimental Botany , 2016, 122 : 10–18. DOI:10.1016/j.envexpbot.2015.08.006 |
| [17] | 伍松林, 张莘, 陈保冬. 丛枝菌根对土壤-植物系统中重金属迁移转化的影响[J]. 生态毒理学报 , 2013 (6) : 847–856. WU Song-lin, ZHANG Xin, CHEN Bao-dong. Effects of arbuscular mycorrhizal fungi on heavy metal translocation and transformation in the soil-plant continuum[J]. Asian Journal of Ecotoxicology , 2013 (6) : 847–856. |
| [18] | 孙跃春, 郑小亮, 刘昕旸, 等. 盐碱条件下接种丛枝菌根真菌对甘草种苗生长的影响[J]. 安徽农业科学 , 2013, 25 : 10284–10285. SUN Yue-chun, ZHENG Xiao-liang, LIU Xin-yang, et al. Effects of inoculation with arbuscular mycorrhizal fungi on the growth of Glycyrrhiza Uralensis fisch in saline-alkaline soil[J]. Journal of Anhui Agricultural Sciences , 2013, 25 : 10284–10285. |
| [19] | Phillips J M, Hayman D S. Improved procedure of clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society , 1970, 55 : 159–161. |
| [20] | Biermann B, Linderman R G. Quantifying vesicular-arbuscular mycorrhizae:A proposed method towards standardization[J]. New Phytologist , 1981, 87 : 63–67. DOI:10.1111/nph.1981.87.issue-1 |
| [21] | Chen Y L, Zhang X, Ye J S, et al. Six-year fertilization modifies the biodiversity of arbuscular mycorrhizal fungi in a temperate steppe in Inner Mongolia[J]. Soil Biology & Biochemistry , 2014, 69 : 371–381. |
| [22] | Verbruggen E, Xiang D, Chen B D, et al. Mycorrhizal fungi associated with high soil N:P ratios are more likely to be lost upon conversion from grasslands to arable agriculture[J]. Soil Biology & Biochemistry , 2015, 86 : 1–4. |
| [23] | Liu H, Yuan M, Tan S Y, et al. Enhancement of arbuscular mycorrhizal fungus(Glomus versiforme) on the growth and Cd uptake by Cd-hyperaccumulator Solanum nigrum[J]. Applied Soil Ecology , 2015, 89 : 44–49. DOI:10.1016/j.apsoil.2015.01.006 |
| [24] | Chen B D, Zhu Y G, Zheng X, et al. The influence of mycorrhiza on uranium and phosphorus uptake by barley plants from a field-contaminated soil[J]. Environmental Science and Pollution Research , 2005, 12 (6) : 325–331. DOI:10.1065/espr2005.06.267 |
| [25] | Sarkar A, Asaeda T, Wa ng, Q Y, et al. Arbuscular mycorrhizal influences on growth, nutrient uptake, and use efficiency of Miscanthus sacchariflorus growing on nutrient-deficient river bank soil[J]. Environmental Science and Pollution Research , 2015, 212 : 46–54. |
| [26] | Schneider K D, Lynch D H, Dunfield K, et al. Farm system management affects community structure of arbuscular mycorrhizal fungi[J]. Applied Soil Ecology , 2015, 96 : 192–200. DOI:10.1016/j.apsoil.2015.07.015 |
| [27] | Bagyaraj D J, Sharma M P, Maiti D. Phosphorus nutrition of crops through arbuscular mycorrhizal fungi[J]. Current Science , 2015, 108 (7) : 1288–1293. |
| [28] | 童琳, 唐旭利, 张静, 等. 菌根形成对不同成熟度的森林优势树种磷吸收的影响[J]. 生态科学 , 2015, 34 (4) : 93–98. TONG Lin, TANG Xu-li, ZHANG Jing., et al. Influence of mycorrhizal formulation on phosphorus acquisition of dominant tree species in young forest and old-growth forest[J]. Ecological Science , 2015, 34 (4) : 93–98. |
| [29] | Wu Q S, Zou Y N, He X H. Contributions of arbuscular mycorrhizal fungi to growth, photosynthesis, root morphology and ionic balance of citrus seedlings under salt stress[J]. Acta Physiologiae Plantarum , 2010, 32 (2) : 297–304. DOI:10.1007/s11738-009-0407-z |
| [30] | 冉琼, 钟章成. 模拟岩溶旱钙土壤基质中AM真菌对玉米幼苗光合生长的影响[J]. 生态学报 , 2015 (2) : 460–467. RAN Qiong, ZHONG Zhang-cheng. Effect of AMF on the photosynthetic characteristics and growth of maize seedlings under the stress of drought, high calcium and their combination in Karst area[J]. Acta Ecologica Sinica , 2015 (2) : 460–467. |
| [31] | 田帅, 刘振坤, 唐明. 不同水分条件下丛枝菌根真菌对刺槐生长和光合特性的影响[J]. 西北林学院学报 , 2013, 28 (4) : 111–115. TIAN Shuai, LIU Zhen-kun, TANG Ming. Effects of arbuscular mycorrhizal fungi on growth and photosynthetic characteristics of Robinia pseudoacacia under different water conditions[J]. Journal of Northwest Forestry University , 2013, 28 (4) : 111–115. |
| [32] | 张中峰, 张金池, 黄玉清, 等. 接种丛枝菌根真菌对青冈栎幼苗生长和光合作用的影响[J]. 广西植物 , 2013, 33 (3) : 319–323. ZHANG Zhong-Feng, ZHANG Jin-Chi, HUANG Yu-Qing, et al. Effects of arbuscular mycorrhizal fungal inoculation on growth and photosynthesis of Cyclobalanopsis glauca seedlings[J]. Guhaia , 2013, 33 (3) : 319–323. |
| [33] | 牛伟, 鹿茸, 田琴, 等. 长期施沼肥对果园土壤肥力和苹果品质的影响研究[J]. 中国农学通报 , 2014 (10) : 243–246. NIU Wei, LU Rong, TIAN Qin, et al. Effect of long-term biogas residues application on soil physicochemical and apple quality[J]. Chinese Agricultural Science Bulletin , 2014 (10) : 243–246. |
| [34] | Wu S L, Chen B D, Sun Y, et al. Chromium resistance of dandelion(Taraxacum platypecidum Diels) and bermudagrass(Cynodon dactylon[Linn.] Pers.) is enhanced by arbuscular mycorrhiza in Cr(VI)-contaminated soils[J]. Environmental Toxicology & Chemistry , 2014, 33 (9) : 2105–2113. |
| [35] | Zhang X, Ren B H, Wu S L, et al. Arbuscular mycorrhizal symbiosis influences arsenic accumulation and speciation in Medicago truncatula L. in arsenic-contaminated soil[J]. Chemosphere , 2015, 119 : 224–230. DOI:10.1016/j.chemosphere.2014.06.042 |
| [36] | Yu Z H, Cheng J M, Wong M H. Earthworm-mycorrhiza interaction on Cd uptake and growth of ryegrass[J]. Soil Biology & Biochemistry , 2005, 37 : 195–201. |
| [37] | Chen X, Wu C H, Tang J J, et al. Arbuscular mycorrhizae enhance metal lead uptake and growth of host plants under a sand culture experiment[J]. Chemosphere , 2005, 60 (5) : 665–671. DOI:10.1016/j.chemosphere.2005.01.029 |
 2016, Vol. 35
2016, Vol. 35