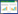文章信息
- 王玉梅, 柴如山, 郜红建
- WANG Yu-mei, CHAI Ru-shan, GAO Hong-jian
- 茶树根系跨膜主动吸收氟的表观特征
- Apparent characteristics of active transmembrane uptake of fluoride by tea plant roots
- 农业环境科学学报, 2016, 35(8): 1473-1479
- Journal of Agro-Environment Science, 2016, 35(8): 1473-1479
- http://dx.doi.org/10.11654/jaes.2016-0094
文章历史
- 收稿日期: 2016-01-20
茶树(Camellia sinensis(L.)O. Kuntze)是一种高富集氟植物,茶树根系吸收的氟主要在叶片中累积[1-2]。茶叶中的氟约80%以上均可溶解在茶汤中,饮茶摄氟成为人体吸收氟的重要途径[3]。适量的氟有助于人体骨骼发育,但是摄入过多的氟,可能会导致氟斑牙、氟骨病等氟中毒症状,茶树吸收氟的过程及对茶叶质量的影响引起了众多学者的关注。茶树吸收氟的过程受到外界氟浓度、pH 值和离子通道抑制剂等因素的影响。在低氟浓度下,茶树根系吸收溶液呈现一个主动吸收的规律,而在高氟浓度下,呈现出一个被动吸收的规律[4]。pH值影响茶树根部对氟的吸收,当培养液pH 值在4.0~6.0 之间时,茶树根系氟含量随着pH 值的增加先增加后减少,在pH 值为5.5 时达到最大[5]。Zhang 等[6]的研究发现,阴离子通道抑制剂(5-Nitro-2-(phenylpropylamino)-benzoate)、阳离子通道抑制剂(Tetramethylammonium chloride)和水通道抑制剂(HgCl2)均可减少茶树根系对氟的吸收,其中以阴离子通道贡献最大,这说明阴离子通道是外界氟进入茶树体内的重要途径。
研究表明,茶树根系可通过被动和主动吸收两种途径吸收介质中的氟,在高氟(50~100mg·L-1)条件下以被动吸收为主,而主动吸收过程是茶树富集氟的主要途径[4]。但是,有关载体蛋白、代谢能量和电化学势在茶树根系主要吸收氟的过程中的作用还缺少可靠的试验证据。
本文采用溶液培养法研究了不同氟浓度条件下茶树根系吸收氟的动力学特性,对比分析茶树体内与培养介质中氟浓度的差异;通过低温处理(4℃)和添加代谢抑制剂(2,4-DNP、叠氮钠和正钒酸钠)探究了茶树对氟的吸收过程与能量代谢的关系;利用氯离子作为陪伴离子,分析茶树根系氟与氯在跨膜吸收过程中的竞争关系。研究结果可为阐明氟在茶树根系跨膜主动吸收过程提供实验依据。
1 材料与方法 1.1 试剂与仪器本实验所用氟化钠、硝酸铵、磷酸二氢钾、氯化钾、氯化钠、二水合柠檬酸三钠、冰醋酸、2,4-DNP、叠氮钠和正钒酸钠等均为分析纯,购自上海国药集团化学试剂有限公司。奥立龙氟离子测量仪(配有9609BN原WP氟电极)购自美国热电公司;电热恒温水浴锅购自上海精宏实验设备有限公司;PHS-3C 精密pH 计购自上海精密科学仪器有限公司雷磁仪器厂。
1.2 试验方法 1.2.1 茶苗培养方法供试茶树品种为龙井43,采自合肥高新技术农业园内。精选颗粒饱满的茶籽在自来水中浸泡2 d后,选取健康茶籽定植于洗净的石英砂中(直径0.3cm),待种子发芽后,转移至人工气候室内培养。光照时间12 h·d-1,室温(22±1)益,光照强度约1500 lx,空气湿度45%~50%。待茶苗长至4~5片叶时,选长势一致的幼苗,用去离子水冲净根部,滤纸吸干表面水分后,转移到盛有1/4 浓度营养液的塑料盆(50 cm×30cm)中培养,改进的茶树水培标准营养液配方为:硝酸铵0.114 g·L-1,磷酸二氢钾0.013 6 g·L-1,氯化钾0.038 69 g·L-1,pH 值调节至5.00~5.50 之间[6-7],定时供气。待茶苗根系长出大量白色吸收根后,再继续水培1周进行试验处理。
1.2.2 茶树吸收氟的短时间动力学试验锥形瓶内加入250 mL 氟浓度为50 mg·L-1氟(以NaF 形态加入),用NaOH(0.1 mol·L-1)和H2SO4(0.1mol·L-1)将营养液pH值调至5.0。锥形瓶瓶口用脱脂棉封口,瓶体用黑色胶带包好遮光,以利于根系生长。茶苗在25℃恒温培养箱条件下培养0、8、16、24、48、72 h和96 h,每个处理设3 个重复。
1.2.3 茶树吸收氟的浓度动力学试验锥形瓶内分别添加氟浓度为0、0.25、0.5、1.0、2.5mmol·L-1和5.0 mmol·L-1氟(以NaF 形态加入),茶苗在25℃恒温培养箱中培养72 h,每个处理设3 个重复。其他培养条件同1.2.2。
1.2.4 氯离子对茶树吸收氟的影响锥形瓶内加入250 mL 氟浓度为5 mmol·L-1的营养液,同时加入氯离子浓度为5 mmol·L-1 NaCl,茶苗在25℃条件下培养72 h,以不含氯的处理为对照,每个处理设3个重复。其他培养条件同1.2.2。
1.2.5 培养温度对茶树吸收氟的影响锥形瓶内加入250 mL 氟浓度为5 mmol·L-1的营养液,培养温度分别设置为4℃和25℃,每个处理设3个重复。低温处理(4℃)时,先将营养液用冰浴预冷到4℃,并保持8 h,后移走冰浴,继续培养72 h[8]。其他培养条件同1.2.2。
1.2.6 代谢抑制剂对茶树吸收氟的影响锥形瓶内加入250 mL 氟浓度为5 mmol·L-1的营养液,同时分别进行不同代谢抑制剂处理,其中2,4-DNP 处理浓度设置为0、0.5、1.0 mmol·L-1 和2.0mmol·L-1;Na3VO4 的浓度设置为0、0.2、0.4 mmol·L-1和0.6 mmol·L-1;NaN3的浓度设置为0、0.05、0.1 mmol·L-1 和0.2 mmol·L-1。茶苗分别在不同代谢抑制剂和25℃条件下培养72 h,以不含代谢抑制剂的处理为对照,每个处理设3 个重复。其他培养条件同1.2.2。
1.3 氟的提取和测定方法培养结束后,将茶苗根系先用自来水冲洗,然后再用蒸馏水洗净,擦干,分为根、茎、叶置于烘箱中105℃杀青后,75℃烘干至恒重,分别测定茶苗根和叶中的氟含量。茶苗根和叶中氟的提取参照张显晨等[9]的方法:将茶苗根和叶充分研磨粉碎后,称取样品置于50 mL 离心管中,加入30 mL 超纯水,在100℃沸水浴中静置提取30 min。提取液中氟含量按照郜红建等[10]的方法测定:准确量取15 mL 提取液置于50 mL聚四氟乙烯烧杯中,再加入15 mL总离子强度缓冲液,将两者充分搅拌混匀后,用奥立龙氟离子测量仪测定提取液中氟离子浓度。总离子强度缓冲液由58 g氯化钠、68 g二水合柠檬酸三钠和57 mL 冰醋酸溶于700mL纯水,用5 mol·L-1 NaOH调节pH 值至5.0,再用纯水定容至1000 mL配制而成。
1.4 数据处理茶苗根系氟含量和累积量采用DPS 统计软件中单因素方差分析(ANOVA),组间差异用Tukey 法进行多重性比较,显著性检验水平(P)分别为0.05 和0.01,米氏方程采用Origin 9.0 软件进行拟合。
2 结果与分析 2.1 茶树吸收氟的短时间动态变化茶树根系氟含量随着培养时间的延长而不断升高(图 1),在0~24 h的培养时间内为快速吸收阶段。在培养到0、8、16 h和24 h时,茶树根系氟含量分别为64.5、137.3、149.4 mg·kg-1和153.4 mg·kg-1,而在随后的24~96 h的培养时间范围内呈现慢速吸收阶段。茶树根系氟含量在72 h时达到最大值262.7 mg·kg-1,为不供氟对照处理的4倍之多。茶树根系氟的累积量随着培养时间延长逐渐增加,并且在72 h达到最大值,分别为30.1 μg。这与茶树根系氟含量结果一致。本文选择72 h为茶树吸收氟的平衡时间,进行如下实验。
|
| 图 1 不同时间茶树吸收氟的动态变化 Figure 1 Dynamic changes of fluoride absorption by tea plant roots over time |
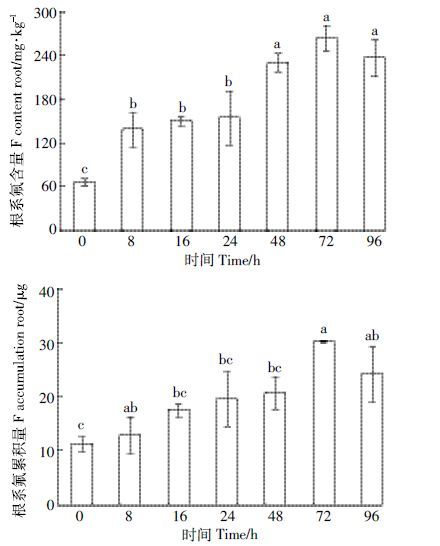
随着营养液中氟浓度的增加,茶树根系中氟的含量及累积量也随之升高(图 2)。在0~5.0 mmol·L-1的氟浓度范围内,茶树根系吸收氟的速率[单位时间全株总氟累积量/根部干重,μg·h-1·g-1(根DW)]以及根系氟的累积量均随供氟浓度的升高而快速增加,在2.5~5.0 mmol·L-1氟浓度范围内缓慢增加。当氟浓度为5.0 mmol·L-1时,茶树根系氟吸收速率和氟累积量均达到最大值,分别为13.9 μg·h-1·g-1(根DW)、32.3μg,但根系氟累积量与2.5 mmol·L-1供氟浓度下差异不显著。茶树对氟的吸收累积规律符合Michaelis-Menten 动力学模型,可以用米氏方程V=Vmax·c/(Km+c)进行描述,其中Vmax=13.9 μg·h-1·g-1(根DW),Km=0.59 mmol·L-1。根据根系吸收原理及酶动力学原理[11],Vmax表示载体饱和时所能达到的最大吸收速率,其值愈大,表示根系吸收离子的潜力愈大;Km为载体对吸收离子亲和力的倒数,其值愈小,说明茶树根系对氟离子的亲和力就越大,反之亦然。
|
| 图 2 茶树吸收氟的浓度动力学特性 Figure 2 Kinetic characteristics of fluoride concentrations on fluoride uptake by tea plant |
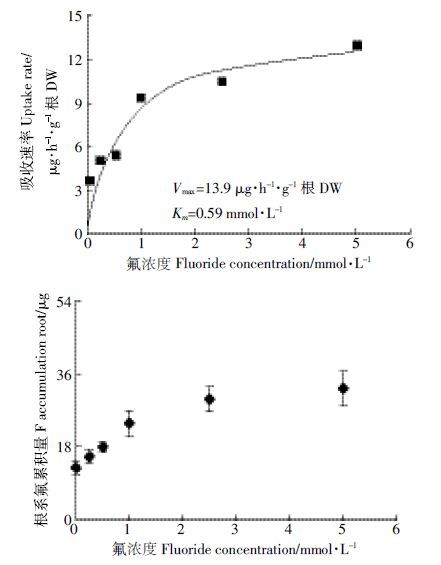
氟和氯在元素周期表中同属卤族元素,具有相似的化学结构。假设茶树在跨膜主动吸收氟和氯的过程中存在竞争关系。前期研究表明,在氯离子浓度不超过20mmol·L-1的情况下,氯离子不会对茶树造成毒害作用。当营养液氯浓度为5mmol·L-1时,明显抑制了茶树对氟离子的吸收(图 3),茶树根系氟含量(130.4mg·kg-1)比不加氯离子的对照下降了73.1%,茶树根系氟累积量为11.7μg,比对照下降了85.1%,达显著差异水平(P<0.05)。
|
| 图 3 氯对茶树吸收富集氟的影响 Figure 3 Effect of chloride on absorption and accumulation of fluoride in tea plant |
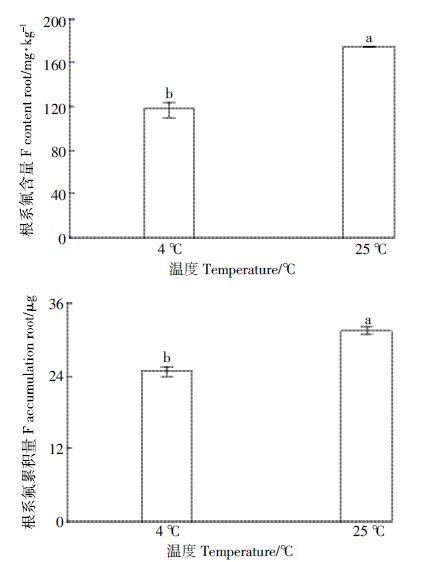
低温(4℃)明显抑制了茶树对氟离子的吸收(图 4)。在25℃和4℃培养条件下,茶树根系氟含量分别为173.56 mg·kg-1和115.9 mg·kg-1,根系氟的累积量分别为31.1、24.4 μg。与25℃培养条件下相比,4℃低温处理时茶树根系氟含量和累积量分别降低了49.8%、1.4%,均达显著性差异(P<0.05)。
|
| 图 4 温度对茶树吸收富集氟的影响 Figure 4 Effect of temperature on absorption and accumulation of fluoride in tea plant |
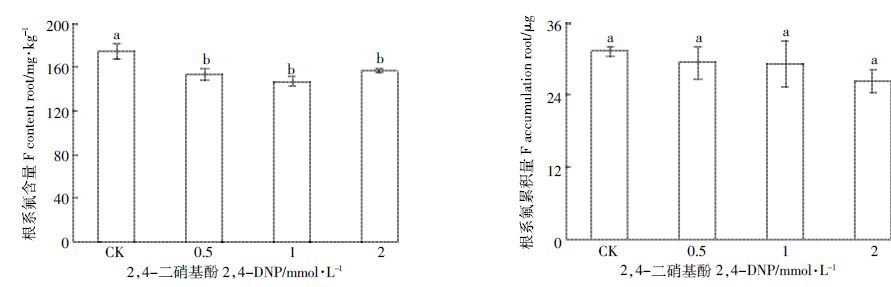
在2,4-DNP 处理浓度分别为0.5、1 mmol·L-1 和2mmol·L-1的条件下,茶树根系氟含量分别比对照降低了12.1%、16.1%和10.7%,达显著差异(P<0.05),茶树根系氟的累积量分别为31.1、29.3μg和26.2μg,分别比对照降低了5.8%、6.5%和15.8%,但差异不是很显著(图 5)。
|
| 图 5 2,4-DNP对茶树吸收富集氟的影响 Figure 5 Effect of 2,4-DNP on absorption and accumulation of fluoride in tea plant |
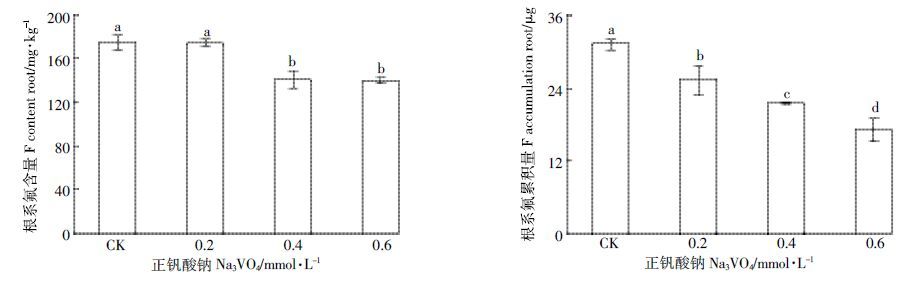
在正钒酸钠处理浓度为0.2 mmol·L-1的条件下,茶树根系氟的含量为172.3 mg·kg-1,对茶树根部氟吸收的抑制效应不明显(图 6)。当正钒酸钠浓度为0.6mmol·L-1 时,茶树根系氟含量、根系氟累积量分别为137.9 mg·kg-1、17.0 μg,分别比对照降低了20.6%、30.5%,达显著差异水平(P<0.05)。
|
| 图 6 正钒酸钠对茶树吸收富集氟的影响 Figure 6 Effect of Na3VO4 on absorption and accumulation of fluoride in tea plant |
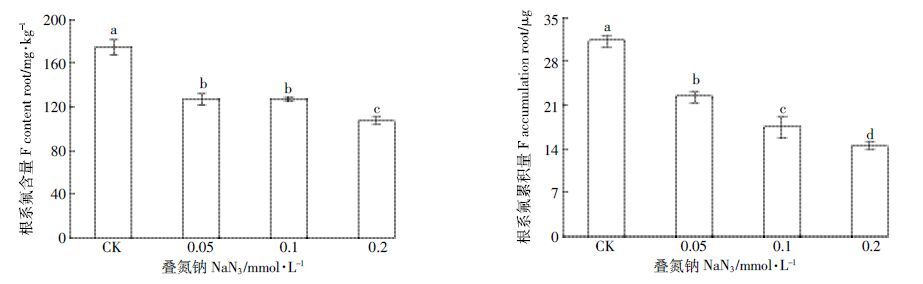
随着叠氮钠浓度的增加,茶树根系氟含量逐渐降低(图 7)。在叠氮钠浓度为0.05、0.1 mmol·L-1 和0.2mmol·L-1 的情况下,茶树根系氟含量分别为126.3、125.8 mg·kg-1 和105.8 mg·kg-1,分别比对照降低了27.3%、27.5%和39.1%,达显著差异水平(P<0.05)。茶树根系氟累积量为22.1、17.3、14.2 μg,分别比对照降低了28.8%、44.4%、54.3%,达显著差异水平(P<0.05)。
|
| 图 7 叠氮钠对茶树吸收富集氟的影响 Figure 7 Effect of NaN3 on absorption and accumulation of fluoride in tea plant |
氟离子进入茶树根部可能是主动运输过程,也可能通过被动吸收或者自由扩散,这取决于外界供氟条件[4, 12]。彭传燚等[4]研究得出,在0.1~10 mg·L-1的供氟浓度范围内,茶树根系对氟离子的吸收是主动吸收,并符合Michaelis-Menten动力学模型,而在高供氟条件(50~100 mg·L-1)下则表现出被动吸收的过程。Zhang等[12]的研究表明,氟浓度较低时,茶树对氟的吸收可能存在一个与能量代谢相关的主动吸收过程,氟浓度较高时,茶树对氟的吸收随外界氟浓度提高呈线性增长。本研究结果表明,在0~2.5 mmol·L-1 的供氟浓度范围内,茶树对氟的吸收为快速吸收阶段,在2.5~5.0mmol·L-1供氟浓度范围内为缓慢吸收阶段,这一吸收过程可用Michaelis-Menten 动力学方程进行描述,其中Vmax为13.9 μg·g-1· h-1(根DW),Km为0.59 mmol·L-1。被动吸收是一个非代谢扩散过程,而主动吸收是一个消耗能量,需要电化学势质子梯度和ATP结合蛋白-载体,或是受H+-ATP泵驱动的过程[7]。本文从代谢能量、载体和质子驱动力探究茶树根部主动吸收氟的途径及其特征。
载体蛋白是存在于细胞膜结构中起运输作用的蛋白质,是生物体主动吸收营养物质或主动排出代谢废物时所必需的[13]。载体蛋白在离子跨膜吸收/外排过程中存在竞争和饱和作用。竞争作用是指某一营养元素(或离子)的存在,能抑制另一营养元素(或离子)的吸收。主要表现在阳离子与阳离子之间或阴离子与阴离子之间。例如:Natasha 等[14]研究显示,NO-3可能会竞争质膜上的同一结合位点而抑制植物叶片中Cl-的浓度。Hopper 等[15]研究显示,SO42-与 SeO42-之间由于竞争同一结合位点而存在竞争效应。本文的研究结果表明,氯离子显著降低了茶树体内氟含量和累积量,这可能是因为氟离子与氯离子之间存在竞争作用有关。饱和效应是指植物吸收一种离子(或者化合物)达到最大吸收程度时,即使再增加相应离子(或者化合物)也不再吸收的现象。如:Zhang 等[16]研究表明,水稻根部吸收Se 时达到饱和效应,符合Michaelis-Menten米氏方程,其中Vmax 为4.5 μmol·kg-1·h-1 DW,Km为3.8 μmol·kg-1 DW。Peter 等[17]的研究数据表示,玉米根部吸收NO3-时,达到饱和动力学方程,其中Km为0.05mmol·L-1。本文结果显示,在0~5.0 mmol·L-1氟浓度范围内,茶树根部的吸收曲线符合Michaelis-Menten 米氏方程,其中最大吸收速率Vmax为13.9 μg·g-1·h-1(根DW),米氏常数Km 为0.59 mmol·L-1,说明茶树根部在吸收氟离子时呈现出载体动力学饱和效应。上述两种现象说明茶树根部在低氟浓度时是一个需要载体的主动吸收过程。
主动吸收过程中能量的作用就是为离子主动吸收提供所需的能源,主要来自ATP水解。低温通过降低合成ATP 所需的线粒体ATPase 和丙酮酸激酶的活性,而使腺苷酸,尤其是ATP 水平明显下降,从而导致代谢过程发生紊乱,使ATP 的利用速度明显超过合成速度[18]。Liang 等[8]研究显示,低温通过降低主动吸收所需的ATP 而抑制了黄瓜对硅的主动吸收。Zhan等[19]的研究结果表明,低温通过抑制能量代谢和膜运输过程来限制小麦对菲的主动吸收过程。本文研究结果表明,在低温(4℃)培养条件下,茶树根系吸收氟离子过程受到明显抑制,这可能是因为低温抑制了线粒体ATPase 活性,阻碍了ATP 的合成,从而导致茶树主动吸收氟离子减少。
2,4-DNP 作为一种主要的氧化磷酸化解偶联剂,瓦解跨膜的质子梯度,减少ATP 合成所需的质子驱动力,阻碍了ATP 的合成。Liang 等[8]报道,2,4-DNP通过氧化解偶联作用,抑制了Si 的吸收。Zhan等[19-20]也发现,2,4-DNP 通过减少ATP 的合成,抑制了污染物的吸收。本文研究结果显示,2,4-DNP的加入,降低了茶树根系对氟的吸收和累积,这可能与2,4-DNP 使根系代谢过程氧化磷酸化作用解偶联,ATP合成降低,减少能量供应有关。
作为一种代谢抑制剂,叠氮钠可抑制ATP水解,导致三磷酸腺苷形成的能量减少。Hiroshi 等[21]研究表明,小于1.0 mmol·L-1的叠氮钠可以抑制ATP的水解。焦新之等[22]发现,叠氮钠降低根细胞的ATP水解,抑制了K+的吸收。本文研究结果表明,叠氮钠抑制了茶树对氟的吸收,可能是因为叠氮钠抑制了茶树体内ATP的水解,减少了茶树根部吸收氟离子所需要的能量供应。
离子跨膜吸收和主动运输时主要依赖于H+-AT原Pase 水解ATP在细胞膜内外两侧建立起来的H+浓度梯度和电化学势[20, 23-24]。植物细胞膜H+-ATPase 在激活养分离子、代谢产物跨膜运输方面起着重要的作用。质膜H+-ATPase 的主要作用是形成质子电化学势梯度,为跨膜吸收的离子提供质子驱动力[25-26]。植物细胞内具有较高的负电荷,而在细胞膜外具有较高的正电荷。植物吸收阴阳离子电化学势的高低主要取决于化学势梯度与电势梯度的绝对值大小。正钒酸钠主要是通过抑制H+-ATPase 活性来阻碍质子驱动力的形成,从而降低了细胞膜内外H+浓度梯度和电化学势[22]。Yin 等[27]的研究发现,正钒酸钠通过抑制H+-ATPase来减弱电化学势,降低作物对污染物的吸收。Shen等[24]研究数据显示,在大豆缺P 状态下,正钒酸钠通过抑制质膜H+-ATPase 的活性,导致电化学势降低,从而严重降低了大豆根系对P的吸收。我们的研究结果表明,随着正钒酸钠浓度的增加,茶树根部氟含量和氟累积量也随之不断减少,这可能归因于正钒酸钠抑制了H+-ATPase 的水解,减少了H+的产生,使茶树根系主动吸收所需的质子(H+)梯度合成受阻,降低了茶树根系质膜内外的质子驱动力。
4 结论在0~5.0 mmol·L-1 的氟浓度范围内,茶树对氟的吸收先后出现快速吸收和缓慢吸收两个阶段,吸收过程符合Michaelis-Menten 动力学模型。低温条件(4益)明显抑制了茶树对氟的吸收。代谢抑制剂2,4-DNP(解偶联化,抑制ATP 合成)、叠氮钠(抑制ATP水解)和正钒酸钠(抑制质子驱动力形成)均抑制了茶树根系对氟吸收。氯离子显著降低了茶树对氟的吸收,这可能与氯离子和氟离子竞争同一载体的吸附位点有关。由此可得,茶树根系对氟的吸收是一个与跨质膜电化学势梯度、代谢能量和载体蛋白密切相关的主动运输过程。
| [1] | Shu W S, Zhang Z Q, Lan C Y, et al. Fluoride and aluminium concentrations of tea plants and tea products from Sichuan Province, PR China[J]. Chemosphere , 2003, 52 (9) : 1475–1482. DOI:10.1016/S0045-6535(03)00485-5 |
| [2] | Yoshida T, Fujiwara T, Saito M, et al. Concentration and distribution measurements of fluorine in tea leaves by micro-PIGE[J]. International Journal of PIXE , 2013, 23 : 119–125. DOI:10.1142/s0129083513410040 |
| [3] | Gao H J, Zhang Z Z, Wan X C. Influences of charcoal and bamboo charcoal amendment on soil-fluoride fractions and bioaccumulation of fluoride in tea plants[J]. Environmental Geochemistry and Health , 2012, 34 (5) : 551–562. DOI:10.1007/s10653-012-9459-x |
| [4] | 彭传燚, 陈静, 蔡荟梅, 等. 茶树对氟的吸收动力学特性研究[J]. 热带作物学报 , 2013, 34 (3) : 495–500. PENG Chuan-yi, CHEN Jing, CAI Hui-mei, et al. The kinetic characteristics of solution fluoride uptake by tea plant[J]. Chinese Journal of Tropical Crops , 2013, 34 (3) : 495–500. |
| [5] | Ruan J Y, Ma L F, Shi Y Z, et al. The impact of pH and calcium on the uptake of fluoride by tea plants(Camellia sinensis L.)[J]. Annals of Botany , 2004, 93 (1) : 97–105. DOI:10.1093/aob/mch010 |
| [6] | Zhang X C, Gao H J, Zhang Z Z, et al. Influences of different ion channel inhibitors on the absorption of fluoride in tea plants(Camellia sinesis L.)[J]. Plant Growth Regulation , 2013, 69 (1) : 99–106. DOI:10.1007/s10725-012-9751-x |
| [7] | 童启庆. 茶树栽培学[M]. 中国农业出版社, 2000 . TONG Qi-qing. Tea culture[M]. China Agriculture Press, 2000 . |
| [8] | Liang Y C, Si J, Römheld V. Silicon uptake and transport is an active process in Cucumis sativus[J]. New Phytologist , 2005, 167 (3) : 797–804. DOI:10.1111/j.1469-8137.2005.01463.x |
| [9] | 张显晨, 郜红建, 张正竹, 等. 茶叶氟化物提取方法对比与电位法测定条件优化[J]. 安徽农业大学学报 , 2011, 38 (1) : 27–30. ZHANG Xian-chen, GAO Hong-jian, ZHANG Zheng-zhu, et al. Comparison of extraction methods and potentiometric determination of fluoride in tea[J]. Journal of Anhui Agricultural University , 2011, 38 (1) : 27–30. |
| [10] | 郜红建, 张显晨, 蔡荟梅, 等. 水中氟化物测定过程中总离子强度调节缓冲液的对比与优化[J]. 环境化学 , 2010, 29 (4) : 754–758. GAO Hong-jian, ZHANG Xian-chen, CAI Hui-mei, et al. Comparison and optimization of total ionic strength adjustment buffer for the determination of fluoride in water[J]. Environmental Chemistry , 2010, 29 (4) : 754–758. |
| [11] | 陆景陵, 张福锁, 曹一平, 等. 植物营养学[M]. 北京: 中国农业大学出版社, 2003 : 79 -92. LU Jing-ling, ZHANG Fu-suo, CAO Yi-ping, et al. Science of plant nutrition[M]. Beijing: China Agriculture University Press, 2003 : 79 -92. |
| [12] | Zhang L, Li Q, Ma L F, et al. Characterization of fluoride uptake by roots of tea plants(Camellia sinensis(L.)O. Kuntze)[J]. Plant and Soil , 2013, 366 (1) : 659–669. |
| [13] | Marschner H. Mineral nutrition of higher plants[J]. Advance in Horticultural Science , 1995, 9 : 153–154. |
| [14] | Natasha L, Teakle Stephen D, Tyerman. Mechanisms of Cl- transport contributing to salt tolerance[J]. Plant, Cell and Environment , 2010, 33 (4) : 566–589. DOI:10.1111/pce.2010.33.issue-4 |
| [15] | Hopper J L, Parker D R. Plant availability of selenite and selenate as influenced by the competing ions phosphate and sulfate[J]. Plant and Soil , 1999, 210 (2) : 199–207. DOI:10.1023/A:1004639906245 |
| [16] | Zhang L H, Hu B, Li W, et al. OsPT2, a phosphate transporter, is involved in the active uptake of selenite in rice[J]. New Phytologist , 2014, 201 (4) : 1183–1191. DOI:10.1111/nph.12596 |
| [17] | Peter R, Mcclure Leon V, Kochian, et al. Evidence for cotransport of nitrate and protons in maize roots[J]. Plant Physiologist , 1990, 93 : 281–289. DOI:10.1104/pp.93.1.281 |
| [18] | 杨孝育, 刘存德. 水稻幼苗的低温伤害及其与腺苷酸代谢的关系[J]. 植物生理学报 , 1988, 14 (4) : 344–349. YANG Xiao-yu, LIU Cun-de. Relationship between chilling injury and adenylate metabolism in rice seedlings[J]. Acta Phytophysiologica Sinica , 1988, 14 (4) : 344–349. |
| [19] | Zhan X H, Ma H L, Zhou L X, et al. Accumulation of phenanthrene by roots of intact wheat(Triticum acstivnm L.) seedings:Passive or active uptake?[J]. BMC Plant Biology , 2010 . DOI:10.1186/1471-2229-10-52 |
| [20] | Zhan X H, Zhang X B, Yin X M, et al. H+/phenanthrene symporter and aquaglyceroporin are implicated in phenanthrene uptake by wheat(Triticum aestivum L.) roots[J]. Journal of Environmental Quality , 2012, 41 (1) : 188–196. DOI:10.2134/jeq2011.0275 |
| [21] | Hiroshi K, Masatomo M, Yasuhiro A. Membrane-bound adenosine triphosphatase of escherichia coli Ⅲ. Effects of sodium azide on the enzyme functions[J]. Department of Botany, Faculty of Science, University of Tokyo, Bunkyo-ku, Tokyo , 1977, 113 : 1071–1077. |
| [22] | 焦新之, 倪进山. 钒酸钠、叠氮钠对小麦根细胞K+吸收和质膜K+-Mg2+-ATPase的作用[J]. 实验生物学报 , 1982, 15 (4) : 411–419. JIAO Xin-zhi, NI Jin-shan. Effect of vanadate and azide on K+ uptake, H+ extrusion and plasma membrane ATPase in wheat roots[J]. Acta Biologiae Experimentalis Sinica , 1982, 15 (4) : 411–419. |
| [23] | Zhu Y Y, Zeng H Q, Shen Q R. Interplay among NH4+ uptake, rhizosphere pH and plasma membrane H+-ATPase determine the release of BNIs in sorghum roots-possible mechanisms and underlying hypothesis[J]. Plant and Soil , 2012, 358 (1) : 131–141. |
| [24] | Shen H, Chen J H, Wang Z Y, et al. Root plasma membrane H+-ATPase is involved in the adaptation of soybean to phosphorous starvation[J]. Journal of Experimental Bontany , 2006, 57 (6) : 1353–1362. |
| [25] | Sze H, Li X, Palmgren M. Energization of plant cell membranes by H+-pumping ATPases:Regulation and biosynthesis[J]. Plant Cell , 1999, 11 (4) : 677–689. |
| [26] | Chang C R, Hu Y B, Sun S B, et al. Proton pump OsA8 is linked to phosphorus uptake and translocation in rice[J]. Journal of Experimental Botany , 2009, 60 (2) : 557–565. DOI:10.1093/jxb/ern298 |
| [27] | Yin X M, Liang X, Xu G H, et al. Effect of phenanthrene uptake on membrane potential in roots of soybean, wheat and carrot[J]. Environmental and Experimental Botany , 2014, 99 : 53–58. DOI:10.1016/j.envexpbot.2013.11.001 |
 2016, Vol. 35
2016, Vol. 35