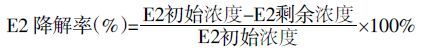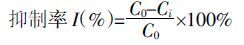文章信息
- 刘静娴, 刘娟, 孙敏霞, 高彦征, 李舜尧, 凌婉婷
- LIU Jing-xian, LIU Juan, SUN Min-xia, GAO Yan-zheng, LI Shun-yao, LING Wan-ting
- 抗生素对雌二醇降解菌JX-2降解性能的影响
- Effects of antibiotics on the estradiol degradation by strain JX-2
- 农业环境科学学报, 2016, 35(8): 1488-1497
- Journal of Agro-Environment Science, 2016, 35(8): 1488-1497
- http://dx.doi.org/10.11654/jaes.2016-0620
文章历史
- 收稿日期: 2016-05-05
当前,环境雌激素污染问题备受各国政府和学者关注,被喻为严重威胁人类生命安全的一个定时炸弹[1]。其中,生活污水和养殖业畜禽粪便是环境雌激素的重要来源。大量排放到环境中的雌激素已经严重威胁人类和动物的安全与健康。利用功能降解菌有望高效去除雌激素,国内外学者已分离获得了多株雌激素降解菌[2-5],这些降解菌具有较好的雌激素降解效果,从而为去除环境中的雌激素提供了一个很好的思路。
环境中抗生素往往与雌激素共存。目前在土壤、地表水及地下水中均能检测到抗生素[6]。抗生素的污染状况、环境行为、生态效应等是近年来环境领域的研究热点之一。环境中抗生素能自然产生,这属于微生物自然防御机制,其环境本底值非常低,而目前环境中大量抗生素主要来自于工业生产的医用抗生素和兽用抗生素。大量未失活的抗生素通过医院的污水、使用者粪便、畜禽与水产养殖所产生的废弃物等排入环境,严重威胁人群健康和环境微生物的生态安全[7]。环境中的残留抗生素已被证实可直接影响微生物的生物量[8-9]、群落结构[10-11]、活性等[12],并诱导产生抗性基因[13-14]。
抗菌性是抗生素的本质属性。抗生素可对雌激素降解菌这类环境有℃菌产生生态效应,进而影响降解菌对环境中雌激素的降解性能。然而,有关抗生素影响微生物降解与转化雌激素的文献报道还很少。Chun 等[15]报道,粘土中的抗生素显著降低了土壤微生物的脱氢酶活性,影响雌二醇(Estradiol,E2)向雌酮(Estrone,E1)的转化。本课题组前期筛选到一株E2降解菌Rhodococcus sp. JX-2,有望实现环境中E2 的高效去除;但共存抗生素的影响是制约功能菌降解效率的一个关键因素。
本文选用12种常见抗生素,研究了抗生素对菌株JX-2 毒性和降解性能的影响,以期为利用功能菌去除实际污染环境中雌激素提供理论依据。
1 材料与方法 1.1 试验材料供试菌:菌株为实验室筛选分离得到的降解菌Rhodococcus sp. JX-2。
菌悬液的制备:将菌落接种于LB 液体培养基中,30℃、150 r·min-1 摇床培养15 h,8000 r·min-1 离心10 min,倒掉上清液,用无机盐培养基(MSM)或无菌水洗涤菌体,再次离心5 min,倒去上清液。重复洗涤1次后,利用MSM或无菌水重新悬浮菌体,利用分光光度计调整菌体浓度到OD600=1。
抗生素:青霉素(Penicillin,P;G 钠盐,纯度98%),四环素(Tetracycline,TC;盐酸四环素,纯度98%),红霉素(Erythromycin,EM;纯度98%),庆大霉素(Gentamycin,GM;硫酸庆大霉素,纯度98%),链霉素(Streptomycin,SM;硫酸链霉素,纯度98%),氨苄青霉素(Ampicillin,AMP;氨苄青霉素钠盐,纯度98%),氯霉素(Chloramphenicol,C;纯度99%),卡那霉素(Kanamycin,KM;硫酸卡那霉素,纯度98%),土霉素(Oxytetracy原cline,OTC;盐酸土霉素,纯度99%),羧苄青霉素(Car原benicillin,CAR;羧苄青霉素二钠盐,纯度98%),金霉素(Chlortetracycline,CTC;盐酸金霉素,纯度98%),磺胺嘧啶(Sulfadiazine,SDZ;纯度98%)。
抗生素母液配置:红霉素、氯霉素配制成浓度为5120 μg·mL-1 的乙醇溶液,其余抗生素为5120 μg·mL-1的水溶液,即为抗生素母液;实验前均用无菌水稀释成浓度为1280 μg·mL-1的溶液备用。
雌二醇(纯度逸98%)购自Sigma-Aldrich 公司。其基本性质如下:分子量272.38 g·mol-1,纯水中溶解度5.4~13.3 mg·L-1,辛醇-水分配系数(lgKow)为3.8~4.0,蒸发压3×10-8 kPa[16]。
1.2 培养基组成MH 肉汤(g·L-1):牛肉粉2.0,酸水解酪蛋白17.5,可溶性淀粉1.5,pH(7.3±0.1)。
无机盐培养基(g·L-1):(NH4) 2SO4 1.50、K2HPO4·3H2O 1.91、KH2PO4 0.50、NaCl 0.50、MgSO4·7H2O 0.20,微量元素溶液2 mL,自然pH 值。其中微量元素溶液成分(g·L-1):CoCl2·6H2O 0.1,MnCl2·4H2O 0.425,ZnCl20.05,NiCl2·6H2O 0.01,CuSO4·5H2O 0.015,Na2MoO4·2H2O 0.01,Na2SeO4·2H2O 0.01。
E2 降解培养基(MSM-E2 培养基):1000 mg·L-1的E2丙酮溶液过0.22 μm滤膜除菌,取一定量置于灭菌三角瓶中,待丙酮完全挥发完后,加入灭菌的MSM 培养基,使E2 的最终浓度达到实验设计浓度。
1.3 试验方法 1.3.1 最小抑菌浓度菌株对抗生素的最小抑菌浓度(Minimuminhibitoryconcentration,MIC):指在体外培养细菌18~24 h后能抑制培养基内细菌生长的最低药物浓度[17]。根据美国临床和实验室标准协会(NCCLS)关于抗菌药物敏感性试验操作标准,采用MH 肉汤稀释法测定菌株JX-2 的最小抑菌浓度。取无菌小试管12支排于试管架上,于第1 管加入MH肉汤1.6 mL,第2~12 管各加1.0 mL。于第1 管中加入稀释好的1280 μg·mL-1的抗生素0.4 mL,混匀后取1.0 mL 至第2 管,第2 管混匀后取1.0 mL至第3 管,如此连续倍比稀释至第11 管,并从第11 管中吸取1.0 mL 弃去,第12 管为不含药物的生长对照。此时各管抗生素浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25 μg·mL-1。然后将菌悬液浓度校正至0.5 麦氏比浊标准,并在每管内加入校正好浓度的菌液各1.0 mL。第1 管至第11 管抗生素终浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125 μg·mL-1。
1.3.2 抗生素对菌株生物量及降解性能的影响根据试验测得菌株JX-2 的最小抑菌浓度,设置抗生素的浓度。分为两个浓度梯度:低浓度抗生素(浓度低于MIC),菌株生长不受抑制;高浓度抗生素(浓度高于MIC),菌株生长受到抑制。在E2含量为30mg·L-1的MSM-E2 培养基中,分别加入相应浓度的低浓度抗生素和高浓度抗生素。再按5%(体积比)的接种量向20 mL培养基中加入菌悬液,30℃、150 r·min-1摇床培养,同时设置时间梯度,分别在第1、3、5、7 d取样,测定培养基中残留E2 浓度,并对细菌进行平板计数测定其生长。试验设置不加任何抗生素的对照(CK)。
1.3.3 混合抗生素对纯培养条件下菌株JX-2 降解E2的影响在E2 含量为30 mg·L-1 的MSM-E2 培养基中,加入混合抗生素,使混合抗生素中每一种抗生素的浓度均达到试验要求浓度,每种抗生素浓度设置4 个梯度,分别为10.0、100.0 μg·L-1 和1.0、10.0 mg·L-1。再按5%(体积比)的接种量向20 mL 培养基中加入菌悬液,30℃、150 r·min-1 摇床培养,同时设置时间梯度,分别在第1、3、5、7 d 取样,测定培养基中残留E2浓度,计算E2 降解率。试验设置不添加抗生素的对照(CK)。
1.3.4 混合抗生素对污水中菌株JX-2 降解E2的影响污水样品采自南京某污染湖泊生活污水排污口,实验前测定污水中E2 含量。1 L污水中按照5%(体积比)接种JX-2 菌悬液50 mL,另一组污水样品中添加等体积无菌水取代菌悬液。同时在污水中添加混合抗生素,使每一种抗生素的浓度分别为10.0、100.0μg·L-1 和1.0、10.0 mg·L-1。30℃、150 r·min-1 摇床培养7 d后测定污水中E2 浓度。试验设置不添加抗生素的对照(CK)。
1.4 培养液和污水中E2的分析方法 1.4.1 培养液中E2 含量的测定E2浓度测定采用定时整瓶提取培养基的方法[18]。向培养液中加入等体积色谱纯甲醇,超声振荡30min 后过0.22 μm滤膜,用高效液相色谱仪(High per-formance liquid chromatography,HPLC)测定E2 浓度。HPLC(岛津LC-20AT)设定参数为:Inertsil ODS-SPC18反相色谱柱(150 mm ×4.6 mm,5 μm),流动相为乙腈:水=70:30(V/V),流速1.00 mL·min-1,柱温40℃,紫外检测波长280 nm,进样量20 μL。通过加标回收试验测得此方法E2 的加标回收率为95.84%,相对标准偏差RSD 为1.91%(n=5)。
1.4.2 污水中E2 的分析方法利用HPLC 检测污水中E2 含量参考付银杰等[19]和李欣等[20]文献。污水样品以约5 mL·min-1流速通过已分别用5 mL 甲醇和5 mL 超纯水活化的C18 固相萃取柱(200mg/6mL)。5mL超纯水淋洗柱体并抽吸3min后,用15 mL 甲醇洗脱,洗脱液收集至试管中。氮气吹干后,加入甲醇2 mL 溶解,过0.22 μm 滤膜,HPLC-荧光检测器(Fluorescence detection,FLD)分析。设定参数为:Inertsil ODS-SP-C18 反相色谱柱(150 mm×4.6mm,5 μm),激发波长和发射波长分别为280 nm和310nm,流动相为甲醇:乙腈:水=20:30:50(V/V),流速0.8mL·min-1,柱温40℃,进样量20 μL。通过加标回收试验测得此方法E2的加标回收率为88.34%~93.85%,RSD为1.97%~2.28%(n=5),检出限为0.186μg·L-1。
1.5 数据分析所有图表中的数据均采用3次重复的平均值依标准偏差来表示。采用SPSS 19.0 统计分析软件在95%的置信区间下进行差异显著性分析。
式中:E2 剩余浓度指用HPLC 测得培养基中经过菌株JX-2 降解后的E2 实际剩余浓度;E2 初始浓度指用HPLC 测得空白对照组的实际E2 浓度。
式中:C0指CK 的E2 降解率;Ci 指添加抗生素后E2降解率。
2 结果与分析 2.1 最小抑菌浓度(MIC)菌株JX-2 对青霉素和红霉素的MIC 很低,其中青霉素在试验的最低浓度0.125 μg·mL-1时菌株也不可生长,红霉素浓度在0.25 μg·mL-1(含)以上时菌株不可生长;JX-2 对氯霉素、土霉素和磺胺嘧啶的耐药性相对较高;对于其他抗生素的耐药性介于两者之间。菌株JX-2对12 种抗生素的MIC 见表 1。
根据试验结果设置低浓度抗生素(<MIC):青霉素0.05 μg·mL-1,四环素0.5 μg·mL-1,红霉素0.05μg·mL-1,庆大霉素0.125 μg·mL-1,链霉素0.25 μg·mL-1,氨苄青霉素0.125 μg·mL-1,氯霉素2.0 μg·mL-1,卡那霉素0.5 μg·mL-1,土霉素4.0 μg·mL-1,羧苄青霉素0.5 μg·mL-1,金霉素0.5 μg·mL-1,磺胺嘧啶2.0μg·mL-1。
 |
高浓度抗生素(>MIC):青霉素0.25 μg·mL-1,四环素4.0 μg·mL-1,红霉素0.5 μg·mL-1,庆大霉素1.0μg·mL-1,链霉素2.0 μg·mL-1,氨苄青霉素1.0 μg·mL-1,氯霉素16.0 μg·mL-1,卡那霉素4.0 μg·mL-1,土霉素32.0 μg·mL-1,羧苄青霉素4.0 μg·mL-1,金霉素4.0μg·mL-1,磺胺嘧啶16.0 μg·mL-1。
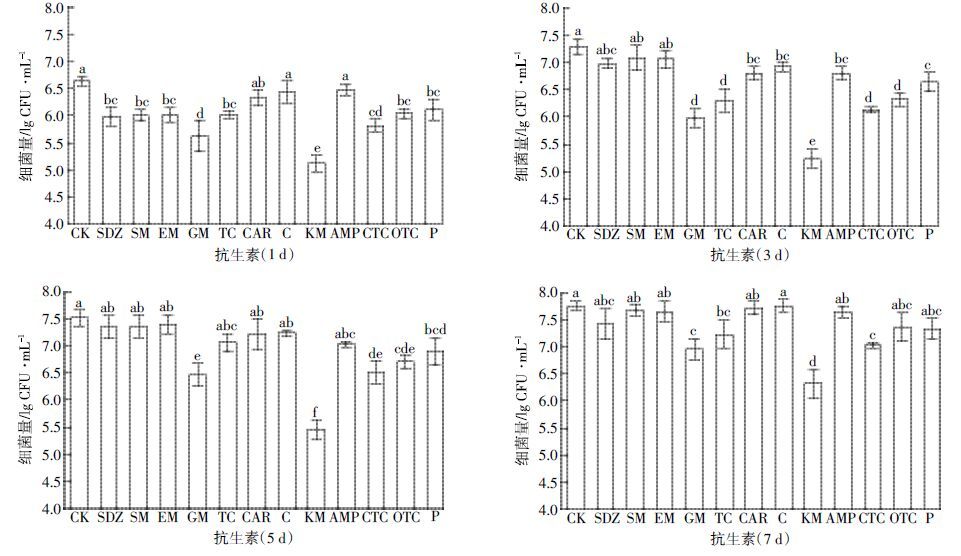
2.2 抗生素对菌株JX-2 生物量的影响低浓度抗生素(<MIC)对菌株JX-2 降解E2 时生物量的影响如图 1所示。随着培养时间延长,CK 和添加低浓度抗生素的菌株生物量均增加。在低浓度抗生素的作用下,除GM、TC、KM 和CTC 外,7 d时菌株JX-2 的生长情况与CK 差异不显著。这说明,大部分低浓度抗生素对菌株的生长没有显著影响,只有少部分低浓度抗生素(如GM、TC、KM 和CTC)对JX-2 的生长有一定抑制作用,但抑制作用不强烈。
|
| 图 1 低浓度抗生素(<MIC)对菌株JX-2 生物量的影响 Figure 1 Effects antibiotics at low concentrations on the cell growth of strain JX-2 相同小写字母表示各处理间差异不显著(P>0.05),下同 |
高浓度抗生素(>MIC)对菌株JX-2 降解E2 时生物量的影响见图 2。与CK 相比,高浓度的抗生素明显抑制菌株JX-2 的生长。但从图 2 中可看出,即使是添加了浓度高于MIC 值的抗生素,菌株JX-2 的生长也并不是完全被抑制。随着培养时间延长,菌株JX-2的生物量从3.6~4.0 lgCFU·mL-1 增长至5.0~5.6lgCFU·mL-1,增长较为明显。
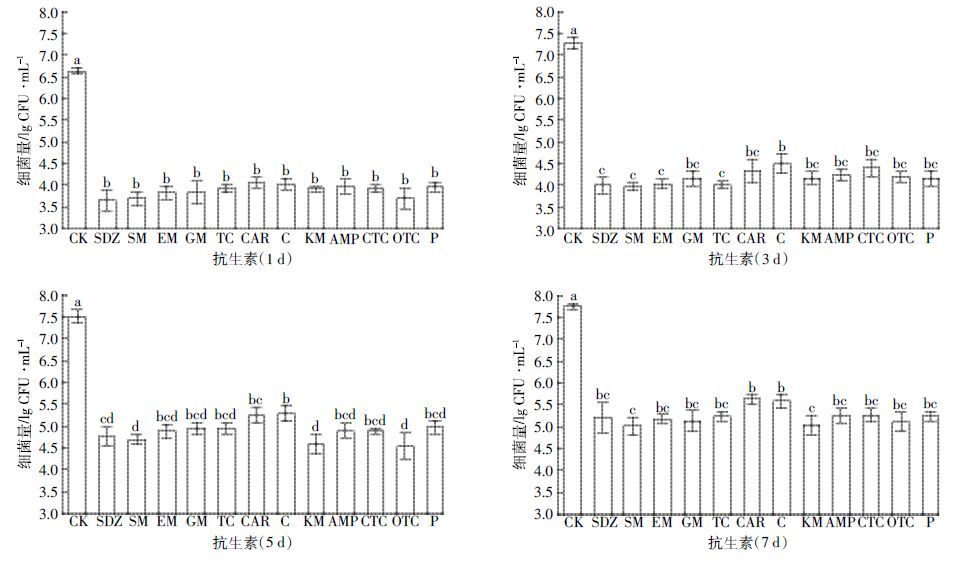
|
| 图 2 高浓度抗生素(>MIC)对菌株JX-2生物量的影响 Figure 2 Effects antibiotics at high concentrations on the cell growth of strain JX-2 |
低浓度抗生素(<MIC)对菌株JX-2 降解E2 的影响如图 3 所示。培养7 d时,CK 处理的E2 降解率高达91.5%,表明在没有抗生素存在的条件下菌株JX-2的降解活性良好;当降解体系中加入低浓度抗生素后,培养1 d和3 d时低浓度抗生素导致菌株降解E2的降解率显著下降。这可能是因为菌株刚被接种到培养基中,对抗生素环境尚没有产生适应性。但7 d时,菌株已基本适应低浓度抗生素胁迫,其E2 降解率相比于1 d和3 d时明显上升,达到76%~89%。其中,低浓度GM、CAR、AMP和OTC 作用下JX-2 对E2 的降解率与CK 无显著性差异。

|
| 图 3 低浓度抗生素(<MIC)对菌株JX-2 降解E2 的影响 Figure 3 Effects of antibiotics at low concentrations on E2 degradation by strain JX-2 |
高浓度抗生素(>MIC)对菌株JX-2 降解E2 的影响见图 4。在1、3、5、7 d内,高浓度抗生素均导致菌株对E2 的降解率显著低于CK,7 d时E2 的降解率仅为20%~35%。随着降解时间延长,JX-2 对E2降解率从1d时的不到10%提高至7d时的20%~35%,说明菌株JX-2 在高浓度抗生素环境中仍具有一定生长和降解能力,但其活性已受到了一定抑制。
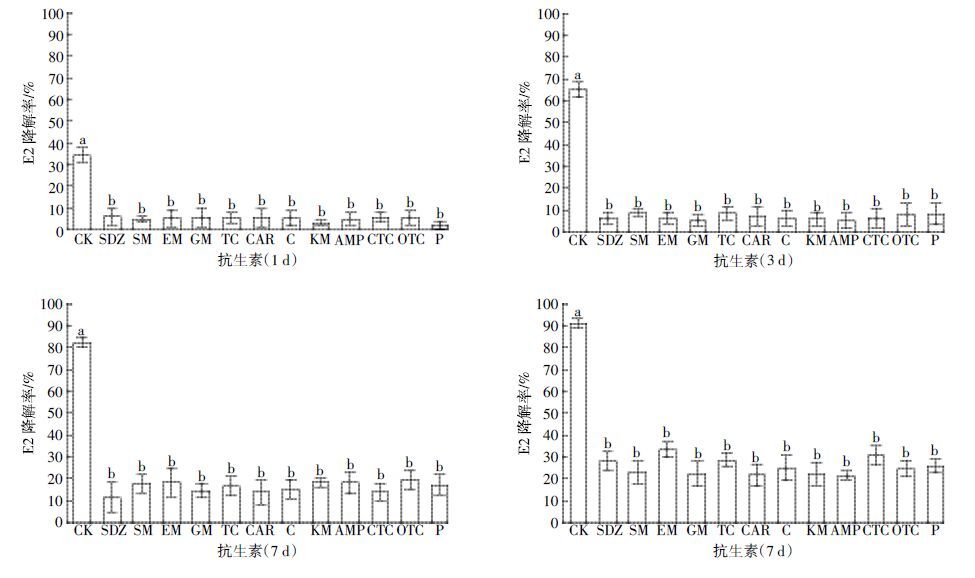
|
| 图 4 高浓度抗生素(>MIC)对菌株JX-2 降解E2 的影响 Figure 4 Effects of antibiotics at high concentrations on E2 degradation by strain JX-2 |
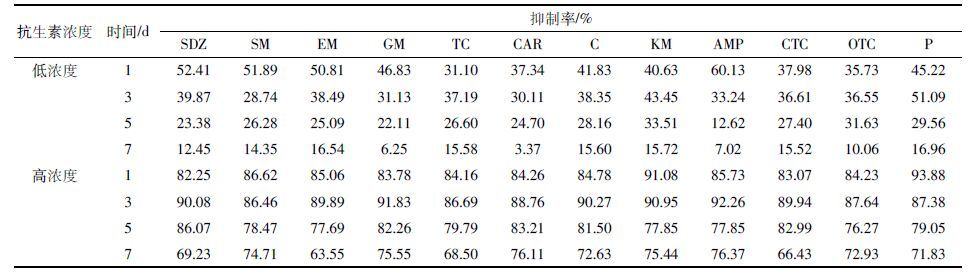
根据图 3 和图 4 的结果计算了不同浓度抗生素对菌株JX-2 降解E2 的抑制率(表 2)。随着降解时间延长,低浓度抗生素对JX-2 降解E2 的抑制作用减弱,其抑制率由1 d时的31.10%~60.13%下降至7d 时的3.37%~16.96%。当环境抗生素浓度低于MIC值时,菌株JX-2 对E2 的降解作用基本不受影响,其7 d降解率可达76%以上,抑制率17%以下。而高浓度抗生素对JX-2 降解E2 的抑制作用减弱不明显,其抑制率由1 d时的82.25%~93.88%下降至7 d时的63.55%~76.37%。当环境抗生素浓度高于MIC值时,菌株JX-2 对E2 的降解能力受到一定程度的抑制。但是在高浓度抗生素作用下,菌株JX-2对E2仍具有20%~35%的降解率,再结合图 2 高浓度抗生素对菌株JX-2 降解E2 生物量的影响,可说明此时菌株JX-2 并没有被完全杀死。这是因为当抗生素浓度高于MIC 值后,在短时间内对受试菌的生长产生了抑制,但并不是完全杀死受试菌;只有当抗生素浓度大于等于最小杀菌浓度(Minimum bactericidal concen原tration,MBC)时,才能杀死99.9%以上的受试菌。
 |
进一步研究了12 种抗生素的混合体系对菌株JX-2 降解E2 的影响(图 5)。当各抗生素浓度为10.0、100.0 μg·L-1和1.0 mg·L-1时,混合抗生素对菌株JX-2的降解并无影响,7 d时E2 降解率均可达到90%以上,与CK处理的降解率无显著差异;但当抗生素浓度增大到10.0 mg·L-1时,混合抗生素明显抑制了JX-2对E2的降解,7 d时E2降解率仅48.2%。从时间梯度看,随着培养时间延长,4个抗生素浓度下菌株对E2的降解率均增大。这说明该浓度的混合抗生素没有完全抑制菌株JX-2 的活性。
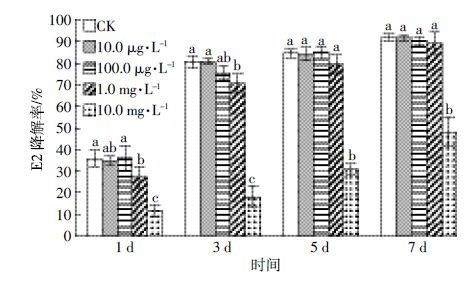
|
| 图 5 混合抗生素对纯培养条件下菌株JX-2 降解E2的影响 Figure 5 Effect of mixed antibiotics on E2 degradation in aqueous solution by strain JX-2 相同小写字母表示在相同处理天数内各处理间差异不显著(P>0.05) |
污水样品中的抗生素环境本底值与人为添加量相比非常低[21],且试验设置了CK 作为对照,因此可忽略污水中原有的抗生素含量。图 6为7 d时不同浓度混合抗生素对污水中菌株JX-2 降解E2 的影响。用HPLC-FLD 测得污水样品中E2 的平均含量为78.26ng·L-1。在不同浓度抗生素作用下,即使不接种菌株JX-2,其E2 含量仍有所下降,但降解率只有6.2%~19.1%。接种菌株JX-2 后,当抗生素浓度为10.0、100.0 μg·L-1 和1.0 mg·L-1 时,菌株JX-2 对污水中E2 具有良好的降解效果,降解率均达80%以上,与CK 降解率无显著性差异,远高于不接种JX-2 处理的降解率。而当抗生素浓度为10.0 mg·L-1时,菌株JX-2 对E2 的降解率略有下降,为68.9%,但仍明显高于不接种JX-2 处理的降解率。

|
| 图 6 混合抗生素对污水中菌株JX-2 降解E2 的影响 Figure 6 Effect of mixed antibiotics on E2 degradation in sewage by strain JX-2 相同小写字母表示接种或不接种JX-2时各处理间差异不显著(P>0.05) |
利用降解菌高效降解雌激素已在实验室纯培养条件下取得初步成功,但环境中抗生素往往与雌激素共存,抗生素的影响是制约降解菌降解效率的一个关键因素,而目前关于抗生素对降解菌降解雌激素影响的研究报道还很少。水体中抗生素实际浓度一般为痕量残留[7]。本文结果表明,环境中实际浓度水平下抗生素对降解菌JX-2 的降解率没有显著影响,菌株JX-2在抗生素作用下仍能发挥高效降解性能。这为应用菌株JX-2 时如何规避抗生素风险、并高效去除环境中E2的实际应用提供了基础依据。
添加了高浓度抗生素后,菌株的生长和降解受到一定抑制。但随着培养时间的延长,菌株生物量和降解率都有所增加,这说明培养基中的抗生素对菌株的抑制作用在减弱,可能是因为抗生素在各类环境介质中会自然降解,但其降解机理与降解速率随抗生素的种类及环境条件的不同而有所差异。大环内酯类、内酰胺类和磺胺类抗生素易溶于水并水解[22],四环素类抗生素易光解[23],部分抗生素如喹乙醇、甲硝唑、泰乐菌素和土霉素在水体中也会被生物降解[24]。在摇床培养过程中,随着抗生素浓度的自然衰减,其药性将会有一定程度的减弱。培养7 d时,不同浓度的抗生素对菌株JX-2 的抑制强度相对于1、3、5 d同比降低,这与抗生素自身的缓慢降解以及菌株JX-2 对抗生素胁迫产生一定的适应性有关。
抗生素能否影响菌株JX-2 在环境介质中的高效降解性能,取决于抗生素在环境中的实际浓度与对应MIC 值的大小关系。本实验设计的抗生素浓度系列包含了环境中抗生素的实际浓度,同时设置了高浓度组作为对照。叶计朋等[25]分析了珠江流域水体中典型抗生素的环境含量,指出珠江广州河段(枯季)和深圳河抗生素污染严重,最高含量可达1.34 μg·L-1;Zhang 等[21]研究发现,在抗生素污染严重的珠江流域中,浓度最高的抗生素是阿莫西林,达到3384 ng·L-1。大量文献数据显示[21, 26-29],不同抗生素在不同环境介质中的浓度不同:水体残留浓度为ng·L-1级到μg·L-1级;土壤残留浓度一般为μg·kg-1级;粪便农用的土壤可达到mg·kg-1级。抗生素种类、用量和环境条件等都会影响环境介质中抗生素的残留量。一般来说,环境介质中的残留抗生素浓度小于菌株JX-2对各抗生素的MIC 值。理论上,环境中的抗生素不会完全抑制菌株JX-2 对E2 的降解活性。
将含有E2 的生活污水作为培养基,并添加一定浓度的混合抗生素,模拟自然条件下的降解环境,揭示不同浓度抗生素对E2 降解菌降解性能的影响,这在已有文献中还鲜见报道。Xuan 等[30]证明了在粉砂壤土中微生物直接参与降解E2,并研究了抗生素在粉砂壤土中对E2 降解动力学的影响,发现在浓度为40 μmol·kg-1的磺胺二甲氧嘧啶共存下,E2 降解速率常数从0.750 d-1下降到0.492 d-1。本研究结果表明,抗生素对环境中E2 降解菌的降解活性产生了明显的抑制作用,而菌株JX-2 在混合抗生素浓度高达10.0 mg·L-1 的污水中对E2 的降解率仍有68.9%,具有较强的抗抗生素胁迫能力。在混合抗生素对污水中菌株降解E2的影响结果中,不接种菌株JX-2 时E2降解率为6.2%~19.1%,这是因为环境中E2 可自然降解或被生物降解,但降解效率不高。研究表明,环境中的E2可在生物或非生物作用下转化为E1,其在淡水沉积物中的半衰期为5~10 d[31],在20℃河水中半衰期可达9 d[32]。在添加了不同浓度的抗生素后,随着抗生素浓度的提高,不接种菌株JX-2 的污水中E2 降解率逐渐下降。这可能是因为抗生素抑制了污水中土著微生物的降解活性,降低了E2 降解率。而接种了降解菌JX-2,即使添加高于环境浓度100~1000 倍的混合抗生素,菌株JX-2 仍具有良好的降解性能,降解率均能达到80%以上。这说明菌株JX-2在环境中的正常生理功能不易受到各类抗生素的抑制,其有望直接应用于我国各类环境介质中E2 的去除,具有应用前景。
4 结论(1)菌株JX-2 对青霉素和红霉素的MIC 很低,对氯霉素、土霉素和磺胺嘧啶的耐药性相对较高,对其他抗生素的耐药性介于两者之间。
(2)低浓度抗生素(<MIC)对菌株JX-2 的生长和降解性能影响不大;而高浓度抗生素(>MIC)则会明显抑制菌株生长并降低其对E2的降解性能。随着降解时间延长,低浓度抗生素对菌株JX-2 降解E2 的抑制作用减弱。
(3)当各抗生素浓度为10.0、100.0 μg·L-1和1.0mg·L-1时,混合抗生素对菌株JX-2的降解并无影响,而当各抗生素浓度增大到10.0 mg·L-1时,混合抗生素抑制了菌株JX-2 对E2 的降解,7 d时E2 降解率仅为48.2%。
(4)当各抗生素浓度为10.0、100.0 μg·L-1和1.0mg·L-1 时,菌株JX-2 对污水中E2 具有良好的降解效果(降解率>80%)。而当各抗生素浓度为10.0 mg·L-1时,菌株JX-2对E2的降解率下降(为68.9%)。
| [1] | Lorenz S. EU shifts endocrine disrupter research into overdrive[J]. Science , 2003, 300 (5622) : 1069. DOI:10.1126/science.300.5622.1069 |
| [2] | Kurisu F, Ogura M, Saitoh S, et al. Degradation of natural estrogen and identification of the metabolites produced by soil isolates of Rhodococcus sp.. and Sphingomonas sp.[J]. Journal of Bioscience and Bioengineering , 2010, 109 (6) : 576–582. DOI:10.1016/j.jbiosc.2009.11.006 |
| [3] | Yu C P, Roh H, Chu K H. 17β-estradiol-degrading bacteria isolated from activated sludge[J]. Environmental Science and Technology , 2007, 41 (2) : 486–492. DOI:10.1021/es060923f |
| [4] | 史江红, 韩蕊, 宿凌燕, 等. 某污水处理厂中17α-乙炔基雌二醇降解菌的分离鉴定及其降解特性[J]. 环境科学学报 , 2010, 30 (12) : 2414–2419. SHI Jiang-hong, HAN Rui, SU Ling-yan, et al. Isolation and identification of a 17α-ethynylestradiol-degrading strain from a wastewater treatment plant and its degradation characteristics[J]. Acta Scientiae Circumstantiae , 2010, 30 (12) : 2414–2419. |
| [5] | 杨俊, 姜理英, 陈建孟. 1株17β-雌二醇高效降解菌的分离鉴定及降解特性[J]. 环境科学 , 2010, 31 (5) : 1313–1319. YANG Jun, JIANG Li-ying, CHEN Jian-meng. Isolation, identification of 17β-estradiol(E2)-degrading strain and its degradation characteristics[J]. Environmental Science , 2010, 31 (5) : 1313–1319. |
| [6] | Campagnolo E R, Johnson K R, Karpati A, et al. Antimicrobial residues in animal waste and water resources proximal to large-scale swine and poultry feeding operations[J]. Science of the Total Environment , 2002, 299 (1) : 89–95. |
| [7] | 俞慎, 王敏, 洪有为. 环境介质中的抗生素及其微生物生态效应[J]. 生态学报 , 2011, 31 (15) : 4437–4446. YU Shen, WANG Min, HONG You-wei. Antibiotics in environmental matrices and their effects on microbial ecosystems[J]. Acta Ecologica Sinica , 2011, 31 (15) : 4437–4446. |
| [8] | Haller M Y, Müller S R, McArdell C S, et al. Quantification of veterinary antibiotics(sulfonamides and trimethoprim) in animal manure by liquid chromatography mass spectrometry[J]. Journal of Chromatography A , 2002, 952 (1) : 111–120. |
| [9] | Thiele-Bruhn S, Beck I C. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass[J]. Chemosphere , 2005, 59 (4) : 457–465. DOI:10.1016/j.chemosphere.2005.01.023 |
| [10] | Hammesfahr U, Heuer H, Manzke B, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology and Biochemistry , 2008, 40 (7) : 1583–1591. DOI:10.1016/j.soilbio.2008.01.010 |
| [11] | Schauss K, Focks A, Leininger S, et al. Dynamics and functional relevance of ammonia-oxidizing archaea in two agricultural soils[J]. Environmental Microbiology , 2009, 11 (2) : 446–456. DOI:10.1111/emi.2009.11.issue-2 |
| [12] | Sara B, Carmen A, Javier P, et al. Toxicity of the antimicrobial oxytetracycline to soil organisms in a multi-species-soil system(MS. 3) and influence of manure co-addition[J]. Journal of Hazardous Materials , 2005, 122 (3) : 233–241. DOI:10.1016/j.jhazmat.2005.03.003 |
| [13] | Pruden A, Pei R, Storteboom H, et al. Antibiotic resistance genes as emerging contaminants:Studies in Northern Colorado[J]. Environmental Science and Technology , 2006, 40 (23) : 7445–7450. DOI:10.1021/es060413l |
| [14] | Arias C A, Murray B E. Antibiotic-resistant bugs in the 21st century:A clinical super-challenge[J]. New England Journal of Medicine , 2009, 360 (5) : 439–443. DOI:10.1056/NEJMp0804651 |
| [15] | Chun S, Lee J, Geyer R, et al. Effect of agricultural antibiotics on the persistence and transformation of 17β-estradiol in a Sequatchie loam[J]. Journal of Environmental Science and Health Part B , 2005, 40 (5) : 741–751. DOI:10.1080/03601230500189691 |
| [16] | 张方方, 秦丹, 高良敏, 等. 环境中雌激素的微生物降解[J]. 微生物学通报 , 2012, 39 (5) : 711–721. ZHANG Fang-fang, QIN Dan, GAO Liang-min, et al. Microbial degradation of estrogens in the environment[J]. Microbiology China , 2012, 39 (5) : 711–721. |
| [17] | Pridmore A, Burch D, Lees P. Determination of minimum inhibitory and minimum bactericidal concentrations of tiamulin against field isolates of Actinobacillus pleuropneumoniae[J]. Veterinary Microbiology , 2011, 151 (3) : 409–412. |
| [18] | Gao Y, Li Q, Ling W, et al. Arbuscular mycorrhizal phytoremediation of soils contaminated with phenanthrene and pyrene[J]. Journal of Hazardous Materials , 2011, 185 (2) : 703–709. |
| [19] | 付银杰, 高彦征, 董长勋, 等. SPE-HPLC/FLD法同时测定水中4种雌激素[J]. 农业环境科学学报 , 2012, 31 (11) : 2296–2303. FU Yin-jie, GAO Yan-zheng, DONG Chang-xun, et al. SPE-HPLC/FLD method for the determination of four estrogens in water samples[J]. Journal of Agro-Environment Science , 2012, 31 (11) : 2296–2303. |
| [20] | 李欣, 凌婉婷, 刘静娴, 等. 固定化菌剂对污水和牛粪中雌二醇和己烯雌酚的去除作用[J]. 环境科学 , 2015, 36 (7) : 2581–2590. LI Xin, LING Wan-ting, LIU Jing-xian, et al. Immobilization of estrogen-degrading bacteria to remove the 17β-estradiol and diethylstilbestrol from polluted water and cow dung[J]. Environmental Science , 2015, 36 (7) : 2581–2590. |
| [21] | Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science and Technology , 2015, 49 (11) : 6772–6782. DOI:10.1021/acs.est.5b00729 |
| [22] | Combalbert S, Hernandez-Raquet G. Occurrence, fate, and biodegradation of estrogens in sewage and manure[J]. Applied Microbiology and Biotechnology , 2010, 86 (6) : 1671–1692. DOI:10.1007/s00253-010-2547-x |
| [23] | Lunestad B T, Samuelsen O B, Fjelde S, et al. Photostability of eight antibacterial agents in seawater[J]. Aquaculture , 1995, 134 (3) : 217–225. |
| [24] | Ingerslev F, Toräng L, Loke M L, et al. Primary biodegradation of veterinary antibiotics in aerobic and anaerobic surface water simulation systems[J]. Chemosphere , 2001, 44 (4) : 865–872. DOI:10.1016/S0045-6535(00)00479-3 |
| [25] | 叶计朋, 邹世春, 张干, 等. 典型抗生素类药物在珠江三角洲水体中的污染特征[J]. 生态环境 , 2007, 16 (2) : 384–388. YE Ji-peng, ZOU Shi-chun, ZHANG Gan, et al. Characteristics of selected antibiotics in the aquatic environment of the Pearl River Delta, South China[J]. Ecology and Environment , 2007, 16 (2) : 384–388. |
| [26] | Castiglioni S, Bagnati R, Calamari D, et al. A multiresidue analytical method using solid-phase extraction and high-pressure liquid chromatography tandem mass spectrometry to measure pharmaceuticals of different therapeutic classes in urban wastewaters[J]. Journal of Chroma-tography A , 2005, 1092 (2) : 206–215. DOI:10.1016/j.chroma.2005.07.012 |
| [27] | Tang C M, Huang Q X, Yi-Yi Y U, et al. Multiresidue determination of sulfonamides, macrolides, trimethprim, and chloramphenicol in sewage sludge and sediment using ultrasonic extraction coupled with solid phase extraction and liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry , 2009, 37 (8) : 1119–1124. DOI:10.1016/S1872-2040(08)60120-6 |
| [28] | Arikan O A, Rice C, Codling E. Occurrence of antibiotics and hormones in a major agricultural watershed[J]. Desalination , 2008, 226 (1) : 121–133. |
| [29] | Watkinson A J, Murby E J, Kolpin D W, et al. The occurrence of antibiotics in an urban watershed:From wastewater to drinking water[J]. Science of the Total Environment , 2009, 407 (8) : 2711–2723. DOI:10.1016/j.scitotenv.2008.11.059 |
| [30] | Xuan R, Blassengale A A, Wang Q. Degradation of estrogenic hormones in a silt loam soil[J]. Journal of Agricultural and Food Chemistry , 2008, 56 (19) : 9152–9158. DOI:10.1021/jf8016942 |
| [31] | Lee L S, Strock T J, Sarmah A K, et al. Sorption and dissipation of testosterone, estrogens, and their primary transformation products in soils and sediment[J]. Environmental Science and Technology , 2003, 37 (18) : 4098–4105. DOI:10.1021/es020998t |
| [32] | Zheng W, Yates S R, Bradford S A. Analysis of steroid hormones in a typical dairy waste disposal system[J]. Environmental Science and Technology , 2008, 42 (2) : 530–535. DOI:10.1021/es071896b |
 2016, Vol. 35
2016, Vol. 35