文章信息
- 陆守昆, 杨青青, 王红菊, 李金凤, 沈羽, 占新华
- LU Shou-kun, YANG Qing-qing, WANG Hong-ju, LI Jin-feng, SHEN Yu, ZHAN Xin-hua
- 不同条件下小麦根系吸收菲的动力学参数变化
- Changes in kinetic parameters of phenanthrene uptake by wheat roots under different conditions
- 农业环境科学学报, 2016, 35(9): 1660-1664
- Journal of Agro-Environment Science, 2016, 35(9): 1660-1664
- http://dx.doi.org/10.11654/jaes.2016.0255
文章历史
- 收稿日期: 2016-03-01
多环芳烃类化合物(PAHs)是环境中普遍存在的持久性有毒有机污染物,具有强烈的“三致”效应[1],美国EPA 优先控制污染物名单中包含了16 种PAHs[2]。PAHs的强疏水性和难降解性使其在土壤环境中大量累积,进而污染农作物,危害人类健康。因此植物对土壤中PAHs 的吸收及其机制研究已受到研究者的广泛关注。
植物对有机物的吸收是一个复杂的主动、被动或主被动兼有的过程[3]。近年来,不少研究者基于被动吸收的假设建立了一些有机污染物的吸收模型[4-6]。由于未考虑主动吸收过程,在运用这些模型预测植物对包含主动过程的有机污染物的吸收时会产生较大偏差,而且不能圆满地解释不同环境条件下根系吸收有机污染物能力的差异。主动过程相较于被动过程更易于调控且更易受到环境因素的影响,吸收动力学参数则可以揭示并表征主动吸收过程,因而吸收动力学参数的研究对根系吸收数学模型的建立就显得尤为重要。早在20 世纪50 年代,Epstein 和Hagen 就将酶促反应动力学方程应用于植物对离子的吸收中。Caassen等[7]依据动力学方程构建了养分离子的吸收模型,方程中最大吸收速率(Vmax)和米氏常数(Km)两个参数可定量描述植物根系吸收养分离子的特征,能表征环境条件对植物吸收养分的影响。尽管目前对植物根系吸收PAHs 的机理与动力学特征方面已开展了大量研究[8-10],但是关于不同环境条件对植物根系吸收PAHs的动力学参数的影响尚未见报道。自然界中植物的生长环境千差万别,不同温度及pH 等条件下植物根系活力及吸收能力会发生变化,植物根系吸收PAHs 的动力学特征也必然会发生改变。探讨环境条件对植物根系吸收PAHs 动力学参数的影响有助于深入揭示植物根系吸收PAHs 的生物化学机制和科学预测农作物PAHs污染的风险。
为此,本文选取小麦为材料,菲为PAHs 的代表,通过水培试验,探究不同条件下植物根系吸收PAHs的动力学参数差异,旨在揭示植物根系吸收PAHs 的动力学参数在不同环境条件下的变化规律,为阐释植物根系吸收PAHs 的生物学机制及构建作物根系吸收PAHs的机制型数学模型,更准确有效地预测农作物PAHs污染的风险提供科学依据。
1 材料与方法 1.1 供试材料供试小麦(Triticum aestivum L.)品种为南农9918(江苏地区主要栽培品种之一),购于江苏省农业科学院种子站。
1.2 试验设计 1.2.1 幼苗培养选取一定量比较均一的小麦种子用去离子水浮选去除瘪粒,然后用3%H2O2消毒5 min。消毒洗净后的小麦种子置于底部铺有用去离子水浸湿的滤纸的搪瓷托盘中,并放入恒温培养箱中,在黑暗、25℃条件下进行催芽。种子出芽后转移至底部铺有石英砂的搪瓷托盘中,并放入人工气候箱,白天/夜晚温度分别为25℃/20℃,光照强度为400 μmol·s-1·m-2,光周期为16 h,相对空气湿度为75%的条件下培养7 d。
1.2.2 水培试验选择长势比较一致的小麦幼苗移入水培箱内进行连续曝气培养,先后在1/2 浓度和全浓度Hoagland营养液(pH 5.50)中各培养3 d。接着用去离子水培养1d,然后按以下方案进行处理:①营养液中ρ(菲)为0、0.2、0.4、0.6、0.8、1.0 mg·L-1,pH 5.50,分别在15、20、25、30、35℃条件下处理4 h;②营养液中ρ(菲)梯度同①,25℃,在pH 分别为3.00、5.50、8.00 的条件下处理4 h;③营养液中ρ(菲)梯度同①,pH 5.50,25益,分别用营养液培养7、10、14 d(即苗龄分别为14、17、21 d)的小麦幼苗处理4 h;④营养液中ρ(菲)梯度同①,pH 5.50,25℃,分别用活体根和离体根处理4h。以上方案中每个处理都在黑色蜡纸包裹的500 mL玻璃烧杯中进行,各烧杯均加入500 mL 营养液,以PVC 孔板固定小麦21 株,然后置于人工气候箱中曝气培养,每处理设置3次重复。营养液中菲用甲醇溶解后加入,且各处理均含有等量的甲醇(控制甲醇浓度小于0.1%,在此浓度范围内甲醇对小麦生长无明显影响[11])。方案④中的离体根是从茎基部剪下的完整根。上述处理结束后,小麦根系用超纯水洗净后,放入甲醇中浸泡1~2 min,然后再用纯水洗净,擦干水分后测定菲含量。
1.2.3 测定方法称取鲜重1.00 g 左右小麦根或茎叶,剪碎混匀,装入离心试管中,加入10 mL 丙酮/二氯甲烷为1:1(体积比)的混合溶液,超声萃取30 min,萃取过程重复3次。将萃取液过无水硫酸钠硅胶柱收集至50 mL锥形瓶中,然后用10 mL 正己烷/二氯甲烷为1:1(体积比)的混合溶液淋洗,合并收集液与洗脱液在40℃下用真空旋转蒸发器蒸干;再用2 mL 甲醇(色谱纯)溶解,过0.22 μm 滤膜后用HPLC 分析。同时在鲜样中加入菲标准品测定回收率,该方法菲回收率为90.67%。
HPLC 分析条件:美国Thermo 公司UltiMate 3000HPLC,泵的型号为LPG-3400SDN,紫外检测器型号为VWD-3100,色谱柱为4.6 mm伊150 mm C18 柱(Thermo,美国),柱温30℃,流动相为甲醇/水(80/20,V/V),流速为1.0 mL·min-1,进样量为10 μL,紫外检测波长为254 nm。
1.3 数据统计分析采用Excel 和Origin 9.0 软件对试验结果进行数据处理、作图,用SPSS 21.0 软件作差异显著性分析。文中涉及到的动力学参数均采用米氏双倒数方程1/V=(Km/Vmax)伊(1/C)+1/Vmax求解[9-10]。
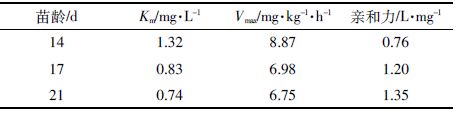
2 结果与讨论 2.1 不同温度条件下小麦根系菲吸收的动力学参数变化温度是影响酶和载体活性的重要因素[12-13]。通常,在一定温度范围内,随着温度的升高,酶和载体的活性增强,植物根系载体的转运能力也会增强;超过最适温度后,温度的升高会抑制载体活性和体内代谢,从而降低植物根系载体的转运能力。温度对小麦根系菲吸收动力学参数的影响如表 1 所示。在30℃范围内随着温度的升高,小麦根系菲吸收动力学的米氏常数和最大吸收速率均逐渐增大;当温度超过30℃时,米氏常数和最大吸收速率开始下降。在养分离子吸收动力学的研究中[14-15],Km为吸收速率达到最大吸收速率一半时营养液中离子浓度,通常以1/Km表示载体亲和力的大小,表征吸收效率的高低;Vmax是吸收所能达到的最大速率,其值越大,表明吸收的内在潜力越大。Vmax较大,Km较小时有利于植物对养分的吸收[16]。转运载体亲和力与温度的关系因植物和底物而异,如紫萍H2PO-4转运载体亲和力大小依次为25℃>10℃>35℃[17];苹果幼苗铁离子载体亲和力大小则依次为35℃>25益>10益[18]。本研究中,小麦菲转运载体亲和力大小为15益>25益>30益,表明小麦在相对低温的条件下对菲的吸收效率较高。在本研究条件下,35益范围内营养液中菲浓度无明显变化(P<0.05)[19],因此高温小麦根系菲亲和力差异不是因菲挥发引起的。可能原因是:菲转运载体不同于紫萍磷酸根转运载体和苹果苗铁离子载体,其适宜温度范围较低。35℃小麦根系菲亲和力增大可能是因介质温度过高导致小麦根系细胞膜结构受到一定程度的破坏,从而削弱了细胞膜对菲吸收的屏障作用所致。

|
土壤温度通常在25℃范围内[20],因此对表 1 中30℃范围内Km、Vmax与温度T(K)之间的关系采用指数方程拟合如下(拟合过程中开氏温度T=273.15+摄氏温度t):
 (1)
(1) 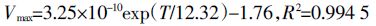 (2)
(2) 据以上公式可以推算出某温度下小麦根系菲吸收的Km和Vmax值。
2.2 不同pH条件下小麦根系菲吸收的动力学参数变化笔者课题组前期研究已证实需要载体协助并有耗能的主动过程参与了根系PAHs 的吸收,且此过程通过与H+共运方式进行[21];小麦根系菲吸收会改变根系细胞内部和外部的pH[22],同时该吸收过程对营养液中ρ(H+)具有依赖性,营养液pH 越高,根系菲的吸收量越小[21]。因此,介质ρ(H+)的高低必然会对小麦根系菲吸收的动力学过程产生影响。
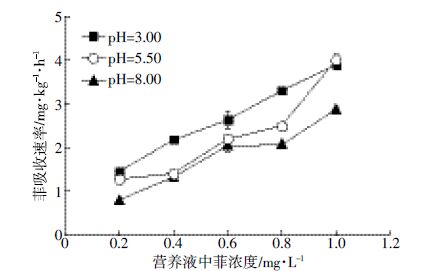
在一定pH 范围内,随着pH 升高,小麦根系菲吸收速率明显减小(P<0.05,成对数据t-检验,图 1),米氏常数值变大(表 2),根系菲转运载体的亲和力变小,小麦根系菲吸收的效率降低。研究发现在低pH的条件下,玉米根系ATPase 酶活性、H+泵的活性、质膜H+的渗透性都会增加[23]。而在低pH 的条件下营养液中ρ(H+)较大,H+的势能更高,H+进入根系的速率也加快,进而促进了菲与H+共运进入小麦根系,导致在相同ρ(菲)下根系菲吸收的速率增加。在pH3.00时,菲转运载体亲和力最大;在pH5.50 时,最大吸收速率的值最大。因此,弱酸条件更有利于小麦根系对菲的吸收。
|
| 图 1 不同pH条件下小麦根系菲吸收速率的浓度依赖性 Figure 1 Concentration-dependent uptake of phenanthrene by wheat roots at different pH values |

|
在养分离子的吸收动力学研究中,即使同一个植物品种,不同苗龄的根系对离子的吸收动力学参数也各异[24]。研究表明,培养6、13、20 d和27 d的苹果幼苗对N、P、K、Ca、Mg、Mn、Zn、Fe 元素的吸收速率明显不同[25]。小麦幼苗随苗龄的增长对P、K 的吸收下降,Vmax值变小而Km值增大[25]。小麦幼苗根系对菲的吸收动力学参数随着苗龄的增加也表现出差异(表 3)。在三周内,米氏常数和最大吸收速率都有减小的趋势,但苗龄从14 d到17 d其吸收动力学参数变化较17~21 d 更为明显,17 d之后动力学参数变化幅度变小。亲和力的变化表明,随着苗龄的增长,小麦根系菲吸收效率增加。更长时间小麦根系菲吸收能力的变化情况还有待进一步的研究。随着小麦的生长,小麦根长、根重、根尖数等形态参数都会发生变化[26-27]。国外学者发现根的形态在植物获取土壤营养元素的过程中发挥重要作用[28]。Zhan 等[29]逐步多元线性回归分析结果表明,比表面积在小麦根系菲吸收过程中起着至关重要的作用。因此,笔者推测小麦生长过程中根系形态的变化是导致小麦根系菲吸收动力学参数发生变化的重要原因。
|
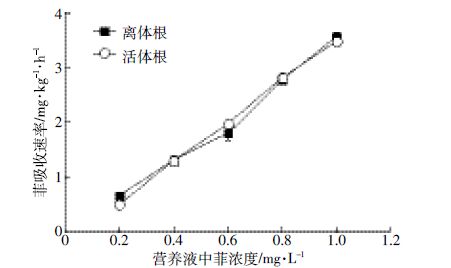
离体根是指剪掉植物的地上部分而保留茎基部以下的完整根。剪切对植株最直接的影响是降低了根系对水分的运输以及限制根系碳水化合物的供应,其对养分离子吸收的抑制不仅通过阻断蒸腾流中养分离子的被动吸收过程,而且离子主动向地上部分的转运也被中断。对离体根的研究,有助于阐明植物地上部分对根系吸收的影响以及有利于深入揭示有机污染在植物体内迁移和转运机理。在养分离子吸收动力学研究中,离体根与活体根吸收动力学是否一致尚无定论。有研究发现小麦离体根对养分和气体的吸收都出现了下降[30];韩振海等[14]研究表明,小金海棠、八楞海棠、青海花叶和山定子苹果的离体根和活体根对Fe3+吸收的动力学曲线基本一致。小麦离体根与活体根菲吸收的动力学曲线如图 2 所示。成对数据t-检验表明,在0~1.0 mg·L-1ρ(菲)内离体根与活体根菲吸收的动力学无显著差异(P>0.05),即地上部在较短的时间内对小麦根系菲吸收动力学的影响不明显,植物根系有机污染物吸收动力学更大程度上依赖植物根系在特定环境条件下自身的吸收能力。
|
| 图 2 小麦活体根和离体根菲吸收速率的浓度依赖性 Figure 2 Concentration-dependent uptake of phenanthrene by in vivo and in vitro wheat roots |
(1)在15~30℃范围内,小麦根系菲的最大吸收速率和米氏常数随着温度的升高而增大,其与温度的关系满足指数方程,通过此方程可以推算出该温度范围内任意温度下小麦根系菲吸收的Km和Vmax值。
(2)在pH 3.00~8.00 范围内,小麦根系菲吸收的速率随着pH 的增加而降低。在pH 3.00~5.50 条件下,小麦根系对菲的亲和力强、吸收潜力大,表明弱酸条件更有利于小麦根系菲吸收。在实际生产中可以通过调控土壤pH,以减少农作物对菲的吸收。
(3)水培条件下,幼苗期小麦随着苗龄的增加,小麦根系对菲亲和力增强。更长生育期小麦根系菲吸收动力学变化情况还有待进一步的研究。
(4)水培4 h内,小麦离体根与活体根吸收菲的动力学无显著差异。
| [1] | Kipopoulou A M, Manoli E, Samara C. Bioconcentration of polycyclic aromatic hydrocarbons in vegetables grown in an industrial area[J]. Environmental Pollution , 1999, 106 (3) : 369–380. DOI:10.1016/S0269-7491(99)00107-4 |
| [2] | Nisbet I C T, Lagoy P K. Toxic equivalency factors(TEFs) for polycyclic aromatic hydrocarbons(PAHs)[J]. Regulatory Toxicology and Pharmacology , 1992, 16 (3) : 290–300. DOI:10.1016/0273-2300(92)90009-X |
| [3] | Bromilow R H, Richard H, Chamberlain K. Principles governing uptake and transport of chemicals[M]. Contamination: odeling and Simulation of Organic Chemical Processes, 1995 : 37 -68. |
| [4] | Chiou C T, Sheng G Y, Manes M. A partition-limited model for the plant uptake of organic contaminants from soil and water[J]. Environmental Science & Technology , 2001, 35 (7) : 1437–1444. |
| [5] | Trapp S. Dynamic root uptake model for neutral lipophilic organics[J]. Environmental Toxicology and Chemistry , 2001, 21 (1) : 203–206. |
| [6] | Trapp S. Calibration of a plant uptake model with plant-and site-specific date for uptake of chlorinated organic compound into radish[J]. Environmental Science & Technology , 2015, 49 : 395–402. |
| [7] | Claassen N, Barber S A. Simulation model for nutrient uptake from soil by a growing plant root system[J]. Agronomy Journal , 1976, 68 (6) : 961–964. DOI:10.2134/agronj1976.00021962006800060030x |
| [8] | 王戎, 何杞双, 王雁, 等. 可溶性有机物对玉米根部菲和芴吸着与吸收过程的影响[J]. 农业环境科学学报 , 2009, 28 (1) : 35–39. WANG Rong, HE Qi-shuang, WANG Yan, et al. Impact of dissolved organic matter on sorption and absorption of fluorine and phenanthrene to maize root[J]. Journal of Agro-Environment Science , 2009, 28 (1) : 35–39. |
| [9] | 梁宵, 占新华, 周立祥. 不同作物根系多环芳烃吸收特征差异的比较研究[J]. 环境科学 , 2012, 33 (7) : 2516–2521. LIANG Xiao, ZHAN Xin-hua, ZHOU Li-xiang. Characterization comparison of polycyclic aromatic hydrocarbon uptake by roots of different crops[J]. Environment Science , 2012, 33 (7) : 2516–2521. |
| [10] | 易修, 袁嘉韩, 顾锁娣, 等. 小麦根系吸收萘、菲、芘的动力学特征[J]. 环境科学学报 , 2013, 33 (4) : 1135–1140. YI Xiu, YUAN Jia-han, GU Suo-di, et al. Kinetic characteristics of naphthalene, phenanthrene and pyrene uptake by wheat roots[J]. Acta Scientiae Circumstantiae , 2013, 33 (4) : 1135–1140. |
| [11] | Chapin F S, Moilanen L, Kielland K. Preferential use of organic nitrogen for growth by a non-mycorrhizal article sedge[J]. Nature , 1993, 361 : 150–153. DOI:10.1038/361150a0 |
| [12] | 陈书涛, 桑琳, 张旭, 等. 增温及秸秆施用对冬小麦田土壤呼吸和酶活性的影响[J]. 环境科学 , 2016, 37 (2) : 703–709. CHEN Shu-tao, SANG Lin, ZHANG Xu, et al. Effect of warming and straw application on soil respiration and enzyme activity in a winter wheat cropland[J]. Environment Science , 2016, 37 (2) : 703–709. |
| [13] | 杨春璐, 孙铁珩, 和文祥, 等. 温度对汞抑制土壤脲酶动力学影响研究[J]. 环境科学 , 2007, 28 (2) : 278–282. YANG Chun-lu, SUN Tie-heng, HE Wen-xiang, et al. Effect of temperature on kinetic of soil urease inhibited by Hg[J]. Environment Science , 2007, 28 (2) : 278–282. |
| [14] | 韩振海, 王倩. 植物的离子吸收动力学研究的现状和前景(综述)[J]. 北京农业大学学报 , 1994, 20 (4) : 381–387. HAN Zhen-hai, WANG Qian. Current status and perspectives of ion absorption kinetics in research on crop and fruit nutrition(Review)[J]. Acta Agriculturae Universitatis Pekinensis , 1994, 20 (4) : 381–387. |
| [15] | 常会庆, 李娜, 徐晓峰. 三种水生植物对不同形态氮素吸收动力学研究[J]. 生态环境 , 2008, 17 (2) : 511–514. CHANG Hui-qing, LI Na, XU Xiao-feng. NH4+ and NO3- uptake kinetics of three aquatic macrophytes[J]. Ecology and Environment , 2008, 17 (2) : 511–514. |
| [16] | Cacco G, Ferrari G, Saccomani M. Variability and inheritance of sulfate uptake efficiency and ATP-sulfurylase in maize[J]. Crop Science , 1978, 18 (3) : 503–505. DOI:10.2135/cropsci1978.0011183X001800030038x |
| [17] | 蔡树美, 张震, 辛静, 等. 光温条件和pH对浮萍生长及磷吸收的影响[J]. 环境科学与技术 , 2011, 34 (6) : 63–66. CAI Shu-mei, ZHANG Zhen, XIN Jing, et al. Effect of photon flux density and pH on growth ability and phosphorus removal efficiency of two duckweed species[J]. Environmental Science & Technology , 2011, 34 (6) : 63–66. |
| [18] | 李振侠, 徐继忠, 高仪. 苹果矮化砧木SH40和M26铁吸收动力学参数比较[J]. 果树学报 , 2006, 22 (5) : 548–550. LI Zhen-xia, XU Ji-zhong, GAO Yi. Kinetic paramenters of iron absorption of two apple dwarf rootstocks SH40 and M26[J]. Journal of Fruit Science , 2006, 22 (5) : 548–550. |
| [19] | Zhan X H, Ma H L, Zhou L X, et al. Accumulation of phenanthrene by roots of intact wheat(Triticum aestivnm L.) seedlings:Passive or active uptake?[J]. BMC Plant Biology , 2010, 10 : 52. DOI:10.1186/1471-2229-10-52 |
| [20] | Chen S Y, Zhang X Y, Pei D, et al. Effects of straw mulching on soil temperature, evaporation and yield of winter wheat:Field experiments on the North China Plain[J]. Annals of Applied Biology , 2007, 150 (3) : 261–268. DOI:10.1111/aab.2007.150.issue-3 |
| [21] | Zhan X H, Zhang X B, Yin X M, et al. H+/phenanthrene symporter and aquaglyceroporin are implicated in phenanthrene uptake by wheat(Triticum aestivum L.) roots[J]. Journal of Environmental Quality , 2012, 41 (1) : 188–196. DOI:10.2134/jeq2011.0275 |
| [22] | Zhan X H, Yi X, Yue L, et al. Cytoplasmic pH-Stat during phenanthrene uptake by wheat roots:A mechanistic consideration[J]. Environmental Science & Technology , 2015, 49 : 6037–6044. |
| [23] | Yan F, Robert F, Stefanie S, et al. Adaptation of active proton pumping and plasmalemma ATPase activity of corn roots to low root medium pH[J]. Plant Physiology , 1998, 117 (1) : 311–319. DOI:10.1104/pp.117.1.311 |
| [24] | Kelly J M, Barber S A. Magnesium uptake kinetics in lobolly pine seeding[J]. Plant and Soil , 1991, 134 (2) : 227–232. DOI:10.1007/BF00012040 |
| [25] | Bhat K S. Nutrient inflows into apple roots[J]. Plant and Soil , 1983, 71 (1) : 371–380. |
| [26] | Anghinoni I, Baligar V, Barber S. Growth and uptake rates of P, K, Ca and Mg in wheat[J]. Journal of Plant Nutrition , 1981, 3 (6) : 923–933. DOI:10.1080/01904168109362888 |
| [27] | Al-khafaf S, Aziz F G, Salih H M, et al. Shoot and root growth and nutrients uptake of wheat as affected by soil layers[J]. Plant and Soil , 1989, 117 (1) : 59–66. DOI:10.1007/BF02206257 |
| [28] | Schenk M K, Barber S A. Root characteristics of corn genotypes as related to P uptake[J]. Agronomy Journal , 1979, 71 (6) : 921–924. DOI:10.2134/agronj1979.00021962007100060006x |
| [29] | Zhan X H, Liang X, Xu G H, et al. Influence of plant root morphology and tissue composition on phenanthrene uptake:Stepwise multiple linear regression analysis[J]. Environmental Pollution , 2013, 179 : 294–300. DOI:10.1016/j.envpol.2013.04.033 |
| [30] | Bloom A J, Caldwell R M. Root excision decreases nutrient absorption and gas fluxes[J]. Plant Physiology , 1988, 87 (4) : 794–796. DOI:10.1104/pp.87.4.794 |
 2016, Vol. 35
2016, Vol. 35




