文章信息
- 刘聪, 许平平, 王亚, 郑燕恒, 林巧云, 唐皓, 张春华, 葛滢
- LIU Cong, XU Ping-ping, WANG Ya, ZHENG Yan-heng, LIN Qiao-yun, TANG Hao, ZHANG Chun-hua, GE Ying
- 不同氮磷浓度对蛋白核小球藻砷富集和转化的影响
- Effects of various nitrogen and phosphorus concentrations on arsenic accumulation and transformation in Chlorella pyrenoidesa
- 农业环境科学学报, 2016, 35(9): 1665-1671
- Journal of Agro-Environment Science, 2016, 35(9): 1665-1671
- http://dx.doi.org/10.11654/jaes.2016-0402
文章历史
- 收稿日期: 2016-03-26
2. 南京农业大学生命科学实验中心, 元素与生命科学示范实验室, 南京 210095
2. Laboratory Centre of Life Science, Nanjing Agricultural University, Nanjing 210095, China
砷是自然界中有毒的的类金属元素,被列为玉类致癌物[1]。随着经济和社会的发展,工农业活动的不合理排放导致砷污染日趋严重,引起了国内外学者的广泛关注。在自然水体中,砷含量范围为0.5~5000 μg·L-1[2],在某些受污染的水体中甚至高达20 mg·L-1[3],其形态以砷酸盐(As5+)和亚砷酸盐(As3+)为主[4]。
微藻是海洋和淡水生态系统中的初级生产者,以阳光、CO2、无机盐和水分自养生长,通过光合作用产生氧气和有机物,对维护水环境生态平衡具有重要作用。小球藻分布广泛、适应能力强,对砷的富集高达50 000 μg·g-1[5],因而在含砷废水的净化上有巨大的潜力[6],但其修复效果受到培养介质中营养条件的影响[7]。
氮(N)、磷(P)等无机营养盐是限制小球藻生长和繁殖的重要因子,不足或过多都会对藻细胞的生长和砷代谢过程产生影响。磷酸盐(PO43-)能与 As5+竞争藻细胞膜上的磷酸盐结合位点[8-9],因此P 含量的变化会影响小球藻对As 的吸收和毒性。Bahar 等[6]发现低P 增加了As5+对小球藻的毒性,Knauer 等[10]报道低P 促进了蛋白核小球藻对As5+的富集,Levy等[11]和Karadjova 等[12]则证实增加P 营养降低了As5+和As3+对小球藻的吸收和毒性效应。
与P 相比,N 对微藻As 富集和转化的影响则报道很少。Maeda等[13]发现随着培养液硝酸盐(NO3-)浓度的增加,念珠藻细胞中总砷的含量减少,Wang 等[14]发现缺N条件下莱茵衣藻能够富集更多的As3+。然而在上述研究中,N浓度的变化对藻类的生长有显著的影响[13-14],由此可能造成微藻As富集的差异。为了排除N、P浓度变化对小球藻生长的影响,本文在多个N、P水平中选出不影响藻细胞生长的N、P 组合,再结合As3+和As5+处理,研究N、P浓度对小球藻As富集和转化的影响,为揭示蛋白核小球藻As代谢的调控机制、提高水环境砷污染的修复效率提供理论依据。
1 材料与方法 1.1 藻种及培养条件蛋白核小球藻(C. pyrenoidesa)FACHB-5 购于中科院武汉水生生物研究所国家淡水藻种库。所用培养基为BG-11[15],pH 调至7.1,高压蒸汽灭菌(121℃、30min),培养条件为:温度30±1℃,光照明暗比12 h颐12h,光照强度为3500~4000 lx,培养期间每天定时摇匀3次。
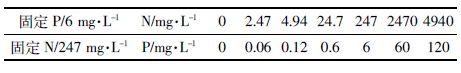
1.2 N、P浓度对蛋白核小球藻生长的影响培养基N 源和P源分别为NaNO3(247 mg N·L-1)和K2HPO4(6 mg P·L-1)。为研究N、P浓度对小球藻生长的影响,在固定一种元素浓度后,设置另一种元素的系列浓度(表 1),连续培养,每天用酶标仪测定小球藻的OD680值。固定P元素、不同N 浓度的藻样于第3 d收集,固定N元素、不同P浓度藻体由于第3 d生长无差异,故延长至第5 d收集,用甲醇提取色素,利用分光光度法分别测定其在470、653、666 nm 处的A 值,计算其叶绿素a,叶绿素b 和类胡萝卜素的含量[16]。
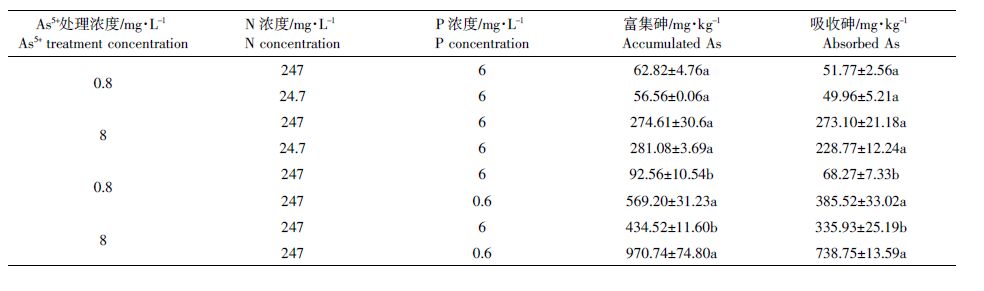
小球藻培养至对数期后,离心得到的藻细胞用去离子水清洗2次,将其转入不同N、P 浓度的BG11 培养基。由于小球藻对缺N很敏感,为了避免藻细胞生长受抑制对As 富集和代谢的影响,培养液N 浓度设置为247 mg·L-1 和24.7 mg·L-1,且没有进行缺N 处理;另一方面,小球藻在生长过程中能大量吸收P 并储存在细胞内,为了降低藻细胞的P 含量,小球藻在缺P营养液中培养2 d后,再转至P浓度为6 mg·L-1和0.6 mg·L-1的培养基中。与前述小球藻生长实验类似,N、P 浓度设置也采取了固定一种元素浓度、变换另一种元素浓度的方法,即247 mg·L-1 N 与6、0.6 mg·L-1 P 组合、6 mg·L-1 P 与247、24.7 mg·L-1 N 组合,在此基础上设置As3+和As5+处理浓度0.8 mg·L-1、8 mg·L-1,每个处理3 个平行,并以不加砷的藻液作为对照,初始OD680为0.085。为消除pH 变化的影响,培养液中加入20 mmol·L-1 3-吗啉丙磺酸(MOPS),控制pH在7.1 左右。培养3 d后,离心7 mL 藻液,用去离子水清洗藻体2次,样品消解后测定其富集的砷含量。另外离心7 mL 藻体,用pH 7.0 的0.1 mol·L-1磷酸缓冲盐溶液(PBS)清洗(每次用量为5 mL 并冲洗3 次),去除藻细胞表面吸附的砷[17],测定藻内吸收的砷含量及其形态。
1.4 藻体总砷的测定称取干重为1.00 g样品,加入2 mL 体积比为4:1的HNO3颐HClO4混合酸,转至玻璃消煮管中,静置过夜,采用海能SH230 石墨消解仪(上海海能实验仪器科技有限公司)电热消解至溶液澄清透明,赶酸至剩余约0.2 mL液体,用去离子水润洗并移至5 mL 容量瓶中,加浓盐酸(优级纯)、10%硫脲和10%抗坏血酸混合溶液后定容[18]。采用氢化物发生-双道原子荧光光度计(HG-AFS,北京吉天仪器有限公司)测定样品砷含量,同批次运用同样方法消解标准物质(NIST-1568b),回收率为84%~102%,表明测定方法可靠。
1.5 砷形态提取及测定称取干重样品1.00 g,加入0.28 mol·L-1 HNO3进行提取,90℃水浴超声10 min 后14 000伊g 离心10min,重复提取3 次[19],上清液合并后用0.22 μm 滤膜过滤,滤液采用高效液相-氢化物发生-原子荧光(HPLC-HG-AFS,北京吉天仪器有限公司)测定小球藻中砷的形态。检测条件如下:进样体积100 μL,阴离子交换柱(Hamilton PRP-X100),流动相为17.5mmol·L-1磷酸氢二铵(pH=6.1),等度洗脱;载流5%盐酸;还原剂1.5%硼氢化钾垣0.5%氢氧化钾;屏蔽气700mL·min-1;载气Ar,600mL·min-1;光电倍增管电压270 V;灯电流100 mA。本实验中砷提取效率为84.7%~108.5%,说明提取方法可靠。
1.6 数据处理运用Excel 2007 和SPSS 20 统计分析软件进行数据处理与分析,用SigmaPlot 12.5作图。采用单因素方差分析(One-way ANOVA)和Duncan 检验进行差异显著性分析(P<0.05)。
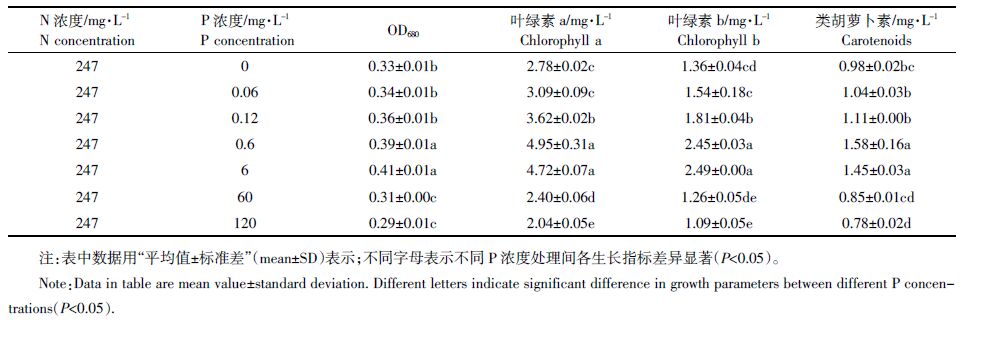
2 结果与分析 2.1 不同N、P浓度对蛋白核小球藻生长的影响由表 2 可以看出,P 浓度为6 mg·L-1 时,N 浓度过高或过低都会影响小球藻的生长。而在藻体培养3 d内,24.7 mg·L-1 和247 mg·L-1 的N 浓度对OD680 值、叶绿素a、b 及类胡萝卜素含量都没有显著影响。这表明,3 d内24.7 mg·L-1和247 mg·L-1的N 浓度对小球藻的生长没有影响。

|
当N 浓度为247 mg·L-1,P 浓度过高或过低也会影响小球藻的生长。藻体培养3 d时各个P浓度都不影响小球藻的OD680值,因此延长至第5 d,发现P 浓度为0.6 mg·L-1 和6 mg·L-1,对小球藻的OD680、叶绿素a、叶绿素b 和类胡萝卜素都没有显著性差异(表 3)。这表明,5 d内0.6 mg·L-1和6 mg·L-1的P浓度对小球藻生长没有影响。
|
由表 4 和表 5 可知:相同N、P 浓度处理下,小球藻对砷的富集和吸收总量随As3+和As5+处理浓度的增加而增加。当N 为247 mg·L-1时,降低P浓度导致藻细胞对As3+和As5+的富集和吸收都显著增加(P<0.05),而当P浓度为6 mg·L-1时,降低N 浓度却不影响小球藻对As3+和As5+的富集和吸收。

|
|
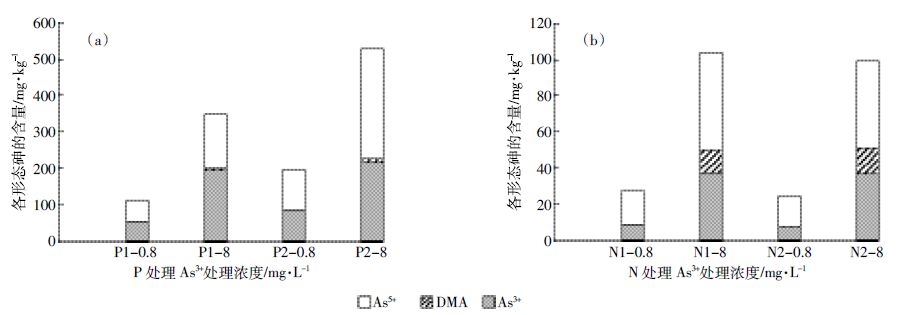
形态的影响As3+处理小球藻3 d后,不同P 浓度对藻细胞As形态及各形态的含量有显著影响(图 1a)。在P-As3+处理组合下,胞内主要以As3+和As5+两种形态存在,其中As5+所占比例为42.8%~57.1%。当As3+浓度为8mg·L-1时,胞内都出现了二甲基砷(DMA),表明当外界As浓度高时,小球藻体内存在砷甲基化途径。此外,当P浓度降为0.6 mg·L-1时,相同浓度的As3+处理下,胞内As3+、As5+和DMA的含量都有明显的增加。
|
| 图 1 不同浓度P-As3+(a)和N-As3+(b)处理组合下蛋白核小球藻胞内各种形态砷的含量 Figure 1 Content of various As species in C. pyrenoidesa under different concentrations of P-As3+(a)and N-As3+(b)combinations |
然而,当培养液P 浓度不变,N 浓度降为24.7mg·L-1时,相同浓度的As3+处理下,N 浓度的降低不会影响小球藻胞内各As形态的含量(图 1b)。在N-As3+处理组合下,当0.8 mg·L-1的As3+处理时,胞内存在As3+和As5+两种形态无机As,As5+所占比例为67.7%~68.9%。当8 mg·L-1的As3+处理时,胞内As以As3+、As5+和DMA 三种形态存在,所占比例分别为35.8%~37.1%,48.3%~52.0%和12.2%~14.6%。
2.4 As5+处理下不同N、P浓度对蛋白核小球藻胞内砷形态的影响由图 2可知,小球藻在As5+处理3 d后,各个N、P浓度组合下胞内绝大多数是As5+,约占总As含量的94.2%~99.4%。不同浓度P-As5+处理组合下小球藻胞内砷形态有明显的差异,当N 浓度固定为247 mg·L-1、P 降为0.6 mg·L-1时,会促进胞内As5+还原成As3+,随后甲基化产生二甲基砷(DMA),并且在培养液中检测到3.23 μg·L-1的DMA,说明小球藻在体内甲基化后会将DMA 排出体外。与As3+处理类似,当P浓度固定为6 mg·L-1、N 浓度降为24.7 mg·L-1 时,胞内各As形态的含量没有明显的变化,当As5+处理浓度从0.8mg·L-1上升至8 mg·L-1时,胞内的As形态从只有As5+变为以As5+为主,并有少量As3+。

|
| 图 2 不同浓度P- As5+(a)和N-As5+(b)处理组合下蛋白核小球藻胞内各种形态砷的含量 Figure 2 Content of various As species in C. pyrenoidesa under different P-As5+ and N-As5+ concentration combinations |
蛋白核小球藻含有丰富的蛋白质,对N 营养的需求比对P营养的需求更敏感。当提供较少的N 时,N营养不能维持小球藻的正常生长,由于硝酸盐还原酶的活性存在一定阈值,提供较多的N 元素时也会抑制其生长[20]。培养3 d时发现24.7 mg·L-1 和247mg·L-1的N 浓度处理下小球藻生长和色素含量达到最佳。当提供较多或较少的P元素时,前3 d小球藻的生长并没有明显的变化,这是由于小球藻细胞具有储存磷酸盐的功能,外界P含量较低时会利用体内的磷酸盐来维持其生长的需要[21],但随着体内P 含量的消耗,当培养液中P浓度过高或过低时都表现出显著抑制其生长。培养5 d和P浓度在0.6 mg·L-1 和6mg·L-1时,生长和色素含量达到最大。这说明N、P 营养过高或者过低都会显著影响蛋白核小球藻的生长和色素的合成,与马彩虹等[22]发现N、P 浓度过高和过低都会降低小球藻的生长是一致的。此外,微藻的生长也与其N颐P 关系密切相关[23],因此在大规模培养蛋白核小球藻时,N、P浓度和N颐P 是生长的重要影响因素,适宜的N、P 浓度和N颐P 才能促进小球藻的快速生长。
3.2 N、P营养对蛋白核小球藻砷富集的影响有研究指出,N 浓度会影响微藻对As 的富集。Maeda 等[13]用100 mg·L-1 的As5+处理念珠藻,细胞中总砷的含量随培养液中硝酸盐(NO3-)浓度的增加而减少。Wang等[14]发现缺N 条件下莱茵衣藻能够富集更多的As3+。然而本研究结果表明,降低N 浓度为24.7 mg·L-1没有改变蛋白核小球藻对As3+和As5+的富集量。造成这些差异的原因在于不同N 浓度下微藻的生长是否受影响。上述试验中,在不同的N 浓度下,念珠藻和莱茵衣藻的生长差异显著。本实验选择不影响小球藻生长的两个N 浓度,能较为准确地反映N对小球藻As富集的影响。
Levy 等[11]和Karadjova 等[12]指出,P 浓度的降低会增加小球藻对砷的富集。本试验与前人的结果是一致的。降低P浓度为0.6 mg·L-1会显著增加蛋白核小球藻对As3+和As5+的富集量。低P 会促进小球藻对As5+的吸收是由于As5+和P 的竞争作用,而低P会促进小球藻对As3+的吸收可能是由于培养液中P 浓度降低时,会促进小球藻合成更多数量的转运体或者更强能力的转运体来吸收更多的As3+[12]。由此可见,胞外P浓度对微藻As3+和As5+富集有着重要的影响。这对提高水环境砷污染的修复效率提供了理论依据。
3.3 N、P营养对蛋白核小球藻砷转化的影响在As3+处理后,小球藻胞内As3+和As5+的比例介于30.6%~37.1%和42.8%~69.4%,As3+处理浓度提高到8 mg·L-1时,藻细胞内出现了DMA(图 1)。其他微藻也有类似的结果,例如,集胞藻在As3+处理时能启动氧化机制,将大部分的As3+转化为毒性较小的As5+后存储[24]。当As3+处理浓度更高,小球藻则通过甲基化机制,将体内过量的无机砷转化为毒性更小的DMA。As5+处理时,小球藻胞内94.2%~99.4%都是As5+,As3+只占总As 的0.63%~4.19%,说明小球藻的As 还原很少(图 2)。同样,Levy 等[11]和Murray 等[25]的结果发现淡水藻体内As5+还原成As3+的比例为1%~6%。As5+还原量低可能是与小球藻胞内高达8 g·kg-1 的P含量有关,P 能与砷酸盐还原酶结合,不利于胞内As5+的还原。
P 浓度为6 mg·L-1,且N 浓度降为24.7 mg·L-1时,无论As3+和As5+处理,都没有改变小球藻体内砷形态转化。这说明在不影响小球藻生长的前提下,一定程度上N 浓度的变化对小球藻砷代谢没有影响。有研究表明缺N 条件下会促进念珠藻甲基化,生成MMA 和DMA[13],可能是由于缺N 时,念珠藻会合成刺激砷富集和甲基化的固氮酶[26]。本实验中小球藻是否也存在同样的固氮酶仍需进一步研究。N 浓度为247 mg·L-1且P 降为0.6 mg·L-1 时,促进小球藻体内的As5+还原为As3+,并产生DMA。这与不同P水平下钝顶螺旋藻As代谢的结果[27]是一致的。培养液中检测到了DMA,说明胞内As 的外排也得到了强化。
4 结论(1)固定N 为247 mg·L-1 和P 为0.6、6 mg·L-1,以及固定P为6 mg·L-1和N 为24.7、247 mg·L-1的浓度组合对蛋白核小球藻的生长没有影响。
(2)上述N、P 浓度组合中,降低N 浓度不会影响小球藻对As3+和As5+的富集,而降低P 浓度则会显著增加两种形态As的富集。
(3)As3+和As5+处理时,小球藻胞内存在As 氧化、还原和甲基化过程。降低N浓度不影响As在胞内的形态转化,而降低P浓度会促进As的还原、甲基化和外排。
| [1] | Oremland R S, Stolz J F. The ecology of arsenic[J]. Science , 2003, 300 (5621) : 939–944. DOI:10.1126/science.1081903 |
| [2] | Gladysheva T B, Oden K L, Rosen B P. Properties of the arsenate reductase of plasmid R77h3[J]. Biochemistry , 1994, 33 (23) : 7288–7293. DOI:10.1021/bi00189a033 |
| [3] | Raman M A, Hasegawa H. Arsenic in freshwater systems:Influence of eutrophication on occurrence, distribution, speciation, and bioaccumulation[J]. Applied Geochemistry , 2012, 27 (1) : 304–314. DOI:10.1016/j.apgeochem.2011.09.020 |
| [4] | Yin X X, Wang L H, Bai R, et al. Accumulation and transformation of arsenic in the Blue-Green alga Synechocysis sp[J]. Water, Air, & Soil Pollution , 2011, 223 (3) : 1183–1190. |
| [5] | Maeda S, Nakashima S, Takeshita T, et al. ioaccumulation of arsenic by freshwater algae and the application to the removal of inorganic arsenic from an aqueous phase:PartⅡ. By Chlorella vulgaris isolated from arsenic-polluted environment[J]. Separation Science and Technology, , 1985, 20 (2/3) : 153–161. |
| [6] | Bahar M M, Megharaj M, Naidu R. Influence of phosphate on toxicity and bioaccumulation of arsenic in a soil isolate of microalga Chlorella sp[J]. Environmental Science and Pollution Research , 2016, 23 (3) : 2663–2668. DOI:10.1007/s11356-015-5510-7 |
| [7] | Pantoja M L. The mechanisms of arsenic detoxification by the green microalgae Chlorella vulgaris[D]. Middlesex University, 2014. |
| [8] | Wang N X, Li Y, Deng X H, et al. Toxicity and bioaccumulation kinetics of arsenate in two freshwater green algae under different phosphate regimes[J]. Water Research , 2013, 47 (7) : 2497–2506. DOI:10.1016/j.watres.2013.02.034 |
| [9] | Wang Y, Wang S, Xu P, et al. Review of arsenic speciation, toxicity and metabolism in microalgae[J]. Reviews in Environmental Science and Bio/Technology , 2015, 14 (3) : 427–451. DOI:10.1007/s11157-015-9371-9 |
| [10] | Knauer K, Hemond H. Accumulation and reduction of arsenate by the freshwater green alga Chlorella sp[J]. Journal of Phycology , 2000, 36 (3) : 506–509. DOI:10.1046/j.1529-8817.2000.99056.x |
| [11] | Levy J L, Stauber J L, Adams M S, et al. Toxicity, biotransformation, and mode of action of arsenic in two freshwater microalgae(Chlorella sp[J]. Environmental Toxicology and Chemistry , 2005, 24 (10) : 2630–2639. DOI:10.1897/04-580R.1 |
| [12] | Karadjova I B, Slaveykova V I, Tsalev D L. The biouptake and toxicity of arsenic species on the green microalga Chlorella salina in seawater[J]. Aquatic Toxicology , 2008, 87 (4) : 264–271. DOI:10.1016/j.aquatox.2008.02.006 |
| [13] | Maeda S, Mawatari K, Ohki A, et al. Arsenic metabolism in a freshwater food chain:Blue green alga(Nostoc sp[J]. Applied Organometallic Chemistry , 1993, 7 (7) : 467–476. DOI:10.1002/(ISSN)1099-0739 |
| [14] | Wang N X, Huang B, Xu S, et al. Effects of nitrogen and phosphorus on arsenite accumulation, oxidation, and toxicity in Chlamydomonas reinhardtii[J]. Aquatic Toxicology , 2014, 157 : 167–174. DOI:10.1016/j.aquatox.2014.10.012 |
| [15] | Podder M S, Majumder C B. Phycoremediation of arsenic from wastewaters by Chlorella pyrenoidosa[J]. Groundwater for Sustainable Development , 2015, 1 (1) : 78–91. |
| [16] | Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Biochemical Society Transactions , 1983, 11 (5) : 591–592. DOI:10.1042/bst0110591 |
| [17] | 王亚, 张春华, 王淑, 等. 带菌盐藻对不同形态砷的富集和转化研究[J]. 环境科学 , 2013, 34 (11) : 4257–4265. WANG Ya, ZHANG Chun-hua, WANG Shu, et al. Accumulation and transformation of different arsenic species in nonaxenic Dunaliella salina[J]. Environmental Science , 2013, 34 (11) : 4257–4265. |
| [18] | Ge Y, Ning Z, Wang Y, et al. Quantitative proteomic analysis of Dunaliella salina upon acute arsenate exposure[J]. Chemosphere , 2016, 145 : 112–118. DOI:10.1016/j.chemosphere.2015.11.049 |
| [19] | Shi G L, Lou L Q, Zhang S, et al. Arsenic, copper, and zinc contamination in soil and wheat during coal mining, with assessment of health risks for the inhabitants of Huaibei, China[J]. Environmental Science and Pollution Research , 2013, 20 (12) : 8435–8445. DOI:10.1007/s11356-013-1842-3 |
| [20] | 王金花, 唐洪杰, 王修林, 等. 氮, 磷营养盐对东海原甲藻生长和硝酸还原酶活性的影响[J]. 应用与环境生物学报 , 2008, 14 (5) : 620–623. WANG Jin-hua, TANG Hong-jie, WANG Xiu-lin, et al. Effects of nitrate and phosphate on growth and nitrate reductase activity of Prorocentrum donghaiense[J]. Chinese Journal of Applied and Environmental Biology , 2008, 14 (5) : 620–623. |
| [21] | 李斌. 氮, 磷等环境因子对有害赤潮生物海洋卡盾藻的生理生态效应[D]. 广州:暨南大学, 2009. LI Bin. The ecophysiological responses of harmful algal chattonella marina to nitrogen and phosphorus[D]. Guangzhou:Jinan University, 2009. |
| [22] | 马彩虹, 麻晓霞, 马玉龙, 等. 不同氮磷浓度对小球藻生长性能的影响[J]. 安徽农业科学 , 2012, 40 (22) : 11367–11369. MA Cai-hong, MA Xiao-xia, MA Yu-long, et al. Effects of different concentrations of N, P on the growth performance of Chlorella sp[J]. Journal of Anhui Agriculture Science , 2012, 40 (22) : 11367–11369. |
| [23] | Rhee G Y. Effects of N:P atomic ratios and nitrate limitation on algal growth, cell composition, and nitrate uptake[J]. Limnology and Oceanography , 1978, 23 (1) : 10–25. DOI:10.4319/lo.1978.23.1.0010 |
| [24] | 张兵, 王利红, 徐玉新, 等. 集胞藻(Synechocystis sp. PCC6803)对砷吸收转化特性的初步研[J]. 生态毒理学报 , 2011, 6 (6) : 629–663. ZHANG Bing, WANG Li-hong, XU Yu-xin, et al. Study on absorption and transformation of arsenic in blue alga(Synechocystis sp. PCC6803)[J]. Asian Journal of Ecotoxicology , 2011, 6 (6) : 629–663. |
| [25] | Murray L A, Raab A, Marr I L, et al. Biotransformation of arsenate to arsenosugars by Chlorella vulgaris[J]. Applied Organometallic Chemistry , 2003, 17 (9) : 669–674. DOI:10.1002/(ISSN)1099-0739 |
| [26] | Maeda S, Kumeda K, Maeda M, et al. Bioaccumulation of arsenic by freshwater algae(Nostoc sp.) and the application to the removal of inorganic arsenic from an aqueous phase[J]. Applied Organometallic Chemistry , 1987, 1 (4) : 363–370. DOI:10.1002/(ISSN)1099-0739 |
| [27] | 王淑, 许平平, 刘聪, 等. 不同磷浓度对钝顶螺旋藻吸附, 吸收和转化砷酸盐的影响[J]. 农业环境科学学报 , 2015, 34 (6) : 1034–1040. WANG Shu, XU Ping-ping, LIU Cong, et al. Effects of phosphorus at various concentrations on adsorption, uptake and transformation of arsenate by Spirulina platensis[J]. Journal of Agro-Environment Science , 2015, 34 (6) : 1034–1040. |
 2016, Vol. 35
2016, Vol. 35