文章信息
- 徐小逊, 董袁媛, 邓玉兰, 霍庆霖, 张世熔, 蒲玉琳
- XU Xiao-xun, DONG Yuan-yuan, DENG Yu-lan, HUO Qing-lin, ZHANG Shi-rong, PU Yu-lin
- 镉胁迫对豨莶生长及光合作用相关参数的影响
- Effects of cadmium stress on growth and photosynthetic parameters of Sigesbeckia orientalis L.
- 农业环境科学学报, 2016, 35(9): 1672-1679
- Journal of Agro-Environment Science, 2016, 35(9): 1672-1679
- http://dx.doi.org/10.11654/jaes.2016-0573
文章历史
- 收稿日期: 2016-04-22
镉(Cd)是一种对植物有较强毒害作用的重金属元素[1],由于其在土壤中有较强的移动性,容易被植物吸收和积累[2]。过量的Cd 进入植物体内,会抑制根系的生长[3]、破坏生物细胞膜的结构和功能[4],使叶绿素、糖及蛋白质合成受阻,抑制光合及呼吸作用,降低酶的活性,最终导致生理代谢紊乱甚至死亡[5-7]。
光合作用是植物赖以生长和生物量递增所必须的重要生理过程[8]。Cd对植物光合作用的影响主要表现在直接干扰叶绿素的生物合成、破坏光合器官及色素、显著降低植物光合作用速率等[9],这种影响与不同植物对Cd的耐受程度有关。研究发现,非耐受植物的光合色素(叶绿素a、叶绿素b 等)[10]、气体交换参数(净光合速率Pn、气孔导度Gs 等)[11]和叶绿素荧光参数(电子传递的量子产率椎PS域、光化学淬灭系数qP 等)[9]等光合特性指标在Cd胁迫下均会出现显著降低。但对那些Cd富集或超积累植物而言,较低浓度的Cd胁迫却对其光合作用未产生明显抑制,如龙葵(Solanum nigrum L.)、宝山堇菜(Viola baoshanensis)等在低Cd胁迫下,植株生物量、叶绿素含量、Pn和最大光化学量子产量Fv/Fm等与对照无显著差异[12-13]。然而,不同超积累植物的光合特性也存在明显差异。如,球果蔊菜[Rorippa globosa(Turcz.)Thell.]叶绿素含量随Cd 浓度的升高呈先升高后降低的趋势[14],而龙葵的叶绿素含量则呈不断下降的趋势[12]。上述结果表明,Cd胁迫对不同植物的光合作用影响不同,可能存在较为复杂的调控机制。因此,进一步开展Cd超积累植物的光合特性研究,对阐明超积累植物在Cd胁迫下的光合适应能力有重要意义。
豨莶(Sigesbeckia orientalis L.)为菊科豨莶属的植物,在我国长江流域及以南地区有较广泛的分布。前期研究发现,豨莶具有生物量大、生长迅速的特点,同时其对Cd 有较强的富集和向地上部转运的能力,是一种潜在的Cd污染土壤修复的超积累植物材料[15]。目前对豨莶耐受Cd 的生理机制研究还不够深入,仅分析了Cd 胁迫下豨莶根和叶中抗氧化酶的响应特征[15],而对植物生理代谢的重要过程光合作用在Cd胁迫下的应答机制尚未进行研究。因此,本研究拟通过盆栽试验,分析不同Cd 浓度下豨莶的生长、光合色素含量、气体交换参数和叶绿素荧光参数的变化规律,为深入揭示其耐受Cd 的生理机制提供依据。
1 材料与方法 1.1 试验材料豨莶种子采集于四川省凉山州会东县铅锌矿区(26°39’40”N,102°46’11”E)。
1.2 试验设计 1.2.1 幼苗培养挑选饱满豨莶种子,用0.05%NaClO 浸泡消毒30min,再用蒸馏水将其冲洗干净,播种于未受重金属污染的营养土中,培养4 周后选择长势一致的幼苗(4叶1心,株高为5~6 cm)备用。
1.2.2 盆栽试验供试土壤为水稻土,采自四川省成都市温江区(30°43’04义N,103°52’13义E)。土壤pH值为7.12,全氮和有机质分别为1.28、21.32 g·kg-1,碱解氮、有效磷和有效钾分别为75.35、16.79、145.43 mg·kg-1,Cd 含量为0.13 mg·kg-1,机械组成为粉粒40.8%、砂粒33.7%、粘粒25.5%。
采集表层土(0~20 cm),经风干、压碎,过5 mm筛后备用。试验用桶为塑料桶(30 cm×20 cm),每桶装6.0kg 土,设置5 个Cd 处理浓度(0、10、50、100、150mg·kg-1),每个处理设置3 个重复。Cd 以CdCl2·2.5H2O 的形式固态加入到土壤中,同时每桶施4.0 g复合肥(N:P2O:K2O=17:17:17,以NH4NO3和K2HPO4的形式供给),投加的Cd 和复合肥在土壤中充分混匀并静置4 周,使重金属Cd 含量及形态达到平衡状态再进行幼苗移栽。试验于2014 年3 月开始育苗,4 月底选取长势一致的豨莶幼苗(4 叶1 心)进行移栽,每桶3株,即每个处理浓度9 株。
1.3 测定项目及方法 1.3.1 生物量及Cd 含量把豨莶植株从土壤中取出,先用蒸馏水将根系表面的泥土冲洗干净,然后在20 mmol·L-1乙二胺四乙酸二钠(EDTA-Na2)溶液中交换30 min,去除根系表面吸附的镉,最后用去离子水洗干净。用吸水纸将表面水分吸干,将豨莶地上部和地下部分出,105℃下杀青2 h,然后在60℃下烘干至恒重,称量并记录。
采用FAAS-M6 原子吸收火焰分光光度计测定植物地下部和地上部的Cd 含量。Cd胁迫60 d后,将烘干的豨莶植株的地下部和地上部分别混合取样,分别称取0.300 g于50 mL锥形瓶中,加入12 mL 混酸(浓HNO3:HClO4=5:1),浸泡过夜,电炉上加热至冒白烟,用去离子水转移,定容至50 mL 容量瓶,然后用原子吸收分光光度计测定Cd 含量[16]。
1.3.2 光合色素Cd 胁迫60 d后,选取同一叶位的样品(从第1片展开叶向下数的第5、6 两片健康成熟功能叶)测定,每个处理重复3 次。测定时,洗净叶片并擦干,叶片剪碎混匀后称取0.05 g,用液氮迅速研磨,用10 mL 80%的丙酮浸提过夜,浸提至叶肉组织完全变白再将浸提液倒出,用80%的丙酮定容至10 mL。以80%的丙酮为空白,用紫外分光光度仪(UV-2010 型,美国)分别测定浸提液在波长663、645、470 nm 处的光密度OD值,计算各光合色素的含量[17-18]。
1.3.3 气体交换参数Cd 胁迫60 d后,在不同处理的植株上,选取两片健康成熟功能叶进行标记,用便携式光合测定仪(Li6400,USA;红蓝光源叶室)测定标记叶片的光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)[19],通过公式(1)计算叶片的气孔限制值(Ls)[20]。测定选择在晴天上午的9:00—11:30进行。选取同一叶位的样品(从第一片展开叶向下数的第5、6两片健康成熟功能叶)测定,每个处理测定9株。
式中:Ca 为样品室CO2浓度。
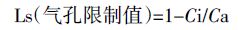 (1)
(1) 荧光参数测定方法参照王晓黎等[21]的方法:气体交换参数测定结束后,换上荧光叶室测定光适应下的荧光参数,待荧光基本稳定时,打开光化学光(光强300μmol·m-2·s-1,蓝光占10%)测定稳态荧光(Fs)和光适应下最大荧光(Fm’),同时打开远红光测得光适应下初始荧光(Fo’)。暗适应下的荧光参数于当日晚间测定,天黑2 h(暗适应充分)后开始,关闭化学光和远红光,先照射检测光(<0.5 μmol·m-2·s-1)测叶片初始荧光Fo,再照射饱和脉冲(6800 μmol·m-2·s-1,0.8 s)测得暗适应最大荧光Fm。根据测得的参数,通过公式(2)~公式(7)计算可变荧光(Fv)、最大光化学量子产率(Fv/Fm)、电子传递的量子产率(椎PS域)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、表观光合电子传递速率(ETR)[22]。选取同一叶位的样品(从第一片展开叶向下数的第5、6两片健康成熟功能叶)测定,每个处理测定9株。
1.4 数据处理运用Microsoft Excel 2016 进行数据处理和图表制作,所有结果均为三次重复数据的平均值,用IBMSPSS Statistics 20 软件进行单因素方差(ANOVA)检验,采用DUNCAN 多重比较检验差异显著性,显著水平为P<0.05。
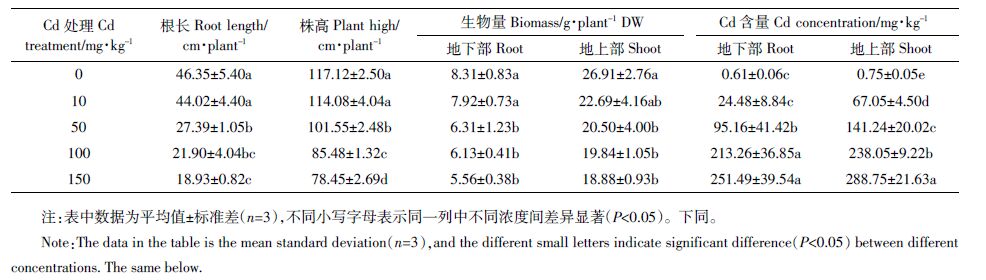
2 结果与分析 2.1 Cd胁迫对豨莶生长和器官中Cd 含量的影响当Cd 浓度为10 mg·kg-1 时,豨莶生长(根长、株高和生物量)与对照相比无显著性差异(P>0.05),随着Cd 浓度的进一步升高,植株生长各形态指标呈逐渐下降的趋势(表 1)。Cd胁迫对根长、株高和生物量的抑制较为明显,在Cd≥50 mg·kg-1 时,三者均显著低于对照;在Cd 浓度为150 mg·kg-1 时,分别比对照降低了59.16%、33.02%、33.09%和29.84%。
从表 1还可以看出,植株地下部和地上部Cd 含量均随着Cd 浓度的升高而增加,在Cd 浓度为150mg·kg-1时,地下部和地上部Cd 含量达到最高值,分别为251.49 mg·kg-1和288.75 mg·kg-1。地下部和地上部Cd 含量与Cd 浓度均呈极显著正相关,相关系数r分别为0.948和0.991。各处理地上部Cd含量均高于地下部,表明豨莶有较强的向地上部转运Cd的能力。
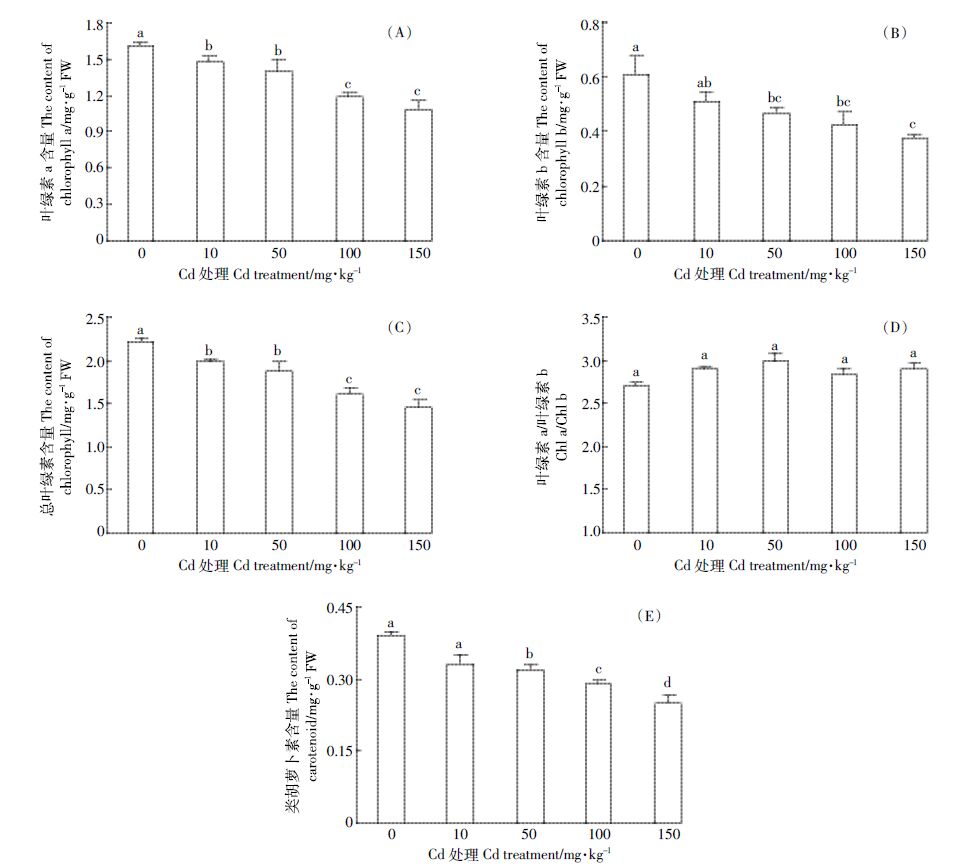
2.2 Cd胁迫对叶片光合色素含量的影响由图 1 可知,在不同浓度Cd 胁迫下,豨莶体内各种光合色素含量变化趋势基本一致,即随着Cd 浓度的升高,叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素含量(Chl)和类胡萝卜素(Car)呈逐渐下降的趋势,与对照相比分别降低了8.70%~32.63%、16.39%~38.12%、10.81%~34.17%、15.38%~35.73%。Chl a、Chlb、Chl 和Car 与Cd 浓度均呈极显著负相关,相关系数r 分别为-0.947、-0.862、-0.958 和-0.941。然而,各处理叶绿素a/叶绿素b(Chl a/Chl b)的值与对照相比无显著变化(P>0.05),在50 mg·kg-1 Cd 处理下,叶绿素a/叶绿素b 值最大,较对照增加了10.37%(图 1D)。Chl a/Chl b与Cd浓度无显著相关性,相关系数r 为0.161。
|
| 图 1 Cd 胁迫对豨莶叶绿素含量的影响 Figure 1 Effects of Cd stress on pigment contents of S. orientalis |
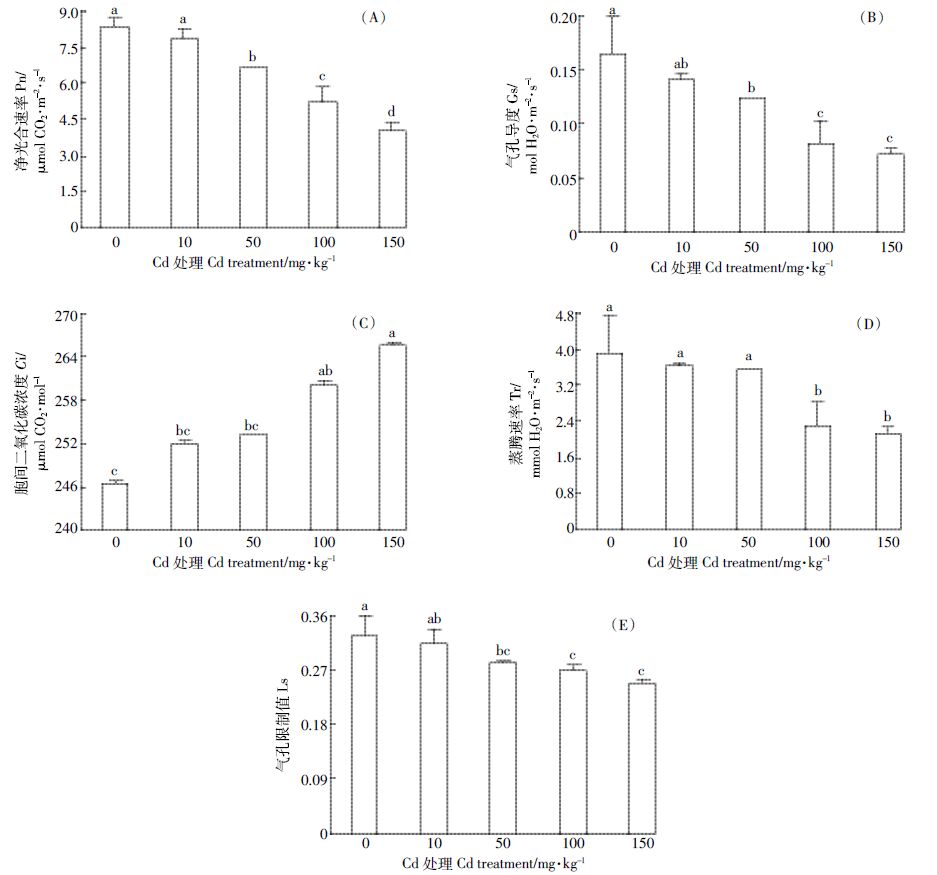
Cd 胁迫对Pn、Gs、Tr 和Ls 的影响基本一致,在Cd 浓度为10 mg·kg-1时,上述4 种气体交换参数与对照相比无显著差异(P>0.05),随着Cd 浓度的进一步升高则呈逐渐降低的趋势(图 2)。其中,Pn 比对照降低5.86%~51.91%,Gs 降低12.50%~56.25%,Tr 降低6.94%~45.24%,Ls降低6.06%~24.24%。相关分析表明,Pn、Gs、Tr 和Ls 与Cd 浓度均呈极显著负相关,相关系数r分别为-0.970、-0.905、-0.835和-0.864。随着Cd浓度的升高,Ci则逐渐增大,在Cd浓度150 mg·kg-1时达最大值,与对照相比升高了7.83%(图 2C)。Ci与Cd浓度呈极显著正相关,相关系数r 为0.823。
|
| 图 2 Cd胁迫对豨莶气体交换参数的影响 Figure 2 Effects of cadmium stress on photosynthesis of S. orientalis with different cadmiumconcentrations |
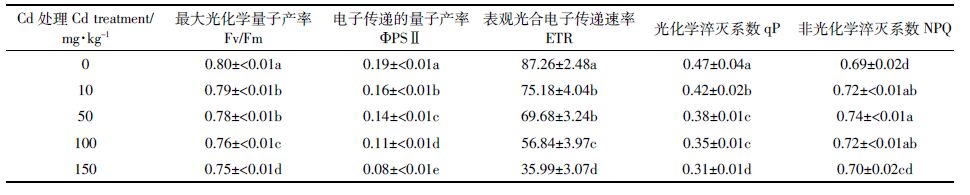
叶绿素荧光参数是衡量植株叶片PS域活性的指标,植株光能耗散特征可通过各荧光参数指标的分析获得[21]。由表 2 可知,Cd 胁迫使豨莶植株的Fv/Fm、椎PS域、ETR 和qP均呈现逐渐降低的趋势,且与对照相比呈显著差异(P<0.05)。与对照相比,Fv/Fm、椎PS域、ETR、qP 的降幅分别为1.25%~6.25%、15.79%~57.89%、13.84%~58.76%、10.64%~34.04%。上述4 个叶绿素荧光参数与Cd 含量均呈极显著负相关关系,相关系数r 分别为-0.983、-0.988、-0.835 和-0.956。而NPQ 的值随Cd 胁迫浓度的升高呈先增后降的趋势,且各Cd 处理浓度下的值均高于对照,当Cd 为50mg·kg-1 处理时,NPQ 值最大,与对照相比增加了7.25%。相关分析表明,NPQ 值与Cd 含量无显著相关性,相关系数r 为0.123。
|
过量的重金属累积于植物叶片中,往往会抑制叶绿素合成所必需的元素吸收,导致叶绿素合成受阻,进而影响植物的生长发育[23-24]。一般认为土壤和植物中Cd 含量分别达到3~8 mg·kg-1 和9.5 mg·kg-1 时就会对植物产生毒害作用[9, 13]。本试验表明,当Cd 浓度为10 mg·kg-1时,植物生长和光合色素含量与对照相比无显著差异,表明该植物对低浓度Cd 有很强的耐受能力;高浓度Cd(≥50 mg·kg-1)明显降低了各种光合色素的含量,生长也受到显著抑制(表 1 和图 1)。这与郭智等[12]对镉胁迫下超积累植物龙葵的光合特性的研究结果一致。然而,Cd胁迫下叶绿素a/叶绿素b 的值有一定的增大(图 1D),表明Cd 对叶绿素b 合成的抑制作用大于叶绿素a。前人在对Cd 超积累植物印度芥菜(Brassica juncea)[25]、东南景天(Sedum al原fredii Hance)[26]和苎麻(Boehmeria nivea)[27]的研究中均得到类似结果。产生这一现象的原因可能与这些重金属超积累植物的光合器官中含有较低的捕光叶绿素蛋白有关,而捕光叶绿素蛋白的减少被认为是叶绿体的一种适应性防御机制[25]。因此,高浓度Cd胁迫下豨莶叶片仍能维持较高的叶绿素a/叶绿素b 比值,可能与豨莶对Cd 的耐性有关。
叶绿素荧光变化能反映植物光合机构的运转状况。本研究中,Cd胁迫导致Fv/Fm、椎PS域、ETR 和qP值均出现不同程度的下降,表明豨莶叶片的光合机构受到一定程度的伤害。椎PS域和ETR 都用来表示植物实际光化学反应效率,两者在Cd 胁迫下降幅最为明显(表 2),表明豨莶叶片PS域光反应中心对Cd 比较敏感,高浓度Cd 会破坏光合电子传递链,使PS域向PS玉传递电子的数量减少,从而影响光合作用,这与其他植物中测定的结果基本一致[13, 28]。更重要的是,本试验发现各处理Fv/Fm 值仅比对照降低1.25%~6.25%,具有相对较高的水平,表明Cd 对豨莶叶片PS域复合体的伤害较小,PS域原初光能转换效率受到的影响较弱。这与Cd胁迫下超积累植物东南景天的响应一致[26]。在qP降低的同时,NPQ与对照相比略有增加(表 2),表明豨莶叶片PS域的天线系统能利用非光化学淬灭机制将过量光能耗散为热能,这种耗散过剩激发能的能力可缓解光合机构的受损程度[23],在一定程度上提高了其抵御Cd胁迫的能力。
Cd 胁迫使豨莶实际光化学反应效率降低,导致电子传递受到抑制,从而造成叶片中的ATP 含量降低,这是引起Pn 降低的重要原因。在逆境中,植物Pn降低可能由气孔关闭导致的气孔限制或叶肉细胞光合活性降低导致的非气孔限制引起,如果Pn 的下降伴随着Ci 的上升,说明非气孔限制是光合作用的限制因素[27]。近年的研究发现,多数超积累植物如垂序商陆(Phytolacca americana L.)[23]和苎麻[27]的Pn 下降是由非气孔限制引起。本试验中,随着Cd 处理浓度的升高,Pn 的降低伴随着Ci 升高和Ls 的下降,表明豨莶净光合速率的下降也是由非气孔限制引起的,Cd 胁迫导致暗反应酶活性受到抑制,CO2 利用率降低。本研究还发现在Cd≤50 mg·kg-1时,Tr 与对照相比无显著差异(图 2 D)。这表明高Cd胁迫抑制Pn 的同时,豨莶叶片通过维持相对较高的蒸腾作用从根部吸收更多营养元素参与代谢活动,这可能是豨莶耐受Cd的原因之一。
4 结论(1)低浓度Cd(10 mg·kg-1)胁迫未抑制豨莶生长和光合色素含量,植物表现出对Cd 较强的耐受能力。高浓度Cd(≥50 mg·kg-1)胁迫引起光合色素、部分气体交换参数和叶绿素荧光参数的下降,表明高浓度Cd 会降低豨莶电子传递能力,减弱光合作用,从而导致植物生长受到抑制。
(2)Cd 胁迫使Pn、Gs、Tr 和Ls 逐渐降低,但Ci随着Cd 浓度的升高而逐渐增大,表明豨莶光合速率的下降是由非气孔限制因素引起的。
(3)高浓度Cd(≥50 mg·kg-1)胁迫下豨莶仍能维持较高的叶绿素a/叶绿素b 比值、较高的Fv/Fm水平和NPQ 值,可能是豨莶耐受Cd 胁迫的关键所在。
| [1] | Farooq M A, Ali S, Hameed A, et al. Cadmium stress in cotton seedlings:Physiological, photosynthesis and oxidative damages alleviated by glycinebetaine[J]. South African Journal of Botany , 2016, 104 : 61–68. DOI:10.1016/j.sajb.2015.11.006 |
| [2] | 张云芳, 陈楚, 陈晨, 等. 镉胁迫对青菜幼苗某些生理特性以及基因组多态性的影响[J]. 农业环境科学学报 , 2016, 35 (3) : 432–439. ZHANG Yun-fang, CHEN Chu, CHEN Chen, et al. Effects of cadmium stresses on physiological characteristics and genomic DNA polymorphism of Brassica chinensis L. seedlings[J]. Journal of Agro-Environment Science , 2016, 35 (3) : 432–439. |
| [3] | Belimov A A, Safronova V I, Tsyganov V E, et al. Genetic variability in tolerance to cadmium and accumulation of heavy metals in pea(Pisum sativum L.)[J]. Euphytic , 2003, 131 (1) : 25–35. DOI:10.1023/A:1023048408148 |
| [4] | 孙光闻, 朱祝军, 陈日远, 等. 镉对小白菜根细胞质膜氧化还原系统的影响[J]. 华北农学报 , 2007, 22 (3) : 65–67. SUN Guang-wen, ZHU Zhu-jun, CHEN Ri-yuan, et al. Effect of cadmium on the redox system of root plasma membrane in pakchoi[J]. Acta Agriculturae Boreali-Sinica , 2007, 22 (3) : 65–67. |
| [5] | Sandalio L M, Dalurzo H C, Gomez M, et al. Cadmium-induced changes in the growth and oxidative metabolism of pea plants[J]. Journal of Experimental Botany , 2001, 52 (364) : 2115–2126. |
| [6] | 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报 , 2000, 20 (3) : 514–523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological and ecological effects of cadmium on plants[J]. Acta Ecologica Sinica , 2000, 20 (3) : 514–523. |
| [7] | 宋瑜, 金樑, 曹宗英, 等. 植物对重金属镉的响应及其耐受机理[J]. 草业学报 , 2008, 17 (5) : 84–91. SONG Yu, JIN Liang, CAO Zong-ying, et al. Response and resistance mechanisms of plants to cadmium[J]. Acta Prataculturae Sinica , 2008, 17 (5) : 84–91. |
| [8] | 张金彪, 黄维南. 镉胁迫对草莓光合的影响[J]. 应用生态学报 , 2007, 18 (7) : 1673–1676. ZHANG Jin-biao, HUANG Wei-nan. Effects of cadmium stress on photosynthetic functions of strawberry[J]. Chinese Journal of Applied Ecology , 2007, 18 (7) : 1673–1676. |
| [9] | 李德明, 朱祝军, 刘永华, 等. 镉对小白菜光合作用特性影响的研究[J]. 浙江大学学报:农业与生命科学版 , 2005, 31 (4) : 459–464. LI De-ming, ZHU Zhu-jun, LIU Yong-hua, et al. Influence of cadmium on photosynthesis of Brassica campestris ssp. chinensis L[J]. Journal of Zhejiang University(Agric & Life Sci) , 2005, 31 (4) : 459–464. |
| [10] | 惠俊爱, 党志, 叶庆生. 镉胁迫对玉米光合特性的影响[J]. 农业环境科学学报 , 2010, 29 (2) : 205–210. HUI Jun-ai, DANG Zhi, YE Qing-sheng. Influence of cadmium stress on photosynthetic characteristics of Maize[J]. Journal of Agro-Environment Science , 2010, 29 (2) : 205–210. |
| [11] | 慈敦伟, 姜东, 戴廷波, 等. 镉毒害对小麦幼苗光合及叶绿素荧光特性的影响[J]. 麦类作物学报 , 2005, 25 (5) : 88–91. CI Dun-wei, JIANG Dong, DAI Ting-bo, et al. Effect of Cd toxicity on photosynthesis and chlorophyll fluorescence of wheat seedling[J]. Journal of Triticeae Crops , 2005, 25 (5) : 88–91. |
| [12] | 郭智, 原海燕, 奥岩松. 镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响[J]. 生态环境学报 , 2009, 18 (3) : 824–829. GUO Zhi, YUAN Hai-yan, AO Yan-song. Effect of cadmium on photosynthesis and nutrient elements uptake of Solanum nigrum L. seedlings[J]. Ecology and Environmental Sciences , 2009, 18 (3) : 824–829. |
| [13] | 邓培雁, 刘威, 韩博平. 宝山堇菜(Viola baoshanensis)镉胁迫下的光合作用[J]. 生态学报 , 2007, 27 (5) : 1858–1862. DENG Pei-yan, LIU Wei, HAN Bo-ping. Photosynthesis of Viola baoshanensis under Cd stress[J]. Acta Ecologica Sinica , 2007, 27 (5) : 1858–1862. |
| [14] | 孙瑞莲, 王文兴, 周启星. 球果蔊菜脯氨酸的积累及与Cd耐性的关系[J]. 中国环境科学 , 2009, 29 (2) : 142–146. SUN Rui-lian, WANG Wen-xing, ZHOU Qi-xing. Cadmium tolerance and proline accumulation in Rorippa globose(Turcz.) Thell.[J]. China Environmental Science , 2009, 29 (2) : 142–146. |
| [15] | Zhang S R, Lin H C, Deng L J, et al. Cadmium tolerance and accumulation characteristics of Siegesbeckia orientalis L[J]. Ecological Engineering , 2013, 51 (2) : 133–139. |
| [16] | Zacchini M, Pietrini F, Mugnozza G S, et al. Metal tolerance, accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics[J]. Water, Air, and Soil Pollution , 2009, 197 (1-4) : 23–34. DOI:10.1007/s11270-008-9788-7 |
| [17] | 沈伟其. 测定水稻叶片叶绿素含量的混合液提取法[J]. 植物生理学报 , 1988 (3) : 62–64. SHEN Wei-qi. Extraction of mixed solution for determination of chlorophyll content in rice leaf blade[J]. Plant Physiology Communications , 1988 (3) : 62–64. |
| [18] | 张宪政. 作物生理研究法[M]. 北京: 农业出版社, 1992 : 142 . ZHANG Xian-zheng. The method of crop physiology stud[M]. Beijing: Agricultural Press, 1992 : 142 . |
| [19] | Wan G, Najeeb U, Jilani G, et al. Calcium invigorates the cadmium-stressed Brassica napus L. plants by strengthening their photosynthetic system[J]. Environmental Science and Pollution Research , 2011, 18 (9) : 1478–1486. DOI:10.1007/s11356-011-0509-1 |
| [20] | 张杰, 梁永超, 娄运生, 等. 镉胁迫对两个水稻品种幼苗光合参数, 可溶性糖和植株生长的影响[J]. 植物营养与肥料学报 , 2005, 11 (6) : 774–780. ZHANG Jie, LIANG Yong-chao, LOU Yun-sheng, et al. Effect of cadmium on photosynthesis parameters, leaf soluble sugar and plant growth in two rice cultivars[J]. Plant Nutrition and Fertilizer Science , 2005, 11 (6) : 774–780. |
| [21] | 王晓黎, 郝敬虹, 董春娟, 等. 外源水杨酸对黄瓜幼苗叶片PSⅡ活性和光能分配的影响[J]. 西北植物学报 , 2011, 31 (8) : 1644–1650. WANG Xiao-li, HAO Jing-hong, DONG Chun-juan, et al. Effect of exogenous salicylic acid on PSⅡactivity and absorbed light allocation in leaves of cucumber seedling[J]. Acta Botanica Boreali-Occidentalia Sinica , 2011, 31 (8) : 1644–1650. |
| [22] | 马新明, 李春明, 田志强, 等. 镉污染对烤烟光合特性、产量及其品质的影响[J]. 生态学报 , 2006, 26 (12) : 4039–4044. MA Xin-ming, LI Chun-ming, TIAN Zhi-qiang, et al. Effects of Cd pollution on photosynthetic characteristics, yield and quality of tobacco leaves[J]. Acta Ecologica Sinica , 2006, 26 (12) : 4039–4044. |
| [23] | 梁文斌, 薛生国, 沈吉红, 等. 锰胁迫对垂序商陆光合特性及叶绿素荧光参数的影响[J]. 生态学报 , 2010, 30 (3) : 619–625. LIANG Wen-bin, XUE Sheng-guo, SHEN Ji-hong, et al. Effects of manganese stress on photosynthesis and chlorophyll fluorescence parameters of Phytolacca americana[J]. Acta Ecologica Sinica , 2010, 30 (3) : 619–625. |
| [24] | 秦天才, 阮捷, 王腊娇. 镉对植物光合作用的影响[J]. 环境科学与技术 , 2000, 23 (1) : 33–35. QIN Tian-cai, RUAN Jie, WANG La-jiao. Effect of Cd on the plant photosynthesis[J]. Environmental Science and Technology , 2000, 23 (1) : 33–35. |
| [25] | Mobin M, Khan N A. Photosynthetic activity, pigment composition and antioxidative response of two mustard(Brassica juncea) cultivars differing in photosynthetic capacity subjected to cadmium stress[J]. Journal of Plant Physiology , 2007, 164 (5) : 601–610. DOI:10.1016/j.jplph.2006.03.003 |
| [26] | Zhou W B, Qiu B S. Effects of cadmium hyperaccumulation on physiological characteristics of Sedum alfredii Hance(Crassulaceae)[J]. Plant Science , 2005, 169 (4) : 737–745. DOI:10.1016/j.plantsci.2005.05.030 |
| [27] | 简敏菲, 杨叶萍, 余厚平, 等. 不同浓度Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J]. 植物生理学报 , 2015, 51 (8) : 1331–1338. JIAN Min-fei, YANG Ye-ping, YU Hou-ping, et al. Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of Ramie(Boehmeria nivea)[J]. Plant Physiology Journal , 2015, 51 (8) : 1331–1338. |
| [28] | 高建欣, 张文辉, 王校锋. Cd2+处理对5个柳树无性系气体交换参数及叶绿素荧光参数的影响[J]. 西北植物学报 , 2013, 33 (9) : 1874–1884. GAO Jian-xin, ZHANG Wen-hui, WANG Xiao-feng. Effects of Cd2+ stress on photosynthetic and fluorescent parameters of five willow clones[J]. Acta Bot Boreal Occident Sin , 2013, 33 (9) : 1874–1884. |
 2016, Vol. 35
2016, Vol. 35