文章信息
- 张雪娜, 贾海滨, 李橙, 王伟, 张丽秀, 冯圣东, 杨志新
- ZHANG Xue-na, JIA Hai-bin, LI Cheng, WANG Wei, ZHANG Li-xiu, FENG Sheng-dong, YANG Zhi-xin
- 添加淀粉和通气对固定化Fusarium.sp修复煤矿区老化污染土壤HMW-PAHs的影响
- Effect of starch and aeration addition on degradation of HMW-PAHs by immobilized Fusarium.sp in a polluted and aged soil of a coal mining area
- 农业环境科学学报, 2016, 35(9): 1709-1716
- Journal of Agro-Environment Science, 2016, 35(9): 1709-1716
- http://dx.doi.org/10.11654/jaes.2016-0596
文章历史
- 收稿日期: 2016-04-28
2. 河北省农田生态环境重点实验室, 河北 保定 071000 ;
3. 河北省环境科学研究院, 石家庄 050000
2. Key laboratory for Farm Land Eco-environment, Baoding 071000, China ;
3. Hebei Institute of Environmental Science, Shijiazhuang 050000, China
多环芳烃(Polycyclicaromatichydrocarbons,PAHs)是由两个或两个以上苯环组成的一类化合物,具有致癌、致畸、致突变的性质[1-2],是美国环境保护署优先控制的持久性有机污染物[3],其中4环及4环以上的高环PAHs(High molecular weight-PAHs,HMW-PAHs),因疏水性、亲脂性、稳定性更强,不易被去除[4-5],最终会通过食物链和其他暴露途径对人体产生威胁[6]。环境中绝大多数的PAHs 积累于土壤中[7],煤矿区、焦化厂区及其影响的农田土壤范围是典型的多环芳烃污染场地[8],如本课题组前期对河北省某煤矿区农田土壤中PAHs 进行生态风险评估发现,89%土壤存在生态风险[9],10 种HMW-PAHs 总含量为3 392.77 μg·kg-1,而一般污染农田土壤中以低环PAHs积累为主[10]。目前许多研究主要集中于土壤中PAHs 的含量分布、来源、迁移转化特征以及PAHs 的物化性质与其环境行为间的关系、风险评价等方面,对煤矿区附近土壤中PAHs 污染修复的研宄较少[11],煤矿区农田污染土壤的修复迫在眉睫。
目前,环境友好的微生物修复是土壤中PAHs 修复的主要途径之一。在真菌修复中,关于白腐真菌的研究报道较为深入[12-13],而镰刀属真菌(Fusarium.sp)修复PAHs 老化污染土壤仅见零星报道[14]。本课题组前期在煤矿区污染土壤中筛选出的Fusarium.sp 培养7d 对无机盐溶液BaP、BKF、DbA、BghiP、InP 单个PAH 的去除率均达38%以上,证实了它是具有去除HMW-PAHs潜力的菌株。微生物固定化技术是一种有效的土壤修复技术,能够显著增强微生物的环境适应能力和污染物去除能力,极大地提高污染土壤修复效果[15-17],Su 等[16]证实固定化的真菌对环境具有更强适应能力和更快的反应启动速度。此外,许多学者已证实,通过外加碳源如水杨酸、邻苯二甲酸、邻苯二酚、矿物油、葡萄糖等可提高微生物对PAHs 的去除效果[18-22],而大分子淀粉的作用影响研究尚少[23]。课题组前期发现,添加淀粉可显著促进Fusarium.sp 对无机盐溶液中HMW-PAHs 的去除,1 g·L-1 淀粉使Fusarium.sp 对其去除率达到了83.07%,该菌株在淀粉外加碳源的条件下效果卓越。
本研究针对通过淀粉强化固定化Fusarium.sp 修复煤矿区老化HMW-PAHs 污染土壤是否也能达到较为理想的效果,以及其降解效果与前人研究的对PAHs 去除相关的土壤酶活性是否有关等问题[24-26],以河北某典型煤矿区长期污染的农田土壤为研究对象,利用玉米秸秆载体材料将Fusarium.sp ZH-H2 固定化,在添加淀粉并伴随通气措施下,研究该菌剂对污染土壤HMW-PAHs 的修复效果以及土壤酶活性变化规律,以期为煤矿区农田土壤HMW-PAHs 的修复提供理论依据及技术支撑。
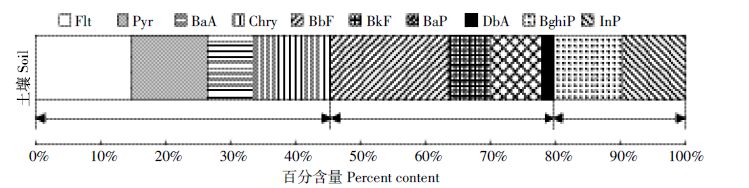
1 材料与方法 1.1 试验材料试验用土取自河北某典型煤矿区周边农田,阴干后过2 mm筛,4℃冰箱内保藏待用。其基本性质见表1,10 种HMW-PAHs 总含量为3 392.77 μg·kg-1,各PAHs含量比例如图 1所示。
|
| 图 1 土壤中单个PAH在移10种PAHs的百分含量 Figure 1 The proportion of individual PAHs content in total 4环PAHs:荧蒽(Flt)、芘(Pyr)、苯并(a)蒽(BaA)、苗屈(Chry);5 环PAHs:苯并(b)荧蒽(BbF)、苯并(k)荧蒽(BkF)、苯并(a)芘(BaP)、 二苯并(a,n)蒽(DbA);6 环PAHs:苯并(ghi)苝(BghiP)、茚苯(1,2,3-cd)芘(InP),总计10种 |
表 1供试菌株ZH-H2(Fusarium.sp)为本课题组前期在煤矿区农田土壤中筛选的HMW-PAHs 高效去除菌。保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏号:CGMCC No.9316,已申请专利(专利号:201410432336.5)。
供试载体玉米秸秆,取自河北省保定市,将其洗净,杀青30 min(105℃),阴干粉碎,过1 mm 筛,并分别与草炭土按1:2混合均匀,121益灭菌20 min,备用。
有机试剂丙酮、二氯甲烷、氘代三联苯(替代物),4溴-2氟联苯(替代物)、氘代苝(内标物质)等均购于北京百灵威试剂公司。
1.2 样品制备菌种培养:从斜面挑取一株ZH-H2 菌接入高氏一号固体培养基的培养皿中,培养皿用封口膜封口,在30℃恒温培养箱中培养7 d。用无菌水反复冲洗吹打菌落,菌液经灭菌的4 层纱布过滤后,得到孢子悬浮液,再用灭菌水调节孢子的数量为1.25×107 cfu·mL-1,作为原液备用。取出5 mL 原液放入20 mL 高氏一号液体培养基中,摇床培养2 d得到菌丝悬液。
载体菌剂制备:分别称取1.1 中制备的秸秆材料90 g 放入500 mL 锥形瓶(共9 瓶)。于121℃高温高压灭菌20 min,降温后分别加入上述菌液,并适当补充无菌水,在30℃、150 r·min-1 摇床条件下培养3h,即得到固定化ZH-H2 的玉米载体材料,用于土壤培养试验。
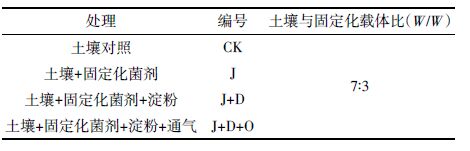
1.3 试验方案采用上口直径13 cm,底面直径9 cm,高11 cm的试验用塑料盆钵,土壤培养试验处理见表 2。试验设置3个处理,每个处理3 个重复,共12 个盆钵。取210 g阴干土放入每个盆钵中,依据表 2 处理方案按3:7质量比向土壤中添加灭菌载体材料和玉米秸秆固定化ZH-H2 载体材料,淀粉添加量为5 g·kg-1,充分混合后调节水分含量为田间持水量的60%,将盆钵置于30℃恒温培养箱中培养。每2 d补水一次,通气时间设定在灌水以后,由空气压缩机注入,输气管平铺于土壤中,由土壤的体积质量、孔隙度和体积含水率计算注入空气量,通气量系数为0.05,以2 d 为一个通气周期,60 d后采集土壤样品。将每盆土壤混合均匀后采用四分法分取样品,一半土壤样品过1 mm筛,密封,置于4℃冰箱中保存,用于测定PAHs 的残留量;另一半自然阴干后过1 mm 筛,用于测定土壤酶活性。
土壤基本理化性质采用土壤农化常规分析法[27]。HMW-PAHs 指标测定及分析方法:Flt、Pyr、BaA、Chry、BbF、BkF、BaP、DbA、BghiP、InP,总计10种HMW-PAHs。采用超声-索式联合提取法提取,称取土壤样品20 g及10 g无水硫酸钠,混合均匀后,加入替代物(20 μg·mL-1氘代三联苯与4-溴-2 氟联苯)20 μL,用丙酮与正己烷体积比1:1 的提取剂超声提取30 min,索氏水浴温度70℃提取12 h,经过干燥、浓缩、净化、再次浓缩定容,通过气相色谱-质谱法(GC-MS,Aglient 7890/5975c)测定样品[28]。GC-MS程序升温步骤:起始温度为80℃,保持2 min;以10℃·min-1上升到140℃,保持3 min;再以10℃·min-1上升到210℃保持3 min;最后以5℃·min-1上升到290℃保持3 min。进样口温度为280℃,进样量为1 μL,不分流进样,流速为1.1 mL·min-1,离子源温度230℃,四极杆温度150℃[28]。
土壤酶活性测定指标及分析方法:土壤过氧化氢酶活性采用高锰酸钾滴定法测定,以20 min 每克土壤消耗0.1 mol·L-1 KMnO4的毫升数表示:土壤木质素过氧化物酶活性以每分钟使1 μmol 黎芦醇氧化成黎芦醛所需的酶量为一个酶活力单位(U)表示,黎芦醛的摩尔吸光系数着=9300 L·mol-1·cm-1[29]。
气相色谱仪-质谱仪联用,气相色谱仪为安捷伦7890,质谱仪为美国HP5975系列。
回收率和检测限的测定参考EPA 标准方法。回收率采用土壤基质加标法,氘代三联苯与4-溴-2 氟联苯回收率控制在70%~130%,同时设置样品的20%进行平行提取试验[28, 30]。
1.5 数据统计分析HMW-PAHs的去除率(Rs)=(C0-Ct)/C0×100%式中:C0 为对照土壤HMW-PAHs 的含量;Ct 为土壤中HMW-PAHs的残留含量(相对去除率)。
本论文数据采用Excel 2003 和SPSS 17.0 软件进行统计分析。
2 结果与分析 2.1 淀粉和通气促进固定化ZH-H2 菌剂修复土壤HMW-PAHs的研究
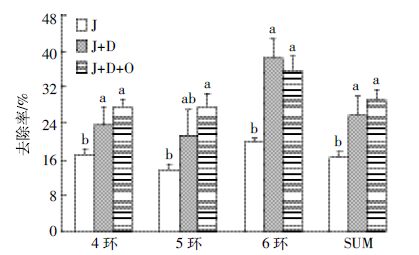
2.1.1 ZH-H2菌剂修复土壤HMW-PAHs总量在不同处理条件下,固定化ZH-H2 菌剂对土壤10 种HMW-PAHs总量及不同环数成分的去除效果见图 2。HMW-PAHs总量去除率在J+D和J+D+O 处理间差异不显著(P>0.05),分别为25.89%和29.19%,但均显著高于处理J(16.54%),分别提高了56.5%、76.0%,说明添加淀粉能够显著促进固定化ZH-H2菌剂对土壤中10 种HMW-PAHs 总量的去除,而增加空气对其去除影响并不显著。
|
| 图 2 不同措施下固定化ZH-H2 菌剂对土壤总量及 不同环数PAHs的去除效果 Figure 2 The degradation of the total PAHs and the PAHs with different rings in soil by immobilized ZH-H2 in the different treatments 同一环数PAHs柱状图上不同小写字母表示不同处理下PAHs 去除率差异显著(P<0.05),下同 |
比较不同环数的去除率可知(图 2),在J+D 和J+D+O 两组处理下,6 环PAHs 总量的去除率均高于4环和5 环,分别为38.31%和35.73%,J 处理下不同环数之间的去除效果差异不显著。另外,各环在J+D+O和J+D两组处理间的差异均不显著,且与J 处理相比均有显著提高(P<0.05),J+D+O 与J 相比,4 环、5 环和6 环PAHs 去除率分别提高了61%、100%和80%,去除效果提高显著;J+D 与J 相比分别提高了39.34%、54.89%和92.81%,去除效果提高显著。可见,添加淀粉并伴随通气条件对5 环PAHs 总量的去除提高最突出,而只添加淀粉处理对6 环PAHs 总量的去除提高更明显。
2.1.2 ZH-H2菌剂修复土壤单个HMW-PAH如图 3 所示,在J 处理下,单个PAH 去除率范围为9.12%~21.73%。经检验,BaA 的去除效果最佳,去除率达21.73%;其次为Flt、Pry、Chry、DbA、InP 和BghiP;BkF和BaP的去除效果最差,去除率为9.12%、11.66%。但与课题组前期向老化污染土壤中添加0.1g·kg-1 游离菌相比,ZH-H2 对BbF、BKF、BaP、InP、DbA、BghiP 的去除率(5.49%、8.46%、0.35%、6.75%、5.79%、7.06%)分别提高了1.94、0.08、32.32、1.29、2.60、1.66 倍,对PAHs 的去除效果显著。这说明在该矿区长期污染的老化土壤中添加该固定化菌剂对10 种单个HMW-PAHs均有不同程度的去除潜力且比游离菌对老化污染土壤的修复效果高。在J+D 处理下,10种HMW-PAHs去除率范围为17.93%~43.12%。经检验,在10种PAHs中,各PAH的去除效果由大到小依次为InP(43.12%)>DbA、BghiP(31.56%,33.92%)>BaA(30.60%)>Flt、Pry、Chry、BkF、BaP>BbF(17.93%)。在J+D+O 处理下,10 种单个PAH 去除率范围为24.34%~35.81%,其中BaA、BghiP、InP的去除率显著高于其他7 种HMW-PAHs,分别为35.81%、35.67%、35.79%。与J 处理相比,J+D 处理下Flt、Chry、BkF、BaP、DbA、BghiP、InP 7种HMW-PAHs 的去除率显著提高,其中BkF 的增幅最大,增加了63.78%,表明添加淀粉对不同种类HMW-PAHs 的去除促进作用有一定差异;J+D+O 处理中10 种单个HMW-PAHs 去除率比J 处理均有显著增加,其中BkF 的增幅最明显,增加了68.09%。对比J+D 和J+D+O 处理不难发现,除BbF 外,其余9 种PAHs 的去除率在两组处理之间差异均不显著,通气对单个HMW-PAH的修复未产生显著影响。

|
| 图 3 不同措施下固定化ZH-H2 菌剂对土壤各HMW-PAHs的去除效果 Figure 3 The degradation of individual HMW-PAHs in soil by immobilized ZH-H2 in the different treatments |
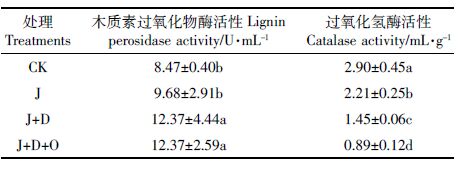
不同处理土壤酶活性的变化见表 3。J 处理下木质素过氧化物酶活性大于CK,但未达到显著水平,J+D、J+D+O 处理下木质素过氧化物酶活性显著高于CK 和J,与HMW-PAHs总量去除率的结果一致,推测土壤HMW-PAHs的降解可能与该酶活性有关,过氧化氢酶活性大小顺次为J+D+O约J+D约J约CK(P<0.05)。同时,研究两种土壤酶活性与PAHs去除率的相关性(表 4)可以看出,土壤过氧化氢酶活性与Chry、BkF、BaP、DbA、BghiP、InP的去除率呈极显著负相关,与Flt、BaA的去除率呈显著负相关;土壤木质素过氧化物酶活性与Chry、BkF、InP、DbA、BghiP 的去除率呈显著正相关。该结果进一步证实了该酶可能与镰刀真菌ZH-H2降解HMW-PAHs的效率有关。
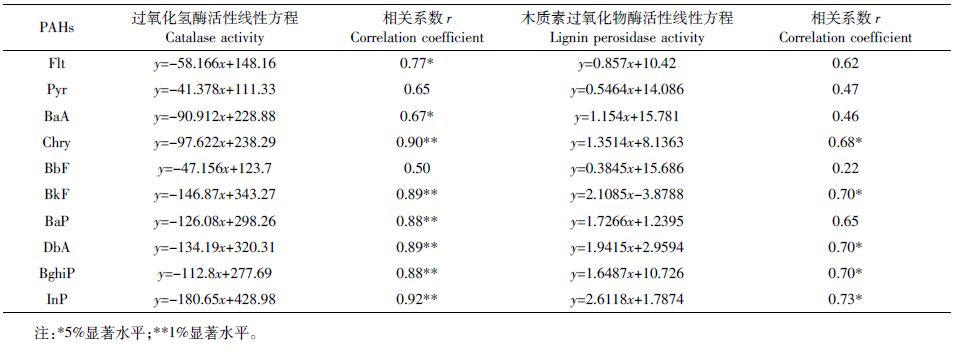
|
向土壤中添加高效去除菌、高效去除菌载体或者其营养物质等共代谢底物来提高污染物去除效果的方法被称为生物强化[31-32]。本研究采用生物强化的方法向PAHs 长期污染土壤中添加玉米秸秆固定化Fusarium.sp 修复HMW-PAHs,并结合添加淀粉以及通气措施来提高HMW-PAHs的修复效率。
与课题组前期向土壤中添加0.1 g·kg-1游离菌的研究结果相比,ZH-H2 经固定化后显著促进了PAHs的去除。这可能是因为ZH-H2经固定化后单位体积介质中微生物的数量显著增加,增加了ZH-H2 与PAHs接触的机会;或者是ZH-H2 经固定化后微环境有利于屏蔽土著菌的竞争作用,降低了污染物对ZHH2的毒害作用,使其可以保证高效的修复效果[33]。另外,过氧化氢酶分解土壤中过氧化氢,是H2O2的解毒剂,有利于防止过氧化氢对生物体的毒害作用,可用作PAHs引起的氧化胁迫的生物标志物[34]。本研究土壤过氧化氢酶活性随去除率升高而降低,与王洪等[35]研究得出的PAHs 修复效果与过氧化氢酶活性呈负相关结论相一致,可能是由于PAHs 或者其中间代谢产物的毒性作用,促使微生物固定化、添加淀粉等措施增强了对ZH-H2 的保护作用,导致土壤过氧化氢酶活性降低。
本研究中土培60 d后,固定化ZH-H2、固定化ZH-H2-淀粉处理均能够显著促进固定化Fusarium.sp 对HMW-PAHs 污染农田土壤的修复。淀粉加强HMW-PAHs去除效果一方面归于淀粉基质可能改善了土壤微生物的营养条件,利于固定化降解菌ZHH2及土著微生物的生长[36],改变了微生物种群结构,课题组前期已证实淀粉促进Fusarium.sp 对HMWPAHs降解的显著效果;另一方面,添加淀粉可能促进了固定化ZH-H2及土著微生物分泌一些关键的去除酶[37]。Wang[38]已证实,P. Chrysosporium 分泌的木质素过氧化物酶和锰过氧化物酶是土壤中PAHs 去除的主要酶,且其酶活性随着土壤有机质含量的提高而增加,Collybia.sp 和Rhizoctonia在土壤多环芳烃修复应用中产生木质素过氧化物酶[39-40],而且本研究中木质素过氧化物酶活性与Chry、BkF、InP、DbA、BghiP 的去除率呈显著正相关。该结果进一步说明不同处理措施对土壤HMW-PAHs 的去除影响可能与分泌的木质素过氧化物酶有关;同时,固定化ZH-H2—淀粉处理中过氧化氢酶活性显著低于固定化ZH-H2,也可能是添加淀粉促进了对ZH-H2的保护作用。综合以上两方面因素认为,添加淀粉可能是提升HMWPAHs去除的主要原因。另外,邹德勋等[41]证明通气促进微生物生长,提高了PAHs 修复效果,但Teng[23]等却得到了不同的结论,他们发现在通气的处理中,BaP的含量高于未通气处理。在本研究中,通气措施对HMW-PAHs 修复的影响也不显著,与Teng 等的结论相符,可见,通气对不同菌种降解PAHs 的影响差异较大。
在添加淀粉、淀粉-通气两组处理下,6 环PAHs总量的去除率均高于4 环和5 环。一般来说,随着PAHs环数的增加,去除率因其生物可利用性降低而降低。孙铁珩等[42]指出,PAHs的难去除性与其分子量和环数呈正相关性,与本研究结果相反,不过有学者已证明淀粉能够增加BaP的水溶性[43]。这可能是解释本研究结果的重要证据之一。另外,Olivier 等[14]也发现,镰刀菌属对5 环、6 环HMW-PAHs 的修复效果高于4环PAHs,与本研究结果一致。这可能与该菌种的去除特性有直接关系。
纵观国内外文献不难发现,添加淀粉伴随通气与固定化Fusarium. sp 菌剂相结合修复HMW-PAHs 长期老化污染土壤中10种单体的研究尚未检索到相关文献。有学者已证实添加可溶性淀粉促进了土著微生物对BaP的去除效果[20],但尚未有添加淀粉与固定化Fusarium. sp 菌剂相结合的方法用以修复HMWPAHs长期污染老化土壤的研究。本研究证实了淀粉与固定化Fusarium. sp 菌剂相结合措施对6 环PAHs有较好的去除效果。
4 结论(1)添加淀粉能够显著促进固定化ZH-H2 菌剂的降解能力,而通气对其降解影响不大。
(2)随着淀粉、通气调控因子的改变,单个HMWPAH的去除能力随之发生了改变。在J+D+O 处理下固定化菌剂对BaA、BghiP、InP 的修复效果最佳,且对6 环PAHs 有较好的去除效果,在J+D 处理下对InP的去除最高。
(3)不同处理土壤过氧化氢酶和木质素过氧化物酶活性可能影响对HMW-PAHs的去除。
| [1] | Hunter R D, Ekunwe S I N, Dodor D E, et al. Bacillus subtilis is a potential degrader of Pyrene and Benzo[a]pyrene[J]. International Journal of Environmental Research and Public Health , 2005, 2 (2) : 267–271. DOI:10.3390/ijerph2005020010 |
| [2] | 毛健, 骆永明, 滕应, 等. 一株副球菌对污染土壤中多环芳烃的降解研究[J]. 土壤 , 2009, 41 (3) : 448–453. MAO Jian, LUO Yong-ming, TENG Ying, et al. Biodegradation of PAHs by Paracoccus aminovorans HPD-2 in contaminated soil[J]. Soils , 2009, 41 (3) : 448–453. |
| [3] | Benner B A, Bryner N P, Wise S A, et al. Polycyclic aromatic hydrocarbon emissions from the combustion of crude oil on water[J]. Environ Sci Technol , 1990, 24 : 1418–1427. DOI:10.1021/es00079a018 |
| [4] | Shree N S, Rudra D T. Environmental bioremediation technologies[M]. Berlin: Springer, 2007 : 409 -443. |
| [5] | 罗霂. 高效降解高分子量多环芳烃的混合菌剂的开发[D]. 北京:轻工业环境保护研究所, 2013:1-7. LUO Lin. Develoment of a mixed microbial-agent efficiently degrading High-molecular-weight-polycyclic-aromatic-hydrocarbons[D]. Beijing:Environmental Production Institute of Light Industry, 2013:1-7. |
| [6] | 徐莹. 高分子量多环芳烃降解菌的筛选、鉴定及其降解特性研究[D]. 南京:南京大学, 2014:1-9. XU Ying. Isolation, identification and characteristics of high-molecular-weight polycyclic aromatic hydrocarbons degradation strains[D]. Nanjing:Nanjing University, 2014:1-9. |
| [7] | Wild S R, Jones K C. Polynuclear aromatic hydrocarbons in the united kingdom environment:A preliminary source inventory and budget[J]. Environ Pollut , 1995, 88 (1) : 91–108. DOI:10.1016/0269-7491(95)91052-M |
| [8] | 刘大锰, 王玮, 李运勇. 首钢焦化厂环境中多环芳烃分布赋存特征研究[J]. 环境科学学报 , 2004, 24 (4) : 746–749. LIU Da-meng, WANG Wei, LI Yun-yong. Distribution and occurrence of polycyclic aromatic hydrocarbons from the Shougang coking plant[J]. Acta Scientiae Circumstantiae , 2004, 24 (4) : 746–749. |
| [9] | 赵欧亚, 冯圣东, 石维, 等. 煤矿区农田土壤多环芳烃生态风险评估方法比较[J]. 安全与环境学报 , 2015, 15 (2) : 352–358. ZHAO Ou-ya, FENG Sheng-dong, SHI Wei, et al. A method for assessing the ecological risks due to the polycyclic aromatic hydrocarbons in the farming soil near coal mine area[J]. Journal of Safety and Environment , 2015, 15 (2) : 352–358. |
| [10] | 肖春燕, 邰超, 赵同谦, 等. 燃煤电厂附近农田土壤中多环芳烃的分布特征[J]. 环境科学学报 , 2008, 28 (8) : 1579–1585. XIAO Chun-yan, TAI Chao, ZHAO Tong-qian, et al. Distirbution characteristics of polycyclic aromatic hydrocarbons in the soil around the Jiaozuo Power Plant[J]. Acta Scientiae Circumstantiae , 2008, 28 (8) : 1579–1585. |
| [11] | 刘静静. 典型煤矿区土壤中烃类化合物的地球化学循环研究[D]. 合肥:中国科学技术大学, 2014:1-15. LIU Jing-jing. Geochemical cycling of hydrocarbon compounds in soil of tipical coal mine district[D]. Hefei:University of Science and Technology of China, 2014:1-15. |
| [12] | Tony H, Risky A K. Fate and cometabolic degradation of benzo[a]pyrene by white-rot fungus Armillaria sp. F022[J]. Bioresource Technology , 2012, 107 : 314–318. DOI:10.1016/j.biortech.2011.12.046 |
| [13] | Andrzej M, Christian J, Aloys H. Oxidation of polycyclic aromatic hydrocarbons by laccase of Trametes versicolor[J]. Enzyme and Microbial Technology , 1998, 22 (5) : 335–341. DOI:10.1016/S0141-0229(97)00199-3 |
| [14] | Olivier P, Catherine R, Etienne V, et al. Bioremediation of an aged polycyclic aromatic hydrocarbons(PAHs)-contaminated soil by filamentous fungi isolated from the soil[J]. International Biodeterioration & Biodegradation , 2004, 54 : 45–52. |
| [15] | 王新, 李培军, 巩宗强, 等. 混合固定化酵母菌对苯并(a)芘污染土壤的修复[J]. 环境污染与防治 , 2008, 30 (1) : 1–8. WANG Xin, LI Pei-jun, GONG Zong-qiang, et al. Remediation of soil contaminated with benzo(a)pyrene using mixed immobilized yeast strains[J]. Environmental Pollution & Control , 2008, 30 (1) : 1–8. |
| [16] | Su D, Li P J, Wang X, et al. Biodegradation of benzo[a]pyrene in soil by immobilized fungus[J]. Environmental Engineering Science , 2008, 25 (8) : 1181–1188. DOI:10.1089/ees.2006.0171 |
| [17] | 王新, 李培军, 巩宗强, 等. 莲藕状固定化真菌(镰刀菌)对土壤中菲、芘的降解[J]. 中国环境科学 , 2002, 22 (1) : 44–47. WANG Xin, LI Pei-jun, GONG Zong-qiang, et al. The degradation of phenanthrene and pyrene in soil with the lotus-root form to immobilized Fusarium s[J]. China Environmental Science , 2002, 22 (1) : 44–47. |
| [18] | 吕雪峰, 王坚. 污染土壤生物修复的共代谢机制研究进展[J]. 科技创新导报 , 2013 (3) : 49–52. Lü Xue-feng, WANG Jian. Recent advances in cometabolism mechanics for bioremediation of contaminated soil[J]. Science and Technology Innovation Herald , 2013 (3) : 49–52. |
| [19] | Mahaffey W R, Gibson D T, Cerniglia C E. Bacterial oxidation of chemical carcinogens:Formation of polycyclic aromatic acids from benz[a] anthracene[J]. Applied and Environmental Microbilogy , 1988, 54 (10) : 2415–2423. |
| [20] | Lun F Y, Ying T, Luo Y M, et al. Biodegradation of polycyclic aromatic hydrocarbons(PAHs) by Trichoderma reesei FS10-C and effect of bioaugmentation on an aged PAH-contaminated soil[J]. Bioremediation Journal , 2015, 19 (1) : 9–11. DOI:10.1080/10889868.2014.939137 |
| [21] | 温继伟. 白腐真菌Pseudotrametes gibbosa共代谢降解芘的研究[D]. 哈尔滨:东北林业大学, 2011. WEN Ji-wei, Co-metabolie degradation of pyrene by white-rot fungus Pseudotrametes gibbosa[D]. Harbin:Northeast Forestry University, 2011. |
| [22] | Tittle P C. Use of alternative growth sub-strates to enhance PAH degradation. In:R. E. Hinchee(eds)[J]. Bioremediation of Recalcitrant Or-ganics , 1995 : 1–7. |
| [23] | Teng Y, LuoY M, Li F P, et al. Effects of soil amendment with different carbon sources and other factors on the bioremediation of an aged PAH-contaminated soil[J]. Biodegradation , 2010, 21 : 167–178. DOI:10.1007/s10532-009-9291-x |
| [24] | 周礼凯. 土壤酶学[M]. 北京: 科学出版社, 1987年 : 107 -240. ZHOU Li-kai. Soil enzymology[M]. Beijing: Science Press, 1987年 : 107 -240. |
| [25] | 刘世亮, 骆永明, 丁克强, 等. 黑麦草对苯并[a]芘污染土壤的根际修复及其酶学机理研究[J]. 农业环境科学学报 , 2007, 26 (2) : 52–63. LIU Shi-liang, LUO Yong-ming, DING Ke-qiang, et al. Rhizosphere remediation and its mechanism of benzo[a]pyrene-contaminated soil by growing ryegrass[J]. Journal of Agro-Environment Science , 2007, 26 (2) : 52–63. |
| [26] | 蓝靖. 木质素过氧化物酶对疏水性芳香化合物的高效降解及机制研究[D]. 济南:山东大学, 2008. LAN Jing. Studies on the degradation of hydrophobic aromatic compounds with lignin peroxidase and the related mechanism[D]. Jinan:Shandong University, 2008. |
| [27] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000 : 30 -163. BAO Shi-dan. Soil analysis[M]. Beijing: Chinese Agricultural Press, 2000 : 30 -163. |
| [28] | 赵欧亚. 淀粉和苜蓿促进煤矿区土壤高环PAHs污染的真菌修复研究[D]. 保定:河北农业大学, 2015:12-14. ZHAO Ou-ya. Study on enhancing fungi remediation of coal mine area soil comtaminated with HMW-PAHs by starch and alfalfa[D]. Baoding:Agricultural University of Hebei, 2015:12-14. |
| [29] | 程晓滨, 裂褶菌F17锰过氧化物酶的分离纯化及其对偶氮染料脱色的研究[D]. 合肥:安徽大学, 2008:8-10. CHENG Xiao-bin, Purification of a new manganese peroxidase of the White-rot Fungus Schizophyllum sp. F17, and decolorization of Azo Dyes by the enzyme[D]. Hefei:Anhui University, 2008:8-10. |
| [30] | EPA 8270d, Semivolatile organic compounds by gas chromatography-mass spectrometry[S]. United States Environmental Protection Agency. 1998. |
| [31] | Thompson I P, Van G C, Ciric L, et al. Bioaugmentation for bioremediation:The challenge of strain selection[J]. Environmental Microbiology , 2005, 7 (7) : 909–915. DOI:10.1111/emi.2005.7.issue-7 |
| [32] | Seklemova E, Pavlova A, Kovacheva K. Biostimulation-based bioremediation of diesel fuel:Field demonstration[J]. Biodegradation , 2001, 12 (5) : 311–316. DOI:10.1023/A:1014356223118 |
| [33] | 胡广军, 梁成华, 李培军, 等. 固定化微生物对多环芳烃污染土壤的降解[J]. 生态学杂志 , 2008, 27 (5) : 745–750. HU Guang-jun, LIANG Cheng-hua, LI Pei-jun, et al. Degradation of soil polycyclic aromatic hydrocarbons by immobilized microbes[J]. Chinese Journal of Ecology , 2008, 27 (5) : 745–750. |
| [34] | Lionetto M G, Caricato R, Giordano M E, et al. Integrated use of biomarkers(acetyl cholinesterase and antioxidant enzymes activities) in Mytilus galloprovincialis and Mullus barbatus in an Italian coastal marine area[J]. Marine Pollute Bulletin , 2003, 46 : 324–330. DOI:10.1016/S0025-326X(02)00403-4 |
| [35] | 王洪, 李海波, 孙铁珩, 等. 生物修复PAHs污染土壤对酶活性的影响[J]. 生态环境学报 , 2011, 20 (4) : 691–695. WANG Hong, LI Hai-bo, SUN Tie-heng, et al. Bioremediation of PAHs contaminated soil and its impacts on soil enzyme activity[J]. Ecology and Environmental Sciences , 2011, 20 (4) : 691–695. |
| [36] | Ana-Maria R, Catherine R, Gheorghe S, et al. Synthesis of alkylated potato starch derivatives and their potential in the aqueous solubilization of benzo[J]. Carbohydrate Polymers, Carbohydrate Polymers , 2013, 93 : 184–190. DOI:10.1016/j.carbpol.2012.06.062 |
| [37] | 姜岩, 杨颖, 张贤明. 典型多环芳烃生物降解及转化机制的研究进展[J]. 石油学报(石油加工) , 2014, 30 (6) : 1137–1150. JIANG Yan, YANG Ying, ZHANG Xian-ming. Review on the biodegradation and conversion mechanisms of typical polycyclic aromatic hydrocarbons[J]. Acta Petrolei Sinica(Petrol Eum Processing Section) , 2014, 30 (6) : 1137–1150. |
| [38] | Wang C P, Sun H W, Li J M, et al. Enzyme activities during degradation of polycyclic aromatic hydrocarbons by white rot fungus Phanerochaete chrysosporium in soils[J]. Chemosphere , 2009, 77 (6) : 733–738. DOI:10.1016/j.chemosphere.2009.08.028 |
| [39] | 许华夏, 李培军, 刘宛, 等. 真菌细胞色素P450与多环芳烃浓度及降解率的相互关系[J]. 农业环境科学学报 , 2004, 23 (5) : 972–976. XU Hua-xia, LI Pei-jun, LIU Wan, et al. Interrelationship between Cytochrome P450 in fungi and contents and degradation rates of PAHs[J]. Journal Agro-Environment Science , 2004, 23 (5) : 972–976. |
| [40] | McErlean, C, Marchant, R, Banat, I M. An evaluation of soil colonization of selected fungi and their production of ligninolytic enzymes for use in soil bioremediation applications[J]. Anton Leeuw Int J G , 2006, 90 : 147–158. DOI:10.1007/s10482-006-9069-7 |
| [41] | 邹德勋, 骆永明, 滕应, 等. 多环芳烃长期污染土壤的微生物强化修复初步研究[J]. 土壤 , 2006, 38 (5) : 652–656. ZOU De-xun, LUO Yong-ming, TENG Ying, et al. Enhanced microbial remediation of long-term polycyclic aromatic hydrocarbons(PAHs)polluted soils[J]. Soils , 2006, 38 (5) : 652–656. |
| [42] | 孙铁珩, 宋玉芳, 许华夏, 等. 植物法生物修复PAHs和矿物油污染土壤的调控研究[J]. 应用生态学报 , 1999, 10 (2) : 225–229. SUN Tie-heng, SONG Yu-fang, XU Hua-xia, et al. Plant bioremediation of PAHs and mineral oil contaminated soil[J]. Chinese Journal of Applied Ecology , 1999, 10 (2) : 225–229. |
| [43] | Ana-Maria R, Catherine R, Gheorghe S, et al. Synthesis of alkylated potato starch derivatives and their potential in the aqueous solubilization of benzo[J]. Carbohydrate Polymers , 2013, 93 (1) : 184–190. DOI:10.1016/j.carbpol.2012.06.062 |
 2016, Vol. 35
2016, Vol. 35