文章信息
- 王荣荣, 赖欣, 李洁, 常泓, 张贵龙
- WANG Rong-rong, LAI Xin, LI Jie, CHANG Hong, ZHANG Gui-long
- 花生壳生物炭对硝态氮的吸附机制研究
- Adsorption of nitrate nitrogen by peanut shell biochar
- 农业环境科学学报, 2016, 35(9): 1727-1734
- Journal of Agro-Environment Science, 2016, 35(9): 1727-1734
- http://dx.doi.org/10.11654/jaes.2016-0230
文章历史
- 收稿日期: 2016-02-26
2. 农业部环境保护科研监测所/天津市农田生态与环境修复技术工程中心, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture/Tianjin Engineering Research Center of Agricultural Ecological & Environmental Remediation, Tianjin 300191, China
生物炭是生物质材料在低氧环境下高温热解产生的一种富碳类固态物质,其孔隙结构发达、比表面积大、芳香化程度高,且表面含有大量的含氧、含硫、含氮等官能团[1-2],是一种备受广泛关注的多功能环境修复或吸附材料。研究表明,施用生物炭显著改善土壤的物理化学性状[3],吸附土壤中的离子,降低NH+4-N和NO3--N、Ca、P、Mn、Zn等淋失[4-6]。周志红等[7]研究表明,50 t·hm-2和100 t·hm-2的生物炭施用量降低黑钙土氮素淋失分别达29%和74%,减少紫色土氮素淋失分别达41%和78%。关于生物炭对氮素的吸附,有研究认为生物炭表面覆盖大量无机离子,通过离子交换作用,使NH+4-N 或NO3--N 在其表面富集,此外,生物炭表面含有-O-、-OH、-COOH、-C=O、C-O 等含氧官能团,可能通过静电引力、形成氢键或仔共轭等作用吸附NH+4-N或NO3--N等离子。生物炭可利用发达的孔隙结构,滞留水分,进而阻控或载负氮素,减少其淋失。目前,生物炭对土壤氮素吸附作用的确切机制尚未获得共识,清晰揭示其对氮素作用特征,对于利用生物炭调控土壤氮素行为具有积极意义。
本研究采用花生壳为原料,将其进行厌氧热解制备生物炭,并以此做吸附剂,以NO3--N 为吸附质,设置固液相批量吸附体系,从热力学、动力学等方面研究生物炭对硝态氮(NO3--N)的吸附特征,考察NO3--N在生物炭表面的吸附过程,通过吸附等温线和动力学曲线的定量研究,结合吸附前后红外光谱(FTIR)、X射线能谱(XPS)定性分析,以期揭示生物炭对硝态氮(NO3--N)的吸附机制,为生物炭的农学利用提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 吸附剂花生壳去除浮土风干,用去离子水清洗2~3 次后烘干(105℃、8 h),研磨过2 mm 筛,在300℃下制取生物炭。具体操作过程为:称取1000 g花生壳放入炭化槽中,然后放入已设置好程序的热解炉中,炉中保持N2通过,流量为0.1 m3·h-1。热解温度控制:启动温度为40℃,以5℃·min-1升温至170℃,保持30 min,然后再按照5℃·min-1升温至预设炭化温度300℃,保持3 h,然后保持通N2状态冷却至室温。冷却后,将制备的生物炭过2 mm 筛,用1 mol·L-1 HCl 浸泡24 h,去除漂浮物,再用去离子水洗至pH 值接近中性,烘干(105℃、24 h),保存于广口瓶,密闭、干燥保存备用。基本理化性质见表 1。
常温将KNO3(分析纯)溶解于去离子水中,配制1000 mg·L-1的母液,将母液逐级稀释成不同浓度的NO3--N 工作溶液浓度。
1.2 测定方法pH值测定参考GB/T 12496.7—1999,采用pH 计(Sartorius PB-10);C、H、O、N 含量测定采用元素分析仪(Vario Micro cube,Elementar Corp.);比表面积、孔容和孔径测定采用比表面孔分布测定仪(Asap 2010,Micrometrics Corp.);灰分含量测定采用缓慢灰化法;钾(K)含量采用火焰光度法测定;钙(Ca)、镁(Mg)含量采用EDTA 滴定法测定。
SEM 检测(扫描电镜):采用TM-1000 型扫描电镜(HIECH Corp),冷场发射式,观察吸附前后生物炭样品的大小、形状和表面特征。
傅里叶变换红外光谱分析(FITR):用傅里叶变换红外光谱仪(Nicolet 380,Nicolet Corp.)测定吸附前后生物炭的红外光谱,采用KBr 压片制样,扫描波数范围为400~4500 cm-1。
X 射线光电子能谱(XPS)分析采用Kratos AXISUltra DLD 多功能电子能谱仪测定吸附前后生物炭样品,单色Al Ka射线(1486 eV)为激发光源。
溶液硝态氮(NO3- -N)浓度采用全自动连续流动分析仪(AA3,Bran+Luebbe Corp.)测定。
1.3 试验设计 1.3.1 适宜溶液pH值确定预试验称取0.1 g制备好的生物炭若干份,分别置于100 mL 离心管中,再加入用0.1 mol·L-1的NaOH/HCl调节pH 分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0 的50 mL、100 mg·L-1 的NO3- -N溶液中,于室温条件下在振荡器中以180 r·min-1振荡24 h后过滤,测定滤液中NO3--N 含量。按下式计算单位质量生物炭对NO3--N 的吸附量:
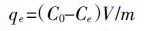 (1)
(1) 式中:qe 为单位质量生物炭吸附硝态氮的量,mg·g-1;C
根据计算结果,选定较高吸附量时溶液pH=5 作为下一步试验吸附溶液适宜pH值设定值。
1.3.2 适宜吸附温度确定预试验称取0.1 g制备好的生物炭若干份,置于100 mL离心管中,加入pH5.0的100 mg·L-1 NO3--N 溶液50 mL,分别于20、30、40、50℃的恒温振荡器中以180 r·min-1振荡24 h后过滤,测定滤液中NO3--N 含量。按公式(1)计算单位质量生物炭对NO3--N 的吸附量,根据计算结果(图 1),选定较高吸附量时溶液吸附体系温度20℃为下一步试验体系温度。
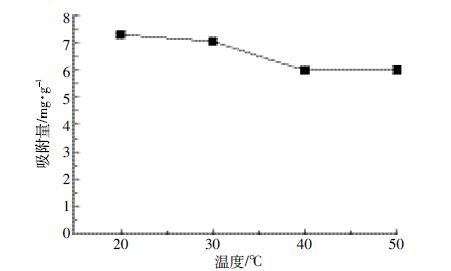
|
| 图 1 溶液温度对生物炭吸附NO3--N 的影响 Figure 1 Effect of temperature on NO3--N adsorption on biochar |
称取0.1 g生物炭粉末置于100 mL 离心管中,分别加入一系列50 mL 浓度不同的硝酸钾溶液,其浓度分别为20、40、60、80、100、200、400、600、800、1000 mg·L-1,用NaOH 或HCl 调节溶液pH 为5±0.1,每个处理6 个重复。置于(20±0.5)℃恒温振荡器中180 r·min-1振荡24 h后过滤,测定滤液中硝态氮含量。按公式(1)计算单位质量生物炭对硝态氮的吸附量,同时分别用Langmuir 模型[8, 10]、Freundlich 模型[9]和Temkin 模型[10]进行数据拟合。
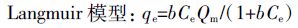 (2)
(2) 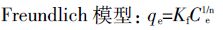 (3)
(3) 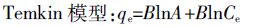 (4)
(4) 式中:qe为单位质量生物炭吸附硝态氮的质量,mg·g-1;Ce为吸附平衡时液相中硝态氮的浓度,mg·L-1;b 为吸附平衡常数,L·g-1,与吸附剂、吸附质的本质和温度有关,b 愈大吸附能力愈强;Kf、n 是吸附过程的经验系数,Kf与吸附剂的吸附亲和力有关,一般随温度升高而减小,n 表示吸附过程的支持力,n 值越大吸附性能越好,当n小于0.5 时,难以吸附;Qm为单分子层吸附硝态氮时的最大吸附量,mg·g-1,与吸附位有关,理论上讲是与温度无关的;A、B 为吸附平衡常数。
1.3.4 动力学吸附试验取50 mL,800 mg·L-1 的硝态氮溶液,加入0.1 g生物炭,恒温振荡,吸附试验在(20±0.5)℃,pH 值为5的条件下进行。分别于6、12、18、20、24、40、60、80 min取出样品,每个处理重复6 次,过滤后测定滤液中硝态氮浓度。
分别利用准一级动力学方程、准二级动力学方程、Elovich 方程和离子扩散方程对实验数据进行拟合,分析生物炭吸附硝态氮的时间与吸附量之间的关系,推断吸附反应机制:
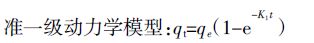 (5)
(5)  (6)
(6) 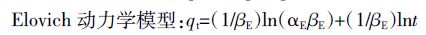 (7)
(7)  (8)
(8) 式中:qt为t时刻生物炭吸附硝态氮的吸附量,mg·g-1;qe为吸附平衡时生物炭吸附硝态氮的吸附量,mg·g-1;K1、K2和Kp分别是准一级吸附、准二级吸附和颗粒内扩散速率常数,Kp 值越大吸附质越易在吸附剂内部扩散;αE为初始吸附速率常数;茁E为解吸附速率常数;C 是涉及到厚度、边界层的常数。
1.4 数据处理用Microsoft Excel 2010 进行检测数据平均值的运算表格绘制,作图软件为Origin 8.5,多重比较采用邓肯法(Duncan’s)。
2 结果与分析 2.1 溶液pH 值对吸附效果的影响随溶液pH 值上升,生物炭对硝态氮的吸附量呈逐渐下降趋势(图 2),当pH值为2 时吸附量最大。在溶液pH约6 时,随pH 值升高,生物炭吸附NO3- -N 的量下降幅度较大,平均为4.5%,当pH跃6,随pH 值升高,吸附量下降的幅度减小,当pH>12 时,吸附量不再显著下降。有研究表明溶液pH不仅影响吸附剂表面电荷性质,而且影响吸附质的离子化程度及存在状态[11]。生物炭表面具有较多的官能团,当溶液pH较低时,表面官能团被质子化,呈现正电[12],利于NO3--N 的阴离子吸附。随溶液pH 值增加,加之生物炭自身呈碱性,溶液OH-的含量增多,与阴离子竞争吸附位点,不利于NO3--N 的吸附。

|
| 图 2 溶液pH 值对生物炭吸附NO3--N的影响 Figure 2 Effect of pH on NO3--N adsorption on biochar |
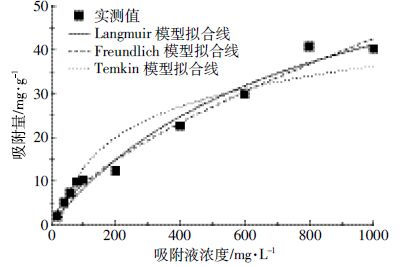
生物炭对NO3- -N 的吸附量随溶液NO3- -N 初始浓度增加而升高(图 3),当溶液NO3- -N 浓度接近800 mg·L-1时,生物炭对NO3--N 的吸附量达到饱和,此时再增加NO3--N 浓度,吸附量不再显著增加,最大饱和吸附量为40 mg·g- 1。根据Langmuir 模型、Freundlich 模型和Temkin 模型进行数据拟合NO3--N在生物炭上的吸附热力学行为,其回归参数显示(表 2),Freundlich 方程能较好地描述生物炭对NO3- -N 的等温吸附过程(R2=0.975),说明NO3- -N 在生物炭表面上的吸附为非均一的多分子层吸附,n>1,表明这种吸附过程较容易进行。Temkin 模型拟合系数仅为0.892,对试验数据拟合较差。Langmuir 方程对NO3--N 吸附过程拟合的回归系数R2=0.961,具有较高的拟合度,但其拟合的理论最大吸附值(68.535 mg·g-1)与实际值差距较大,说明这种吸附方程代表的单分子层吸附有一定程度存在,但不起主导作用。
|
| 图 3 生物炭对NO3--N 的吸附等温线 Figure 3 Adsorption isotherms of NO3--N on biochar |

|
在初始浓度为800 mg·L-1 的溶液中,生物炭对NO3--N 的吸附量在短时内迅速增加,当接近30 min左右达到最大饱和吸附(图 4),之后随时间延长吸附量没有发生显著变化。分别利用准一级动力学方程、准二级动力学方程、Elovich 方程和离子扩散方程对试验数据进行拟合,结果表明准二级动力学方程拟合系数R2=0.973(表 3),显著高于其他两个方程,且qe 值与实际测得值较为接近,因此,能更好地描述吸附动力学过程。准二级动力学模型包含吸附的所有过程,如表面吸附、外部膜扩散和颗粒内扩散等,化学键的形成是影响准二级动力学吸附的主要因素,说明NO3- -N 在生物炭表面的吸附过程是以化学吸附为主。
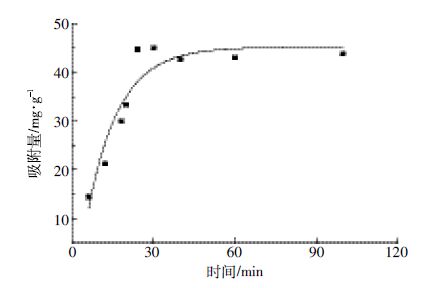
|
| 图 4 时间对生物炭吸附NO3--N的影响 Figure 4 Effect of contact time on NO3--N adsorption on biochar |
通过SEM 图像观察表明,生物炭的微观结构在吸附NO3--N 前表面粗糙,孔道分布密集,凸凹不平(图 5a),吸附后生物炭材料表面聚集较多颗粒附着物或粉末状物质(图 5b),这些物质附着于表面或填充孔道,使得生物炭表面变得较为平整。能谱面扫描图像中生物炭表面具有丰富的N 元素亮点(图 6),并且呈不均匀状态分布。

|
| 图 5 生物炭对NO3--N 吸附前后扫描电镜图(×25 000 倍) Figure 5 SEMmicrographs of biochar before and after NO3--N adsorption(×25 000 times) |

|
| 图 6 生物炭吸附NO3--N 的能谱面扫描图(×5000 倍) Figure 6 Energy spectrum scan of biochar after adsorption of NO3--N(×5000 times) |
生物炭吸附NO3--N 前后FTIR 图谱如图 7。吸附后在3800~3156 cm-1范围内[14],吸收峰强度变弱,该范围吸收峰主要由分子间氢键缔合的-OH 伸缩振动引起,说明生物炭表面的羟基(-OH)参与了NO3- -N的吸附过程。1608 cm-1左右[14]的吸收峰是芳香环羰基(-C=O)和羟基(-OH)的伸缩振动,吸附后,波数发生蓝移,峰形变宽,说明该基团也参与了生物炭吸附NO3--N 的过程。1043 cm-1左右[14]的变化一般认为是醇羟基(-OH)的弯曲振动和脂肪族醚类(-O-)的伸缩振动引起的,吸附后,吸收峰明显变弱,峰宽变窄,说明生物炭表面醇羟基或脂肪族醚类等活性基团参与了吸附过程[15]。
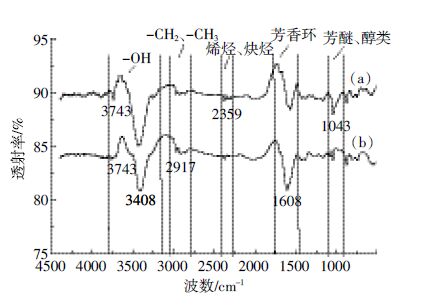
|
| 图 7 生物炭吸附NO3--N 前后的FT-IR 谱图 Figure 7 FTIR spectrogram of biochar before and after adsorption of NO3--N |
由图 8 可知,吸附前图谱通过曲线拟合分峰可以得到四个分峰(图 8a),表明存在四种状态的C,其中C1 峰归属于-C-C-键或-C-H-键(284.70 eV),C2 峰归属于-C-O 键(285.50 eV),C3 峰归属于-C=O键(286.70 eV),C4峰归属于-O-C=O 键(288.93 eV)。由生物炭吸附NO3- -N 后,表面O 元素含量升高,C元素含量降低,O1s/C1s 升高,说明生物炭表面含氧官能团增加[16]。吸附后(图 8b)284.70 eV 处的特征峰没有发生明显的位移,说明烷基类的-C-C-或-C-H-形式的C 原子没有直接参与NO3- -N 的吸附;C2、C3 和C4 峰的结合能分别升高0.14、0.09、0.17 eV,说明羟基碳(-C-O)、羰基碳或羧基碳(-C=O)、酯基碳(-O-C=O)等不同程度地参与了生物炭对NO3- -N 的吸附[17],其中,羟基通过形成氢键能够较强地吸附NO3--N,而羰基碳或羧基碳(-C=O)、酯基碳(-O-C=O)等带负电的基团可能通过络合或静电作用与生物炭表面大量分布的金属离子(Ca2+,K+,Mg2+)结合(图 9),进而形成金属键桥对NO3- -N进行吸附。
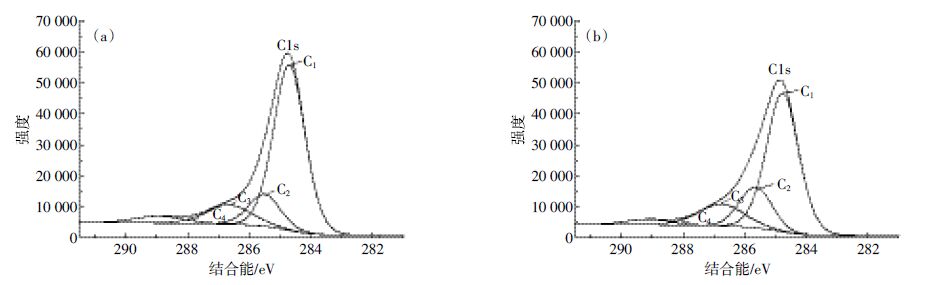
|
| 图 8 生物炭吸附NO3--N 前后的X-射线光电子能谱 Figure 8 XPS spectra of biochar before and after NO3--N adsorption (a)吸附前生物炭的C1s谱图;(b )吸附后生物炭的C1s谱图 |

|
| 图 9 生物炭吸附NO3--N 后能谱面扫描图(×5000 倍) Figure 9 Energy spectrum scan of biochar after NO3--N adsorption(×5000 times) |
生物炭具有高比表面积、孔隙度、极性、非极性表面位点,这些特性使其能够有效地吸附土壤中的NO3--N[18],进而阻控NO3--N 淋失。然而,其吸附效率也较大程度受吸附溶液pH 值[19]及吸附质浓度[20]等影响。Rajesh 等[21]在研究不同种类生物炭在不同pH 值条件下对吸附容量影响的研究中得出,当溶液pH 值从4.0 升到9.0 时,吸附容量则随之逐渐减小。Khan等[22]研究认为,当溶液pH>5.9 时,大量的OH-会吸附在活性炭表面引起静电排斥,并会与NO3-形成竞争吸附,从而使吸附量降低,Ozturk 等[23]研究中也有类似的结果。当溶液pH<6 时,生物炭对NO3--N 具有较大的吸附量,且在pH=2.0时达到最大,主要是因为低pH 值溶液中过量的H+降低了吸附剂表面的负电荷,增加了表面活性吸附点位,进而提高了对阴离子的吸附容量。
生物炭对NO3--N 吸附效率一定程度上受体系中NO3- -N 初始浓度所影响,Tofighy[24]等研究发现,在吸附平衡前,生物炭对水体中NO3--N 的去除率会随其浓度的增大而增大,故在高初始浓度下,物质传输驱动力更大,更有利于对NO3--N 的吸附。这与本文的研究结果类似,在吸附平衡以前,花生壳生物炭对溶液NO3--N 吸附量随其初始浓度增加而增大,达到吸附平衡后,吸附量不再随NO3--N 浓度增加发生显著变化,Freundlich 方程较好地拟合其吸附过程。郭素华等[25]、程启明等[26]针对花生壳生物炭吸附性能的研究也有类似的结论。
Wang 等[27]研究发现,经氯醇改性后的小麦秸秆生物炭,对NO3--N 的吸附可在30 min 达到平衡,与本文的研究结果较为接近。生物炭对NO3--N 吸附所需的平衡时间可能与其表面分布的阴离子结合位点有关,结合位点多,吸附平衡时间较短,反之,结合位点少,吸附平衡时间较长。生物炭对NO3--N 的吸附动力学过程主要受制备材料和条件所影响,多数符合伪一级动力学或伪二级动力学模型[10, 20]。本研究中花生壳生物炭对NO3--N 的吸附过程符合伪二级动力学模型,说明NO3--N 在生物炭表面的累积是通过化学作用实现的[28]。
扫描电镜图和能谱面扫描图像丰富的N 元素亮点,直观地证明了生物炭对NO3--N 的吸附作用。从N元素亮点的分布来看,其在生物炭表面分布的疏密程度并不均一,一方面可能与生物炭表面沟槽或孔隙分布不均有关,另一方面可能与生物炭表面参与吸附的官能团不同有关。这种异质性的吸附特征在刘国成[13]的研究中也有发现。
吸附前后FTIR 图谱反映,花生壳生物炭表面分布的-OH、C=O 及-O-参与了对NO3- -N 的吸附,其中-OH 可以通过氢键的形成吸附NO3--N。本研究中在3800~3156 cm-1、1608 cm-1、1043 cm-1 等处均发生-OH 吸收峰的改变,说明生物炭表面富含的-OH 在吸附过程中起到关键作用。另有研究认为,生物炭表面分布的含氧官能团(-COO、-C=O、-O-)及金属离子(Zn2+)可以通过仔-仔电子作用和金属桥键作用吸附土霉素(OTC-)、PO-4等阴离子[29],并在李丽[30]等和Zhang[31]等研究中得以证实。吸附前后XPS 图谱也证明羟基碳(-C-O)、羰基碳或羧基碳(-C=O)、酯基碳(-O-C=O)等确实均参与了生物炭对NO3--N 的吸附过程。据此推断,通过氢键形成和金属桥键作用在花生壳生物炭吸附溶液中NO3- -N 的过程中起重要作用。因此,本试验通过对生物炭吸附水体中硝态氮的吸附机制研究证明,生物炭可以作为一种新型的氮肥吸附剂,通过固定硝态氮减少硝态氮在土壤中的淋失,提高土壤氮素利用率。这为生物炭应用于农学方面提供了理论基础。
4 结论(1)生物炭对NO3--N的吸附过程可以用Freundlich方程较好地拟合,最大吸附量达40 mg·g-1。
(2)伪二级方程可以较好地描述吸附动力学过程,表明吸附为快速化学反应所控制。
(3)FTIR 和XPS图谱表征认为,生物炭表面分布的含氧官能团(-OH、-C=O、-O-)参与了吸附过程。结合生物炭表面元素分布状况,通过氢键形成和金属桥键作用是生物炭对NO3--N 吸附的主要机制。
| [1] | Lehmann J, Gaunt J, Rondon M. Bio-char sequestration in terrestrial ecosystems:A review[J]. Mitigation and Adaptation Strategies for Global Change , 2006, 11 (2) : 395–419. DOI:10.1007/s11027-005-9006-5 |
| [2] | Marris E. Putting the carbon back:Black is the new green[J]. Nature , 2006, 442 (7103) : 624–626. DOI:10.1038/442624a |
| [3] | Spokas K, Novak J, et al. Biochar:A synthesis of its agronomic impact beyond carbon sequestration[J]. Journal of Environmental Quality , 2012, 41 (4) : 973–989. DOI:10.2134/jeq2011.0069 |
| [4] | 盖霞普, 刘宏斌, 翟丽梅, 等. 玉米秸秆生物炭对土壤无机氮素淋失风险的影响研究[J]. 农业环境科学学报 , 2015, 34 (2) : 310–318. GAI Xia-pu, LIU Hong-bin, ZHAI Li-mei, et al. Effects of corn-stalk biochar on inorganic nitrogen leaching from soil[J]. Journal of Agro-Environment Science , 2015, 34 (2) : 310–318. |
| [5] | Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a south-eastern coastal plain soil[J]. Soil Science , 2009, 174 (2) : 105–112. DOI:10.1097/SS.0b013e3181981d9a |
| [6] | 高德才, 张蕾, 刘强, 等. 旱地土壤施用生物炭减少土壤氮损失及提高氮素利用率[J]. 农业工程学报 , 2014, 30 (6) : 54–61. GAO De-cai, ZHANG Lei, LIU Qiang, et al. Application of biochar in dryland soil dacreasing loss of nitrogen and improving nitrogen using rate[J]. Transactions of the Chinese Society of Agricultural Engineering , 2014, 30 (6) : 54–61. |
| [7] | 周志红, 李心清, 邢英, 等. 生物炭对土壤氮素淋失的抑制作用[J]. 地球与环境 , 2011, 39 (2) : 278–284. ZHOU Zhi-hong, LI Xin-qing, XING Ying, et al. Biochar inhibitory effect on soil nitrogen leaching[J]. Earth and Environment , 2011, 39 (2) : 278–284. |
| [8] | Chatterjee S, Woo S H. The removal of nitrate from aqueous solutions by chitosan hydrogel beads[J]. Journal of Hazardous Materials , 2009, 164 (2/3) : 1012–1018. |
| [9] | Hameed B H, Daud F B M. Adsorption studies of basic dye on activated carbon derived from agricultural waste:Hevea brasiliensis seed coat[J]. Chemical Engineering Journal , 2008, 139 (1) : 48–55. DOI:10.1016/j.cej.2007.07.089 |
| [10] | Demiral H, Gunduzoglu G. Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse[J]. Bioresource Technology , 2010, 101 (6) : 1675–1680. DOI:10.1016/j.biortech.2009.09.087 |
| [11] | Regmi P, Mao J, Kumar S, et al. Removal of copper and cadmium from aqueous solution using switchgrass biochar produced via hydrothermal carbonization process[J]. Journal of Environmental Management , 2012, 109 (17) : 61–69. |
| [12] | Abdel-Fattah T M, Mahmoud M E, Ahmed S B, et al. Biochar from woody biomass for removing metal contaminants and carbon sequestration[J]. Journal of Industrial and Engineering Chemistry , 2015, 22 : 103–109. DOI:10.1016/j.jiec.2014.06.030 |
| [13] | 刘国成. 生物炭对水体和土壤环境中重金属铅的固持[D]. 青岛:中国海洋大学, 2014. LIU Guo-cheng. Immobilization of Pb2+ in contaminated watered and soils by biochars[D]. Qingdao:Ocean University of China, 2014. |
| [14] | 刘振海, 山立子. 分析化学手册(第三册)[M]. 北京: 化学工业出版社, 2000 . LIU Zhen-hai, SHAN Li-zi. Manual of analytical chemistry(Volume Ⅲ)[M]. Beijing: Chemical Industry Press, 2000 . |
| [15] | Das D D, Schnitzer M I, Mayer P, et al. Chemical composition of acid base fractions separated from biooil derived by fast pyrolysis of chicken manure[J]. Bioresource Technology , 2009, 100 : 6524–6532. DOI:10.1016/j.biortech.2009.06.104 |
| [16] | Yao F X, Camps A M, Virgel S, et al. Simulated geochemical weathering of a mineral ash-rich biochar in a modified Soxhlet reactor[J]. Chemosphere , 2010, 80 (7) : 724–732. DOI:10.1016/j.chemosphere.2010.05.026 |
| [17] | Taty-Costodes V C, Fauduet H, Porte C, et al. Removal of Cd(Ⅱ) and Pb(Ⅱ) ions, from aqueous solutions, by adsorption onto sawdust of Pinus sylvestris[J]. Journal of Hazardous Materials , 2003, 105 (1-3) : 121–142. DOI:10.1016/j.jhazmat.2003.07.009 |
| [18] | Balwant S, Annettel C, Bhupinderpal S. Characterisation and evaluation of biochars for their application as a soil amendment[J]. Australian Journal of Soil Research , 2010, 48 (7) : 516–525. DOI:10.1071/SR10058 |
| [19] | Wang B, Lehmann J, Hanley K, et al. Adsorption and desorption of ammonium by maple wood biochar as a function of oxidation and pH[J]. Chemosphere , 2015, 138 : 120–126. DOI:10.1016/j.chemosphere.2015.05.062 |
| [20] | Mizuta K, Matsumoto T, Hatate Y, et al. Removal of nitrate-nitrogen from drinking water using bamboo power charcoal[J]. Bioresource Technology , 2004, 95 (3) : 255–257. DOI:10.1016/j.biortech.2004.02.015 |
| [21] | Chintala R, Mollinedo J, Schumacher T E, et al. Nitrate removal from aqueous solution by adsorption onto various materials[J]. Journal of Hazardous Materials , 2004, 112 : 155–162. DOI:10.1016/j.jhazmat.2004.05.001 |
| [22] | Khan M A, Ahn Y T, Kumar M, et al. Adsorption studies for the removal of nitrate using modifield lignite granular activated carbon[J]. Separation Science and Technology , 2011, 46 : 2575–2584. DOI:10.1080/01496395.2011.601782 |
| [23] | Ozturk N, Bektas T E. Nitrate removal from aqueous solution by adsorption onto various materials[J]. Journal of Hazardous Materials , 2004, 112 (1/2) : 155–162. |
| [24] | Tofighy M A, Mohammadi T. Adsorption of divalent heavy metal ions from water using carbon nanotube sheets[J]. Journal of Hazardous Materials , 2011, 185 (1) : 140–147. DOI:10.1016/j.jhazmat.2010.09.008 |
| [25] | 郭素华, 徐中坚, 等. 生物炭对水中Pb和Zn的吸附特性[J]. 环境工程学报 , 2015, 9 (7) : 3215–3222. GUO Su-hua, XU Zhong-jian, et al. Adsorption of Pb(Ⅱ), Zn(Ⅱ) from aqueous solution by biochars[J]. Chinese Journal of Environment Engineering , 2015, 9 (7) : 3215–3222. |
| [26] | 程启明, 黄青, 等. 花生壳与花生壳生物炭对镉离子吸附性能研究[J]. 农业环境科学学报 , 2014, 33 (10) : 2022–2029. CHENG Qi-ming, HUANG Qing, et al. Adsorption of Cadmium(Ⅱ) on peanut shell and its biochar[J]. Journal of Agro-Environment Science , 2014, 33 (10) : 2022–2029. |
| [27] | Wang Y, Gao B Y, Yue W W, et al. Adsorption kinetics of nitrate from aqueous solution onto modified wheat residue[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects , 2007, 308 : 1–5. |
| [28] | 徐楠楠, 林大松, 等. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报 , 2014, 33 (5) : 958–964. XU Nan-nan, LIN Da-song, et al. Adsorption of aquatic Cd2+ by biochar obtained from corn stover[J]. Journal of Agro-Environment Science , 2014, 33 (5) : 958–964. |
| [29] | 李际会. 改性生物炭吸附硝酸盐和磷酸盐研究[D]. 北京:中国农业科学院, 2012:35-42. LI Ji-hui. Adsorption of nitrate and phosphate by modified biochar[D]. Beijing:Chinese Academy of Agricultural Sciences, 2012:35-42. |
| [30] | 李丽, 陈旭, 吴丹, 等. 固定化改性生物质炭模拟吸附水体硝态氮潜力研究[J]. 农业环境科学学报 , 2015, 34 (1) : 137–143. LI Li, CHEN Xu, WU Dan, et al. Adsorption of aqueous nitrate-N by immobilized modified biochar[J]. Journal of Agro-Environment Science , 2015, 34 (1) : 137–143. |
| [31] | Zhang H, Lin K, Gan J. Effect of pinus radiata derived biochars on soil sorption and desorption of phenanthrene[J]. Environmental Pollution , 2010, 158 (9) : 2821–2825. DOI:10.1016/j.envpol.2010.06.025 |
 2016, Vol. 35
2016, Vol. 35






